Конспект количество вещества 8 класс химия
Обновлено: 05.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Химия 8 класс
задачи урока:
1. Образовательные:
а) Ввести понятие о количестве вещества и единицах его измерения: моль, ммоль, кмоль.
б) Дать представление о постоянной Авогадро.
в) Показать взаимосвязь массы, количества вещества и числа частиц.
г) Научить решать задачи по химии.
д) Научить выполнять задания по образцу и переносу знаний в новую ситуацию.
2. Воспитательные:
а) Формирование познавательной потребности.
б) Формирование стремления к глубокому усвоению знаний.
в) Воспитание аккуратности в оформлении и записи задач.
3. Развивающие:
а) Развивать умения применять знания на практике.
б) Развивать логическое мышление учащихся.
в) Развивать умение анализировать условия.
г) Развивать умение работать в должном темпе, организованность.
Тип урока: Урок изучения и первичного закрепления знаний.
Методы, используемые на уроке: Объяснительно-
Этапы урока:
Организация начала 1 мин
Проверка домашнего задания 5 мин
Подготовка к активной учебно-познавательной деятельности 3 мин
Усвоение новых знаний 17 мин
Закрепление знаний 7мин
Первичная проверка понимания 5 мин
Подведение итогов урока 5 мин
Информация о домашнем задании 2мин
1. Приветствие и подготовка учащихся к уроку.
2. Проверка домашнего задания:
- Что такое неметаллы?
- Что такое аллотропия?
3. Подготовка к активной учебно-познавательной деятельности.
Учитель: Сегодня на уроке вы познакомитесь с новым для вас понятием - количество вещества, моль, молярная масса. Научитесь решать задачи по химии, связанные с этими понятиями. Записываем тему урока в тетради: Количество вещества. Молярная масса вещества. Но сначала вспомним:
- Что такое химия?
- Что показывает относительная атомная масса, как обозначается, как найти её значение?
- Как обозначается относительная молекулярная масса, как найти её значение?
4. Усвоение новых знаний
Учитель: Мы вспомнили, что химия - это наука о веществах, их свойствах и превращениях. Для получения определённого количества продукта в химической лаборатории или на заводе необходимо брать строго определённые количества исходных веществ. Подумайте, в чём удобнее измерять вещества?
Учитель: Давайте оставим пока химию и представим, что у нас есть куча картошки. Как нам удобнее пересчитать её? Конечно мешками.
Что изучает химия? (наука о веществах) А в чем измерять вещества?
Температура измеряется в градусах, путь в метрах, масса – в граммах, килограммах.
Какие бы вы предложили единицы измерения?
Может быть, вспомнить из каких частиц состоит вещество?
- из молекул, атомов.
Но отсчитать нужное число молекул и атомов технически невозможно из-за малого размера. Вот если бы найти способ, в котором объединились бы масса (её измерить просто) и число молекул (атомов). И ученые придумали. Если брать столько граммов вещества, какова его относительная молекулярная масса, сколько же там будет содержаться молекул?
Для О 2 – 32г / Mr ( O 2 ) = 32 /
Для O 3 – 48г / Mr ( O 3 ) = 48 /
Для H 2 O – 18г / Mr ( H 2 O ) = 18 /
Оказалось, что в 32г O 2 , в 48г О 3 , в 18г H 2 O и т.д. содержится одинаковое число молекул, равное 6∙10 23 . Это число назвали числом Авогадро (обозначается N A ).
Сделаем вывод: если мы возьмём такую массу вещества, которая равна атомной массе по величине, но взята в граммах, то там будет всегда (для любого вещества) 6,02∙10 23 атомов этого вещества.
Запись на доске.
N A = 6,02∙10 23 – постоянная Авогадро
Вот это количество вещества, которое содержит 6,02∙10 23 молекул какого – либо вещества, и назвали молем .
Что такое моль? (работа с учебником).
Моль – количество вещества, в котором содержится 6,02∙10 23 молекул, атомов или ионов, т.е. структурных единиц.( записывают определение в тетради)
Бывает моль молекул, моль атомов, моль ионов.
где n – число молей, N – число атомов или молекул, N A – постоянная Авогадро.
кМоль = 10 3 Моль, мМоль = 10 -3 Моль.
0,5 Mo ль – 3,01∙10 23
10 Моль – 60,02∙10 23
А что нужно сделать, чтобы отмерить 1 Моль вещества?
Ответ: нужно взять столько граммов этого вещества, какова его Mr .
Вопрос: Чему равна масса 1 Моля вещества?
Масса 1 Моль вещества называется молярной массой, обозначается М .
│ Mr │=│ M │
И вычисляется по формуле:
M = m / n , единицы измерения: г/Моль, кг/Моль, мг/Моль.
А в тысячу раз большая единица количества вещества (киломоль, кМоль). А в тысячу раз меньшая единица количества вещества (миллимоль, мМоль).
n = m / M , m = M ∙ n
Вывод: Масса Моль измеряется в г/Моль, масса кМоль измеряется в кг/кМоль, масса мМоль измеряется в мг/Моль.
Предлагается задача: Я взяла 64г О 2 . Какое количество вещества (сколько Молей) я взяла? (Два)
n = m / M , n = 64г/32г/Моль = 2Моль.
А сколько молекул кислорода будут содержать эти 64г его. Ответ: 4 Моль.
N = N A ∙ n , N = 6,02∙10 23 ∙ 2Моль = 12,04∙10 23 молекул.
Закрепление.
Число молекул
N = N A ∙ n
Молярная масса
M = m / n
Число Молей
Масса вещества
m = M ∙ n
N = 6,02 ∙10 23 ∙ 5 = 31 ∙10 23
H 2 SO 4
M(FeCl 2 ) = 127 г/Моль
Задача №1. Сколько молей составляют и сколько молекул содержат 8 г кислорода О 2 ?
Дано: m ( O 2 ) = 8г Решение: Mr ( O 2 ) = 16∙2=32.
Найти: n ( O 2 ); N ( O 2 ) n ( O 2 )= m ( O 2 )/ M ( O 2 )=8г/32г/моль=0,25 моль
N ( O 2 ) = N A ∙ n ( O 2 )= 6,02∙10 23 моль -1 ∙0,25 моль=1,505∙10 23
Ответ: 8г кислорода составляют 0,25 моль и содержат 1,505∙10 23 молекул.
Задача №2. Определите массу 0,25 моль серной кислоты.
n ( H 2 SO 4 ) = 0,25 моль 1. Находим молярную массу серной кислоты
Найти: m ( H 2 SO 4 ); 2. Найдем массу вещества m = n ∙ M ;
Ответ: масса 0,25 моль серной кислоты равна 24,5 г.
Повторим то, что мы с вами прошли на уроке:
1. Как обозначается количество вещества и в чём измеряется?
2. Сколько частиц содержит 1 моль любого вещества, как эта величина называется?
3. Чтобы отмерить 1 моль вещества, что надо сделать?
4. Что называется молярной массой, как обозначается, в чём измеряется, чему численно равна?
Итоги урока.
Общий вывод (предлагается записать в тетрадях основные определения и некоторые выводы).
Количество вещества – физическая величина, которая означает определённое число структурных элементов (молекул, атомов, ионов), обозначается n (эн), измеряется в Молях, в миллимолях, киломолях.
1Моль любого вещества содержит число молекул его, равное постоянной Авогадро N A (6,02∙10 23 ).
Чтобы отмерить 1Моль вещества, нужно взять столько граммов его, какова его относительная масса Mr .
Масса 1Моль вещества называется молярной массой (М), она измеряется в г/Моль и численно равна Mr .
Домашнее задание. §15. Упр. 1-3, задания из рабочей тетради: разделы Количество вещества и Молярная масса
Найти массу 24 * 10 23 молекул озона.
n = 24 *10 23 /6 *10 23 = 4 моль
N = 24 * 10 23 молекул
Сколько молекул содержится в 111г гидроксида кальция Ca(OH) 2 ?
n = 111/74 = 1,5 моль
N = 6 *10 23 *1,5 = 9 *10 23 молекул
Учитель: Решим задачки устно:
1. Сколько молекул кислорода содержится в 2 моль его? Какую массу будет иметь это количество кислорода?
2. Какую массу имеют 5 кмоль водорода? Сколько молекул водорода содержится в этом его количестве?
Тип урока: урок изучения и первичного закрепления новых знаний.
Ход урока
I. Организационный момент
III. Изучение нового материала
1. Количество вещества – моль
Вещества вступают в реакцию в строго определённых соотношениях. Например, чтобы получить вещество вода нужно взять столько водорода и кислорода, чтобы на каждые две молекулы водорода приходилась одна молекула кислорода:
Чтобы получить вещество сульфид железа, нужно взять столько железа и серы, чтобы на каждый атом железа приходился один атом серы.
Чтобы получить вещество оксид фосфора, нужно взять столько молекул фосфора и кислорода, чтобы на четыре молекулы фосфора приходилось пять молекул кислорода.
Определить количество атомов, молекул и других частиц на практике невозможно – они слишком малы и не видны невооружённым глазом. Для определения числа структурных единиц (атомов, молекул) в химии применяют особую величину – количество вещества (v – ню). Единицей количества вещества является моль.
- Моль – это количество вещества, которое содержит столько структурных частиц (атомов, молекул), сколько атомов содержится в 12 г углерода.
Экспериментально установлено, что 12 г углерода содержит 6·10 23 атомов. Значит один моль любого вещества, независимо от его агрегатного состояния содержит одинаковое число частиц – 6· 10 23 .
- 1 моль кислорода (O2) содержит 6·10 23 молекул.
- 1 моль водорода (Н2) содержит 6·10 23 молекул.
- 1 моль воды (Н2O) содержит 6·10 23 молекул.
- 1 моль железа (Fe) содержит 6·10 23 молекул.
Задание: Используя полученную информацию, ответьте на вопросы:
а) сколько атомов кислорода содержится в 1 моле кислорода?
б) сколько атомов водорода и кислорода содержится в 1 моле воды (Н2O)?
– 6·10 23 ·2 = 12· 10 23 атомов водорода и 6·10 23 атомов кислорода.
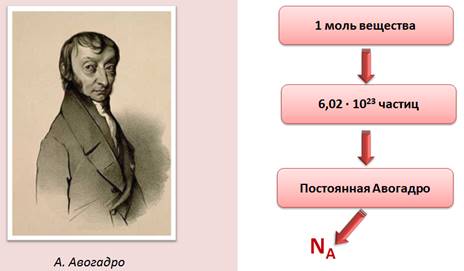
Число 6·10 23 названо постоянной Авогадро в честь итальянского учёного 19 века и обозначается NА. Единицы измерения атомы/моль или молекулы/моль.
2. Решение задач на нахождение количества вещества
Часто нужно знать, сколько частиц вещества содержится в определённом количестве вещества. Или же найти количество вещества по известному числу молекул. Эти расчёты можно сделать по формуле:
| N = v·NА |
где N – число молекул, NА – постоянная Авогадро, v – количество вещества. Из этой формулы можно выразить количество вещества.
| v = N / NА |
Задача 1. Сколько атомов содержится в 2 молях серы?
Задача 2. Сколько атомов содержится в 0,5 молях железа?
Задача 3. Сколько молекул содержится в 5 молях углекислого газа?
Задача 4. Какое количество вещества составляет 12·10 23 молекул этого вещества?
Задача 5. Какое количество вещества составляет 0,6·10 23 молекул этого вещества?
v = 0,6·10 23 / 6·10 23 = 0,1 моль.
Задача 6. Какое количество вещества составляет 3·10 23 молекул этого вещества?
3. Молярная масса
Для химических реакций нужно учитывать количество вещества в молях.
В: Но как на практике отмерить 2, или 2,5 моль вещества? В каких единицах лучше всего измерять массу веществ?
Для удобства в химии используют молярную массу.
Молярная масса – это масса одного моля вещества.
Обозначается – М. Измеряется в г/моль.
Молярная масса равна отношению массы вещества к соответствующему количеству вещества.
| М = т / v |
где М – молярная масса вещества, v – количество вещества, т – масса вещества.
| v = т / М |
Молярная масса – величина постоянная. Численное значение молярной массы соответствует значению относительной атомной или относительной молекулярной массы.
В: Как можно найти значения относительной атомной или относительной молекулярной массы?
Мr (S) = 32; M (S) = 32 г/моль – что соответствует 1 молю серы
Мr (Н2О) = 18; М (Н2О) = 18 г/моль – что соответствует 1 молю воды.
Например, Н2О соответствует одному молю молекулы воды.
В: Сколько молей атомов кислорода и водорода содержится в одном моле молекулы воды?
В одном моле молекулы воды содержится два моля атомов водорода и один моль атомов кислорода.
4. Решение задач на нахождение массы вещества
Задача 7. Определить массу 0,5 моль железа.
Задача 8. Определить массу 0,25 моль меди
Задача 9. Определить массу 2 моль углекислого газа (СO2)
Задача 10. Сколько молей оксида меди – CuО составляют 160 г оксида меди?
Задача 11. Сколько молей воды соответствуют 30 г воды
Задача 12. Сколько молей магния соответствует его 40 граммам?
IV. Закрепление
Фронтальный опрос:
Задачи:
- Сколько молекул содержится в 180 граммах воды?
- Сколько молекул составляет 80 г углекислого газа?
V. Домашнее задание
Изучить текст параграфа, составить две задачи: на нахождение количества вещества; на нахождение массы вещества.

Данный видеофрагмент дает объяснение нового понятия – количества вещества, единицы его измерения, а также знакомит с постоянной Авогадро и новыми формулами. При этом, на основе примеров, учащиеся видят, как находить количество вещества и число структурных единиц, что делает данную тему более доступной для понимания.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Количество вещества"
Следует различать массу и количество: 2 кг яблок – это масса, а 2 яблока – это количество. В жизни мы часто используем определённые порции, например, коробок спичек или мешок зерна, ведь никто из нас не будет поштучно покупать спички или зерно.

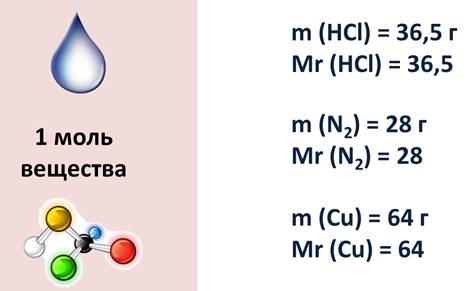
В химии для измерения количество вещества была выбрана единица, которая объединила в себе число частиц и массу. Эта единица называется моль и обозначается буквой n (эн). Чтобы измерить 1 моль любого вещества, нужно взять его столько грамм, какова относительная атомная или относительная молекулярная масса вещества.
Давайте посмотрим на вещества количеством один моль: сравните, как отличается 1 моль воды, соли, кислоты и сахара. Почему? У этих веществ различная относительная молекулярная масса. У воды – 18, соли – 58,5, кислоты – 98, а сахара – 332, поэтому и масса вещества их тоже различна.

Например, 1 моль воды имеет массу 18 г, т.к. относительная молекулярная масса вода равна 18; 1 моль азота имеет массу 28 г, потому что относительная молекулярная масса его равна 28; 1 моль меди равен 64 г, т.к. относительная молекулярная масса ее равна 64.
А если нам нужно узнать, какую массу имеет вода количеством 2 моль, то мы 2 умножим на 18, т.е. 36 г; 0,5 моль азота имеет массу 14 г, т.к. 0,5 умножить на 28, будет 14.
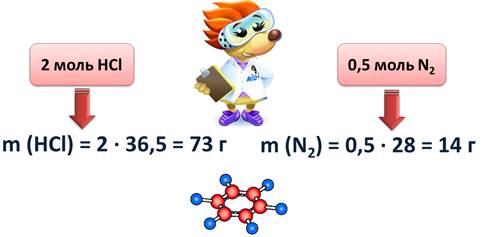
Количество вещества не только связано с массой, но и с числом частиц.
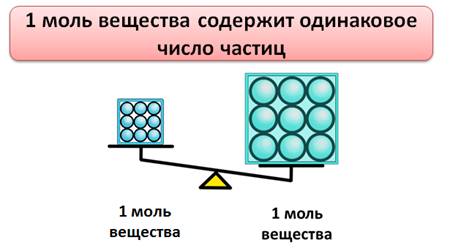
Установлено, что 1 моль любого вещества содержит одинаковое число частиц. Это число равно 6,02 · 10 23 . Это число называется постоянной Авогадро, в честь итальянского ученого А. Авогадро и обозначается оно NA.
Т.е. 1 моль воды имеет массу 18 г и содержит 6,02 · 10 23 частиц; 2 моль воды имеет массу 36 г и содержит 12,04 · 10 23 частиц; 0,5 моль азота имеет массу 14 г и содержит 3,01 · 10 23 частиц.

Для того чтобы узнать число частиц (N), которое содержится в определенном количестве вещества, можно использовать формулу:
N = NA · n
где n – количество вещества, т.е. число молей; N – число частиц.
Из этой формулы верны и следующие выражения:
NA = N/ n
n = N/ NA
Теперь дадим определение понятия моль – это такое количество вещества, в котором содержится 6,02 · 10 23 частиц этого вещества.
Используя новые формулы, решим задачи.
1. Определите количество вещества кислорода, в котором содержится 18,06 · 10 23 молекул.
Нам дано число молекул кислорода, найти нужноколичество вещества кислорода. Для решения этой задачи используем формулу n = N/ NA, подставляем значения в выражение и находим результат (величина NA является потоянной). Получается 3 моль. Следовательно, количество кислорода равно 3 моль.

2. Определите число молекул хлора (Cl2) которое, содержится в порции этого газа количеством вещества 0,1 моль.
В этой задаче по условию нам дано количество вещества хлора. Найти нужно число молекул. Следовательно, используем формулу N = NA · n, подставим данные в формулу, получаем результат 0,602 · 10 23 молекул. Получается, что порция хлора количеством 0,1 моль содержит 0,602 · 10 23 молекул.

В текущем учебном году урок разработан для восьмиклассников.
Задачи урока:
воспитывающая: воспитывать взаимовыручку и взаимодействие через групповую форму работы;
развивающие: развивать познавательный интерес к предмету и навыки самооценки знаний, умение логически мыслить, выдвигать гипотезы, делать аргументированные выводы,
обучающая: формировать понятия о молярной массе и единицах ее измерения, показать взаимосвязь понятий: масса, количество вещества, молярная масса, молярный объем газа.
личностные: формировать умения понимать значимость естественнонаучных и математических
знаний для решения практических задач,
устанавливать связь между целью деятельности и ее результатом, оценивать
собственный вклад в работу группы;
метапредметные: формировать умения планировать, контролировать и оценивать учебные действия
в соответствии с поставленной задачей,
самообразование, самоорганизация, саморазвитие и самоопределение,
сотрудничество в команде (планирование, распределение функций, взаимопомощь, взаимоконтроль);
предметные: установить взаимосвязь понятий: масса, количество вещества, молярная масса,
молярный объем газа.
Ученики знают понятия:
на повышенном уровне: киломоль, миллимоль.
на базовом уровне: называть количество вещества и молярную массу по обозначениям, указывать единицы измерения, видоизменять расчетную формулу при решении прямых задач;
для повышенного уровня: видоизменять расчетную формулу при решении прямых и обратных задач, производить белее сложные расчёты (например, находить массу вещества, если известен объем или число структурных частиц).
Межпредметные связи: математика, информатика, физика, биология.
Виды учебной деятельности: проводят соответствие между названием величин и их единиц измерения; внимательно прочитывают задачу, оформляют ее решение; работают с весами и измерительным цилиндром, проводят расчеты; доказывают свою точку зрения; решают задачу в программе Microsoft Office Excel.
Характер деятельности: частично-поисковый с элементами исследования.
Методы и формы обучения: объяснительно-иллюстративный с элементами проблемно-поискового изложения; групповая работа по решению задач.
Используемые педагогические технологии: игровые, групповые, ИКТ, проблемно-поисковый (дифференцированный, работа по схеме-алгоритму).
Оборудование: ИД, презентация, весы с разновесами, мерный цилиндр, химический стакан, столовая ложка, фильтровальная бумага, чашка Петри, одноразовые стаканчики, салфетки, кусочки мела, минеральная вода, сахар-рафинад.
В целях повышение качества образования, совершенствования научно-методического обеспечения образовательного процесса используются групповая форма работы, исследовательский метод, которые повышают мотивацию, позволяют выбирать индивидуальный темп, решать творческие задачи, формируют навыки самоорганизации и самообразования, обеспечивают деятельностный и личностно-ориентированный характер образования, который является неотъемлемой частью Федеральных Государственных стандартов второго поколения.
Актуальность и оригинальность:
Материалы уроков могут быть использованы на уроках химии, информатики, математики, физики, биологии.
Приемы, методы, формы обучения соответствуют возрастным психологическим и педагогическим особенностям восьмиклассников.
Использование ИКТ на уроках химии позволяет стимулировать познавательную активность детей и участвовать в освоении новых знаний через поиск необходимой информации, развитие умений находить несколько способов решения проблемной задачи
При проведении уроков используются:
интерактивная доска, что позволяет сделать занятия интересными и развивают мотивацию; предоставляют больше возможностей учащимся для участия в коллективной работе, легче воспринимать и усваивать сложные вопросы в результате более ясной, эффективной и динамичной подачи материала. Школьники работают у доски с удовольствием, более творчески, с уверенностью в себе. Учитель может своевременно вносить коррективы, организовать коллективное обсуждение,
электронные модули из базы ФЦИОР:
Читайте также:

