Классификация химических реакций в органической и неорганической химии конспект
Обновлено: 07.07.2024
Оборудование и реактивы. Мультимедийная установка. Раздаточный материал. Магний, цинк, р-р соляной кислоты, бихромат аммония, р-р гидроксида натрия, спиртовка, универсальный индикатор.
Учащиеся дают определение химической реакции. Демонстрируется презентация, выполненная учащимися.Приложение1. Презентация
Рассмотрим примеры реакций.
Определите тип химической реакции, уравняйте, назовите реагенты. Чем отличаются эти реакции?
(Реакции разложения, а и б - ОВР )
Определите тип химической реакции, уравняйте, назовите реагенты. Чем отличаются эти реакции?
(Реакции соединения, в - реакция присоединения, г - ОВР)
Опыт. Горение магния.
Определите тип химической реакции, уравняйте, назовите реагенты. Чем отличаются эти реакции?
(Реакции замещения, б и г - ОВР)
Опыт. Взаимодействие цинка с раствором соляной кислоты
Определите тип химической реакции, уравняйте, назовите реагенты. Какие из этих реакций возможны и почему?
(а, б, г, д - реакции ионного обмена, д - реакция нейтрализации, реакция в - невозможна, т.к. не образуется осадок, газ, малодиссоциированное вещество)
Опыт. Взаимодействие гидроксида натрия с раствором соляной кислоты.
Запишите реакции а, б, г и д -в ионном виде.
Запишите примеры реакций аллотропизации.
Запишите примеры реакций изомеризации.
Тепловой эффект реакции горения угля равен 410 кдж/моль. Вычислите количество тепла, которое выделится при сгорании 2 кг угля.
Запишите уравнеиие реакции. Укажите её тип согласно классификации вашего учебника.
Дайте определение степени окисления.
На доске записана структурная формула органического вещества. Определяем степени окисления углерода и азота в этом соединении:

.
Уравниваем окислительно-восстановительную реакцию методом баланса.
Учащиеся уравнивают ОВР на карточках.
К какому типу реакций можно отнести это уравнение:
3. Не относится к реакции соединения, разложения, замещения, обмена.
Учащиеся делают вывод. Подводится итог.
Классификаций химических реакций существует множество. Любая классификация - это отражение определённых свойств веществ. Не все реакции можно определить к какому-то типу реакции. Одну и ту же реакцию можно отнести сразу к нескольким типам реакций. Это говорит об относительности всех классификаций.

С помощью данного видеосюжета учащиеся смогут обобщить представления о химической реакции как о процессе превращения одного или нескольких исходных веществ в продукты реакции, отличающихся от начальных по химическому составу или строению. Этот видеоурок рассказывает о многочисленных классификациях веществ в органической и неорганической химии, особенностях органических реакций.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Классификация химических реакций в органической и неорганической химии"
Мир химических реакций огромен и многообразен. Сущность химических реакций состоит в превращении одних веществ в другие. При этом разрушается структура исходных веществ за счёт разрыва химических связей и возникают новые вещества с новыми связями и другим строением. Каждая химическая реакция имеет свои характеристики.
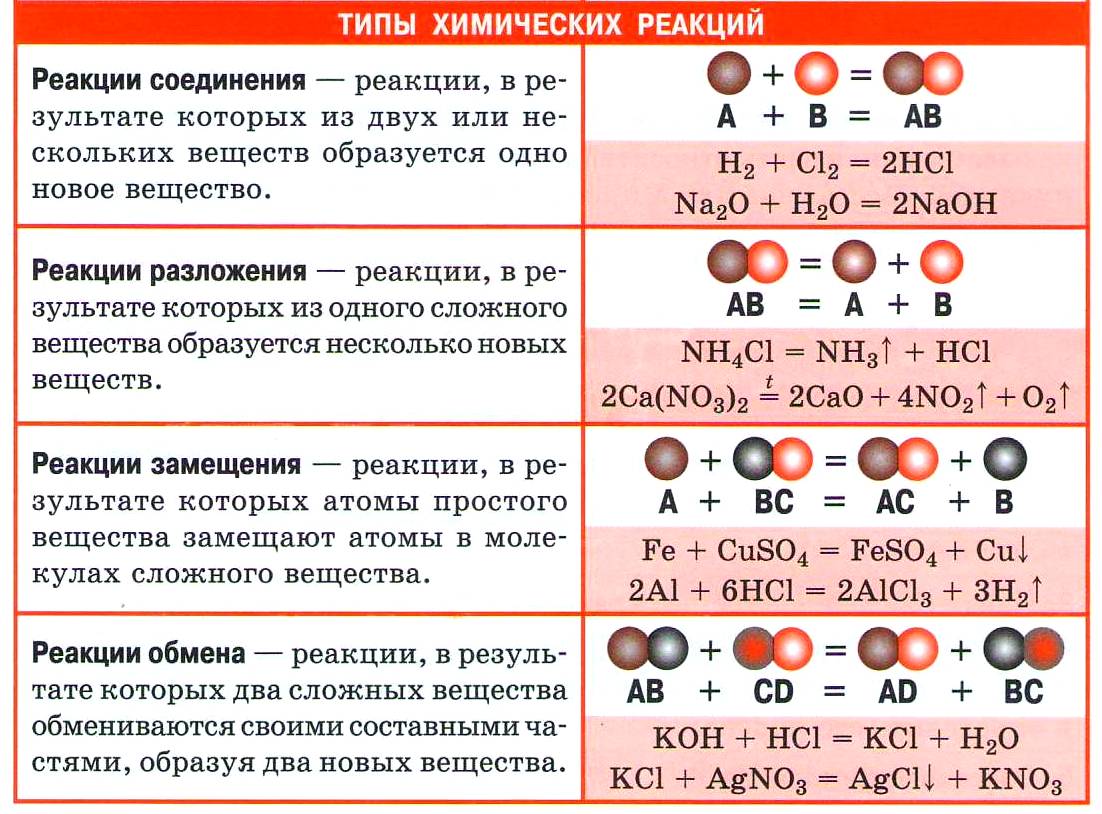
Неорганические реакции классифицируют по нескольким признакам. По числу и составу исходных веществ и продуктов реакции можно выделить следующие типы химических реакций: реакции соединения, реакции разложения, реакции замещения и реакции обмена.

Реакции соединения – это реакции, в ходе которых из двух или более веществ образуется одно сложное вещество.

Существует большое число реакций соединения простых веществ: например, железа и хлора с образованием хлорида железа три, водорода с хлором с образованием хлороводорода.

А также известно много реакций соединения сложных веществ: например, в результате взаимодействия оксида калия и воды образуется гидроксид калия, в реакции оксида магния и оксида серы шесть образуется сульфат магния, в реакции хлорида железа два с хлором образуется хлорид железа три.

Реакциями разложения называются реакции, в результате которых из одного сложного вещества образуются два или более новых веществ.

Так, в реакции разложения карбоната бария образуется оксид бария и углекислый газ, в реакции разложения нитрата серебра один образуется серебро, оксид азота четыре и кислород, в реакции разложения малахита образуется оксид меди два, углекислый газ и вода.
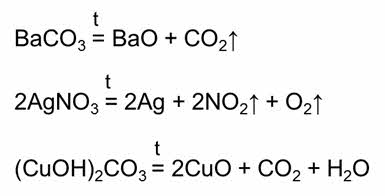
Реакции замещения – это реакции между простыми и сложными веществами, при протекании которых атомы простого вещества замещают атомы одного из элементов в молекуле сложного вещества.

Например, в реакции алюминия с оксидом железа три образуется железо и оксид алюминия, в реакции хлора с бромидом калия образуется хлорид калия и бром, в реакции карбоната кальция с оксидом кремния четыре образуется силикат кальция и углекислый газ.

Реакциями обмена называются реакции между двумя сложными веществами, которые обмениваются своими составными частыми.

Так, в реакции азотной кислоты с гидроксидом натрия образуется нитрат натрия и вода, в реакции хлорида бария с серной кислотой образуется сульфат бария и соляная кислота, в реакции карбоната натрия с соляной кислотой образуется хлорид натрия, углекислый газ и вода.

В результате реакций обмена обычно образуется осадок, газообразное вещество или слабый электролит.
По признаку изменения степеней окисления элементов в молекулах реагирующих веществ, все реакции делятся на: окислительно-восстановительные, которые идут с изменением степени окисления, и на реакции, идущие без изменения степени окисления.
Так, реакция разложения карбоната кальция до оксида кальция и оксида углерода четыре не является окислительно-восстановительной, так как элементы здесь не изменяют свои степени окисления.
А реакция меди с хлором является окислительно-восстановительной, потому что медь повышает свою степень окисления с нуля до плюс двух, а хлор понижает свою степень окисления с нуля до минус единицы. Медь является восстановителем, а хлор – окислителем.

По знаку теплового эффекта все реакции делятся на: экзотэрмические, идущие с выделением теплоты, и эндотермические, которые идут с поглощением теплоты.
Например, реакция образования хлороводорода из водорода и хлора является экзотэрмической, а реакция образования оксида азота два из азота и кислорода является эндотэрмической.

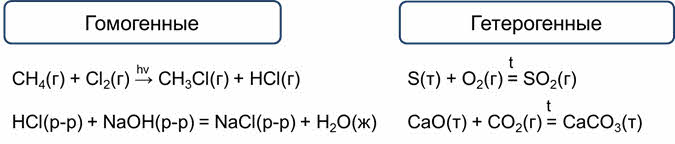
По признаку однородности реакционной системы различают реакции гомогенные, протекающие в однородной системе, и гетэрогенные, протекающие в неоднородной системе.
Например, реакция метана с хлором является гомогенной, потому что исходные вещества и продукт реакции находятся в одном агрегатном состоянии – газообразном.
Реакция соляной кислоты с гидроксидом натрия также является гомогенной, так как все вещества являются жидкостями.
А реакция серы с кислородом будет гетэрогенной, так как сера является твёрдым веществом, а кислород и сернистый газ – газообразными.
Реакция оксида кальция с оксидом углерода четыре также будет гетэрогенной, потому что оксид кальция и карбонат кальция являются твёрдыми веществами, а оксид углерода четыре – газом.
В зависимости от присутствия или отсутствия катализатора реакции делятся на: каталитические, которые идут с участием катализатора и некаталитические, идущие без участия катализатора.
Например, реакция образования оксида серы шесть из оксида серы четыре и кислорода является каталитической, так как эта реакция идёт в присутствии катализатора – оксида ванадия пять.
А реакция серной кислоты с гидроксидом натрия будет некаталитической, так как не требует участия катализатора.

По признаку обратимости все реакции делят на необратимые, которые идут только в одном направлении и на обратимые, которые идут одновременно в прямом и обратном направлении. Например, реакция образования аммиака из азота и водорода является обратимой, а реакция горения метана – необратимой.

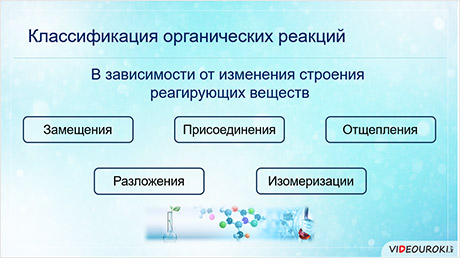
В органической химии реакции классифицируют в зависимости от изменения строения реагирующих молекул и характера изменения связей. Кроме того, органические реакции имеют свои особенности.
Органические реакции идут медленно и требуют определённых условий: температура, давление, катализатор. Выход продуктов реакции невысокий, так как большинство реакций идёт в несколько стадий.

Cуществует несколько классификаций органических реакций.
Первая классификация по механизму реакции, то есть по разрыву ковалентной связи. Это гомолитические, или радикальные реакции, которые идут с образованием радикалов – частиц с неспаренным электроном. Их течение сопровождается гомолитическим разрывом связи.

Например, гомолотической реакцией является реакция хлорирования алканов, которая идёт по свободнорадикальному цепному механизму.
Гетэролитические, или ионные реакции протекают с образованием катиона и аниона. Гетэролитический разрыв ковалентной связи приводит к образованию нуклеофилов (анионов) и электрофилов (катионов).
В зависимости от природы атакующего реагента реакции могут быть нуклеофильными и электрофильными.
Нуклеофильными являются реакции, где реагентом является нуклеофил, то есть анион или молекула, которые предоставляют свою пару электронов на образование новой связи.
Например, в реакции хлорметана с с гидроксидом натрия гидроксид натрия выступает в роли нуклеофильного реагента.
Электрофильными называются реакии с электрофильными реагентами (электрофилами), то есть катионами или молекулами, которые имеют свободную орбиталь, которая может принять электроны для образования новой связи.

Так, в реакции этилена с хлороводородом электрофилом является катион водорода в составе хлороводорода.
В зависимости от изменения строения реагирующих веществ реакции разделяют на реакции замещения, присоединения, отщепления, разложения и изомеризации.
В реакциях замещения атом или группа атомов в исходной молекуле замещается на атом или группу атомов.
Например, в реакции хлорирования метана, атом хлора замещает один атом водорода в молекуле метана, при этом образуется хлорметан и хлороводород. В реакции бензола с хлором в присутствии катализатора, атом хлора также замещает один атом водорода в молекуле бензола и образуется бромбензол и хлороводород. Реакции замещения характерны для алканов, ароматических соединений, спиртов, фенолов, карбоновых кислот, углеводов.

В реакциях присоединения происходит разрыв пи-связей и присоединение к атомам углерода и гетэроатомам фрагментов реагентов.
Например, в реакции пропэна с бромом разрывается пи-связь в молекуле пропэна и к каждому атому углерода при двойной связи присоединяется атом брома. В данной реакции образуется один-два-дибромпропан. В реакции бутаналя с водородом в молекуле бутаналя также разрывается пи-связь, по месту разрыва этой связи присоединяется водород, при этом образуется бутанол-один.

Таким образом, реакции присоединения характерны для углеводородов с кратными связями, альдэгидов, кетонов, моносахаридов, при определённых условиях эти реакции характерны и для ароматических соединений.
Реакции отщепления характерны для галогенуглеводородов и спиртов. Так, в реакции один-бромбутана со спиртовым раствором щёлочи образуется бромид натрия, вода и бутэн-два. При отщеплении воды от молекулы этанола образуется этэн.

В ходе реакций разложения из одного органического вещества образуются новые вещества. Например, при тэрмическом крекинге бутана образуется этан и этэн. Таким образом, разорвались углеро-углеродные связи и образовался алкан и алкен.

Реакциями изомеризации называются реакции превращения данного органического вещества в его изомер. Например, в реакции изомеризации пентана образуется его изомер – два-метилбутан.

Особым видом органических реакций являются реакции полимеризации и реакции поликондэнсации. Так, в реакции полимеризации этилена образуется полиэтилен.
В реакции полимеризации стирола – полистирол.

В реакции поликондэнсации шесть-аминогексановой кислоты образуется капрон и низкомолекулярное вещество – вода. Примером реакции поликонденсации служит также реакция получения крахмала из глюкозы.

С участием кислорода или водорода проходят реакции окисления и восстановления. При этом происходит изменение степеней окисления. Так, при окислении этаналя гидроксидом меди два образуется этановая кислота. При этом степень окисления углерода меняется от плюс единицы до плюс трёх. При восстановлении уксусного альдэгида в присутствии никелевого катализатора образуется спирт – этанол. Степень окисления углерода изменяется с плюс единицы до минус единицы.
Таким образом, классифицировать химические реакции можно по различным признакам. Химические реакции сопровождаются разрывом одних связей и образованием других связей.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
20. Классификация химических реакций в неорганической и органической химии
Химические реакции – это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению.
Классификация реакций
По числу и составу реагирующих веществ и продуктов реакции:
Реакции, идущие без изменения состава вещества:
В неорганической химии это реакции превращения одних аллотропных модификаций в другие:
C (графит) → C (алмаз);
P (белый) → P (красный).
В органической химии это реакции изомеризации – реакции, в результате которых из молекул одного вещества образуются молекулы других веществ того же качественного и количественного состава, т.е. с той же молекулярной формулой, но другим строением.
н-бутан 2-метилпропан (изобутан)
Реакции, идущие с изменением состава вещества:
а) Реакции соединения (в органической химии присоединения) – реакции, в ходе которых из двух и более веществ образуется одно более сложное: S + O 2 → SO 2
В органической химии это реакции гидрирования, галогенирования, гидрогалогенирования, гидратации, полимеризации.
б) Реакции разложения (в органической химии отщепления, элиминирования ) – реакции, в ходе которых из одного сложного вещества образуется несколько новых веществ:
В органической химии примеры реакций отщепления - дегидрирование, дегидратация, дегидрогалогенирование, крекинг.
в) Реакции замещения – реакции, в ходе которых атомы простого вещества замещают атомы какого-нибудь элемента в сложном веществе (в органической химии – реагентами и продуктами реакции часто являются два сложных вещества).
Примеры реакций замещения, не сопровождающихся изменением степеней окисления атомов, крайне немногочисленны. Следует отметить реакцию оксида кремния с солями кислородсодержащих кислот, которым отвечают газообразные или летучие оксиды:
г) Реакции обмена – реакции, в ходе которых два сложных вещества обмениваются своими составными частями:
По изменению степеней окисления химических элементов, образующих вещества
Реакции, идущие с изменением степеней окисления, или ОВР:
∙ 2| N +5 + 3e – → N +2 (процесс восстановления, элемент – окислитель),
∙ 3| Cu 0 – 2e – → Cu +2 (процесс окисления, элемент – восстановитель),
В органической химии :
Всегда ОВР: реакции с участием простых веществ.
Никогда не бывают ОВР: реакции обмена.
Реакции, идущие без изменения степеней окисления химических элементов:
По тепловому эффекту
Экзотермические реакции протекают с выделением энергии:
Эндотермические реакции протекают с поглощением энергии:
По агрегатному состоянию реагирующих веществ
Гетерогенные реакции – реакции, в ходе которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях:
Гомогенные реакции – реакции, в ходе которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии:
По участию катализатора
Некаталитические реакции , идущие без участия катализатора:
Каталитические реакции , идущие с участием катализаторов:
Необратимые реакции протекают в данных условиях только в одном направлении:
Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях:
По механизму протекания
Радикальный механизм: А : В → А· + ·В
Происходит гомолитический (равноценный) разрыв связи. При гемолитическом разрыве пара электронов, образующая связь, делится таким образом, что каждая из образующихся частиц получает по одному электрону. При этом образуются радикалы – незаряженные частицы с неспаренными электрономи. Радикалы – очень реакционноспособные частицы, реакции с их участием происходят в газовой фазе с большой скоростью и часто со взрывом.
Радикальные реакции идут между образующимися в ходе реакции радикалами и молекулами:
Примеры: реакции горения органических и неорганических веществ, синтез воды, аммиака, реакции галогенирования и нитрования алканов, изомеризация и ароматизация алканов, каталитическое окисление алканов, полимеризация алкенов, винилхлорида и др.
Ионный механизм: А : В → :А - + В +
Происходит гетеролитический (неравноценный) разрыв связи, при этом оба электрона связи остаются с одной из ранее связанных частиц. Образуются заряженные частиц (катионы и анионы).
Ионные реакции идут в растворах между уже имеющимися или образующимися в ходе реакции ионами.
Например, в неорганической химии – это взаимодействие электролитов в растворе, в органической химии – это реакции присоединения к алкенам, окисление и дегидрирование спиртов, замещение спиртовой группы и другие реакции, характеризующие свойства альдегидов и карбоновых кислот.
По виду энергии, инициирующей реакцию:
Фотохимические реакции происходят при воздействии квантов света. Например, синтез хлороводорода, взаимодействие метана с хлором, получение озона в природе, процессы фотосинтеза и др.
Радиационные реакции инициируются излучениями больших энергий (рентгеновскими лучами, γ-лучами).
Электрохимические реакции инициирует электрический ток, например, при электролизе.
Термохимические реакции инициируются тепловой энергией. К ним относятся все эндотермические реакции и множество экзотермических, для инициации которых необходима теплота.
Вспомните, чем отличаются химические явления или химические реакции от физических (Конспект).

Химические реакции, протекающие
без изменения состава веществ.
Одно из положений теории химического строения утверждает, что свойства веществ зависят не только от их качественного и количественного состава, но и от строения. Следовательно, можно сделать вывод, что некоторые химические реакции могут сопровождаться изменением только качественного или только количественного состава исходных и образующихся веществ или же изменением их строения.
На примере кислорода и озона можно проиллюстрировать философский закон о переходе количественных отношений в качественные. Вспомните и сравните физические, химические и физиологические свойства кислорода и озона.
Влияние строения простых веществ, образованных одним химическим элементом на их свойства, иллюстрируют аллотропные модификации углерода.
Процесс получения искусственных алмазов моделирует природные экстремальные явления: проводится при очень высоких давлениях и температурах.
Первые сведения об аллотропии и аллотропных модификациях связаны с фосфором. В 1669 г. алхимик Хеннинг Брант, прокаливая сухой остаток мочи в попытке получить философский камень, получил белый фосфор (от греч. phos — свет и phoros — несущий), который затем превратился в красный.
Химические реакции, протекающие
с изменением состава веществ
(по признаку числа и состава реагентов и продуктов реакции).
Из курса химии основной школы вы знаете четыре типа реакций по этому признаку: соединения, разложения, замещения и обмена.
1. Реакции соединения (присоединения)
В неорганической химии весь спектр разнообразных реакций можно проиллюстрировать примерами промышленных процессов:
- Реакция горения фосфора — первая стадия получения чистой фосфорной кислоты: 4Р + 5O2 = 2Р2O5
В этом процессе участвуют два простых вещества и получается одно сложное.
- Заключительная стадия получения фосфорной кислоты описывается уравнением Р2O5 + 3Н2O = 2Н3РO4(сложное вещество образуется в результате взаимодействия двух сложных веществ).
- На заключительной стадии получения азотной кислоты в реакцию вступают три вещества (одно простое и два сложных): 4NO2 +O2 + 2Н2O = 4HNO3
В органической химии реакции соединения называются реакциями присоединения, так как к основному веществу (субстрату) присоединяется дополнительное вещество (реагент). Такие реакции характерны для непредельных углеводородов и в зависимости от реагента носят видовые названия:
- гидрирование — присоединение водорода;
- галогенирование — присоединение галогенов;
- гидрогалогенирование — присоединение галогеноводородов;
- гидратация — присоединение воды.
Частным случаем реакции присоединения является реакция полимеризации — соединение множества одинаковых молекул мономера в макромолекулу полимера.
2. Реакции разложения (отщепления)
Рассмотрим реакции разложения на примере реакций получения кислорода лабораторными способами.
Последняя реакция используется не для получения кислорода, а в медицинских целях. Полученное при разложении серебро прижигает ранки или удаляет бородавки, если используется особый ляписный (от лат. lapis infernalis — адский камень) карандаш.
В органической химии реакции разложения называют реакциями отщепления. Так, для получения этилена используются реакции дегидратации этанола, деполимеризации полиэтилена, дегидрирования этана (запишите уравнения реакций).
3. Реакции замещения
Как видно из определения, эти реакции характеризуют свойства классов простых веществ. Например, такое важное свойство галогенов, как их способность вытеснять менее активные галогены из растворов галогеноводородных кислот или их солей: Сl2 > Вг2 > I2.
Аналогично, этот тип реакций характеризует химические свойства металлов:
- Щелочные и щёлочноземельные металлы активно взаимодействуют с водой: 2Na + 2Н2O = 2NaOH + Н2↑
- С растворами кислот взаимодействуют металлы, стоящие в ряду напряжений до водорода: Zn + 2НСl = ZnCl2 + H2↑
- Металлы, стоящие в ряду напряжений до металла соли, вытесняют его из раствора соли: Fe +CuSO4 = Сu +FeSO4
- Более активные металлы вытесняют менее активные из их оксидов с выделением большого количества теплоты — металлотермия: 2Аl +Fe2O3 = Аl2O3 + 2Fe
Реакции замещения характерны для предельных соединений, например галогенирование метана, согласно цепочке переходов: СН4 –> СН3Сl –> СН2Сl2 –> СНСl3 –> ССl4.
Нитрование бензола относится к реакциям замещения, но протекает между двумя сложными веществами: С6Н6 + HNO3 —> C6H5NO2 + Н2O
В органической химии продуктами реакций этого типа являются не простое и сложное вещества, а два сложных. Кроме этого, в реакцию замещения могут вступать и сложные вещества.
4. Реакции обмена
Для растворов электролитов такие реакции протекают в соответствии с правилом Бертолле (названным по имени предложившего его французского химика Клода Бертолле) и возможны в том случае, если образуется осадок, газ или малодиссоциирующее вещество (например, вода).
- Золотисто–жёлтый осадок иодида свинца выпадает при взаимодействии растворов иодида натрия и нитрата свинца:
2NH4Cl + Са(ОН)2 = СаСl2 + 2NH3↑ + 2Н2O
NH4 + + ОН – = NH3↑ + Н2O
- Частным случаем реакции обмена является реакция нейтрализации — она протекает между растворами кислот и щелочей:
NaOH + НСl = NaCl + Н2O
OH – + H + = H2O
Химические реакции, протекающие
с тепловым эффектом.
Важный классификационный признак реакций — выделение или поглощение теплоты. Как правило, реакции соединения сопровождаются выделением теплоты. Такие реакции называются экзотермическими.
Если экзотермическая реакция сопровождается выделением света, то она называется реакцией горения: 2Mg + О2 = 2MgO + Q
Важным источником теплоты и энергии является горение углеводородов: СН4 + 2О2 –> СО2↑ + 2Н2О + Q
Но нет правил без исключения: реакция взаимодействия азота с кислородом сопровождается поглощением теплоты: N2 + О2 2NO – Q
Схематично экзо- и эндотермические реакции отражает рисунок.
Если в уравнении реакции указывается тепловой эффект, то уравнение называется термохимическим.
Например:
СН4 + 2О2 —> СO2 + 2Н2O + 800 кДж — реакция экзотермическая;
СаСO3 = СаО + СO2 – 187 кДж — реакция эндотермическая.
Классификация реакций по другим критериям
Классификация реакций — многоплановый процесс. Их можно классифицировать также:
- по направлению (обратимые и необратимые реакции);
- по использованию катализатора (каталитические и некаталитические реакции);
- по агрегатному состоянию реагентов и продуктов реакции (гомогенные и гетерогенные реакции);
- по изменению степеней окисления элементов, образующих реагенты и продукты реакции (окислительно–восстановительные и реакции, протекающие без изменения степеней окисления).

Читайте также:

