Кислоты 8 класс химия конспект урока презентация
Обновлено: 06.07.2024
После того как вы поделитесь материалом внизу появится ссылка для скачивания.
Подписи к слайдам:
Составитель: учитель химии
Зиновьева Анастасия Андреевна
Изучить классификацию и химические свойства кислот.
Задание: распределите формулы по классам в таблицу HCl, HNO3, H2SO4, Ca(OH)2, K2O, Na2O, Al2O3, Zn(OH)2, Al(OH)3
Кислоты – это сложные вещества, молекулы которых
состоят из атомов водорода и кислотного остатка.
Способы образования названий кислот:
Бескислородные кислоты:
неметалл-о-водородная кислота
HCl – хлороводородная кислота
H2S – сероводородная кислота
Кислородсодержащие кислоты:
неметалл-ист(н)-ая кислота
HNO2 – азотистая кислота
HNO3 – азотная кислота
1. Наличие кислорода
H2SO4, HNO3, H3PO4
2. Основность (число атомов водорода в молекуле, способных замещаться на металл)
На данном уроке изучается состав кислот, номенклатура, классификация кислот, определение зарядов кислотного остатка. Выполняется лабораторная работа по изучению свойств кислот. На уроке использована презентация.


Целевая аудитория: для 8 класса
Хороший урок, неплохая презентация. Единственный небольшой минус - некоторые фотографии и картинки низкого качества, либо они чрезмерно увеличены. Спасибо.
Очень полезный материал.Бери и используй!Спасибо Вам за труд и экономию моего времени! Успехов и дальнейших наработок .Редко встретишь такой конкретный материал.

Физкультминутки обеспечивают кратковременный отдых детей на уроке, а также способствуют переключению внимания с одного вида деятельности на другой.


Диплом и справка о публикации каждому участнику!



© 2007 - 2022 Сообщество учителей-предметников "Учительский портал"
Свидетельство о регистрации СМИ: Эл № ФС77-64383 выдано 31.12.2015 г. Роскомнадзором.
Территория распространения: Российская Федерация, зарубежные страны.
Учредитель: Никитенко Евгений Игоревич
Сайт является информационным посредником и предоставляет возможность пользователям размещать свои материалы на его страницах.
Публикуя материалы на сайте, пользователи берут на себя всю ответственность за содержание материалов и разрешение любых спорных вопросов с третьими лицами.
При этом администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта.
Если вы обнаружили, что на сайте незаконно используются материалы, сообщите администратору через форму обратной связи — материалы будут удалены.
Все материалы, размещенные на сайте, созданы пользователями сайта и представлены исключительно в ознакомительных целях. Использование материалов сайта возможно только с разрешения администрации портала.

Фотографии предоставлены
Цели урока: Сформировать представления учащихся о кислотах как одном из классов неорганических веществ.
- сформировать понятие о кислотах; рассмотреть состав, название, классификацию кислот;
- познакомить учащихся с представителями неорганических кислот;изучить химические свойства кислот ;продолжить формирование знаний о различных зарядах ионов и степени окисления элементов.
- Развивать практические навыки; учить анализировать полученную информацию;развивать логическое мышление путем сравнения, обобщения, систематизации;учить выделять причинно-следственные связи
- Развивать интерес к предмету; развивать взаимосвязь между предметами; развивать знания о применении химии в быту; учить аккуратности при выполнении химических опытов
Оборудование: мультимедийная презентация (ПК, проектор); штатив для пробирок, пробирки, спиртовка, спички, держатель для пробирок, химические стаканы, белый экран для демонстрации опытов
Реактивы: индикаторы: лакмус, метилоранж, фенолфталеин; кислоты: соляная и серная;металлы: цинк, железо, медь;оксид меди (II); гидроксид натрия;соли: сульфат меди (II), хлорид бария, карбонат кальция
Тип урока: изучение нового материала
I. Организационный момент. Введение в тему.
II. Проверка домашнего задания
1. 2 ученика выполняют домашнее задание у доски
2. Работа с тренажерами
3. Актуализация опорных знаний (работа с классом)
1. Вспомните как классифицируют неорганические соединения? ( На оксиды, основания, кислоты и соли).
2. Назовите какие из них мы с вами уже изучили. (Оксиды и основания).
(Показываю 2-3 карточки с формулами оксидов).
3. Какой класс неорганических соединений я вам показываю? (Оксиды).
4. На основании чего вы сделали такой вывод? (Дают определение оксидам).
5. Прочитайте и назовите каждый оксид.(Показываю 2-3 карточки с основаниями).
6. Формулы каких веществ я показываю сейчас? (Оснований).
7.Почему эти вещества относятся к основаниям? (Дают определение оснований).
8. Прочитайте и дайте названия этим основаниям.
III. Актуализация знаний учащихся
Учитель: В этом учебном году вы приступили к изучению новой для вас науки. Как известно, химия – наука о веществах. Какие классы веществ вам известны? (cлайд 1). (металлы, неметаллы, оксиды, основания, кислоты, соли).
Слайд 4 – тема урока.
Слайд 5 – цели урока:
- сформировать понятие о кислотах;
- рассмотреть состав, название, классификацию кислот;
- познакомиться с представителями неорганических кислот;
- изучить химические свойства кислот.
IV. Изучение нового материала
Учитель: С понятием кислоты вы встречались неоднократно в бытовой жизни. Какие кислоты вам известны? Где встречаются эти кислоты?
1. Кислоты вокруг нас
Учитель: Кислоты постоянно присутствуют вокруг нас. Например, дождевая вода на первый взгляд кажется чистой. На самом деле в ней присутствует немало других веществ. За счет растворения углекислого газа из атмосферы она является раствором угольной кислоты. После летней грозы в ней оказывается еще и азотная кислота, которая получается из оксидов азота, образующихся при горении воздуха вокруг плазменного шнура молнии, при работе реактивных двигателей самолетов (ракет) и под воздействием солнечной радиации. Ежегодно с дождями на землю выпадает примерно 100 млн т азотной кислоты. Это немало. Извержение вулканов и сгорания топлива способствуют появлению в дождевой и снеговой воде серной кислоты( cлайд 6).
Учитель: Если вы присядете вблизи муравейника, то надолго запомните жгучие укусы его обитателей. Муравей впрыскивает в ранку от укуса яд, содержащий муравьиную кислоту. Муравьиной кислотой обусловлено жжение крапивы, ее выделяют некоторые гусеницы. Голожаберные моллюски в порядке самообороны выстреливают парами серной кислоты (cлайд 7).
Учитель: “Химическое оружие” используется в природе весьма широко. Мухоморы в качестве ядовитых токсинов “используют” иботеновую кислоту. Это вещество так ядовито, что мухомору незачем прятаться (cлайд 8).
Самая значительная функция кислот в природе состоит в разрушении горных пород и образовании почвы ( слайд 9).
Важна роль кислот и в человеческом организме: аскорбиновая кислота – поставщик витамина С, фолиевая кислота – витамин В9, аминокислоты образуют множество белков, соляная кислота – сильнейший бактерицид, находящийся у нас в желудке, помогает переваривать пищу, ацетилсалициловая кислота – жаропонижающее средство, молочная кислота образуется в мышцах при физической нагрузке. Олеиновая кислота – это одна из самых полезнейших жирных кислот, без которых нормальный обменный процесс в человеческом организме осуществляться не будет. Гиалуроновая кислота входит в состав многих тканей (кожа, хрящи, стекловидное тело), используется в косметике, как составная часть средств ухода за кожей: кремов, губной помады, лосьонов и пр. Таким образом, мы видим, что наше самочувствие в значительной степени связано с деятельностью кислот (слайд 10).
2. Определение кислот
Учитель: Ребята, а что же собой представляют кислоты с точки зрения химических соединений? Чтобы ответить на этот вопрос давайте запишем формулы и названия некоторых кислот ( слайд 11).
Скажите, пожалуйста, что общего у всех кислот?
Учащиеся: Наличие водорода
Учитель: Совершенно верно. Давайте запишем определение кислот (слайды 12 – 13).
Кислоты - это сложные вещества, состоящие из одного или нескольких атомов водорода и кислотного остатка.
3. Первичное закрепление материала (слайды 14 – 16).
Задание 1. Подчеркните кислотный остаток в молекулах кислот: H2SO4; H2CO3; HNO3; H2SiO3; H3PO4 ( слайд 14).
Задание 2. Определите валентность кислотных остатков в молекулах кислот: H2SO4; H2CO3; HNO3; H2SiO3; H3PO4 ( слайд 15).
Задание 3. Составьте формулы кислот по известным кислотным остаткам: Cl (I), S(II), PO4(III), SiO3(II), ClO4(I), MnO4(II), NO2(II) (слайд 16).
4. Классификация кислот
Учитель: Ребята, посмотрите на слайд и скажите, по какому признаку данные кислоты разделены на две группы? (cлайд 17).
Учащиеся: Наличие и отсутствие кислорода.
Учитель: Записываем в тетрадь (схематично) – “Классификация кислот”.
1. По составу кислоты делятся на кислородсодержащие и бескислородные (слайд 18).
Учитель: По какому признаку данные кислоты разделены на две группы?(cлайд 19).
Учащиеся: Число атомов водорода.
Учитель: Записываем в тетрадь (схематично):
1. По числу атомов водорода делятся на одно-, двух- и трехосновные (слайд 20).
Учитель: Кроме этого, кислоты классифицируют еще по растворимости в воде и по силе (cлайд 21).
5. Общие химические свойства кислот
Учитель: А теперь мы с вами рассмотрим общие химические свойства кислот. Но прежде мы должны познакомиться с техникой безопасности при работе с кислотами. Повторим: выполнять все указания учителя, не пробовать вещества на вкус, пробирку в руки не брать, не приступать к выполнению опыта, не зная, что и как нужно делать, обращаться с лабораторной посудой бережно и закончив работу, привести рабочее место в порядок. При попадании кислоты на кожу надо смыть её струёй воды, обработать 2% раствором гидрокарбонатом натрия.
Учитель проводит демонстрационный опыт растворения в воде концентрированной H2S04, наблюдается сильное разогревание пробирки. Фиксирует внимание учащихся на том, что в связи с выделением большого количества теплоты при растворении концентрированной серной кислоты в воде нельзя вливать воду в кислоту. В этом случае вода, имеющая меньшую плотность, оказывается на поверхности, закипает, и ее брызги вместе с кислотой могут обжечь лицо и руки.
Запомни: Сначала - вода, затем - кислота , иначе случится беда!
Учитель: Одним из общих химических свойств кислот является действие их на индикаторы. Что такое индикаторы?
Учащиеся: Вещества, изменяющие окраску в зависимости от среды – кислотной или щелочной.
Учитель: Какие индикаторы вам известны?
Учащиеся: Лакмус, метилоранж, фенолфталеин.
Учитель: Однажды английский химик Роберт Бойль, изучая свойства соляной кислоты, закупленной в Германии у И. Глаубера, случайно пролил ее. Кислота попала на сине-фиолетовые лепестки фиалок. Спустя некоторое время лепестки стали ярко-красными. Это явление удивило Р. Бойля, и он тут же провел серию опытов с разными кислотами и цветами разных растений. Оказалось, что и васильки, и роза, и цветки некоторых других растений изменяли свою окраску при действии кислот.
Особенно интересным оказался фиолетовый настой лакмусового лишайника. В растворах кислот он становился красным, а в растворах щелочей - синим.
После некоторых раздумий такие вещества Р. Бойль назвал индикаторами, что в переводе с латинского означало “указатели”. Эти вещества затем стали использовать многие химики в своих опытах для распознавания кислот и оснований.
Учитель: Посмотрим демонстрационный опыт: в трех химических стаканах находится соляная кислота. Прильем в стаканы индикаторы. Как изменилась окраска растворов?( cлайд 22).
Учащиеся: При добавлении лакмуса и метилоранжа растворы приобрели красную окраску, в случае фенолфталеина видимых изменений не было.
Учитель: Какой вывод можно сделать?
Учащиеся: Кислоты можно обнаружить только с помощью лакмуса и фенолфталеина.
Учитель: Второе свойство кислот – взаимодействие с основаниями (cлайд 22).
Демонстрация опыта, комментарии по слайду.
Учитель: Третье свойство кислот – взаимодействие с оксидами металлов( cлайд 23). Демонстрация опыта, комментарии по слайду.
Учитель: Следующее свойство кислот, которое мы с вами рассмотрим, – взаимодействие с металлами ( cлайд 23). Демонстрация опыта, комментарии по слайду.
Учитель: И последнее свойство, которое мы с вами рассмотрим – это взаимодействие кислот с солями( cлайд 24). Демонстрация опыта, комментарии по слайду.
Учитель: И в заключении давайте рассмотрим некоторые интересные факты о теперь уже известных вам кислотах.
1. Серная кислота тяжелая маслянистая жидкость, издавна её называют “матерью всех кислот”. Алхимикам удалось получить серную кислоту еще в X веке при прокаливании солей - сульфатов (купоросов). Отсюда произошло историческое название серной кислоты – купоросное масло. Серная кислота очень широко используется при проведении различных химических производств, поэтому ее часто называют “хлебом химической промышленности” ( cлайд 25).
2. HNO3 – азотная кислота – Бесцветная летучая жидкость с резким запахом, дымит на воздухе, сильный окислитель. Азотная кислота применяется для производства взрывчатых веществ, красителей, лаков, лекарств, полимеров, удобрений. Её называют “царицей всех кислот”.
3. HF – Фтороводородная кислота (плавиковая). Плавиковая кислота обладает особыми свойствами: она легко реагирует со стеклом и химически растворяет его, поэтому хранить кислоту приходится не в стеклянной посуде, а в полиэтиленовой.
4. Уксусная кислота – СН3СООН – самая древняя. Упоминания о ней содержатся в древнейших рукописях. Впервые она получена из виноградного сока. Уксусная кислота широко используется в химическом производстве, а также в быту, в частности, для консервирования продуктов.
Все кислоты кислые на вкус. (Салициловая - сладкая, никотиновая - горькая.).
V.Итоговое закрепление (слайды 26 – 27).
1. Найди группу формул кислот:
2. Выберите формулу “третьего лишнего” вещества в каждом ряду:
а) HCl H2SO4 K2O б) HNO3 H2O H2CO3 в) H2S H2SO4 NaOH
3. Даны вещества. Расположите их в таком порядке, чтобы внизу получилось название индикатора.

Презентация к уроку химии "Кислоты" содержит определение кислот, характкрные свойства, действие на индикаторы.


Распределите формулы по классам в таблицу
HCl HNO 3 H 2 SO 4
Ca(OH) 2 K 2 O Na 2 O
Al 2 O 3 Zn(OH) 2 Al(OH) 3

Na 2 CO 3 Cu(OH) 2 FeO
AlCl 3 MgBr 2 NaOH
CO 2 NiO Ca(OH) 2


Цель урока: познакомиться с классификациями и общими химическими свойствами кислот.

Кислоты – это сложные вещества состоящие из атомов водорода и кислотных остатков .
Н Cl H NO 3 H 2 SO 4

Что нас объединяет?

Кислый вкус лимону придает лимонная кислота , яблоку — яблочная кислота, скисшему молоку — молочная кислота. Щавель имеет кислый вкус благодаря наличию в его листьях щавелевой кислоты.

По какому признаку кислоты разделены на группы?
HNO 3
H 2 SO 4
H 2 CO 3
H 2 S
H 2 SiO 3
H 3 PO 4
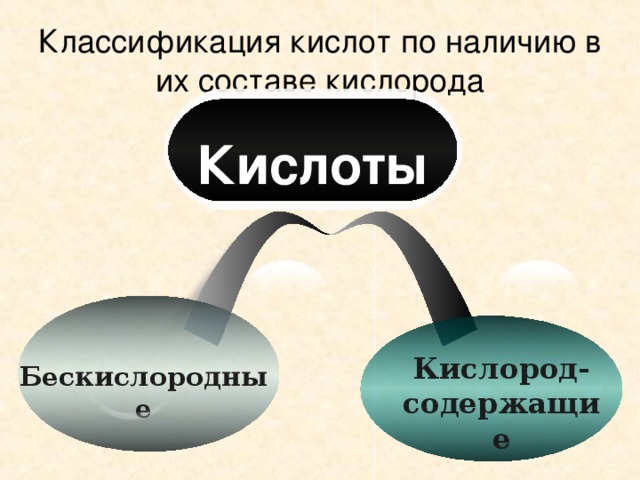
Классификация кислот по наличию в их составе кислорода
Бескислородные

По какому признаку кислоты разделены на группы?
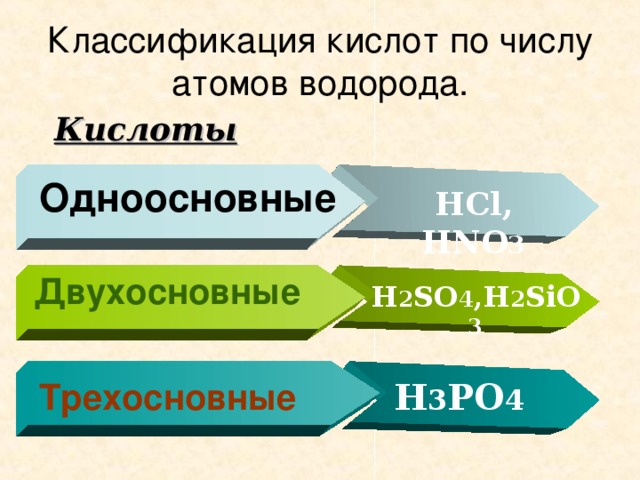
Классификация кислот по числу атомов водорода.
Одноосновные
HCl, HNO 3
Двухосновные
H 2 SO 4 ,H 2 SiO 3
Трехосновные
H 3 PO 4

Физические свойства кислот
состоянию:
- Газообразные (HCl, H 2 S)
- Жидкие (HNO 3 , H 2 SO 4 )
- Твердые (H 3 PO 4 , H 2 SiO 3 )
- Цвет кислот – ?
- Запах – ?
- Вкус – ?
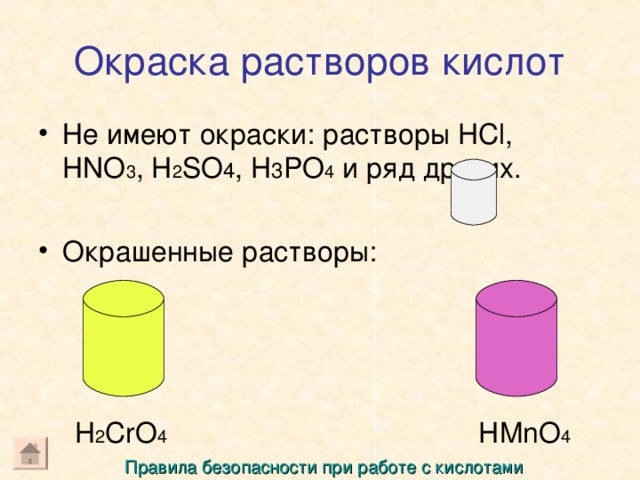
Окраска растворов кислот
- Не имеют окраски: растворы HCl, HNO 3 , H 2 SO 4 , H 3 PO 4 и ряд других.
- Окрашенные растворы:
Правила безопасности при работе с кислотами

ПРАВИЛА БЕЗОПАСНОСТИ
Попавшие на кожу капли раствора кислоты немедленно смойте сильной струей холодной воды, а затем обработайте поврежденную поверхность 2%-м раствором питьевой соды.
Едкое вещество—кислота! Разрушает и раздражает кожу, слизистые оболочки.
Химические свойства кислот

Химические свойства кислот
Ряд активности металлов:
Li K Ba Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
Активность металлов уменьшается
Опыт 1. Взаимодействие цинка с соляной кислотой

Химические свойства кислот
Опыт. Взаимодействие оксида магния с соляной кислотой
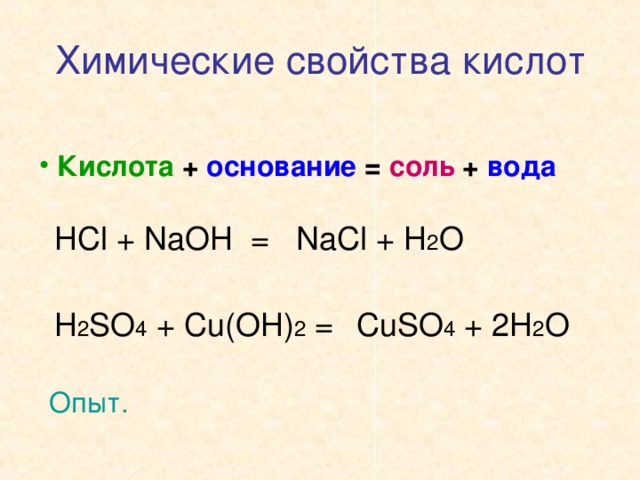
Химические свойства кислот
H 2 SO 4 + Cu(OH) 2 =

Кислоты реагируют с солями, если образуется осадок или газ.

КИСЛОТЫ ПРИМЕНЯЮТСЯ В МЕДИЦИНЕ
Аскорбиновая,
салициловая

Составьте возможные уравнения реакций взаимодействия перечисленных веществ с раствором серной кислоты.
Читайте также:

