Элементы va группы конспект
Обновлено: 02.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Конспект урока по химии (МЛХ 5 2 курс)
1. Организационный момент
3. Изучение нового материала.
-Запишите число и тему нашего урока.
1. Найдите по периодической системе химических элементов V-A группу. Перечислите элементы V-A группы. (N; P; As; Sb; Bi)
2. Как изменяются неметаллические свойства элементов в подгруппе?
(С увеличением порядкового номера неметаллические свойства ослабевают, а металлические усиливаются).
3. Сколько электронов находиться на внешнем электронном уровне атомов этих элементов? (5 электронов).
6. Как изменяются окислительно-восстановительные свойства у элементов V-A группы? (с увеличением порядкового номера в подгруппе окислительные свойства ослабевают, а восстановительные усиливаются).
7. Назовите общую формулу высшего оксида элементов V-A группы. (R 2 O 5 ).
8. Назовите общую формулу летучего водородного соединения элементов V-A группы. (RH 3 ).
9. Дайте характеристику положения азота в периодической системе химических элементов. (порядковый номер - 7, II период , V группа).
10. Дайте характеристику положения фосфора в периодической системе Химических элементов. (порядковый номер - 15, III период , V группа).
-Важнейшими представителями элементов V-A группы - азотом и фосфором.
-Эти химические элементы входят в состав компонентов живых клеток: белков, нуклеиновых кислот, АТФ.

-Их соединения повышают плодородие почвы. Простые вещества и соединения этих элементов используются человеком в различных отраслях хозяйственной деятельности.
1 Задание . Исходя из положения азота и фосфора в периодической системе химических элементов составить схемы строения атомов этих элементов.
2 задание. Сравните особенности строения атомов азота и фосфора.
(Общее – одинаковое количество электронов на последнем энергетическом уровне (5), одинаковое строение последнего энергетического уровня (ns2np3). )
(Различия: у азота – 2 энергетических уровня, 7 электронов в атоме, а у фосфора – 3 энергетических уровня, 15 электронов)
3 задание. Какие степени окисления будут проявлять данные элементы в случае отдачи 5 электронов с последнего электронного уровня и в случае принятия недостающих 3-х электронов?
(Атомы этих элементов могут присоединять недостающие три электрона, приобретая устойчивое состояние, но такое же состояние они приобретают и при отдаче пяти электронов. Поэтому для азота и фосфора характерны различные степени окисления).
-Химические элементы могут проявлять промежуточные степени окисления: у азота ст.о: 0 +1 +2 +3 +4.
4 задание: составьте формулы соединений в которых азот будет проявлять с.о: 0 +1 +2 +3 +4.
-у фосфора ст. о: 0 +3
5 задание : составьте формулы соединений, в которых фосфор будет проявлять с.о: 0 +3
-У какого из элементов сильнее выражены окислительные свойства? (у азота-более электроотрицательный элемент)
-Давайте посмотрим, как в разный года и какими учёными был открыт азот, как простое вещество, и как его называли.
-Рассмотрим строение молекулы азота.
N 2 - ковалентная неполярная связь, тройная молекулярная кристаллическая решётка.
Энергия связи - 945 кДж/моль.
Нахождение азота (элемента) в природе.
Чилийская селитра – NaNO 3
Индийская селитра – KNO 3
Органические вещества – аминокислоты, белки, нуклеиновые кислоты, витамины, гормоны.
В организме человека – 3% по массе.
Получение азота.
В промышленности азот получают разделением сжиженного воздуха (tкип азота = -196 0С, tкип кислорода = - 183 0С).
В лаборатории получают разложением нитрита аммония.
NH 4 NO 2 = N 2 +2 H 2 O (реакция экзотермическая, поэтому сосуд постепенно охлаждают).
Пропускание аммиака над оксидом меди (II)
Физические свойства азота. (Видеоролик для студентов).
При нормальных условиях газ, легче воздуха, плохо растворим в воде, tкип= -196 0С, t пл.= - 210 0 С.
В жидком состоянии (темп. кипения -195,8 °C) - бесцветная, подвижная, как вода, жидкость. Плотность жидкого азота 808 кг/м³. При контакте с воздухом поглощает из него кислород.
При -209,86 °C азот переходит в твёрдое состояние в виде снегоподобной массы или больших белоснежных кристаллов. При контакте с воздухом поглощает из него кислород, при этом плавится, образуя раствор кислорода в азоте.
Химические свойства азота
С простыми веществами.
1. С металлами
3Mg + N 2 = Mg 3 N 2 нитрид магния
2. С водородом
3. С кислородом (электрический разряд, температура более 2000 0 С
N 2 + О 2 = 2NО оксид азота (II)
Со сложными веществами
Не реагирует со сложными веществами, кроме гидридов активных металлов.
Применение азота
Азот применяется при производстве минеральных удобрений, для синтеза аммиака, создания инертной атмосферы в лампах, используется в медицине. Жидкий азот применяется для глубокого охлаждения и вымораживания.
Аммиак используется для получения азотной кислоты, азотсодержащих солей, мочевины и соды. Применяется в холодильных установках; жидкий аммиак и его растворы служат жидкими удобрениями; используется в медицине.
Оксид одновалентного азота используется для создания аэрозолей, применяется как анестезирующее средство при наркозах.
Жидкий диоксид азота применяется как неводный растворитель и как окислитель в двигателях космических кораблей.
Нитрит натрия широко применяется в органическом синтезе и как добавка к колбасным изделиям, придающая им цвет натурального мяса.
Азотная кислота применяется для приготовления минеральных удобрений, взрывчатых веществ, красителей, пластмасс, искусственных волокон; концентрированная азотная кислота применяется в ракетной технике в качестве окислителя топлива.
4. Закрепление изученного материала
1. Как изменяются окислительно-восстановительные свойства у элементов V-A группы с увеличением порядкового номера? (Окислительные ослабевают, восстановительные – усиливаются).
3. Как влияет тройная связь между атомами азота на химические свойства молекулы азота? - Малоактивен при обычных условиях.
4. Почему максимальная валентность азота равна четырем, а степень окисления +5? - У атома азота на внешнем электронном уровне 3 неспаренных р- электрона и пара s- электронов - валентность четыре, общее число электронов внешнем энергетическом уровне 5- степень окисления +5.
5. Азот имеет положительную степень окисления с
6. Почему при обычных условиях атмосферные азот и кислород не взаимодействуют друг с другом? – азот малоактивен при обычных условиях.

Неметаллами в группе VА Периодической системы Д.И. Менделеева являются азот N и фосфор Р; мышьяк As и сурьма Sb проявляют как металлические, так и неметаллические свойства; висмут Bi является типичным металлом. На внешнем энергетическом уровне всех этих элементов находятся 5 электронов (конфигурации ns 2 np 3 ), наиболее характерные степени окисления –3, +3 и +5.
Азот проявляет в своих соединениях степени окисления –3, +1, +2, +3, +4 и +5.
Некоторые сведения о физических свойствах этих элементов приведены в таблице 6.

Азот. Газ без цвета и запаха, малорастворимый в воде. Типичный неметалл. Основной компонент атмосферы. В промышленности азот получают ректификацией жидкого воздуха. В обычных условиях химически мало активен. При нагревании вступает в окислительно-восстановительные реакции.

Нитриды реагируют с водой с образованием соответствующих гидроксидов и аммиака, а при их взаимодействии с кислотами образуется смесь солей:

Азот образует оксиды состава N2O, NO, N2O3, NO2, N2O4, N2O5. При этом N2O, NO являются несолеобразующими оксидами, для которых характерны окислительно-восстановительные реакции; N2O3, NO2, N2O4, N2O5 — солеобразующие кислотные оксиды, для которых также характерны окислительно-восстановительные реакции, в том числе — реакции диспропорционирования.
Химические свойства оксидов азота:


Азот образует летучее водородное соединение состава NH3, аммиак. При обычных условиях это бесцветный газ с характерным резким запахом; t кип. –33,7 °C, t пл. –77,8 °C. Аммиак хорошо растворим в воде (700 объемов NH3 на 1 объем воды при 20 °C) и ряде органических растворителей (спирт, ацетон, хлороформ, бензол).
Химические свойства аммиака:

Азот образует азотистую кислоту HNO2 (в свободном виде известна только в газовой фазе или растворах). Это кислота средней силы, ее соли называют нитритами.
Кроме того, азот образует очень сильную азотную кислоту HNO3. Концентрированная азотная кислота пассивирует некоторые металлы (железо, алюминий, хром). Особенностью азотной кислоты является то, что при ее окислительно-восстановительных реакциях с металлами не выделяется водород, а образуются различные оксиды азота или соли аммония. Продукты восстановления зависят от природы восстановителя и от концентрации кислоты. В целом чем выше концентрация HNO3, тем меньше она восстанавливается.
Ниже приведены реакции, характеризующие ее свойства:

В реакциях с неметаллами концентрированная азотная кислота ведет себя как сильный окислитель:

Также азотная кислота способна окислять сульфиды, йодоводород и т.д.:

Подчеркнем еще раз. Запись уравнений окислительновосстановительных реакций с участием HNO3 обычно условна. Как правило, в них указывают лишь продукт, образующийся в большем количестве. В некоторых из таких реакций в качестве продукта восстановления обнаружен водород (реакция разбавленной HNO3 с Mg и Mn).
Различные случаи термического разложения нитратов:

Особые случаи разложения нитрата аммония:

Фосфор. Существует в виде нескольких аллотропных модификаций (аллотропия состава). Белый фосфор Р4, метастабильный, при комнатной температуре мягкий, плавится, кипит без разложения. Красный фосфор Pn, состоит из полимерных молекул разной длины. При нагревании возгоняется. Черный фосфор состоит из непрерывных цепей Pn, имеет слоистую структуру, по внешнему виду похож на графит. Наиболее реакционноспособным является белый фосфор.
В промышленности фосфор получают прокаливанием фосфата кальция с углем и песком при 1500 °C:

В приведенные ниже реакции вступают любые модификации фосфора, если нет особых оговорок:


Фосфор образует летучее водородное соединение — фосфин, PH3. Это газообразное соединение с крайне неприятным резким запахом. Его соли в отличие от солей аммиака существуют только при низких температурах. Фосфин легко вступает в окислительно-восстановительные реакции:

Фосфор образует два кислотных оксида: P2O3 и P2O5. Последнему соответствует фосфорная (ортофосфорная) кислота H3PO4. Это трехосновная кислота средней силы, которая образует три ряда солей: средние (фосфаты) и кислые (гидро- и дигидрофосфаты). Ниже приведены уравнения химических реакций, характерные для данных соединений:

Видеофрагмент позволяет изучить положение элементов VA группы, особенности строения атомов, а также свойства, получение и применение веществ, образованных этими элементами.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Химия неметаллов VA группы"
К пятой A группе периодической системы относятся азот, фосфор, мышьяк, сурьма и висмут. Азот и фосфор являются неметаллами, мышьяк относится к полуметаллам, а сурьма и висмут – к металлам.
У атомов элементов пятой A группы на внешнем энергетическом уровне находится по пять электронов, электронная конфигурация их внешнего электронного слоя эн-эс-два эн-пэ-три.
В химических соединениях атомы азота и фосфора могут проявлять степени окисления от минус трёх до плюс пяти.
Объёмная доля азота в воздухе составляет 78 %, он входит в состав земной коры и живых организмов. В космосе азот занимает четвёртое место по распространённости, вслед за водородом, гелием и кислородом.
Фосфор в природе встречается только в виде соединений, важнейшими из которых являются фосфориты и апатиты, содержащие фосфат кальция.
Соединения фосфора есть в организме человека, при чём часть его распределена в мышечной, нервной и мозговой тканях. В виде производного фосфорной кислоты фосфор входит в состав ДНК и РНК.
Из фосфора, который поступает с пищей в организм человека, строится АТФ. В организме взрослого человека содержится фосфор массой нуль целых семьдесят пять сотых килограмма. Особенно много фосфора содержат кости скелета и зубы.
Простое вещество азот состоит из двухатомных молекул, где атомы азота связаны между собой тройной ковалентной неполярной связью (одна сигма-связь и две пи-связи).
Элемент фосфор образует несколько аллотропных модификаций, различающихся между собой по строению, физическим свойствам и химической активности.
Белый фосфор имеет форму тэтраэдра, имеет молекулярное строение, поэтому он легкоплавкий и летучий. Красный фосфор имеет атомную полимерную структуру, в которой атом фосфора связан с тремя другими атомами ковалентными связями.
При нагревании под давлением белый фосфор переходит в чёрный, который имеет атомную слоистую кристаллическую структуру. Чёрный фосфор, как металлы, проводит электрический ток и блестит.
Химические свойства элементов пятой A группы на примере азота и фосфора.
При обычных условиях молекулярный азот реагирует лишь с некоторыми металлами, например, литием, при этом образуется нитрид лития.
Азот в данной реакции является окислителем. Нитриды активных металлов представляют собой ионные соединения, которые гидролизуются водой с образованием аммиака.
В реакциях фосфора с металлами образуются фосфиды, так, в реакции кальция с фосфором образуется фосфид кальция. Фосфор в данной реакции является окислителем.
Только под действием электрического разряда азот реагирует с кислородом с образованием оксида азота два. В данной реакции азот является восстановителем.
Фосфор легко окисляется кислородом, при этом образуется оксид фосфора пять или оксид фосфора три. Фосфор этих реакциях является восстановителем.
Реакция азота с водородом протекает при температуре и давлении, в присутствии катализатора – металлического железа. При этом образуется аммиак. Азот в данной реакции является окислителем.
Фосфор с водородом не реагирует.
При высоких температурах азот реагирует с другими неметаллами, например, с бором, с образованием нитрида бора. Азот в данной реакции является окислителем.
Азот непосредственно не взаимодействует с галогенами и серой, но галогениды и сульфиды могут быть получены косвенным путем.
Фосфор взаимодействует со многими простыми веществами – галогенами, серой, проявляя окислительные и восстановительные свойства.
Так. В реакции фосфора с серой образуется сульфид фосфора три, фосфор в данной реакции является восстановителем.
В реакции фосфора с хлором образуется хлорид фосфора три. В этой реакции фосфор – восстановитель.
С водой, кислотами и щелочами азот не взаимодействует.
Фосфор взаимодействует с водой, при этом диспропорционирует с образованием фосфина и фосфорноватистой кислоты.
В растворах щелочей диспропорционирование происходит в большей степени.
Сильные окислители превращают фосфор в фосфорную кислоту.
Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль.
Современные спички, зажигающиеся при трении о специальную поверхность, изобретены в 1855 г. в Швеции.
На боковые поверхности спичечной коробки наносят массу, состоящую из красного фосфора, оксида железа три, соединений сурьмы и марганца, примеси измельчённого стекла и клея. При трении спичечной головки о фосфорные намазки происходит воспламенение.
Основная область применения азота – производство аммиака. Азот применяют для создания инэртной среды при сушке взрывчатых веществ, при хранении ценных произведений живописи и рукописей. Азотом ещё наполняют электрические лампы.
Красный фосфор используется для производства спичек, фосфорной кислоты, которая необходима для производств фосфорных удобрений и кормовых добавок для животных. Фосфор необходим и для производства ядохимикатов.
Соединения мышьяка чрезвычайно ядовиты, их широко используют для уничтожения грызунов и насекомых. И, тем не менее, в малых дозах соединения мышьяка входят в состав лекарств, используемых в качестве обезболивающих средств в стоматологии.
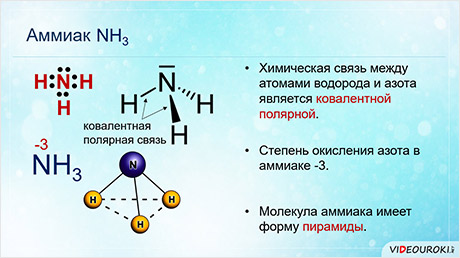
Среди соединений азота с водородом одним из важных является аммиак. Химическая связь между атомами водорода и азота является ковалентной полярной, причём общие электронные пары сильно смещены к азоту, степень окисления которого в аммиаке минус три. Молекула аммиака имеет форму пирамиды, в вершине которой расположен атом азота, а основание пирамиды составляет треугольник из атомов водорода.
Аммиак представляет собой бесцветный газ, с резким характерным запахом, хорошо растворяется в воде. Двадцати-двадцати пяти процентный раствор аммиака в воде – аммиачная вода, а пяти-десяти процентный раствор – нашатырный спирт.
В промышленности аммиак получают синтезом азота и водорода в присутствии катализатора – губчатого железа с примесями оксида алюминия и калия), при высоком давлении и температуре.
В лаборатории аммиак получают нагреванием твёрдых хлорида аммония и гидроксида кальция.
В реакциях аммиак проявляет восстановительные свойства за счёт азота в степени окисления минус три. В кислороде аммиак горит с образованием азота, а в присутствии катализатора образуется оксид азота два и водяной пар.
Смеси аммиака с кислородом или воздухом могут взрываться при нагревании, поэтому они опасны.
Соединение азота с водородом – гидразин сгорает на воздухе с образованием газообразных продуктов, что позволяет применять его в качестве ракетного топлива.
Аммиак проявляет также восстановительные свойства в реакциях с окислителями, например в реакциях с галогенами.
Аммиак восстанавливает металлы из их оксидов.
Аммиак растворяется в воде с образованием гидрата аммиака, который частично диссоциирует, образуя катионы аммония и гидроксид-ионы.
Основные свойства аммиака проявляются и при его взаимодействии с кислотами. В реакции аммиака с серной кислотой могут образовываться как кислые, так и средние соли.
Соли аммония диссоциируют с образованием катионов аммония и анионов кислотного остатка, они взаимодействуют с кислотами, основаниями и другими солями.
Реакция солей аммония со щелочами служит качественной реакцией на ион аммония, т.к. в результате данной реакции образуется газ с характерным резким запахом – аммиак.
Соли аммония при нагревании разлагаются:
Если же соответствующая соли аммония кислота является окислителем, то реакция разложения при нагревании протекает иначе.
В водных растворах соли аммония подвергаются гидролизу по катиону и растворы этих солей имеют кислую среду.
Аммиак находит широкое применение: его используют в производстве красителей, сухих гальванических элементов, в производстве соды, мочевины, азотной кислоты, аммиачных удобрений, как жидкое удобрение, хладагент, в производстве растворителей и в медицине.
Для азота известны и оксиды: оксид азота один, оксид азота два, оксид азота три, оксид азота четыре, оксид азота пять.
Оксид азота один и оксид азота два – это несолеобразующие оксиды, остальные его оксиды – солеобразующие кислотные. Все оксиды азота, за исключением оксида азота один, ядовиты.
Для фосфора характерно два оксида: оксид фосфора три и оксид фосфора пять.
При сжигании белого или красного фосфора в кислороде образуется оксид фосфора пять в виде белого дыма.
При недостатке кислорода образуется оксид фосфора три.
Оксиды фосфора существуют в виде димеров.
Все оксиды азота проявляют окислительные свойства. Так, в реакции оксида азота пять с углеродом азот является окислителем.
При растворении оксида азота четыре в охлаждённой воде одновременно образуется азотистая и азотная кислота, а в присутствии кислорода только одна азотная кислота.
Оксид фосфора пять представляет собой белый порошок, который энергично поглощает пары воды. Это его свойство – гигроскопичность используется для осушения.
Он может вызвать сильные ожоги при попадании на кожу, многие органические вещества обугливаются при действии на них этого оксида.
Оксид фосфора пять – типичный кислотный оксид, поэтом он реагирует с основными оксидами (так в реакции оксида фосфора пять с оксидом кальция образуется фосфат кальция), оксид фосфора пять реагирует и со щелочами.
В реакции оксида фосфора пять с гидроксидом натрия образуется фосфат натрия и вода.
При взаимодействии оксида фосфора пять и воды образуется ортофосфорная кислота, или просто фосфорная кислота.
У азота известно две кислоты – азотистая и азотная.
Азотистая кислота является слабой, которая существует только в растворах. При нагревании она диспропорционирует.
Так как в азотистой кислоте азот проявляет промежуточную степень окисления плюс три, то эта кислота в химических реакциях может проявлять и окислительные, и восстановительные свойства. Так, она является окислителем по отношению к сероводороду и восстановителем в реакции с перманганатом калия.
Соли азотистой кислоты – нитриты, кроме нитрита серебра один, хорошо растворимы в воде. Они используются в качестве пищевых добавок, в частности для придания приятного розового цвета мясным изделиям. Однако в больших дозах нитриты ядовиты. Нитраты щелочных, щелочноземельных металлов и аммония называются селитрами.
В молекуле азотной кислоты атом азота образует четыре ковалентные связи с атомами кислорода, поэтому валентность азота равна четырём, а степень окисления азота в азотной кислоте плюс пять.
Азотная кислота – бесцветная жидкость, с резким удушливым запахом.
В промышленности сырьём для получения азотной кислоты служит азот и водород.
В лаборатории азотную кислоту можно получить при действии концентрированной серной кислоты на твёрдый нитрат натрия при незначительном нагревании.
Оксиду фосфора пять соответствует фосфорная кислота. Она представляет собой твёрдое прозрачное кристаллическое вещество, хорошо растворимое в воде в любых соотношениях.
В водных растворах азотная и фосфорная кислоты диссоциируют на ионы.
Азотная кислота – сильный электролит и полностью диссоциирует на ионы.
А фосфорная кислота диссоциирует ступенчато.
Разбавленная азотная и фосфорная кислота проявляет все свойства, характерные для кислот. Они взаимодействуют с металлами, но концентрированная и разбавленная азотная кислота иначе реагирует с металлами, об этом мы говорили в предыдущих темах.
В реакции фосфорной кислоты с цинком образуется соль – дигидрофосфат цинка и водород.
Разбавленная азотная и фосфорная кислоты реагируют с основными оксидами, основаниями и солями.
Так, в реакции оксида лития и фосфорной кислоты образуется фосфат лития и вода, в реакции оксида кальция и азотной кислоты – нитрат кальция и вода. При взаимодействии гидроксида натрия с фосфорной кислотой образуется фосфат натрия и вода, в реакции гидроксида бария с азотной кислотой – нитрат бария и вода.
При взаимодействии карбоната натрия с фосфорной кислотой образуется дигидрофосфат натрия углекислый газ и вода, в реакции силиката калия с азотной кислотой образуется нитрат калия и кремниевая кислота.
Кроме этого, азотная кислота может окислять и неметаллы, например серу и фосфор.
Качественной реакцией на фосфорную кислоту и ее соли в растворе является взаимодействие с нитратом серебра один. При этом образуется осадок фосфата серебра один желтого цвета.
Азотная кислота используется в промышленности для получения нитратов, полимерных материалов и красителей. Селитры используются в сельском хозяйстве в качестве минеральных удобрений.
Нитраты калия, аммония и натрия применяются для производства чёрного пороха и взрывчатых веществ, для производства стекла, как окислители ракетного топлива, нитраты серебра в медицинских целях.
Фосфорная кислота используется как катализатор в органическом синтезе, для производства кормовых добавок, придания кисловатого вкуса безалкогольным напиткам, в осветлении сахара, фосфаты используются для производства минеральных удобрений, для пропитки древесины, тканей и пластмасс, при производстве стиральных порошков.
Таким образом, в химических соединениях атомы азота и фосфора могут проявлять степени окисления от минус трёх до плюс пяти, простое вещество фосфор существует в нескольких аллотропных модификациях, различающихся свойствами.
Азот и фосфор проявляют как восстановительные, так и окислительные свойства.
Аммиак – водородное соединение азота, он проявляет восстановительные свойства. Аммиак реагирует с водой и кислотами. Азот образует несколько оксидов, в которых он проявляет степени окисления от плюс единицы до плюс пяти.
Азотистая кислота является слабой кислотой, которая существует только в растворе. Азотная кислота проявляет ярко выраженные окислительные свойства.
Оксид фосфора пять взаимодействует с основными оксидами и щелочами. Оксиду фосфора пять соответствует фосфорная кислота. Качественной реакцией на фосфат-ионы в растворе является реакция с нитратом серебра один.
Ключевые слова конспекта: свойства простых веществ, азот, строение и физические свойства, химические свойства, производство и применение азота.
Азот – элемент группы VA. Его важнейшие параметры приведены в таблице.
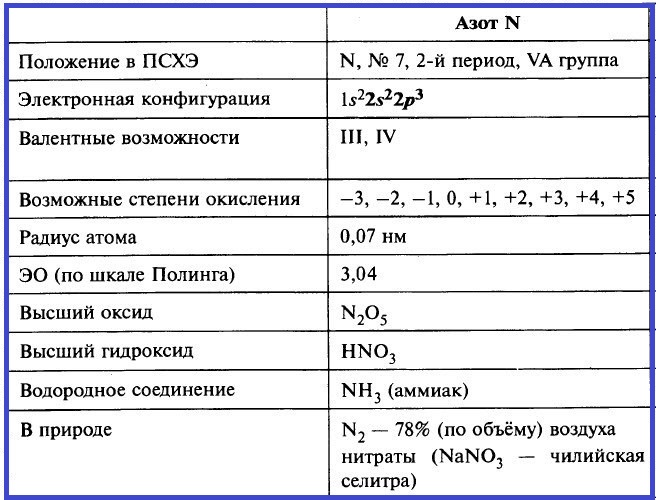
На валентном энергетическом уровне атома азота нет вакантных орбиталей. Следовательно, электронная пара 2s-подуровня не может быть распарена, и поэтому азот в своих соединениях не может быть пятивалентным. Максимальная валентность азота в соединениях – IV.
Азот проявляет степени окисления от –3 (низшей) до +5 (высшей). Примеры соединений с различными степенями окисления азота приведены в таблице.

Примеры веществ с различными степенями окисления азота и фосфора
СТРОЕНИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТА

Для азота не характерна аллотропия, элемент азот образует одно простое вещество – N2. Это молекулярное вещество, молекула азота образована двумя атомами азота, связь – ковалентная неполярная, тройная (одна σ- и две π-связи):
Тройная связь в молекуле азота чрезвычайно прочна, её энергия составляет 946 кДж/моль. Именно это обусловливает крайне низкую реакционную способность азота.
Молекулярный азот – газ (при обычных условиях), без цвета, без запаха, чуть легче воздуха (DB = 28/29 ≈ 0,966), плохо растворим в воде.
ХИМИЧЕСКИЕ СВОЙСТВА АЗОТА
Электроотрицательность элемента азота довольно высока, но химическая активность азота – простого вещества крайне низкая. Это обусловлено прочностью тройной связи в молекуле азота.
Химические свойства азота представлены в таблице ниже. В обычных условиях азот взаимодействует только с литием Li, при нагревании азoт реагирует с металлами с образованием нитридов. Если говорить о неметаллах, то азот реагирует с водородом и кислородом. С водородом реакция идёт при нагревании и повышенном давлении, требуется катализатор.
Реакция азота с кислородом начинается при температуре 3000–4000 °С, но даже при температуре 4000 °С содержание NO составляет всего около 10%. В отличие от других реакций кислорода с простыми веществами, эта реакция – эндотермическая, на образование 1 моль NO требуется 90 кДж. Обычно реакцию с кислородом осуществляют в электрической дуге, но всё равно она идёт с незначительным выходом продукта.
ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ АЗОТА

В промышленности азот получают методом разделения жидкого воздуха на компоненты. Лабораторным способом получения азота является термическое разложение нитрита аммония:
Эта реакция относится к типу конпропорционирования: восстановителем является азот в составе иона аммония (N –3 ), а окислителем – азот в составе нитрит-иона (N +3 ).
Применение азота. Большая часть азота (примерно 3/4) расходуется для синтеза аммиака, который, в свою очередь, используется для получения удобрений.
Применение газообразного азота обусловлены его инертными свойствами. Газообразный азoт пожаро- и взрывобезопасен, препятствует окислению, гниению.
В лабораториях азот применяется для создания инертной среды при проведении некоторых реакций.
В нефтехимии его применяют для продувки резервуаров и трубопроводов, проверки работы трубопроводов под давлением, увеличения выработки месторождений.
В горнодобывающем деле азот может использоваться для создания в шахтах взрыво–безопасной среды, для распирания пластов породы.
В производстве электроники его применяют для продувки областей, не допускающих наличия окисляющего кислорода.
В пищевой промышленности азот используется как газ, наполняющий упаковки, как хладагент.
Газообразным азотом заполняют камеры шин летательных аппаратов.
В жидком азоте, имеющем температуру – 196 °С, хранят в медицинских и исследовательских целях клетки, органы, ткани, другие биологические объекты. Жидкий азот применяют в косметологии для удаления бородавок и родинок.
Читайте также:

