Законы термодинамики 1 2 3 кратко
Обновлено: 08.07.2024
Термодинамика – раздел физики, изучающий тела, находящиеся в состоянии термодинамического равновесия и явления, сопровождающие переходы между этими состояниями.
Термодинамическое равновесие – состояние тел (или частей тела), при котором остаются постоянными все величины, характеризующие эти тела (или части тела): объёмы, давления, расположение масс и др.
Температура – единственная физическая величина, всегда одинаковая у всех тел (или частей тела), находящихся в состоянии термодинамического равновесия.
Термометр – прибор для измерения температуры. Единица температуры – 1 кельвин (1 К). Также используется 1 °С, равный 1 К.
Теплообмен – переход внутренней энергии одного тела во внутреннюю энергию другого тела без совершения механической работы.
Количество теплоты – физическая величина, показывающая энергию, полученную (отданную) телом при теплообмене.
Калориметр – прибор для измерения количества теплоты. Единица количества теплоты – 1 джоуль (1 Дж).
Удельная теплоемкость вещества – физическая величина, показывающая количество теплоты, необходимое для изменения температуры 1 кг этого вещества на 1 °С. Единица удельной теплоёмкости – 1 Дж/(кг·°С).
Количество теплоты, полученное (отданное) телом при теплообмене, пропорционально массе тела и изменению его температуры. Коэффициент пропорциональности – удельная теплоёмкость вещества.
Превращение твёрдого тела в жидкость называют плавлением.Обратное явление называют отвердеванием. Если при этом получается кристаллическое тело, то отвердевание называют кристаллизацией.
Температура
Температурой плавления называют температуру, при которой нагреваемое кристаллическое тело тело начинает плавиться, и при этом одновременно существуют твёрдое и жидкое состояния его вещества.
Температурой кристаллизации называют температуру, при которой охлаждаемая жидкость начинает кристаллизоваться, и при этом одновременно существуют её твёрдое и жидкое состояния.
Как правило, температура кристаллизации вещества равна температуре его плавления. Температура плавления/кристаллизации вещества зависит от внешнего давления и других факторов.
Удельная теплота плавления – физическая величина, показывающая количество теплоты, необходимое для плавления или выделяющееся при кристаллизации 1 кг вещества, находящегося при температуре плавления/кристаллизации. Единица удельной теплоты плавления – 1 Дж/кг.
Количество теплоты, поглощаемое (выделяющееся) при плавлении (кристаллизации), пропорционально массе расплавившегося (кристаллизовавшегося) вещества. Коэффициент пропорциональности – удельная теплота плавления вещества.
Видами парообразования являются: испарение – парообразование, происходящее с поверхности жидкости; кипение – парообразование, происходящее по всему объёму жидкости вследствие возникновения и всплытия на поверхность пузырей пара; сублимация – парообразование, происходящее с поверхности твёрдого тела.
Температурой кипения называют температуру, при которой наблюдается кипение вещества (интенсивное парообразование по всему объёму этого вещества). Температура кипения зависит от внешнего давления и других факторов.
Удельная теплота парообразования – физическая величина, показывающая количество теплоты, необходимое для превращения в пар 1 кг вещества (как правило, при температуре кипения). Единица удельной теплоты парообразования – 1 Дж/кг.
Количество теплоты, поглощённое кипящей (или испаряющейся при постоянной температуре) жидкостью, прямо пропорционально массе образовавшегося пара. Коэффициент пропорциональности – удельная теплота парообразования вещества.
При охлаждении/кристаллизации/конденсации выделяется точно такое же количество теплоты, которое было затрачено для нагревания/плавления/парообразования вещества (если температуры и давления при прямом и обратном процессах соответствуют друг другу).Утверждение будет верным и наоборот.
Тепловые явления

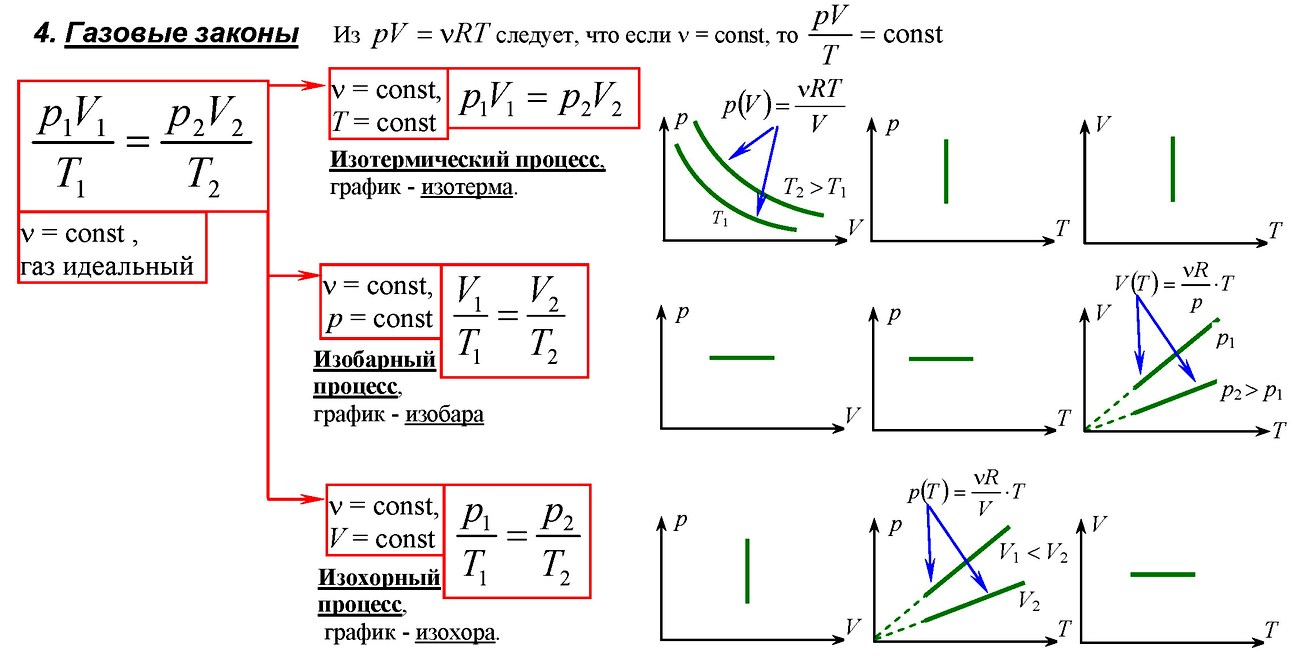
Законы термодинамика
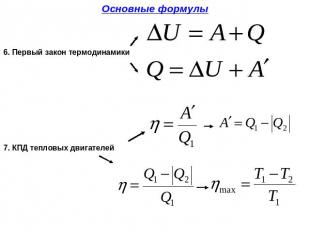
Первый закон термодинамики устанавливает равенство между изменением внутренней энергии тела и суммой полученной телом теплоты и совершённой над ним работы.
Тепловой двигатель – периодически действующее устройство, служащее для превращения внутренней энергии рабочего тела (как правило, газа или пара) в механическую энергию.
Количество теплоты, выделяющееся при полном сгорании вещества (топлива), прямо пропорционально массе сгоревшего вещества (топлива). Коэффициент пропорциональности – удельная теплота сгорания топлива.
Известно три способа теплопередачи (теплообмена) – теплопроводность, конвекция и излучение. При теплопроводности теплота проникает через вещество без его перемещения (в случае отсутствия вещества теплопроводность является нулевой). При конвекции теплота перемещается неравномерно нагретым движущимся веществом (в условиях, когда возможно возникновение архимедовой силы). При излучении теплота передаётся через пространство или вещество в виде электромагнитных волн (для излучения наличие вещества не является обязательным, в отличие от первых двух способов теплопередачи).
Второй закон термодинамики гласит, что теплообмен самостоятельно протекает только в таком направлении, что температура менее нагретого тела возрастает, а более нагретого – уменьшается.

Дополнительные материалы по теме:





Энергия и ее перевоплощения всегда была одним из самых интересных вопросов, который заботил научный мир. Одновременно с раскрытием закона о сохранении энергии появился и бесконечный интерес к исследованиям в области термодинамики, а также законы термодинамики. Само понятие термодинамика представляет собой теорию тепловых процессов в количественной интерпретации. Несмотря на то, что термодинамика рассматривается как часть молекулярной физики, она рассматривает процессы в большом масштабе, на уровне макроскопических явлений. Исследование процессов на гранях различных масштабов позволяет лучше понимать и объяснять различные процессы, поэтому различные методы имеют места быть.
Основное понятие для изучения в термодинамике это энергия, основные процессы – ее превращение и способы передачи. Большая часть процессов происходит с выделением тепла и, исходя из этого появляется еще один параметр, которого нужно учитывать и носит он название температура. Современная наука термодинамика основана на постулатах, которые появились долгое время тому назад и были подтверждены, так как временем, так и заявлениями различных ученых. Различные законы термодинамики были озвучены известными физиками в конкретных формулировках. Те заявления, которые были достаточно изучены и подтверждены различными заявлениями и стали законами термодинамики.

Всего существует три закона термодинамики, некоторые из них известны в несколько интерпретациях. Понятие закон означает, что явление происходит с определенной регулярностью и без существенных изменений условий. Термодинамические наблюдения можно применять в отношении любого вещества в любом состоянии. Правда обобщенность больше мешает, когда не известны свойства конкретного вещества, так как от его свойств будут зависеть определенные параметры. Это единственный серьезный минус метода термодинамики в изучении отдельных процессов. Недостаток проявляется тем, что приходится тратить больше времени на изучение всей информации о веществе.
Законы термодинамики: первый, второй и третий закон термодинамики
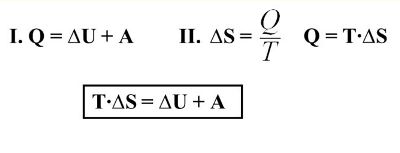
Второй закон термодинамики известен в несколько интерпретациях: Больцмана, Клаузиуса, Томсона и Кельвина. Первая формулировка принадлежит Клаузиусу, поэтому именно ее необходимо озвучить в первую очередь: Любое холодное тело не способно передавать тепло другому телу с более высокой температурой.
Кельвин считал что: "Невозможны те процессы, которые должны повторяться и происходить с учетом использования тепла от конкретного тела. Не реально создать тепловой двигатель на основе принципа использования тепла постороннего тела."

Законы термодинамики и их практическое применение
Термодинамика играет особую роль в различных областях науки и повседневной жизни. Ее закономерности и правила применяются для решения задач в области теплотехники, энергетики, космических исследований, биологии, машиностроении и много других областей. Гораздо проще свершать какие-то новые открытия, когда уже есть общеизвестные и неоспоримые факты. Великие открытия в прошлом всегда продолжают решать задачи человечества, несмотря на наступающий прогресс, потому что он не был бы возможным без всех тех свершений в прошлом.

Активное развитие термодинамики началось в девятнадцатом веке. Именно тогда люди начали строить первые паровые машины, а потом активно внедрять их в производство. Началась промышленная революция, и, естественно, всем хотелось увеличить коэффициент полезного действия машин, чтобы произвести больше продукции, доехать подальше и в конце-концов получить больше денег. Все это очень хорошо стимулировало развитие науки и наоборот. Но давайте ближе к сути вопроса.

Парогенераторная прожекторная установка
Термодинамика – раздел физики, изучающий макроскопические системы, их наиболее общие свойства, способы передачи и превращения энергии в таких системах.
Что такое макроскопические системы? Это системы, состоящие из очень большого числа частиц. Например, баллон с газом или воздушный шар. Описание таких систем методами классической механики просто невозможно – ведь мы не можем измерить скорость, энергию и другие параметры каждой молекулы газа в отдельности. Тем не менее, поведение всей совокупности частиц подчиняется статистическим закономерностям. По сути любой видимый нами (невооруженным глазом) предмет может быть определен как термодинамическая система.

Термодинамическая система – реально или мысленно выделяемая макроскопическая физическая система, состоящая из большого числа частиц, не требующая для своего описания привлечения микроскопических характеристик отдельных частиц. Соответственно, для описания термодинамической системы используются макроскопические параметры, не относящиеся к каждой частице, но описывающие систему целиком. Это температура, давление, объем, масса системы и проч.
Важно отметить, что термодинамические системы могут быть замкнутыми и незамкнутыми. Замкнутая система – это такая система, которую при помощи реальной или воображаемой оболочки оградили от окружающей среды, при этом количество частиц в системе остается постоянным.
Система может находится в разных состояниях. Например, мы взяли баллон с газом и начали его нагревать. Тем самым мы изменили энергию молекул газа, они стали двигаться быстрее, и система перешла в какое-то новое состояние с более высокой температурой. Но что будет, если систему оставить в покое? Тогда система через какое-то время придет в состояние термодинамического равновесия.
Термодинамическое равновесие – это состояние системы, в котором ее макроскопические параметры (температура, объем и др.) остаются неизменными с течением времени.
Термодинамика стоит на трех своих столпах. Существуют три основных постулата или три закона термодинамики. Они называются соответственно первым, вторым и третьим началами термодинамики. Рассмотрим первое начало или первый закон термодинамики.
Первое начало термодинамики
Первое начало термодинамики гласит:
В любой изолированной системе запас энергии остается постоянным.
К слову, у данного постулата есть еще несколько эквивалентных формулировок. Приведем их ниже:
Количество теплоты, полученное системой, идет на изменение внутренней энергии системы, а также на совершение работы против внешних сил.
Невозможен вечный двигатель первого рода (двигатель, совершающий работу без затраты энергии).
Запишем также математическое выражение первого начала термодинамики:
Здесь Q - количество теплоты, дельта U - изменение внутренней энергии, A - работа против внешних сил. Для различных термодинамических процессов в силу их особенностей запись первого начала будет выглядеть по-разному.
Почему невозможен вечный двигатель первого рода?
Людей издревле привлекала ее величество Халява. Философский камень, превращающий любой металл в золото, скатерть самобранка, с которой не нужно готовить, джин, исполняющий любые желания. Еще одной такой идеей была идея вечного двигателя.
Если никто не пытался найти скатерть-самобранку, то вечный двигатель пытались изобрести очень много раз. На протяжении веков разные люди спрашивали себя: как построить вечный двигатель? Согласно историческим записям первым такую попытку предпринял в двенадцатом веке некий индийский ученый. Затем было еще множество попыток, в том числе плотно занимался вопросом и Леонардо да Винчи. Наконец, в девятнадцатом веке светлые головы Германа Гельмгольца и Джеймса Джоуля сформулировали первое начало динамики и подтвердили его опытами, чем развеяли все сомнения. В помощь также статья, о том, как делать презентацию в ворде и powerpoint.

Вечный двигатель Леонардо да Винчи
Вечный двигатель невозможен, потому что так устроен мир. Об этом говорят нам законы термодинамики. Согласно первому началу термодинамики, количество теплоты, полученное системой, идет на изменение внутренней энергии системы, а также на совершение работы против внешних сил. Например, газ, помещенный в цилиндр с поршнем, получая определенное количество теплоты, увеличивает свою внутреннюю энергию, молекулы движутся быстрее, газ занимает больший объем и толкает поршень (работа против внешних сил). Иными словами, если работа совершается без внешнего притока энергии, она может совершаться лишь за счет внутренней энергии системы, которая рано иди поздно иссякнет, преобразовавшись в совершенную работу, на чем все закончится и система придет к состоянию термодинамического равновесия. Ведь энергия в мире никуда не уходит и не приходит, ее количество остается постоянным, а меняется лишь форма. Конечно, Вы обратили внимание на то, что речь идет о так называемом вечном двигателе первого рода (который может совершать работу без энергии). Спешим заверить, существование вечного двигателя второго рода также невозможно и объясняется вторым началом термодинамики, о котором мы поговорим в ближайшем будущем.

Энергия и ее формы
Надеемся, знакомство с термодинамикой прошло для Вас приятно и Вы полюбите ее всем сердцем. Если же этого не произойдет, Вы всегда можете поручить выполнение задач по термодинамике нашим авторам, пока сами занимаетесь более приятными делами.
Законы термодинамики, начала термодинамики, в принципе, — тепла и работы в физике и других ветвях науки, связанных с термодинамикой; часто связываются с понятиями, далекими от того, что непосредственно заявлено в их формулировке.
Содержание
История
Теперь, открыто в общей сложности пять законов. За последние 80 лет различные авторы иногда предлагали добавить ещё законы, но ни один из них не был широко признан.
Краткий обзор
Нулевой закон
| Если каждая из двух термодинамических систем находится в тепловом равновесии с некоторой третьей, то они находятся в тепловом равновесии друг с другом. |
Первый закон
| В любом процессе полная энергия вселенной остается той же самой. |
Он может также быть определен как:: количество подведенного тепла к изолированной системе расходуется на совершение работы и изменение внутренней энергии
| Для любого термодинамического цикла сумма чистого тепла, доставленного в систему, и чистой работы, совершённой системой, равна нулю. |
Второй закон
| Энтропия равновесии имеет тенденцию увеличиваться с течением времени, приближаясь к максимальному значению в равновесии. |
Третий закон
| При стремлении температуры к энтропия системы приближается к постоянному минимуму. |
Любая неравновесная система обладает такими свойствами, называемыми кинетическими, которые определяют особенности протекания неравновесных процессов в направлении, указываемым вторым началом термодинамики, и от которых не зависят термодинамические силы, движущие эти неравновесные процессы.
Читайте также:

