Типы химических реакций на примере воды кратко
Обновлено: 02.07.2024
Цель урока: Познакомить учащихся с химическими свойствами воды и рассмотреть их по признаку “число и состав исходных веществ и продуктов реакции”, рассмотреть условия взаимодействия оксидов металлов и неметаллов с водой, рассмотреть понятия электролиз, фотолиз, гидролиз, продолжить формирование умений составлять уравнения химических реакций, определять тип химических реакций по числу и составу реагирующих веществ и продуктов.
Задачи:
- применение знаний, умений и навыков в новых условиях - создание проблемной ситуации;
- контроль и самоконтроль знаний, умений и навыков с помощью домашней работы;
- уметь устанавливать существенные признаки, являющиеся основой различных классификаций;
- уметь составлять уравнения химических реакций, определять тип химических реакций по числу и составу реагирующих веществ и продуктов
- развитие умений сравнивать, обобщать, правильно формулировать задачи и излагать мысли;
- развитие логического мышления, внимания и умения работать в проблемной ситуации.
- формирование у учащихся познавательного интереса к химии;
- воспитание таких качеств характера, как настойчивость в достижении цели;
- воспитание интереса и любви к предмету через содержание учебного материала, умение работать в коллективе, взаимопомощи, культуры общения.
Элементы содержания: электролиз, фотолиз, фотосинтез, гидролиз
Оборудование: натрий, карбид кальция, оксид кальция, оксид железа, вода, медиапроектора, наборы для лабораторной работы, фенолфталеин, пробирки, штатив для пробирок, флаконы с реактивами.
Тип урока: комбинированный
План урока:
1. Организационный момент.
2. Промежуточный контроль знаний.
3. Изучение новой темы.
5. Домашнее задание.
Ход урока
I. Организационный момент.
Цель: подготовиться к проведению урока, к наиболее эффективной работе на уроке.
Проверяется готовность к уроку, раздаются план урока (Приложение 1), листы с тестом (Приложение 2), инструкции для выполнения лабораторной работы (Приложение 5), лотки с демонстрационным материалом, лист наблюдений (Приложение 5), объявляются этапы урока.
Организовывается работа учащихся на начальном этапе урока, класс слабоподготовленный, обучающиеся с повышенной моторной активностью, поэтому вспоминаются советы учителя о том, как лучше организовать работу на уроке, чтобы сохранить свое здоровье и здоровье одноклассников.
1. Как удобней и полезней для здоровья сидеть на уроке?
2. Почему на уроке учитель просит тишины?
Вступительное слово учителя. На этом уроке мы рассмотрим новую тему “Типы химических реакций на примере свойств воды”. Для этого нам нужно вспомнить материал, который мы уже прошли в темах “Типы химических реакций”, “Химические уравнения”. Сейчас мы выполним тест по этим темам.
II. Промежуточный контроль знаний по темам “Типы химических реакций”, “Химические уравнения” по технологии “Взаимопередачи заданий”
Цель: проверить умения составлять уравнения химических реакций, определять тип химических реакций по числу и составу реагирующих веществ и продуктов и продолжить формировать эти умения в случае недостаточной сформированности..
Учащиеся выполняют тест – 5 минут (Приложение 2). После того, как учащиеся выполнят тест, необходимо проверить работу соседа и поставить оценку, затем тесты передать на проверку учителю. Учитель просит класс поднять руки, кто написал тест на 5 или 4 балла. На закрытой доске или на экране медиапроектора открывают заранее подготовленные ответы теста для самопроверки.
Для медиапроектора, правильные варианты
Тест по темам “Типы химических реакций”, “Химические уравнения”
Время выполнения - 5 минут
I вариант
Расставьте коэффициенты в схемах реакций, укажите тип химической реакции по признаку “число и состав исходных веществ и продуктов реакции”
1 часть карточки
1. 2 Cu + O2 —> 2 CuO реакция соединения
2 часть карточки
3. 2 AL + 3 CuBr2 —> 2 AlBr3 + 3 Cu реакция замещения
II вариант
Расставьте коэффициенты в схемах реакций, укажите тип химической реакции по признаку “число и состав исходных веществ и продуктов реакции”
1 часть карточки
2. Si + 2 F2 —> SiF4 реакция соединения
2 часть карточки
4. 2 FeBr3 + 3 Zn —>3 ZnBr2 + 2 Fe реакция замещения
III. Изучение нового учебного материала.
Учебная цель: В результате этого урока мы должны рассмотреть химические свойства воды. В ходе урока мы узнаем, в каких реакциях разложения, соединения, замещения и обмена участвует вода. Вывод цели с помощью учеников
Слово учителя: Моя цель на уроке рассказать вам об этом, помочь вам запомнить эти реакции, и мы продолжим учиться составлять уравнения химических реакций, определять тип химических реакций по числу и составу реагирующих веществ и продуктов.
Основные положения нового учебного материала, который вы сегодня должны освоить.
Самое удивительное вещество на нашей планете - оксид водорода H2O
Доклад ученика (Приложение 3), возможно презентация, индивидуальная форма работы
В это время ученики составляют конспект доклада в объеме пяти предложений.
Примерное содержание конспекта
Россия занимает первое место в мире по запасам пресной воды.
Вода в России сосредоточена в реках, озерах, водохранилищах
40% суши – это засушливые и полузасушливые регионы мира, имеют только 2% мировых запасов пресной воды
Наш регион также относится к засушливым регионам
Вскоре 2/3 населения планеты будут жить в странах, испытывающих нехватку воды.
Химические свойства воды. Объяснение с опорой на знания учеников.
1. Реакция разложения. Что такое реакция разложения?
Сегодня мы познакомимся с новым типом реакций разложения - электролиз
Электролиз – реакция, протекающая под действием постоянного электрического тока
Давайте вспомним процесс фотосинтеза.
Доклад ученика (Приложение 4), возможно презентация, индивидуальная форма работы
Здесь мы познакомимся с еще одним типом реакции разложения
Фотолиз – разложения воды под действием света
Совокупность этих процессов называют фотосинтезом
Уравнение реакции фотосинтеза (реакция синтеза)
Коэффициенты в уравнении реакции выставляются с опорой на знания учеников фронтально или у доски вызванным учеником
2. Реакции соединения. Фронтальный опрос класса: дать определение реакции соединения.
Сегодня мы рассмотрим реакции соединения на примере взаимодействия оксидов металлов и неметаллов с водой
1. Реакция гашения извести
Запись реакции на доске, с помощью ученика, демонстрация ее учителем и демонстрация ЦОР, видео “Взаимодействие оксида кальция с водой”,
| CaO + H2O негашеная известь | —> | Ca(OH)2 гашеная известь |
гидроксид кальция, растворимое основание, щелочь
Обратить внимание учеников, что такое щелочь
Закрепление. Фронтальный опрос: Что такое щелочь? (Щелочи – это растворимые основания.)
Какие металлы и оксиды каких металлов образуют растворимые основания – щелочи? (Щелочи образуют металлы I группы, главной подгруппы, металлы II группы, главной подгруппы, начиная с кальция.)
2. Реакция образования растворимых, кислородсодержащих кислот из оксидов неметаллов
P2O5 + 3 H2O —> 2H3PO4 фосфорная кислота или гидроксид фосфора
Обратить внимание учеников, что гидроксиды – это не только основания, но и кислородсодержащие кислоты.
Правило – вода реагирует с оксидами металлов и неметаллов, если образуются растворимые гидроксиды (основания или кислоты)
Закрепление, фронтальный опрос: Посмотрите в учебник, страница 171, и объясните, почему в одном случае оксиды взаимодействуют с водой, а других случаях взаимодействие не происходит?
Выполнение Лабораторной работы “Исследование взаимодействия оксидов металлов с водой” (Приложение 5), работа в группах, по методу КСО
Организация работы класса. Перед началом работы один ученик напоминает правила техники безопасности всему классу.
Класс делится на малые группы по 4 человека, например, по скорости работы или по желанию учащихся.
Во всех группах учащимся раздаются инструкции лабораторной работы.
3. Реакции замещения. Объяснение учителя с опорой на знания учеников.
Что такое реакция замещения?
Уравнение реакции взаимодействия натрия с водой на доске записывает вызванный ученик, остальные ученики в Приложение 1. План урока. После этого демонстрируется ЦОР “Взаимодействия натрия с водой” и объясняются учителем особенности эксперимента.
4. Реакция соединения. Объяснение учителя с опорой на знания учеников.
Актуализация знаний. Что такое реакция соединения? Почему в таблице растворимости в некоторых клетках стоят прочерки?
Гидролиз – это реакция обменного разложения вещества с водой. То есть это одновременно реакция и обмена и разложения.
Демонстрация опыта учителем и объяснение его результатов с записью уравнения на доске учеником
| CaC2 + карбид кальция | 2H2O —> | C2H2 + ацетилен | Ca(OH)2 гидроксид кальция |
IV. Закрепление учебного материала
Учебная цель: Закрепить новые понятия и учебные навыки
- Что такое электролиз воды?
- Что такое фотолиз воды?
- Что такое гидролиз?
- Что объединяет эти реакции?
Задание учащимся во время просмотра ресурса
1. Расставить коэффициенты
2. Определить тип реакции
V. Задание на дом
Представлено в рабочих листах.
Цель: выучить реакции соединения, разложения, обмена, замещения на примере реакций с участием воды, научиться писать эти реакции самостоятельно, уметь применять полученные знания в новой ситуации (проблемный вопрос).
Формулируется проблемный вопрос, для домашнего задания, выставляются оценки за урок, уметь применять полученные знания в новой ситуации (проблемный вопрос).
Домашнее задание.
Проблемный вопрос. Как химические свойства воды зависят от строения молекулы воды и химической связи этой молекулы?
VI. Рефлексия
Список литературы.
1. Химия 8, 9 класс. Мультимедийное приложение к учебнику О.С.Габриеляна. Электронное учебное издание. ООО “Дрофа” 2011.
Можно поделить реакции на типы по следующим критериям:
а) По числу веществ и образующихся веществ.
б) По тепловому эффекту.
в) По изменению степени окисления атомов.
г) По присутствию сторонних веществ в реакции.
По числу веществ и образующихся веществ есть 4 типа реакций:
1.Реакция соединения. Когда из двух простых (не всегда) получается сложное вещество:
Та же вода: 2H2 + O2 → 2H2O
2.Реакция разложения. Тут все наоборот. Из сложного вещества получаются более простые.
2HgO → 2Hg + O2
3.Реакция замещения. Здесь атом простого вещества заменяет атом сложного.
2RbCl + Ca → CaCl2 + 2Rb (реакция под температурой)
4.Реакция обмена. Это реакция, когда из двух сложных веществ образуются два сложных вещества))
CaS + 2HCl → CaCl2 + H2S
По тепловому эффекту реакции делят на эндо- и экзотермические
Экзотермические - это когда выделяется тепло (+Q):
2H2 + O2 → 2H2O + Q
Эндотермические - когда тепло поглощается (-Q):
N2 + O2 → 2NO - Q
*В термодинамической химии при записи уравнения реакция требуется обозначать агрегатные состояния веществ.
По изменению степени окисления атомов реакции делятся на те реакции, которые идут без изменений степени окисления:
CaCO3 → CaO + CO2,
и на те, которые проходят с изменением степени окисления:
H2 + Cl2 → 2HCl
Ну а по присутствию сторонних веществ реакции делятся на два типа - каталитические и некаталитические
Каталитические:
2SO2 + O2 -(V2O5)→ 2SO3
Некаталитические:
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Вы уже познакомились с самым удивительным веществом на Земле — оксидом водорода, т. е. с водой Н2O.
Наша Родина занимает первое место в мире по запасам пресной воды — на территории России сосредоточена 1/5 её мировых ресурсов. Речной сток составляет 4270 км 3 в год, что соответствует 10% мирового речного стока, т. е. по 30 тысяч м 3 на каждого россиянина. Для сравнения укажем, что засушливые или полузасушливые регионы мира, которые составляют 40% суши, имеют только 2% мировых запасов пресной воды. За источники чистой воды в некоторых странах Азии и Африки идут настоящие войны. По прогнозам, к 2025 г. в странах, испытывающих умеренную или серьёзную нехватку воды, будут жить уже две трети населения планеты.
И хотя в России, кроме рек, сосредоточено также более 26 тысяч км 3 пресных вод в озёрах и существует 2000 водохранилищ, объём которых более 1 млн м 3 каждое, проблема загрязнения водоёмов и нехватки питьевой воды является одной из актуальных.
Реакция разложения.
С этой реакцией, которая протекает под действием постоянного электрического тока и называется электролизом, вы уже знакомились:

Растения разлагают воду на водород и кислород в процессе фотосинтеза. Если веточку водного растения элодеи поместить в прибор, изображённый на рисунке 112, и выставить на яркий солнечный свет, то уже через 10— 15 мин в верхней части пробирки соберётся кислород, который образовался в результате разложения воды на свету — фотолиза (фотос — свет, лизос — разложение). Как вы знаете из курса биологии, образовавшийся при этом водород с помощью многочисленных биохимических реакций образует с углекислым газом органическое вещество — глюкозу С6Н12O6. Совокупность всех этих процессов и называют фотосинтезом. Процесс фотосинтеза можно записать с помощью следующего обобщённого уравнения:
Реакции соединения.
Вы рассматривали этот тип реакций на свойстве воды соединяться с оксидами металлов и неметаллов с образованием соответственно щелочей и растворимых кислородсодержащих кислот.
Если в фарфоровую чашечку поместить несколько кусочков уже известной вам негашёной извести — оксида кальция СаО, а затем приливать к ним постепенно воду, давая ей впитываться, над чашкой появится пар. Кусочки оксида кальция начнут разогреваться и превратятся в пушистые хлопья или порошок нового вещества — гидроксида кальция, или гашёной извести (рис. 113):


Рис. 113.
Взаимодействие оксида кальция (негашёной извести) с водой
Теперь вам стало понятно, почему эту реакцию называют гашением извести.
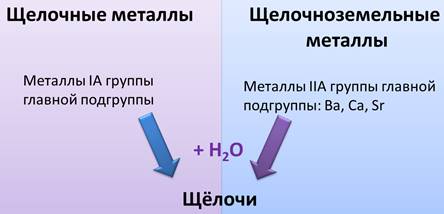
Образуют щёлочи при взаимодействии с водой все оксиды металлов IA группы (главной подгруппы I группы) Периодической системы Д. И. Менделеева, поэтому эти элементы называют щелочными. Оксиды металлов главной подгруппы II группы (IIA группы) Периодической системы Д. И. Менделеева — кальция, стронция, бария (их в старину называли землями) — также образуют при взаимодействии с водой щёлочи. Поэтому эти элементы называют щёлочноземельными.
А вот оксиды неметаллов взаимодействуют с водой, образуя кислоты, в которых неметалл будет иметь ту же степень окисления, что и в соответствующем оксиде:

| Гидроксидами называют кислородсодержащие кислоты и основания. |
Вам следует запомнить несложное правило: вода реагирует с оксидами металлов и оксидами неметаллов в том случае, если образуется растворимый гидроксид (щёлочь или кислородсодержащая кислота):

Реакции замещения.
Щелочные и щёлочноземельные металлы с водой могут образовывать щёлочи не только с помощью своих оксидов, но и при непосредственном взаимодействии. Только это будут уже реакции другого типа — реакции замещения, например:
Нальём в чашку Петри, находящуюся на столике кодоскопа, немного воды и добавим к ней несколько капель фенолфталеина. Затем поместим в сосуд кусочек очищенного натрия величиной со спичечную головку. На экране будет проецироваться происходящая при этом химическая реакция (рис. 114): кусочек натрия превращается в круглый шарик (плавится, так как реакция экзотермическая), бегает по поверхности воды (натрий легче воды и подталкивается образующимся в результате взаимодействия газообразным водородом), оставляя за собой малиновый след (это изменяет окраску фенолфталеина получившаяся в результате реакции щёлочь — гидроксид натрия).

Рис. 114. Взаимодействие натрия с водой
Реакции обмена.
Если вы обратите внимание на уже знакомую вам таблицу растворимости гидроксидов и солей в воде, то, очевидно, заметите, что в некоторых клетках этой таблицы стоят прочерки, которые обозначают, что данное вещество в водной среде разлагается, или, как говорят, гидролизуется (гидро — вода, лизос — разложение).
| Обменное взаимодействие веществ с водой, приводящее к их разложению, называют гидролизом. |
Гидролиз может быть обратимым (с ним вы будете знакомиться при изучении химии в старших классах) и необратимым. Например, необратимо гидролизуется сульфид алюминия:

Если в пробирку прилить на 1/3 её объёма дистиллированной воды, а затем поместить в неё кусочек карбида кальция СаС2 величиной с горошину, то можно заметить выделение газа — ацетилена С2Н2, а если затем в пробирку прилить раствор фенолфталеина, то появление малиновой окраски укажет на образование щёлочи — гидроксида кальция:

Гидролиз органических веществ — жиров, белков и углеводов, протекающий в живых организмах, — это основа их жизнедеятельности.
Следовательно, вода — не только самое важное вещество на Земле, но это и многоликое соединение, обладающее разнообразными химическими свойствами.

Предлагается видеофрагмент, который сделает данную тему легче и привлечет внимание учащихся, здесь рассматриваются все пройденные типы реакций на примере свойств воды. Интересным и увлекательным станет анимация, иллюстрирующая реакцию взаимодействия натрия с водой.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Типы химических реакций на примере свойств воды"
Для воды характерна реакция разложения – электролиз воды. Он протекает под действием электрического тока в специальном устройстве – электролизёре. В результате образуется два газа – кислород и водород.

2Н2О 2Н2↑+ О2↑
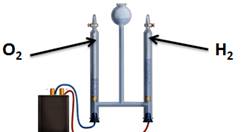
Растения также разлагают воду в процессе фотосинтеза.
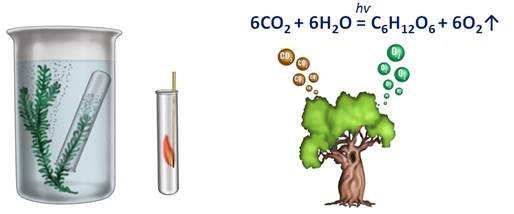
Если веточку водного растения элодеи поместить в специальный прибор и выставить на яркий свет, то уже через 10-15 мин начнет выделяться кислород, в результате разложения воды на свету, т.е. происходит фотолиз воды (фотос – свет, лизос – разложение). Образовавшийся водород вместе с углекислым газом в результате биохимических реакций образует глюкозу. Совокупность всех этих реакций и называют процессом фотосинтеза. В результате фотосинтеза из углекислого газа и воды образуется глюкоза и кислород.
негашеная гашеная
известь известь
Все оксиды металлов I A группы главной подгруппы и металлы IIA группы: Ca, Ba, Sr при взаимодействии с водой образуют щёлочи. Поэтому металлы I A группы главной подгруппы называют щелочными металлами, а металлы II A группы, как Ba, Ca, Sr – щелочноземельными.
При взаимодействии с водой оксидов неметаллов будут образовываться соответствующие кислоты, где неметалл будет иметь туже степень окисления, как и в оксиде. Например, в реакции оксида фосфора (V) образуется фосфорная кислота, в которой степень окисления фосфора тоже +5.
P2O5 + 3H2O = 2H3PO4
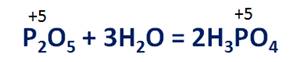
Поэтому, основания и кислородсодержащие кислоты в химии называют гидроксидами.
Вода реагирует с оксидами металлов и неметаллов только в том случае, если образуется растворимый гидроксид. Например, с оксидом калия вода образует растворимое основание – гидроксид калия, а вот с оксидом меди (II) вода не реагирует, т.к. гидроксид меди (II) нерастворимое в воде основание. Аналогично и с оксидами неметаллов: вода реагирует с оксидом серы (VI) с образованием серной кислоты, а с оксидом кремния (IV) не реагирует, т.к. кремниевая кислота нерастворимая.
Реакции замещения идут тогда, когда с водой реагируют щелочные или щелочноземельные металлы. При взаимодействии натрия с водой образуется щёлочь и водород.
2Na + 2H2O = 2NaOH + H2↑
Реакции обмена с участием воды – это реакции гидролиза. Если в таблице растворимости в клетке стоит прочерк, т.е. вещество в таком случае в водной среде гидролизуется (гидро – вода, лизос – разложение). Например, при гидролизе сульфида алюминия образуется гидроксид алюминия – нерастворимое в воде основание и газ – сероводород.
При гидролизе карбида кальция образуется газ – ацетилен и щелочь – гидроксид кальция. В этом легко убедиться, если воду добавить кусочек карбида кальция, то можно заметить выделение газа ацетилена, если в образовавшийся раствор капнуть несколько капель фенолфталеина, то он окрасится в малиновый цвет.

Гидролиз протекает и в живых организмах и составляет основу их жизнедеятельности, как гидролиз жиров и белков.
Поэтому вода не только самое важное вещество на планете, но и соединение, обладающее разнообразными химическими свойствами.
Читайте также:

