Системы с открытой цепью сопряжения кратко
Обновлено: 05.07.2024
Сопряженная система представляет собой систему, в которой имеет место чередование простых и кратных связей или по другому – система, в которой кратные связи находятся друг от друга на расстоянии одной одинарной связи. Такая цепь сопряженных связей называется цепью конъюгации (от латинского conjugati – наложение, перекрывание) В сопряженных системах имеет место дополнительное перекрывание π-электронных облаков кратной связи. Двойная связь представляет собой сочетание σ-связи и π-связи.
Содержимое работы - 1 файл
Сопряженная система представляет собой.docx
Сопряженная система представляет собой систему, в которой имеет место чередование простых и кратных связей или по другому – система, в которой кратные связи находятся друг от друга на расстоянии одной одинарной связи. Такая цепь сопряженных связей называется цепью конъюгации (от латинского conjugati – наложение, перекрывание) В сопряженных системах имеет место дополнительное перекрывание π-электронных облаков кратной связи. Двойная связь представляет собой сочетание σ-связи и π-связи. В алкенах электронная плотность π-связи охватывает только 2 атома и ее называют локализованной. Локализованные двойные связи часто встречаются в природных соединениях, например в ненасыщенных карбоновых кислотах.
В сопряженных системах происходит такое электронное взаимодействие, при котором электронная плотность в молекуле распределяется равномерно, т.е. образуется общая электронная плотность.
Сопряжение – перераспределение (выравнивание) электронной плотности в сопряженной системе, приводящее к стабилизации молекулы.
Сопряжение возможно только в том случае, если все атомы, принимающие участие в этом процессе расположены в одной плоскости, т.е. должно выполняться условие копланарности.
Различают сопряженные системы с открытой цепью и замкнутые сопряженные системы. Возможны два типа сопряжения π, π-сопряжение (в сопряжении участвуют π-электроны кратной связи) и р, π-сопряжение ( в сопряжении участвуют π-электроны кратной связи и р-электроны неподеленной электронной пары гетероатомов – N -, — O -, — S -).
Сопряжение –это энергетически выгодный процесс, происходящий с выделением энергии, поэтому для сопряженных систем характерна повышенная термодинамическая устойчивость. Количественно термодинамическую устойчивость можно оценить как разность энергий соединений с сопряженными двойными связями и соединений с изолированными двойными связями. Эту разность называют энергией сопряжения или энергией делокализации. Термодинамическая устойчивость соединения увеличивается с увеличением длины сопряженной цепи. Из сопряженных полиенов наиболее широко распространены в природе каратиноиды (каротин, витамин А, ретиналь).
Все атомы углерода находятся в sp 2 -гибридизации, все s связи лежат в одной плоскости, 4 негибридизированные Рz орбитали расположены перпендикулярно плоскости s связей и параллельны друг другу (необходимое условие для перекрывания).
Замкнутые сопряженные системы. Ароматичность.
Сопряженные системы с замкнутой цепью сопряжения – это арены, гетероциклические соединения и небензоидные ароматические структуры. Простейшие замкнутые сопряженные структуры – арены, родоначальником которых является бензол. Бензол был известен издавна, однако долгое время эго структура была не доказана и только в 1865 А. Кекуле предложил изображать строение молекулы бензола в виде правильного шестиугольника с системой чередующихся двойных и простых связей. Изображать формулу бензола принято таким образом и сейчас.
Все атомы углерода находятся в sр 2 - гибридизации, все связи С-С равны между собой, имеют длину 1,40 А 0 и занимают как бы промежуточное положение между простой (1,54 А 0 ) и двойной (1,33 А 0 ) связями, При этом каждый атом углерода образует три s- связи (одну связь С – Н и две s-связи С-С), лежащих в одной плоскости , т.е. у каждого атома углерода осталось по одному р-электрону, орбитали которых, за счет двукратного перекрывания друг с другом образуют замкнутую p-электронную систему, которая охватывает все атомы углерода. p-электронная плотность в такой системе распределена равномерно. Замкнутый секстет электронов представляет собой связь, которая отличается от других типов и ее часто называют ароматической. Электронное строение молекулы бензола можно описать с помощью теории резонанса согласно которой молекула бензола рассматривается как резонансный гибрид двух предельных ( граничных структур)
Понятие ароматичности возникло более ста лет тому назад. В настоящее время к ароматическим системам относятся любые плоские замкнутые циклы, отвечающие критериям ароматичности. Критерии ароматичности:
1) Молекула имеет плоское циклическое строение.
2) Все атомы в цикле в состоянии sp 2 - гибридизации (следовательно s-скелет плоский и все рz-орбитали параллельны.
3) В молекуле существует делокализованная p-электронная система, содержащая 4n + 2 р-электрона , где n = 0,1,2,3… — натуральный ряд чисел. Это правило получило название правило Хюккеля, предложено в 1931 на основании метода молекулярных орбиталей ).
Правило Хюккеля применимо не только для моноциклических p-электронных систем, но и для плоских конденсированных систем.
Нафталин Антрацен Фенантрен
4n+2=10 р-эл-нов 4n+2=14 р-эл-нов 4n+2=14 р-эл-нов
Однако не все замкнутые ароматические структуры являются ароматическими. Так например, циклооктатетраен-1,3,5,7 не относится к ароматическим, т.к. не удовлетворяется правило Хюккеля, 4n + 2 = 8 р-электронов, n = 1,5.
Ароматическим характером обладают и гетероциклические соединения. При замене в молекуле бензола -СН = на – N = образуется гетероциклическое соединение пиридин. Пиридиновое ядро входит в состав многих природных веществ: витамины РР, В6, кофермент НАД, никотин и другие, а также входит в состав лекарственных препаратов (фтивазид).
Пиридин удовлетворяет всем критериям ароматичности:
1) Имеет циклическое строение
2) Все атомы углерода в цикле в состоянии sp 2 гибридизации, пиридиновый атом азота также находится
3)Правило Хюккеля 4n + 2 = 6 р-электронов, n = 1
Все критерии ароматичности соблюдены, пиридин является ароматическим соединением.
Атом азота поставляет в ароматическое p- электронное облако Рz- орбиталь с одним электроном, остальные 4 электрона располагаются на трех sp 2 - гибридных орбиталях, причем две из них участвуют в образовании двух s-связей, а третья с неподеленной электронной парой определяет его свойства как основания.
В молекуле пиридина имеет место p,p-сопряжение. Пиридиновый азот из-за большей электроотрицательности по сравнению с углеродом смещает к себе единую p-электронную плотность, в целом понижая электронную плотность ароматического кольца. Поэтому такие системы с пиридиновым азотом называют p-недостаточными.
При замене фрагмента — СН = СН – на > NН возникает пятичленный цикл – пиррол
1. Молекула пиррола имеет циклическое строение.
2. Все атомы углерода в цикле находятся в sp 2 -гибридизации, атом азота также sp 2 -гибридизацию, при этом атом азота поставляет в единое p-электронное облако двухэлектронную Рz-орбиталь.
3. Общая π-электронная плотность пиррола включает в себя 4n+2 = 6 р-электронов
В молекуле пиррола имеет место р,p-сопряжение. Системы, имеющие пиррольный азот называют p-избыточными или суперароматическими системами. Наличие такой системы сильно влияет на реакционную способность пиррола.
В природных соединениях ароматический пиррольный цикл часто встречается в различных многоядерных соединениях, из которых наиболее важное значение имеет порфиновое ядро, входящее в состав гемоглобина и хлорофилла.
Сопряженная система из 26 р-электронов (11 двойных связей и 2 неподеленные пары электронов пиррольных атомов. Большая энергия сопряжения (840 Кдж) свидетельствует о высокой стабильности порфина.
Понятие ароматичности распространяется не только на нейтральгные молекулы, но и на заряженные ионы. _
При замене фрагмента – СН=СН – в бензоле на – СН возникает карбоциклический – циклопентадиенил анион, относящийся к небензоидной структуре. Циклопентадиенил ион входит в состав лекарственного препарата ферроцена (дициклопентадиенил железо) и природного соединения азулена.
Циклопентадиенил анион образуется при отщеплении протона от циклопентадиена-1,3.
Рассмотрим критерии ароматичности для циклопентадиенил аниона:
1) соединение циклическое
2) все атомы углерода имеют sp 2 - гибридизацию
3) Общая π-электронная система включает в себя 4n + 2 = 6 р-электронов
Ферроцен относится к сандвичеобразным металлоорганическим соединениям (стимулирует процессы кроветворения и применяется при железодефицитных анемиях.
Циклогептатриенил катион (тропилий катион) образуется из циклогептатриена-1,3,5 при отщеплении гидрид иона.
Тропилий катион - правильный семиугольник. Ароматический секстет образован перекрыванием 6-одноэлектронных и одной свободной рz-орбиталью.
Рассмотрим критерии ароматичности для тропилий катиона:
1) Соединение циклическое
2) Все атомы углерода имеют sp 2 - гибридизацию
3) Общая π-электронная система включает в себя 4n + 2 = 6 р-электронов
Одно из положений теории А.М. Бутлерова свидетельствует о взаимном влиянии атомов.Наиболее сильное взаимное влияние оказывают атомы непосредственно связанные друг с другом. Природу и механизм этого влияния можно объяснить с помощью теории электронных смещений. Существует два вида электронных смещений – 1)смещение электронной плотности в простых σ-связях и 2)смещение электронной плотности по сопряженной системе.
Индуктивный (индукционный) эффект – это смещение электронной плотности в простых или σ-связях, который возникает в силу различной электроотрицательности атомов. Обозначается индуктивный эффект буквой I.
Можно сказать, индуктивный эффект – это передача электронного влияния заместителя по цепи σ-связей
Индуктивный эффект по знаку может быть (+I) – положительный и (-I) –отрицательный в зависимости от того электронодонорные или электроноакцепторные свойства проявляют данный атом или атомная группа.
Электронодонорным называется такой заместитель, благодаря которому происходит повышение электронной плотности в цепи.
Электроноакцепторным называется такой заместитель, благодаря которому происходит понижение электронной плотности в цепи.
Для изображения такого смещения используют ( →) стрелку на σ-связи.
В молекулах углеводородов связь ковалентная неполярная т.е. электронная плотность в молекулах распределена равномерно. Рассмотрим индуктивный эффект на примере 1-хлорбутана в сравнении его с н-бутаном.
Молекула н-бутана неполярна, т.к. электроотрицательность углерода и водорода приблизительно одинаковы, все атомы углерода находятся в sp 3 -гибридизации, т.е. и их электроотрицательность тоже одинакова, поэтому никакого смещения электронной плотности не происходит.
Введение в молекулу хлора приводит к тому, что молекула становится полярной, т.к. хлор более электроотрицательный элемент, чем углерод.
Х – акцепторная группа Стандарт У – донорная группа
Отрицательным индуктивным эффектом обладают:
Х = -NO2 , -OH, — NH2 , -COH, -COR. –COOH, -SO3H, -OR, -SR, -SH, -Hal
Положительным индуктивным эффектом обладают:
Особенности индуктивного эффекта:
1) Индуктивный эффект заместителей распространяется всегда в одном направлении.
2) Индуктивный эффект постепенно затухает, вызывая поляризацию максимум 3-4 связей.
Отрицательный индуктивный эффект атомов и атомных групп определяется их электроотрицательностью, с увеличением электроотрицательности усиливается и индукционное влияние заместителей. Его удобно рассматривать в пределах одного периода в ПСЭ.
В ряду алкильных радикалов, наибольшей электроноотталкивающей способностью, т.е. наибольшим +I эффектом обладают третичные радикалы, затем вторичные, наименьший +I эффект проявляют первичные радикалы.
Увеличение +I эффекта наблюдается с увеличением углеродной цепи в ряду предельных углеводородов:
Относительную силу индуктивного влияния заместителей можно оценить, сравнивая некоторые свойства соединений лишь в ряду одного класса.
Чем более ЭО элементом является заместитель, тем сильнее должна стать кислота, ч то и наблюдается.
π,π-Сопряжение. Простейшим представителем π,π-сопряженных систем с углеродной цепью служит бутадиен-1,3 (рис. 1, а). Атомы углерода и водорода и, следовательно, все σ-связи в его молекуле лежат в одной плоскости, образуя плоский σ-скелет. Атомы углерода находятся в состоянии sр 2 -гибридизации. Негибридизованные р-АО каждого атома углерода расположены перпендикулярно плоскости σ-скелета и параллельно друг другу, что является необходимым условием для их перекрывания. Перекрывание происходит не только между р-АО атомов С-1 и С-2, С-3 и С-4, но и между р-АО атомов С-2 и С-3, в результате чего образуется охватывающая четыре атома углерода единая π-система, т. е. возникает делокализованная ковалентная связь (см. рис. 1, б).
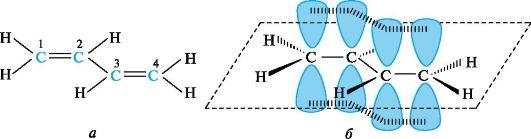
Рис. 1. Атомно-орбитальная модель молекулы бутадиена-1,3
Это отражается в изменении длин связей в молекуле. Длина связи С-1-С-2, а также С-3-С-4 в бутадиене-1,3 несколько увеличена, а расстояние между С-2 и С-3 укорочено по сравнению с обычными двойными и одинарными связями. Другими словами, процесс делокализации электронов приводит к выравниванию длин связей.
Аналогичный эффект наблюдается в изопрене (метилбутадиене-1,3), который является мономером природного каучука:
Углеводороды с большим числом сопряженных двойных связей распространены в растительном мире. К ним относятся, например, каротиноиды – каротин (пигмент моркови и красного перца), витамин А в формах ретинола и ретиналя, ликопин (пигмент помидора). Все они относятся к классу природных веществ терпеноидов. Имеют окраску от желтого до красного цветов, что связано с наличием длинной цепи сопряжения. Каротиноиды хорошо растворимы в жирах, их называют липохромами; накапливаясь в подкожно-жировой клетчатке при избыточном поступлении в организм, придают коже оранжево-желтый оттенок.
Каротиноиды относятся к биологически активным веществам-витаминам
Витамин А участвует в акте фоторецепции, обладает антиоксидантным действием, используется как лекарственный препарат.

Ретинол

Ретиналь
Открытая система сопряжения может включать и гетероатомы. Примером открытых π,π-сопряженных систем с гетероатомом в цепи могут служить α,β-ненасыщенные карбонильные соединения. Например, альдегидная группа в акролеине CH2=CH-CH=O является участником цепи сопряжения трех sр 2 -гибридизованных атомов углерода и атома кислорода. Каждый из этих атомов вносит в единую π-систему по одному р-электрону.
pπ-Сопряжение. Этот вид сопряжения чаще всего проявляется в соединениях, содержащих структурный фрагмент -CH=CH-X, где X - гетероатом, имеющий неподеленную пару электронов (прежде всего O или N). К ним относятся, например, виниловые эфиры, в молекулах которых осуществляется сопряжение двойной связи с р-орбиталью атома кислорода. Делокализованная трехцентровая связь образуется путем перекрывания двух р-АО sр 2 -гибридизованных атомов углерода и одной р-АО гетероатома с парой π-электронов.

Образование аналогичной делокализованной трехцентровой связи имеется в карбоксильной группе. Здесь в сопряжении участвуют π-электроны связи С=О и π-электроны атома кислорода группы ОН. К сопряженным системам с полностью выровненными связями и зарядами относятся отрицательно заряженные частицы, например ацетат-ион.

Направление смещения электронной плотности обозначается изогнутой стрелкой.
Существуют и другие графические способы отображения результатов сопряжения. Так, структура ацетат-иона (I) предполагает, что заряд равномерно распределен по обоим атомам кислорода (как показано на рис. 2, что соответствует действительности).

Структуры (II) и (III) применяются в теории резонанса. Согласно этой теории реальная молекула или частица описывается набором определенных так называемых резонансных структур, которые отличаются друг от друга только распределением электронов. В сопряженных системах основной вклад в резонансный гибрид вносят структуры с различным распределением π-электронной плотности (двусторонняя стрелка, связывающая эти структуры, является специальным символом теории резонанса).
В ρ,π-сопряженных системах с углеродной цепью сопряжение может осуществляться при наличии рядом с π-связью атома углерода с негибридизованной р-орбиталью. Такими системами могут быть промежуточные частицы - карбанионы, карбокатионы, свободные радикалы, например, аллильной структуры. Свободнорадикальные аллильные фрагменты играют важную роль в процессах пероксидого окисления липидов.
В аллил-анионе CH2=CH-CH2 sр 2 -гибридизованный атом углерода С-3 поставляет в общую сопряженную систему два электрона, в аллильном радикале CH2=CH-CH2 ˑ - один, а в аллильном карбокатионе CH2=CH-CH2 + не поставляет ни одного. В результате при перекрывании p-АО трех sp 2 -гибридизованных атомов углерода образуется делокализованная трехцентровая связь, содержащая четыре (в карбанионе), три (в свободном радикале) и два (в карбокатионе) электрона соответственно.
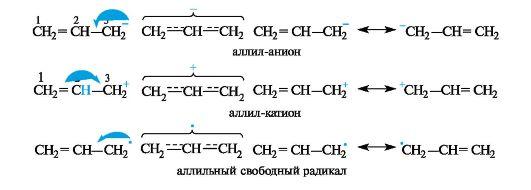
Таким образом, сопряжение приводит к существенному различию в распределении электронной плотности в реальных структурах по сравнению со структурами, изображаемыми обычными формулами строения.
Ароматичность: критерии ароматичности, правило ароматичности Хюккеля, примеры бензоидных и небензоидных ароматических соединений.
Циклические сопряженные системы представляют большой интерес как группа соединений с повышенной термодинамической устойчивостью по сравнению с сопряженными открытыми системами. Эти соединения обладают и другими особыми свойствами, совокупность которых объединяют общим понятием ароматичность. К ним относятся способность таких формально ненасыщенных соединений вступать в реакции замещения, а не присоединения, устойчивость к действию окислителей и температуры.
Типичными представителями ароматических систем являются арены и их производные. Особенности электронного строения ароматических углеводородов наглядно проявляются в атомно-орбитальной модели молекулы бензола. Каркас бензола образуют шесть sp 2 -гибридизованных атомов углерода. Все σ-связи (C-C и C-H) лежат в одной плоскости. Шесть негибридизованных р-АО расположены перпендикулярно плоскости молекулы и параллельно друг другу (рис. 3, а). Каждая р-АО в равной степени может перекрываться с двумя соседними р-АО. В результате такого перекрывания возникает единая делокализованная π-система, наибольшая электронная плотность в которой находится над и под плоскостью σ-скелета и охватывает все атомы углерода цикла (см. рис. 3, б). π-Электронная плотность равномерно распределена по всей циклической системе, что обозначается кружком или пунктиром внутри цикла (см. рис. 3, в). Все связи между атомами углерода в бензольном кольце имеют одинаковую длину (0,139 нм), промежуточную между длинами одинарной и двойной связей.
Ароматические системы (молекулы) – системы, отвечающие критериям ароматичности:
наличие плоского σ-скелета, состоящего из sp 2 -гибридизованных атомов;
делокализация электронов, приводящая к образованию единого π-электрон-ного облака, охватывающего все атомы цикла (циклов);
соответствие правилу Э. Хюккеля, т.е. электронное облако должно насчитывать 4n+2 π-электронов, где n=1,2,3,4… (обычно цифра указывает на количество циклов в молекуле);
высокая степень термодинамической устойчивости (высокая энергия сопряжения).

Рис. 3. Атомно-орбитальная модель молекулы бензола (атомы водорода опущены; объяснение в тексте)

Устойчивость сопряженных систем. Образование сопряженной и особенно ароматической системы - энергетически выгодный процесс, так как при этом увеличивается степень перекрывания орбиталей и происходит делокализация (рассредоточение) р-электронов. В связи с этим сопряженные и ароматические системы обладают повышенной термодинамической устойчивостью. Они содержат меньший запас внутренней энергии и в основном состоянии занимают более низкий энергетический уровень по сравнению с несопряженными системами. По разнице этих уровней можно количественно оценить термодинамическую устойчивость сопряженного соединения, т. е. его энергию сопряжения (энергию делокализации). Для бутадиена-1,3 она невелика и составляет около 15 кДж/моль. С увеличением длины сопряженной цепи энергия сопряжения и соответственно термодинамическая устойчивость соединений возрастают. Энергия сопряжения для бензола гораздо больше и составляет 150 кДж/моль.

Примеры небензоидных ароматических соединений:
Пиридин по электронному строению напоминает бензол. Все атомы углерода и атом азота находятся в состоянии sp 2 -гибридизации, и все σ-связи (C-C, C-N и C-H) лежат в одной плоскости (рис. 4, а). Из трех гибридных орбиталей атома азота две участвуют в образовании

Рис. 4. Пиридиновый атом азота (а), распределение электронов по орбиталям (б) и сопряженная система в молекуле пиридина (в) (связи С-Н для упрощения рисунка опущены)
σ-связей с атомами углерода (показаны только оси этих орбиталей), а третья орбиталь содержит неподеленную пару электронов и в образовании связи не участвует. Атом азота с такой электронной конфигурацией называют пиридиновым.
За счет электрона, находящегося на негибридизованной р-орбитали (см. рис. 4, б), атом азота участвует в образовании единого электронного облака ср-электронами пяти атомов углерода (см. рис. 4, в). Таким образом, пиридин является π,π-сопряженной системой и удовлетворяет критериям ароматичности.
В результате большей электроотрицательности по сравнению с атомом углерода пиридиновый атом азота понижает электронную плотность на атомах углерода ароматического кольца, поэтому системы с пиридиновым атомом азота называют π-недостаточными. Кроме пиридина, примером таких систем служит пиримидин, содержащий два пиридиновых атома азота.
Пиррол также относится к ароматическим соединениям. Атомы углерода и азота в нем, как и в пиридине, находятся в состоянии sp2-гибридизации. Однако в отличие от пиридина атом азота в пирроле имеет иную электронную конфигурацию (рис. 5, а, б).

Рис. 5. Пиррольный атом азота (а), распределение электронов по орбиталям (б) и сопряженная система в молекуле пиррола (в) (связи С-Н для упрощения рисунка опущены)
На негибридизованной р-орбитали атома азота находится неподеленная пара электронов. Она участвует в сопряжении с р-электрона- ми четырех атомов углерода с образованием единого шестиэлектронного облака (см. рис. 5, в). Три sp 2 -гибридные орбитали образуют три σ-связи - две с атомами углерода, одну с атомом водорода. Атом азота в таком электронном состоянии получил название пиррольного.
Шестиэлектронное облако в пирроле благодаря р,п-сопряжению делокализовано на пяти атомах цикла, поэтому пиррол представляет собой π-избыточную систему.
В фуране и тиофене ароматический секстет также включает неподеленную пару электронов негибридизованной p-АО кислорода или серы соответственно. В имидазоле и пиразоле два атома азота вносят разный вклад в образование делокализованного электронного облака: пиррольный атом азота поставляет пару π-электронов, а пиридиновый - один p-электрон.

Ароматичностью обладает также пурин, представляющий собой конденсированную систему двух гетероциклов - пиримидина и имидазола.

Делокализованное электронное облако в пурине включает 8 π-электронов двойных связей и неподеленную пару электронов атома N=9. Общее число электронов в сопряжении, равное десяти, соответствует формуле Хюккеля (4n + 2, где п = 2).
Гетероциклические ароматические соединения обладают высокой термодинамической устойчивостью. Неудивительно, что именно они служат структурными единицами важнейших биополимеров - нуклеиновых кислот.
Поляризация связей и электронные эффекты (индуктивный и мезомерный). Электронодонорные и электроноакцепторные заместители
Элементы, входящие в состав органических соединений, имеют неодинаковую электроотрицательность. Электроотрицательность – это способность атома притягивать к себе электроны. Смещение электронной плотности в сторону более электроотрицательного атома называется поляризацией связи. Смещение электронной плотности вдоль σ-связей в зависимости от электроотрицательности атомов, образующих эти связи, получило название индуктивного эффекта.
Этот эффект сохраняется не более, чем на 3-4 σ-связи. Графически он изображается прямой стрелкой, совпадающей с валентным штрихом, острие которой направленно в сторону более электроотрицательного элемента. Индуктивный эффект может быть положительным (+I), если электронная плотность в молекуле возрастает, или отрицательным (-I), если уменьшается электронная плотность в молекуле.
Поляризация σ-связей ведёт к появлению частичных зарядов на атомах, обозначаемых буквой δ. Например:
Влияние заместителя, передаваемое по сопряженной системе π-связей с перераспределением электронной плотности называется мезомерным эффектом. Мезомерный эффект, в отличие от индуктивного, - незатухающий. Влияние заместителя приводит к сдвигу электронной плотности у всех атомов, участвующих в сопряжении, и, соответственно, появлению на них частичных зарядов. Мезомерный эффект также бывает положительным (+М) и отрицательным (-М). Графически мезомерный эффект изображают изогнутой стрелкой, острие которой направлено в сторону атома, к которому происходит смещение электронной плотности.
Если же одна или более связывающих орбителей охватывают три или даже большее число ядер, то в этом случае говорят о делокализованной связи. Делокализованные связи характерны для соединений, содержащих открытые или замкнутые системы сопряжения.
р-Орбитали нескольких атомов могут перекрываться друг с другом, образуя общую p-электронную систему. Такой особый вид взаимного влияния атомов называется сопряжением. Сопряжение - это образование в молекуле единого делокализованного электронного облака в результате перекрывания негибридных р-орбиталей.
Делокализованные МО могут принадлежать двум или более p-связям, тогда такой тип сопряжения называют p,p-сопряжением:
1,3-бутадиен винилацетилен акролеин
Простейшим представителем p,p-сопряженных систем с углеродной цепью является 1,3-бутадиен. Установлено, что атомы углерода и водорода его молекулы лежат в одной плоскости. Расстояние между атомами углерода, связанными двойной связью (0,134 нм), несколько больше длины связи в этилене (0,133 нм), а длина связи С-2-С-3 (0,147 нм) явно короче связи С-С (0,154 нм) в этане. Негибридные р-орбитали каждого атома углерода перпендикулярны плоскости s-скелета и параллельны друг другу, что создает условия для их взаимного перекрывания и образования единого p-электронного облака (рис.10).

Рис.10Образование сопряженной системы в молекуле 1,3-бутадиена:
а -длина С-С-связей; б - перекрывание р-АО; в - делокализованная p-МО
Дополнительное перекрывание р-АО, приводящее к делокализации p-электронов в сопряженной системе, сопровождается выделением энергии, поэтому сопряженные соединения обладают меньшим запасом энергии. Они стабильнее, чем соединения с изолированными кратными связями.
Например, 1,3-бутадиен можно представить тремя такими структурами, при этом вклад структур с разделенными зарядами значительно меньший, чем структуры без разделения зарядов.
Систему сопряженных p-связей можно рассматривать независимо от s-скелета и именно p-система играет главную роль в проявлении химических свойств сопряженных соединений.
При комбинации четырех р-АО 1,3-бутадиена получают четыре МО. Диаграмма МО 1,3-бутадиена (рис. 1) показывает перекрывание четырех р-АО, которое дает две связывающие p-МО и две разрыхляющие p-МО.
Диаграмма МО 1,3-бутадиена свидетельствует о некоторой двоесвязанности между атомами С-2 и С-3.

Рис..11Схематическое представление уровней энергии и МО
Взаимное влияние атомов в молекулах и способы его передачи
Составляющие молекулу атомы испытывают взаимное влияние, передающееся с помощью электронных и пространственных эффектов. Электронные эффекты характеризуют способность заместителей передавать свое влияние по цепи ковалентно связанных атомов. Влияние заместителей может передаваться как через химические связи, так и через пространство.
А. Индуктивный эффект
Одним из свойств ковалентной связи является возможность смещения электронной плотности связи в сторону одного из партнеров.
В молекуле пропилхлорида атом хлора индуцирует частичный положительный заряд на связанном с ним атоме углерода. Этот заряд индуцирует меньший по величине положительный заряд на следующем атоме углерода, который индуцирует еще меньший положительный заряд на следующем атоме, и т. д.
Способность заместителя смещать электроны вдоль s-связей называется индуктивным эффектом. Индуктивный эффект (I-эффект) имеет природу электростатического эффекта; он передается по линии связи и приводит к появлению дробных зарядов. Электроноакцепторные группы обладают отрицательным индуктивным эффектом (-I), а электронодонорные - положительным индуктивным эффектом (+I). К электроноакцепторным группам относятся F, Cl, Br, NH2, OH, CHO, COOH, COOR, CN и NO2. К электронодонорным группам относятся атомы металлов и алкильные группы.
Индуктивный эффект передается по цепи s-связей с постепенным затуханием и, как правило, через три-четыре связи он уже не проявляется. Графически I-эффект обозначатся стрелкой на конце валентной черты, направленной острием в сторону более электроотрицательного атома. Направление поляризации связи можно установить, используя шкалу электроотрицательности элементов по Полингу (табл. 1). Направление индуктивного эффекта заместителя качественно оценивают, сравнивая с практически неполярной связью С-Н и полагая I-эффект атома водорода равным нулю.
Например, в молекуле пропена атом углерода метильной группы, находящийся в sp 3 -гибридном состоянии, менее электроотрицателен, чем sp 2 -гибридизованные атомы углерода двойной связи. Поэтому метильная группа выступает в роли донора электронов и ее влияние в первую очередь испытывает p-связь. Смещение электронной плотности p-связи обозначают изогнутой стрелкой, как показано на примере пропена:
Положительный индуктивный эффект алкильных групп возрастает при переходе от метильной группы к первичным и далее к вторичным и третичным группам.
Наибольшего значения индуктивные эффекты достигают в том случае, когда на атоме или группе атомов имеется полный заряд. Особенно сильное смещение электронной плотности вызывают ионы, которое распространяется далеко по цепи.

NH3 + (-I-эффект) H2О + (-I-эффект) О − (+I-эффект)
Б. Меэомерный эффект
Мезомерный эффект, или эффект сопряжения (М-эффект), - это передача электронного влияния заместителей по сопряженной системе.
Заместитель может вносить в систему сопряжения p-связь (p,p-сопряжение) или р-АО, которая может быть либо вакантной, либо занятой одним электроном или неподеленной парой электронов (р,p-сопряжение). Мезомерный эффект отражает тот факт, что р-орбитали заместителя, перекрываясь с орбиталями p-связей, образуют делокализованную орбиталь более низкой энергии. В отличие от индуктивного эффекта, мезомерный эффект передается по сопряженной систем без затухания.
Смещение p-электронов или неподеленных пар в сопряженных системах называют мезомерным эффектом.Положительным мезомерным эффектом (+М) обладают электронодонорные группы. К ним относятся заместители, содержащие гетероатом с неподеленной парой электронов или имеющие отрицательный заряд:
винилметиловый эфир анилин феноксид-ион
Электроноакцепторные группы, поляризующие сопряженную систему в противоположном направлении, характеризуются отрицательным мезомерным эффектом ( _ М) (кислород в пропенале). К ним относятся заместители, содержащие кратные связи атома углерода с более электроотрицательным гетероатомом:
пропеналь (акролеин) бензойная кислота бензонитрил
Индуктивный и мезомерный эффект заместителя не обязательно совпадают по направлению. При оценке влияния заместителя на распределение электронной плотности в молекуле необходимо учитывать результатирующее действие этих эффектов. За редким исключением (атомы галогенов) мезомерный эффект превалирует над индуктивным эффектом.
Делокализованная электронная плотность в молекуле может осуществляться с участием электронов и s-связей. Боковое перекрывание орбиталей s-связей с соседними p-орбиталями называют сверхсопряжением. Эффект сверхсопряжения обозначают символом Mh. Обозначение этого эффекта показано на примере пропена.
Упр. 15. Покажите электронные эффекты в молекулах следующих соединений: (а) пропилхлориде, (б) 1-нитропропане, (в) этаноле, (г) пропиллитии,
(д) этанамине, (е) бензальдегиде, (ж) акрилонитриле, (з) феноле, (и) метилбензоате.
КИСЛОТЫ И ОСНОВАНИЯ
В органической химии используют две теории кислот и оснований: протеолитическая теория Бренстеда - Лоури и электронная теория Льюиса. Эти теории не противоречат друг другу и применяются для различных целей.
Среди природных биоорганических веществ большое место занимают соединения, которые относят к сопряженным системам.
Сопряженными( конъюгированными) называют кратные связи( двойные или тройные), разделенные одинарной связью.
Чередующиеся кратные и простые связи образуют цепь сопряжения
Различают два вида сопряженных систем :
ациклические ( цепь сопряжения разомкнута)
циклические ( цепь сопряжения замкнута).
Атомы, присутствующие в цепи сопряжения, находятся в гибридном состоянии sp 2 , sp или содержат неподеленные пары электронов( эти атомы тоже приобретают тип гибридизации sp 2 )
Такими атомами могут быть атомы азота, кислорода, серы, галогенов.
Неподеленная пара электронов- это пара валентных( находится на внешнем энергетическом уровне) электронов, не участвует в обра зовании связи между двумя атомами. К ним относятся атомы –О- , - N -, - S -, - F - Cl .
Неподеленные пары электронов элементов второго периода( азот, кислород,
фтор) не могут быть распарены, поскольку в атоме нет свободных орбиталей. Их условно обозначают двумя точками над символом элемента.
Распределение электронов на внешнем энергетическом уровне атомов азота и
кислорода в невозбужденном состоянии представлено на диаграммах:
-↑- -↑-- - ↑- (одна неподеленная пара)
N 1s 2 2s 2 2p 3 -↑↓- на внешнем уровне
О 1s 2 2s 2 2p 4 -↑↓-
Распределение электронов на внешнем энергетическом уровне атома азота в
возбужденном состоянии N sp 2 возможно в двух вариантах.
В следующем разделе мы еще будем обсуждать распределение электронов на
орбиталях атома азота в ароматических гетероциклических соединениях.
Если в цепи сопряжения находятся только атомы в sp 2 - гибридном состоянии,
то такой вид сопряжения называется –π -π - сопряжение. Если присутствуют дополнительно гетероатомы( азот, кислород ), то обозначают как π -р – сопряжение.
π -π -сопряжение π -р- сопряжение
К ациклическим молекулам с сопряженными связями относятся :
* Бутадиен-1,3 , метилбутадиен-1,3( изопрен), который является мономером природного каучука, хлорвинил, который применяют для получения полимера полихлорвинила. В результате включения в сопряженную систему атом хлора малоподвижен, хлорвинил при попадании в организм накапливается, не подвергаясь обезвреживанию. Обнаружено, что он провоцирует развитие рака печени.
* Каротиноиды- каротин( пигмент моркови и красного перца), витамин А
формах ретинола и ретиналя, ликопин( пигмент помидора). Все они относятся к классу природных веществ терпеноидов. Имеют окраску от желтого до красного цветов, что связано с наличием длинной цепи сопряжения. Каротиноиды хорошо растворимы в жирах, их называют липохромами ; накапливаясь в подкожно-жировой клетчатке при избыточном поступлении в организм, придают коже оранжево- желтый оттенок.
Каротиноиды относятся к биологически активным веществам- витаминам
Витамин А участвует в акте фоторецепции, обладает антиоксидантным действием, используется как лекарственный препарат.
* Биологически активные карбоновые кислоты, занимающие видное место в процессе обмена веществ: пировиноградная , фумаровая, кротоновая.
| Бутадиен-1,3 | Метилбутадиен-1,3 (изопрен) |
| Хлорвинил | СН3 - С – О - СН = СН2 | | O |
| Ретинол | Ретиналь |
Сопряженная система. Цепь сопряжения. Энергия сопряжения.
Делокализация. Неподеленная пара электронов. Сопряжение( конъюгация)
Ключевые слова
СОПРЯЖЕННЫЕ СИСТЕМЫ
Среди природных биоорганических веществ большое место занимают соединения, которые относят к сопряженным системам.
Сопряженными( конъюгированными) называют кратные связи( двойные или тройные), разделенные одинарной связью.

Чередующиеся кратные и простые связи образуют цепь сопряжения
Различают два вида сопряженных систем :
ациклические ( цепь сопряжения разомкнута)
циклические ( цепь сопряжения замкнута).
Атомы, присутствующие в цепи сопряжения, находятся в гибридном состоянии sp 2 , sp или содержат неподеленные пары электронов( эти атомы тоже приобретают тип гибридизации sp 2 )
Такими атомами могут быть атомы азота, кислорода, серы, галогенов.
Неподеленная пара электронов- это пара валентных( находится на внешнем энергетическом уровне) электронов, не участвует в обра зовании связи между двумя атомами. К ним относятся атомы –О- , - N -, - S -, - F - Cl .
Неподеленные пары электронов элементов второго периода( азот, кислород,
фтор) не могут быть распарены, поскольку в атоме нет свободных орбиталей. Их условно обозначают двумя точками над символом элемента.
Распределение электронов на внешнем энергетическом уровне атомов азота и
кислорода в невозбужденном состоянии представлено на диаграммах:
-↑- -↑-- - ↑- (одна неподеленная пара)
N 1s 2 2s 2 2p 3 -↑↓- на внешнем уровне
О 1s 2 2s 2 2p 4 -↑↓-
Распределение электронов на внешнем энергетическом уровне атома азота в
возбужденном состоянии N sp 2 возможно в двух вариантах.
В следующем разделе мы еще будем обсуждать распределение электронов на
орбиталях атома азота в ароматических гетероциклических соединениях.
Если в цепи сопряжения находятся только атомы в sp 2 - гибридном состоянии,
то такой вид сопряжения называется –π -π - сопряжение. Если присутствуют дополнительно гетероатомы( азот, кислород ), то обозначают как π -р – сопряжение.
π -π -сопряжение π -р- сопряжение
К ациклическим молекулам с сопряженными связями относятся :
* Бутадиен-1,3 , метилбутадиен-1,3( изопрен), который является мономером природного каучука, хлорвинил, который применяют для получения полимера полихлорвинила. В результате включения в сопряженную систему атом хлора малоподвижен, хлорвинил при попадании в организм накапливается, не подвергаясь обезвреживанию. Обнаружено, что он провоцирует развитие рака печени.
* Каротиноиды- каротин( пигмент моркови и красного перца), витамин А
формах ретинола и ретиналя, ликопин( пигмент помидора). Все они относятся к классу природных веществ терпеноидов. Имеют окраску от желтого до красного цветов, что связано с наличием длинной цепи сопряжения. Каротиноиды хорошо растворимы в жирах, их называют липохромами ; накапливаясь в подкожно-жировой клетчатке при избыточном поступлении в организм, придают коже оранжево- желтый оттенок.
Каротиноиды относятся к биологически активным веществам- витаминам
Витамин А участвует в акте фоторецепции, обладает антиоксидантным действием, используется как лекарственный препарат.
* Биологически активные карбоновые кислоты, занимающие видное место в процессе обмена веществ: пировиноградная , фумаровая, кротоновая.
Сопряженная система представляет собой систему, в которой имеет место чередование простых и кратных связей или по-другому – система, в которой кратные связи находятся друг от друга на расстоянии одной одинарной связи. Такая цепь сопряженных связей называется цепью конъюгации .В сопряженных системах имеет место дополнительное перекрывание π-электронных облаков кратной связи. Двойная связь представляет собой сочетание σ-связи и π-связи. В алкенах электронная плотность π-связи охватывает только 2 атома и ее называют локализованной. Локализованные двойные связи часто встречаются в природных соединениях, например в ненасыщенных карбоновых кислотах.
В сопряженных системах происходит такое электронное взаимодействие, при котором электронная плотность в молекуле распределяется равномерно, т.е. образуется общая электронная плотность.
π,π-сопряжение (Н2С = СН – СН = СН2 Бутадиен-1,3 ) / р,π-сопряжение (Н2С = СН – Cl Хлорэтен)
Замкнутые сопряженные системы. Ароматичность.
Сопряженные системы с замкнутой цепью сопряжения – это арены, гетероциклические соединения и небензоидные ароматические структуры.Простейшие замкнутые сопряженные структуры – арены, родоначальник - бензол. (Каждая р-орбиталь в равной степени перекрывается с р-орбиталями соседних атомов. Наблюдается сопряжение, возникает единое замкнутое π – электронное облако, которое охватывает все шесть атомов С.)Такая замкнутая с. система называется ароматической. Бензол Все атомы углерода в бензольном цикле находятся в sр2- гибридизации, все связи С–С равны между собой, имеют длину 1,40 А° и занимают как бы промежуточное положение между простой (1,54 А°) и двойной (1,33 А°) связями, При этом каждый атом углерода образует три s- связи (одну связь С–Н и две s-связи С–С), лежащих в одной плоскости , т.е. у каждого атома углерода осталось по одному р-электрону, орбитали которых, за счет двукратного перекрывания друг с другом образуют замкнутую p-электронную систему, которая охватывает все атомы углерода.p-Электронная плотность в такой системе распределена равномерно. Замкнутый секстет электронов представляет собой связь, которая отличается от других типов, и ее часто называют ароматической.
Электронное строение молекулы бензола можно описать с помощью теории резонанса, согласно которой молекула бензола рассматривается как резонансный гибрид двух предельных (граничных структур).
9)
Ароматичность — особое свойство некоторых химических соединений, благодаря которому сопряженноекольцо ненасыщенных связей проявляет аномально высокую стабильность; большую чем та, которую можнобыло бы ожидать только при одном сопряжении .
К ароматическим системам относятся любые плоские замкнутые циклы, отвечающие критериям ароматичности.
Критерии ароматичности
1. Молекула имеет плоское циклическое строение.
2. Все атомы в цикле в состоянии sp2- гибридизации (следовательно s-скелет плоский и все рz-орбитали параллельны.
3. В молекуле существует делокализованная p-электронная система, содержащая 4n + 2 p-электрона , где n = 0,1,2, – натуральный ряд чисел. Это правило получило название правила Хюккеля, предложено в 1931 на основании метода молекулярных орбиталей).
Правило Хюккеля применимо не только для моноциклических p-электронных систем, но и для плоских конденсированных систем.
Нафталин (4n+2=10 p-эл-нов,n = 2) /Антрацен (4n+2=14 p-эл-нов,n = 3) /Фенантрен(4n+2=14 p-эл-нов,n = 3)
Однако н все замкнутые ароматические структуры являются ароматическими. Так, например, циклооктатетраен-1,3,5,7 не относится к ароматическим, т.к. не удовлетворяется правило Хюккеля, 4n + 2 = 8 p-электронов, n = 1,5.
10)Электронные эффекты - смещение электронной плотности в молекуле, ионе или радикале под влиянием заместителей. Заместителем считается любой атом (кроме водорода) или группа атомов, связанные с атомом углерода. Различают индуктивный (I) и мезомерный (M) эффекты заместителей.
Взаимное влияние, передающееся по цепи σ-связей, называется индуктивным эффектом (I)атома или группы, а передающееся по цепи π-связей -мезомерным эффектом или эффектом сопряжения (M).
Заместители проявляют отрицательный индуктивный эффект (-I), если они смещают к себе электронную плотность σ-связи от атома углерода сильнее, чем водород. Таким свойством обладают группы, содержащие полярные связи, и атомы более электроотрицательные, чем углерод:

Заместители характеризуются положительным индуктивным эффектом (+I), если они отталкивают электронную плотность σ-связи к углероду. +I проявляют металлы I-III групп периодической системы и алкильные группы:


Положительный мезомерный эффект (+М) проявляют атомы азота, кислорода и галогенов, непосредственно связанные с ненасыщенными атомами углерода.

1.Индуктивный эффект — смещение электронной плотности по цепи σ-связей, которое обусловлено различиями в электроотрицательностях атомов.(Наличие в молекуле полярной σ-связи вызывает поляризацию ближайших двух–трех σ-связей и ведет к возникновению частичных зарядов δ+ (дельта плюс) или δ– (дельта минус) на соседних атомах)
Индуктивный эффект передаётся по цепи с затуханием, т. к. при образовании ϭ-связи выделяется большое количество энергии и она плохо поляризуется и поэтому индуктивный эффект проявляется в большей степени на одну две связи. Направление смещения электронной плотности всех ϭ-связей обозначают прямыми стрелками.→
Например: СH3 δ+ →CH2 δ+ →CH2 δ+ →Cl δ- Э.О. Сl> Э.О. С / СH3 δ+ →CH2 δ+ →CH2 δ+ →OH δ- Э.О. ОН > Э.О. С
Атом или группа атомов, смещающие электронную плотность ϭ-связи от атома углерода на себя называются электроноакцепторными заместителями и проявляют отрицательный индуктивный эффект(-I-эффект).
Ими являются галогены (Cl, Br, I), OH - , NH2 - , COOH, COH, NO2, SO3H и др.
Атом или группа атомов, отдающие электронную плотность называются электронодонорными заместителями и проявляют положительный индуктивный эффект(+I-эффект).
+I-эффект проявляют алифатические углеводородные радикалы, СН3, С2Н5и др.
Индуктивный эффект проявляется и в случае, когда связанные атомы углерода различны по состоянию гибридизации. Например, в молекуле пропена группа СН3 проявляет +I-эффект, так как атом углерода в ней находится в sp 3 -гибридном состоянии, а атомы углерода при двойной связи в sp 2 -гибридном состоянии и проявляют большую электроотрицательность, поэтому проявляют -I-эффект и являются электроноакцепторами.(пропен-1)
2)Мезомерный эффект - смещение электронной плотности по цепи делокализованных (сопряженных) π-связей.
Этот эффект проявляют заместители, связанные с sp 2 - или sp-гибридизованным атомом. Благодаря подвижности π-электронов, М-эффект передается по цепи сопряжения без затухания.
+М-эффектом обладают заместители, повышающие электронную плотность в сопряженной системе. К ним относятся группы, которые содержат атомы с неподеленной парой электронов, способные к передаче этой пары электронов в общую систему сопряжения. +М-эффект характерен для групп -OH и -NH 2. Так, в молекуле фенола C6H5OH группа -OH проявляет +М-эффект за счет участия одной из неподеленных электронных пар атома кислорода в системе сопряжения.
–М-эффект проявляют заместители с электроотрицательными атомами и смещающие электронную плотность на себя. –М-эффект характерен для групп -CH=O, -COOH, -NO 2. Хотя эти группы имеют неподеленные электронные пары, пространственное расположение орбиталей с этими электронами не позволяет им вступать в систему сопряжения. Таким образом, в данном случае заместитель может лишь оттягивать электроны из общей системы сопряжения за счет своей более высокой электроотрицательности.
Направление смещения электронной плотности под влиянием М-эффекта обозначается изогнутыми стрелками.

11)Гомолитический разрыв связи — разрыв, когда каждому атому отходит по одному электрону. Характерен для обменного механизма образования ковалентной связи.
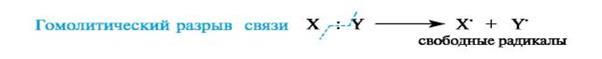
Гетеролитический разрыв связи — разрыв, когда в результате образуются положительно и отрицательно заряженные частицы, т.к. оба электрона из общей электронной пары остаются при одном из атомов. Характерен для донорно-акцепторного механизма образования ковалентной связи.

-Процесс, обратный образованию ковалентной связи по обменному механизму, в результате которого образуются два свободных радикала, называется гомолитическим разрывом связи.
-Процесс обратный образованию связи по донорно-акцепторному механизму называется гетеролитическим разрывом сввязи. При этом часто (но не всегда. ) образуются заряженные частицы ионы.
Читайте также:

