Растворитель это в химии определение кратко
Обновлено: 30.06.2024
РАСТВОРИТЕЛИ, неорг. или орг. соединения, а также смеси, способные растворять разл. в-ва. Для смесей жидкость-газ и жидкость - твердое тело растворителем обычно считают жидкость, для двух- и многокомпонентных р-ров растворителем считают компонент, содержание к-рого существенно выше содержания остальных компонентов.
Р астворители могут быть классифицированы по хим. строению, физ. св-вам и кислотно-основным св-вам.
По хим. строению растворители делят на органические и неорганические. Органические растворители принадлежат к след. классам соед.: алифатич. и ароматич. углеводороды (см. также Нефтяные растворители), их галогено- и нитропроизводные, спирты, карбоновые к-ты, простые и сложные эфиры, амиды к-т, нитрилы, кетоны, сульфоксиды и др. Важнейший неорганический растворитель-вода. К неорганическим растворителям относят легкоплавкие галогениды (напр., BrF 3 ), оксогалогениды (напр., сульфу-рилхлорид, тионилхлорид), азотсодержащие растворители (жидкий NH 3 , гидразин, гидроксиламин и др.), а также жидкий SO 2 , фтористоводородная к-та и др., в нек-рых случаях применяют легкоплавкие металлы (галлий, олово и др.). Относительно новая группа неорганических растворителей-расплавы солей, к-рые, будучи электролитами,-отличные растворители для солей и металлов, пригодны также в качестве среды для проведения орг. р-ций. Используют как легкоплавкие солевые расплавы (нитратные, ацетатные), так и относительно тугоплавкие (галогенидные, боратные, фосфатные, молибдатные, вана-датные и т. п.). Широко применяют расплавы оксидов (РbО, Bi 2 O 3 , В 2 О 3 ), а также смешанные (напр., РbО + PbF 2 ).
Р астворители можно классифицировать по физ. св-вам. (Св-ва растворителей см. на форзаце в конце тома). Растворители с т-рой кипения ниже 100 °С при 760 мм рт. ст. относят к низкокипящим, с т-рой кипения выше 150°С-к высококипящим.
По степени летучести растворители подразделяют на легколетучие, среднелетучие и труднолетучие. Летучесть зависит от теплоты испарения, а не от т-ры кипения.
По вязкости растворители подразделяют на маловязкие (менее 2 мПа·с при 20 °С), средней вязкости (2—10 мПа·с) и высоковязкие (более 10 мПа·с).
В соответствии с наличием или отсутствием дипольного момента и величиной диэлектрич. проницаемости 8 различают растворители полярные и неполярные. Кроме того, молекулы растворителей могут выступать в качестве доноров (акцепторов) протонов или электронов. Различают четыре группы растворителей: 1) протонные (вода, спирты, карбоновые к-ты и др.), к-рые являются хорошими донорами протонов и обладают высокой диэлектрич. проницаемостью ( e > 15); 2) апротонные диполяр-ные (нек-рые апротонные амиды, кетоны, сульфоксиды и др.), обладающие высокой диэлектрич. проницаемостью, но не обладающие донорно-акцепторными св-вами; 3) электро-нодонорные (напр., эфиры); 4) неполярные (сероуглерод, углеводороды), к-рые обладают низкой диэлектрич. проницаемостью ( e
К физ. характеристикам относят также растворяющую способность, определяемую показателем КБ (каури-бутанол),-кол-во растворителя, добавляемого к 20 г 33%-ного р-ра смолы каури в бутиловом спирте до помутнения р-ра (чем выше КБ, тем растворяющая способность больше).
Р астворители также классифицируют в зависимости от их пожаро-и взрывоопасности, токсичности и др.
По кислотно-основным св-вам растворители могут быть кислотными, основными и нейтральными:
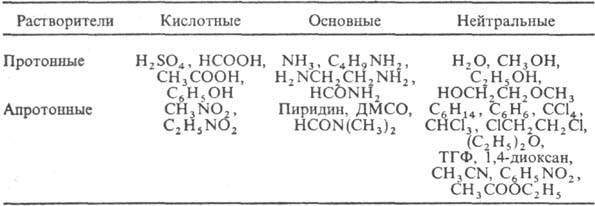
Различают применение растворителей для технол. целей и в качестве среды для проведения хим. р-ций. Как технол. ср-во растворители используют в лакокрасочной, текстильной, фармацевтич., парфюм., мед. лром-сти, при произ-ве ВВ, в с. х-ве.
В лакокрасочной пром-сти растворители-компоненты лакокрасочных материалов, обеспечивающих растворение пленкообразующих в-в (ксилол, толуол, скипидар, спирты, кетоны, ацетаты и др.), в текстильной пром-сти растворители используют для крашения, а также для хим. чистки одежды (перхлорэтилен, 1,1,1-трихлорэтан, хладон 113). Широко применяют растворители для обезжиривания металлов и их сплавов как в условиях холодной очистки (метиленхлорид, спирты, 1,1,1-трихлорэтан, хладон 113), так и в процессе парожидкостного обезжиривания (трихлорэтилен, перхлорэтилен, бензин, керосин и др.). При обезжиривании металлич. пов-стей, особенно состоящих из цветных металлов или их сплавов, хлоруглево-дороды и нек-рые другие растворители обязательно стабилизируют спец. в-вами для предотвращения разложения растворителей.
Очень важна роль растворителей как среды для проведения хим. р-ций. Растворители не только создают гомог. среду, обеспечивая контакт между реагирующими частицами (ионами, молекулами), но и влияют на порядок и скорость хим. р-ций благодаря взаимод. с исходными, промежут. в-вами и продуктами. Растворители влияют также на хим. равновесие. Так, равновесие диссоциации к.-л. к-ты зависит от основности или, соотв., кислотности растворителя, а также от его диэлектрич. проницаемости и способности растворителя сольватировать частицы растворенных в-в (см. Реакции в растворах, Сольватация). Существует ряд эмпи-рич. зависимостей между св-вами растворителей и скоростью и направлением хим. р-ции (см. Корреляционные соотношения).
В хим. технологии и лаб. практике растворители используют для процессов перекристаллизации и экстракции, в спектроскопии и хроматографии, в аналит. химии (напр., для титрования) и др.
Выбор оптимального растворителя с целью его практич. использования определяется суммой разл. факторов: физ. св-вами, растворяющей способностью, стабильностью при воздействии т-ры, света, влаги, примесей и т. д., пожаро- и взрывоопасными св-вами, токсичностью, доступностью и стоимостью.
Проблема утилизации растворителей имеет исключительно важное значение с экономич., санитарно-гигиенич. и экологич. точек зрения. Наиб. экономичные процессы утилизации растворителей-возврат их в рабочий цикл с помощью рекуперации и регенерации. Рекуперацию растворителей (улавливание с возвратом) осуществляют конденсационным, абсорбционным или адсорбционным методом. Последний метод получил наиб. распространение. В качестве адсорбентов используют активир. уголь или др. пористые в-ва (напр., силикагель). Регенерируют растворители перегонкой (иногда с водяным паром) или ректификацией; образующийся остаток сжигают.
Лит:. Одрит Л., Клейнберг Я., Неводные растворители, пер. с англ., М., 1955; Органические растворители, пер. с англ., М., 1958; Райхардт X., Растворители в органической химии, пер. с нем., Л., 1973; Энтелис С. Г., Тигер Р. П., Кинетика реакций в жидкой фазе, М., 1973; Дринберг С. А., Ицко Э.Ф., Растворители для лакокрасочных материалов, 2 изд., Л., 1986; Трегер Ю.А., Карташов Л.М., Кришталь Н. Ф., Основные хлороргани-ческие растворители, М., 1984; Фиалков Ю.Я., Растворитель как средство управления химическим процессом, Л., 1990. Ю.А. Трегер.
неорг. или орг. соединения, а также смеси, способные растворять разл. вещества. Для смесей жидкость-газ и жидкость — твердое тело Р. обычно считают жидкость, для двух- и многокомпонентных растворов Р. считают компонент, содержание которого существенно выше содержания остальных компонентов.
Р. могут быть классифицированы по хим. строению, физ. свойствам и кислотно-основным свойствам.
По хим. строению Р. делят на органические и неорганические. Органические Р. принадлежат к след. классам соед.: алифатич. и ароматические углеводороды (см. также нефтяные растворители), их галогено- и нитропроизводные, спирты, карбоновые кислоты, простые и сложные эфиры, амиды кислот, нитрилы, кетоны, сульфоксиды и др. Важнейший неорганический Р. — вода. К неорганическим Р. относят легкоплавкие галогениды (напр., BrF3), оксогалогениды (напр., сульфу-рилхлорид, тионилхлорид), азотсодержащие Р. (жидкий NH3, гидразин, гидроксиламин и др.), а также жидкий SO2, фтористоводородная кислота и др., в некоторых случаях применяют легкоплавкие металлы (галлий, олово и др.). Относительно новая группа неорганических Р. — расплавы солей, которые, будучи электролитами,-отличные Р. для солей и металлов, пригодны также в качестве среды для проведения орг. реакций. Используют как легкоплавкие солевые расплавы (нитратные, ацетатные), так и относительно тугоплавкие (галогенидные, боратные, фосфатные, молибдатные, вана-датные и т. п.). Широко применяют расплавы оксидов (PbO, Bi2O3, В2O3), а также смешанные (напр., PbO + PbF2).
Р. можно классифицировать по физ. свойствам. (Свойства Р. см. на форзаце в конце тома.) Р. с температурой кипения ниже 100 °C при 760 мм рт. ст. относят к низкокипящим, с температурой кипения выше 150 °C — к высококипящим.
По степени летучести Р. подразделяют на легколетучие, среднелетучие и труднолетучие. Летучесть зависит от теплоты испарения, а не от температуры кипения.
По вязкости Р. подразделяют на маловязкие (менее 2 мПа∙с при 20 °C), средней вязкости (2—10 мПа∙с) и высоковязкие (более 10 мПа∙с).
В соответствии с наличием или отсутствием дипольного момента и величиной диэлектрич. проницаемости 8 различают Р. полярные и неполярные. Кроме того, молекулы Р. могут выступать в качестве доноров (акцепторов) протонов или электронов. Различают четыре группы Р.: 1) протонные (вода, спирты, карбоновые кислоты и др.), которые являются хорошими донорами протонов и обладают высокой диэлектрич. проницаемостью (ε > 15); 2) апротонные диполяр-ные (некоторые апротонные амиды, кетоны, сульфоксиды и др.), обладающие высокой диэлектрич. проницаемостью, но не обладающие донорно-акцепторными свойствами; 3) электро-нодонорные (напр., эфиры); 4) неполярные (сероуглерод, углеводороды), которые обладают низкой диэлектрич. проницаемостью (ε
О специфич. классификации Р. для полимеров см. растворы полимеров.
К физ. характеристикам относят также растворяющую способность, определяемую показателем КБ (каури-бута-нол),-количество Р., добавляемого к 20 г 33%-ного раствора смолы каури в бутиловом спирте до помутнения раствора (чем выше КБ, тем растворяющая способность больше).
Р. также классифицируют в зависимости от их пожаро- и взрывоопасности, токсичности и др.
По кислотно-основным свойствам Р. могут быть кислотными, основными и нейтральными:
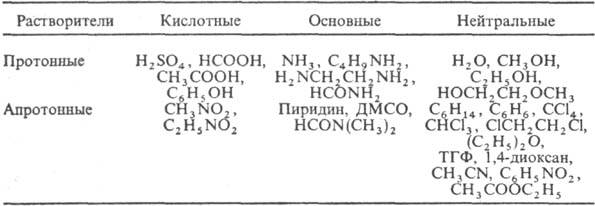
Различают применение Р. для технол. целей и в качестве среды для проведения хим. реакций. Как технол. средство Р. используют в лакокрасочной, текстильной, фармацевтич., парфюм., мед. лром-сти, при производстве ВВ, в сельском хозяйстве.
В лакокрасочной промышленности Р. — компоненты лакокрасочных материалов, обеспечивающих растворение пленкообразующих веществ (ксилол, толуол, скипидар, спирты, кетоны, ацетаты и др.), в текстильной промышленности Р. используют для крашения, а также для хим. чистки одежды (перхлорэтилен, 1,1,1-трихлорэтан, хладон 113). Широко применяют Р. для обезжиривания металлов и их сплавов как в условиях холодной очистки (метиленхлорид, спирты, 1,1,1-трихлорэтан, хладон 113), так и в процессе парожидкостного обезжиривания (трихлорэтилен, перхлорэтилен, бензин, керосин и др.). При обезжиривании металлических поверхностей, особенно состоящих из цветных металлов или их сплавов, хлоруглево-дороды и некоторые другие Р. обязательно стабилизируют спец. веществами для предотвращения разложения Р.
Очень важна роль Р. как среды для проведения хим. реакций. Р. не только создают гомог. среду, обеспечивая контакт между реагирующими частицами (ионами, молекулами), но и влияют на порядок и скорость хим. реакций благодаря взаимод. с исходными, промежут. веществами и продуктами. Р. влияют также на хим. равновесие. Так, равновесие диссоциации к.-л. кислоты зависит от основности или, соотв., кислотности Р., а также от его диэлектрич. проницаемости и способности Р. сольватировать частицы растворенных веществ (см. реакции в растворах, сольватация). Существует ряд эмпи-рич. зависимостей между свойствами Р. и скоростью и направлением хим. реакции (см. корреляционные соотношения).
В хим. технологии и лаб. практике Р. используют для процессов перекристаллизации и экстракции, в спектроскопии и хроматографии, в аналит. химии (напр., для титрования) и др.
Выбор оптимального Р. с целью его практич. использования определяется суммой разл. факторов: физ. свойствами, растворяющей способностью, стабильностью при воздействии температуры, света, влаги, примесей и т. д., пожаро- и взрывоопасными свойствами, токсичностью, доступностью и стоимостью.
Проблема утилизации Р. имеет исключительно важное значение с экономич., санитарно-гигиенич. и экологич. точек зрения. Наиб. экономичные процессы утилизации Р. — возврат их в рабочий цикл с помощью рекуперации и регенерации. Рекуперацию Р. (улавливание с возвратом) осуществляют конденсационным, абсорбционным или адсорбционным методом. Последний метод получил наиб. распространение. В качестве адсорбентов используют активир. уголь или др. пористые вещества (напр., силикагель). Регенерируют Р. перегонкой (иногда с водяным паром) или ректификацией; образующийся остаток сжигают.
Лит.: Одрит Л., Клейнберг Я., Неводные растворители, пер. с англ., М., 1955; Органические растворители, пер. с англ., М., 1958; Райхардт X., Растворители в органической химии, пер. с нем., Л., 1973; Энтелис С. Г., Тигер Р. П., Кинетика реакций в жидкой фазе, М., 1973; Дринберг С. А., Ицко Э.Ф., Растворители для лакокрасочных материалов, 2 изд., Л., 1986; Трегер Ю.А., Карташов Л.М., Кришталь Н. Ф., Основные хлороргани-ческие растворители, М., 1984; Фиалков Ю.Я., Растворитель как средство управления химическим процессом, Л., 1990.

Растворитель — вещество, способное растворять другие твёрдые, жидкие или газообразные вещества, не изменяя их химически. Как правило, при атмосферном давлении и комнатной температуре растворитель является жидким веществом. Соответственно, в растворах, представляющих собой смеси жидкого и твёрдого либо жидкого и газообразного вещества, растворителем считается жидкий компонент. В смесях жидких веществ растворителем считается тот компонент, который присутствует в значительно большем количестве, либо произвольным образом [1] [2] .
Считается, что растворители, применяемые в промышленных масштабах, должны обладать следующими свойствами: быть бесцветными и прозрачными, испаряться без остатка, иметь устойчивость к химическим веществам, проявлять нейтральную реакцию, иметь слабый либо приятный запах, быть безводными, иметь постоянные физические свойства и низкую токсичность, разлагаться в окружающей среде, быть по возможности недорогими [3] .
РАСТВОРИТЕЛИ, неорг. или орг. соединения, а также смеси, способные растворять разл. в-ва. Для смесей жидкость-газ и жидкость - твердое тело растворителем обычно считают жидкость, для двух- и многокомпонентных р-ров растворителем считают компонент, содержание к-рого существенно выше содержания остальных компонентов.
Р астворители могут быть классифицированы по хим. строению, физ. св-вам и кислотно-основным св-вам.
По хим. строению растворители делят на органические и неорганические. Органические растворители принадлежат к след. классам соед.: алифатич. и ароматич. углеводороды (см. также Нефтяные растворители), их галогено- и нитропроизводные, спирты, карбоновые к-ты, простые и сложные эфиры, амиды к-т, нитрилы, кетоны, сульфоксиды и др. Важнейший неорганический растворитель-вода. К неорганическим растворителям относят легкоплавкие галогениды (напр., BrF 3 ), оксогалогениды (напр., сульфу-рилхлорид, тионилхлорид), азотсодержащие растворители (жидкий NH 3 , гидразин, гидроксиламин и др.), а также жидкий SO 2 , фтористоводородная к-та и др., в нек-рых случаях применяют легкоплавкие металлы (галлий, олово и др.). Относительно новая группа неорганических растворителей-расплавы солей, к-рые, будучи электролитами,-отличные растворители для солей и металлов, пригодны также в качестве среды для проведения орг. р-ций. Используют как легкоплавкие солевые расплавы (нитратные, ацетатные), так и относительно тугоплавкие (галогенидные, боратные, фосфатные, молибдатные, вана-датные и т. п.). Широко применяют расплавы оксидов (РbО, Bi 2 O 3 , В 2 О 3 ), а также смешанные (напр., РbО + PbF 2 ).
Р астворители можно классифицировать по физ. св-вам. (Св-ва растворителей см. на форзаце в конце тома). Растворители с т-рой кипения ниже 100 °С при 760 мм рт. ст. относят к низкокипящим, с т-рой кипения выше 150°С-к высококипящим.
По степени летучести растворители подразделяют на легколетучие, среднелетучие и труднолетучие. Летучесть зависит от теплоты испарения, а не от т-ры кипения.
По вязкости растворители подразделяют на маловязкие (менее 2 мПа·с при 20 °С), средней вязкости (2—10 мПа·с) и высоковязкие (более 10 мПа·с).
В соответствии с наличием или отсутствием дипольного момента и величиной диэлектрич. проницаемости 8 различают растворители полярные и неполярные. Кроме того, молекулы растворителей могут выступать в качестве доноров (акцепторов) протонов или электронов. Различают четыре группы растворителей: 1) протонные (вода, спирты, карбоновые к-ты и др.), к-рые являются хорошими донорами протонов и обладают высокой диэлектрич. проницаемостью ( e > 15); 2) апротонные диполяр-ные (нек-рые апротонные амиды, кетоны, сульфоксиды и др.), обладающие высокой диэлектрич. проницаемостью, но не обладающие донорно-акцепторными св-вами; 3) электро-нодонорные (напр., эфиры); 4) неполярные (сероуглерод, углеводороды), к-рые обладают низкой диэлектрич. проницаемостью ( e
К физ. характеристикам относят также растворяющую способность, определяемую показателем КБ (каури-бутанол),-кол-во растворителя, добавляемого к 20 г 33%-ного р-ра смолы каури в бутиловом спирте до помутнения р-ра (чем выше КБ, тем растворяющая способность больше).
Р астворители также классифицируют в зависимости от их пожаро-и взрывоопасности, токсичности и др.
По кислотно-основным св-вам растворители могут быть кислотными, основными и нейтральными:

Различают применение растворителей для технол. целей и в качестве среды для проведения хим. р-ций. Как технол. ср-во растворители используют в лакокрасочной, текстильной, фармацевтич., парфюм., мед. лром-сти, при произ-ве ВВ, в с. х-ве.
В лакокрасочной пром-сти растворители-компоненты лакокрасочных материалов, обеспечивающих растворение пленкообразующих в-в (ксилол, толуол, скипидар, спирты, кетоны, ацетаты и др.), в текстильной пром-сти растворители используют для крашения, а также для хим. чистки одежды (перхлорэтилен, 1,1,1-трихлорэтан, хладон 113). Широко применяют растворители для обезжиривания металлов и их сплавов как в условиях холодной очистки (метиленхлорид, спирты, 1,1,1-трихлорэтан, хладон 113), так и в процессе парожидкостного обезжиривания (трихлорэтилен, перхлорэтилен, бензин, керосин и др.). При обезжиривании металлич. пов-стей, особенно состоящих из цветных металлов или их сплавов, хлоруглево-дороды и нек-рые другие растворители обязательно стабилизируют спец. в-вами для предотвращения разложения растворителей.
Очень важна роль растворителей как среды для проведения хим. р-ций. Растворители не только создают гомог. среду, обеспечивая контакт между реагирующими частицами (ионами, молекулами), но и влияют на порядок и скорость хим. р-ций благодаря взаимод. с исходными, промежут. в-вами и продуктами. Растворители влияют также на хим. равновесие. Так, равновесие диссоциации к.-л. к-ты зависит от основности или, соотв., кислотности растворителя, а также от его диэлектрич. проницаемости и способности растворителя сольватировать частицы растворенных в-в (см. Реакции в растворах, Сольватация). Существует ряд эмпи-рич. зависимостей между св-вами растворителей и скоростью и направлением хим. р-ции (см. Корреляционные соотношения).
В хим. технологии и лаб. практике растворители используют для процессов перекристаллизации и экстракции, в спектроскопии и хроматографии, в аналит. химии (напр., для титрования) и др.
Выбор оптимального растворителя с целью его практич. использования определяется суммой разл. факторов: физ. св-вами, растворяющей способностью, стабильностью при воздействии т-ры, света, влаги, примесей и т. д., пожаро- и взрывоопасными св-вами, токсичностью, доступностью и стоимостью.
Проблема утилизации растворителей имеет исключительно важное значение с экономич., санитарно-гигиенич. и экологич. точек зрения. Наиб. экономичные процессы утилизации растворителей-возврат их в рабочий цикл с помощью рекуперации и регенерации. Рекуперацию растворителей (улавливание с возвратом) осуществляют конденсационным, абсорбционным или адсорбционным методом. Последний метод получил наиб. распространение. В качестве адсорбентов используют активир. уголь или др. пористые в-ва (напр., силикагель). Регенерируют растворители перегонкой (иногда с водяным паром) или ректификацией; образующийся остаток сжигают.
Лит:. Одрит Л., Клейнберг Я., Неводные растворители, пер. с англ., М., 1955; Органические растворители, пер. с англ., М., 1958; Райхардт X., Растворители в органической химии, пер. с нем., Л., 1973; Энтелис С. Г., Тигер Р. П., Кинетика реакций в жидкой фазе, М., 1973; Дринберг С. А., Ицко Э.Ф., Растворители для лакокрасочных материалов, 2 изд., Л., 1986; Трегер Ю.А., Карташов Л.М., Кришталь Н. Ф., Основные хлороргани-ческие растворители, М., 1984; Фиалков Ю.Я., Растворитель как средство управления химическим процессом, Л., 1990. Ю.А. Трегер.
Читайте также:

