Принцип паули распределение электронов в атоме по состояниям кратко
Обновлено: 03.07.2024
Порой кажется странным, почему атомы и молекулы ведут себя определенным образом. Например, почему мы не можем проходить сквозь стены, но инфракрасное излучение через них проходит. Все может объяснить один принцип — принцип исключения Паули.
Принцип исключения Паули утверждает, что два электрона (или два любых других фермиона) не могут иметь одинаковое квантово-механическое состояние в одном атоме или одной молекуле. Другими словами, ни одна пара электронов в атоме не может иметь одинаковые электронные квантовые числа.
Этот принцип был предложен австрийским физиком Вольфгангом Паули в 1925 году для описания поведения электронов. В 1940-м он расширил принцип до всех фермионов в своей теореме о связи спина со статистикой. Бозоны — частицы с целым числом спинов — не следуют принципу исключения. Таким образом, идентичные бозоны могут занимать одно и то же квантовое состояние (как, например, фотоны в лазерах). Принцип исключения Паули применим только к частицам с полуцелым спином.
О спине проще всего думать как о вращении частицы вокруг собственной оси. Конечно, это сильное упрощение — и в реальности невозможно сказать наверняка, вращается ли на самом деле нечто столь малого размера вроде электрона. В общем говоря, спин подчиняется тем же математическим законам момента импульса, что и все вращающиеся объекты в классической физике. Здесь есть два важных момента, о которых стоит помнить: скорость вращения и направление оси, вокруг которой частица вращается (верхний или нижний спин).
Когда в 1922 году Отто Штерн и Уолтер Герлах открыли спин, их эксперименты показали , что присущий момент импульса, или спин, частицы вроде электрона квантовался, то есть мог принимать только определенные дискретные значения. Спин композитных частиц, таких как протоны, нейтроны и атомные ядра, — просто сумма спинов и орбитального момента импульса частиц, из которых они состоят, а значит, они подчиняются тем же условиям квантования. Таким образом, спин — это абсолютно квантово-механическое свойство частицы и оно не может быть объяснено классической физикой.
Позже выяснилось, что есть две подкатегории частиц: частицы с целым спином, известные сегодня как бозоны — среди которых фотоны, глюоны, W- и Z-бозоны, — а также гипотетические гравитоны и частицы с полуцелым спином: фермионы, включающие в себя электроны, нейтрино, мюоны и кварки, из которых состоят композитные частицы типа протонов и нейтронов. Различие между бозонами и фермионами можно описать тем, что у первых есть симметричные волновые функции, а у фермионов волновые функции асимметричны. Концепция частицы с полуцелым спином — очередной пример парадоксальной природы субатомных частиц: грубо говоря, фермиону нужно обернуться вокруг своей оси дважды, прежде чем он примет прежнее положение.
Атом углерода. На первом энергетическом уровне (оболочке первого уровня) расположено два электрона. На втором — уже четыре / © AWS
Атом углерода. На первом энергетическом уровне (оболочке первого уровня) расположено два электрона. На втором — уже четыре / © AWS
Все вышеописанное и подводит нас к одному из важнейших принципов в квантовой механике — принципу исключения Паули. Как было сказано выше, он гласит, что два идентичных фермиона не могут занимать одно и то же квантовое состояние одновременно (хотя два электрона, например, могут приобрести противоположные спины, чтобы дифференцировать свои квантовые состояния). Этот принцип можно описать так: никакие два фермиона в квантовой системе не могут обладать одинаковыми значениями всех четырех квантовых чисел в любой момент времени. Принцип исключения Паули эффективно объясняет продолжительное существование очень высокоплотных белых карликов, а также существование разных типов атомов во Вселенной, крупномасштабную стабильность вещества и ее основную массу.
Два атома формируют ковалентную связь. У каждого из атомов есть всего один электрон на самой дальней орбитали. Для получения более низкого энергетического состояния атомы объединяют свои электроны и образуют общую орбиталь, содержащую два электрона / © The Physics Mill
Два атома формируют ковалентную связь. У каждого из атомов есть всего один электрон на самой дальней орбитали. Для получения более низкого энергетического состояния атомы объединяют свои электроны и образуют общую орбиталь, содержащую два электрона / © The Physics Mill
Если тождественные частицы имеют одинаковые квантовые числа, то их волновая функция симметрична относительно перестановки частиц. Отсюда следует, что два одинаковых фермиона, входящих в одну систему, не могут находиться в одинаковых состояниях, т.к. для фермионов волновая функция должна быть антисимметричной. Обобщая опытные данные, В. Паули сформировал принцип исключения, согласно которому системы фермионов встречаются в природе только в состояниях, описываемых антисимметричными волновыми функциями (квантово-механическая формулировка принципа Паули).
 | Паули Вольфганг (1900–1958) – физик-теоретик. Работы относятся ко многим разделам современной теоретической физики, в развитии которых он принимал непосредственное участие, в частности квантовой механике, квантовой электродинамике, теории относительности, квантовой теории поля, ядерной физике, физике элементарных частиц. |
Из этого положения вытекает более простая формулировка принципа Паули, которая и была введена им в квантовую теорию (1925 г.) еще до построения квантовой механики: в системе одинаковых фермионов любые два из них не могут одновременно находиться в одном и том же состоянии. Отметим, что число одинаковых бозонов, находящихся в одном и том же состоянии, не лимитируется.
Напомним, что состояние электрона в атоме однозначно определяется набором четырех квантовых чисел:

· главного n ;

· орбитального l , обычно эти состояния обозначают 1s, 2d, 3f;
· магнитного ( );
· магнитного спинового ( ).
Распределение электронов в атоме происходит по принципу Паули, который может быть сформулирован для атома в простейшем виде: в одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел: n, l, , :
Z (n, l, , ) = 0 или 1,
где Z (n, l, , ) - число электронов, находящихся в квантовом состоянии, описываемых набором четырех квантовых чисел: n, l, , . Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме различаются значениями, по крайней мере, одного квантового числа.

Максимальное число электронов, находящихся в состояниях, описываемых набором трех квантовых чисел n, l и m, и отличающихся только ориентацией спинов электронов равно:
ибо спиновое квантовое число может принимать лишь два значения 1/2 и –1/2.

Максимальное число электронов, находящихся в состояниях, определяемых двумя квантовыми числами n и l:

При этом вектор орбитального момента импульса электрона может принимать в пространстве (2l + 1) различных ориентаций (рис. 8.1).

Максимальное число электронов, находящихся в состояниях, определяемых значением главного квантового числа n, равно:
Совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число n, называется электронной оболочкой или слоем.
В каждой из оболочек электроны распределяются по подоболочкам, соответствующим данному l.
Область пространства, в которой высока вероятность обнаружить электрон, называют подоболочкой или орбиталью. Вид основных типов орбиталей показан на рис. 8.1.

Поскольку орбитальное квантовое число принимает значения от 0 до , число подоболочек равно порядковому номеру n оболочки. Количество электронов в подоболочке определяется магнитным и магнитным спиновым квантовыми числами: максимальное число электронов в подоболочке с данным l равно 2(2l + 1). Обозначения оболочек, а также распределение электронов по оболочкам и подоболочкам приведено в табл. 1.
Принцип Паули:
В атоме не может быть двух электронов с одинаковым значением четырех квантовых чисел. При одинаковых n, l и m электроны должны отличаться спиновым квантовым числом.
Из этого следует:
1: На каждой орбитали, характеризующейся определенными значениями квантовых чисел (n, l, m), может находиться не более 2-х электронов, спины которых имеют противоположные знаки.
2: Количество электронов на подуровне равно 2(2l + 1).
3: Количество электронов на энергетическом уровне равно 2n 2 , где n – номер энергетического уровня.
Волновая оптика. Физика атома. Ядерная физика, элементарные частицы.
1. Элементы волновой оптики
Волновая оптика это раздел оптики, изучающий явления, в которых проявляются волновые свойства света: интерференция, дифракция, поляризация, дисперсия света и другие, связанные с ними явления. Классическая волновая оптика рассматривает свет как поток электромагнитных волн и основывается на теории электромагнитных волн, разработанной Максвеллом в семидесятых годах девятнадцатого столетия. C ветовые волны по всем своим признакам идентичны с электромагнитными волнами и видимый свет занимает интервал длин волн от 400 нм до 760 нм или частот от 4·10 14 до 7,6·10 14 с -1 в шкале электромагнитных волн . Другим наиболее весомым доводом для установления электромагнитной природы световых волн послужило установление равенства скорости распространения световых и электромагнитных волн в пустоте, которая выражается через магнитную и электростатическую постоянные
Световая волна, как и любая другая электромагнитная волна, состоит из двух взаимосвязанных полей – электрического и магнитного, – векторы напряженности которых и колеблются в одинаковых фазах и во взаимно перпендикулярных плоскостях (рис.1 ).

Они выражаются уравнениями
Опыт показывает, что электрическое и магнитное поля в электромагнитной волне не равноценны. Физиологическое, биологическое, фотохимическое, фотоэлектрическое и другие действия света вызываются, в основном, электрическим полем световой волны. В соответствии с этим вектор электрического поля световой волны принято называть световым вектором. Это значит, что при рассмотрении различных явлений в световой волне учитываются колебания только вектора .
Фазовая скорость световых волн в веществе связана со скоростью распространения в вакууме соотношением
Откуда следует, что показатель преломления среды выражается через магнитную и диэлектрическую проницаемости . Для всех прозрачных веществ , поэтому . Эта формула связывает оптические и электрические свойства вещества.
Монохроматичность и когерентность световых волн . Понятие монохроматической волны подразумевает неограниченную в пространстве волну, характеризуемую единственной и строго постоянной частотой. Близкую к такому определению монохроматичности световую волну могут давать лазеры, работающие в непрерывном режиме. Однако другие реальные источники света не могут излучать такую волну. Излучение таких источников имеет прерывистый характер. Прерывание волн уже приводит к их немонохроматичности. Поэтому понятие монохроматичности световых волн имеет ограниченный смысл. С понятием монохроматичности тесно связано также понятие когерентности волн, означающее согласованность колебаний светового вектора во времени и пространстве в двух или нескольких световых волнах. Когерентными волнами являются волны, имеющие одинаковую частоту и постоянную во времени и в пространстве разность фаз.
Причина отсутствия монохроматичности и когерентности света обычных источников света заключается в самом механизме испускания света атомами или молекулами источника. Продолжительность возбужденного состояния атомов, т.е. продолжительность процесса излучения света, равна τ ≈10 -8 с. За этот промежуток времени возбужденный атом, излучив световую волну, вернется в нормальное состояние и, спустя некоторое время, возбудившись вновь, может излучать световую волну с новой начальной фазой, т.е. фазы этих волн изменяются при каждом новом акте излучения. Поскольку возбуждение атомов является случайным явлением, то и разность фаз двух последовательных волн, испущенных атомом, будет случайным, они не будут когерентными. Сказанное можно отнести и к излучению двух разных атомов вещества, так как их можно рассматривать как два независимых источника света. Отсюда следует, что волны, испускаемые атомами вещества, будут когерентными только в течение интервала времени ≈10 -8 с. Совокупность волн, испущенных атомами за такой промежуток времени называется цугом волн. Значит, когерентны только волны, принадлежащие одному цугу волн. Средняя продолжительность одного цуга волн называется временем когерентности . За время когерентности волна проходит путь , эта величина является длиной когерентности (длиной цуга волн).
При́нципПа́ули (принцип запрета) — один из фундаментальных принципов квантовой механики, согласно которому два и более тождественных фермиона (частиц с полуцелым спином) не могут одновременно находиться в одном квантовом состоянии. Распределение электронов в атоме происходит по принципу Паули, который может быть сформулирован для атома в простейшем виде: в одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел: n, l,m,ms
Металлические свойства элементов в группе сверху вниз усиливаются, т.к. увеличивается количество энергетических уровней, отсюда увеличивается радиус атома , ослабевает притяжение электронов последнего энергетического уровня, уменьшается электроотрицательность, и следовательно усиливаются металлические свойства.
В периоде от начала периода к концу металлические свойства ослабевают Т.К. возрастает заряд ядра атома элемента, усиливается притяжение электронов последнего энергетического уровня , возрастает электроотрицательность и ослабевают металлические свойства.
38Соотношение неопределенностей и его физический смысл

Если имеется несколько (много) идентичных копий системы в данном состоянии, то измеренные значения координаты и импульса будут подчиняться определённомураспределению вероятности — это фундаментальный постулат квантовой механики. Измеряя величину среднеквадратического отклонения координаты и среднеквадратического отклонения импульса, мы найдем что: где ħ — приведённая постоянная Планка. Предыдущие математические результаты показывают, как найти соотношения неопределённостей между физическими переменными, а именно, определить значения пар переменных и , коммутатор которых имеет определённые аналитические свойства.
самое известное отношение неопределённости — между координатой и импульсом частицы в пространстве:
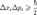
отношение неопределённости между двумя ортогональными компонентами оператора полного углового момента частицы:
где различны и обозначает угловоймомент вдоль оси .следующее отношение неопределённости между энергией и временем часто представляется в учебниках физики, хотя его интерпретация требует осторожности, так как не существует оператора, представляющего время:
Следует подчеркнуть, что для выполнения условий теоремы, необходимо, чтобы оба самосопряженных оператора были определены на одном и том же множестве функций. Примером пары операторов, для которых это условие нарушается, может служить оператор проекции углового момента и оператор азимутального угла . Первый из них является самосопряженным только на множестве 2π-периодичных функций, в то время как оператор , очевидно, выводит из этого множества. Для решения возникшей проблемы можно вместо взять , что приведет к следующей форме принципа неопределенности [** 1] :
Однако, при условие периодичности несущественно и принцип неопределенности принимает привычный вид:
39 Заряд,масса и размеры атомных ядер.Зарядовые и массовые числа.Механический момент импульса ядра и его магнитный момент.Составядра.Нуклоны.атомные ядра имеют размеры примерно 10 -14 -10 -15 м (линейные размеры атома примерно 10~ 10 м). Атомное ядро состоит из элементарных частиц - протонов и нейтронов(протон-но-нейтронная модель ядра была предложена российским физиком Д. Д. Иваненко (р. 1904), а впоследствии развита В. Гейзенбергом).
Ядро обозначается тем же символом, что и нейтральный атом: A ZХ, где X - символ химического элемента, Z - атомный номер (число протонов в ядре), А - массовое число (число нуклонов в ядре).

Орбитальный механический момент импульса атома равен геометрической (векторной) сумме орбитальных моментов всех электронов атома: , Z – число электронов.
40 Радиоактивность. Закон радиоактивного распада.Закономерностипроисхождения α- β-и γ-излучения атомных ядер.Правила смещения
РАДИОАКТИВНОСТЬ-самопроизвольное превращение атомов одного элемента в атомы других элементов, сопровождающееся испусканием частиц и жесткого электромагнитного излучения.
Во всех случаях, когда отделяли один из радиоактивных продуктов и исследовали его активность независимо от радиоактивности вещества, из которого он образовался, было обнаружено, что активность при всех исследованиях уменьшается со временем по закону геометрической прогрессии.из чего с помощью теоремы Бернулли учёные сделали вывод [источник не указан 531 день] :
Скорость превращения всё время пропорциональна количеству систем, еще не подвергнувшихся превращению.
Существует несколько формулировок закона, например, в виде дифференциального уравнения:
которое означает, что число распадов −dN, произошедшее за короткий интервал времени dt, пропорционально числу атомов N в образце.
α-распад.Этот тип распада обычно наблюдается в тяжелых неустойчивых ядрах. При этом разрушается атомное ядро X ("материнское ядро"), образуется α-частица и новое ядро Y ("дочернее ядро"). α-частица представляет собой ядро гелия, имеющее два протона и два нейтрона:
ZX A →Z-2Y A-4 +2α 4 ;2α 4 =2He 4
β-распаднаблюдается в неустойчивых изотопах более легких ядер (гидроген, натрий, азот и т.п.). β -частица испускается материнским ядром и образуется дочернее ядро. Есть три типа β-распада: электронный β- распад, позитронный β- распад и электронный захват.
a) электронный β-распад: из материнского ядра образуется электрон (-1β 0 -частица). Атомный номер дочернего ядра повышается на единицу по сравнению с материнским ядром. Также образуется антинейтрино – незаряженная частица, практически не имеющая массы - v – :
ZX A →Z+1Y A +-1β 0 +v –
b) позитронный β- распад из материнского ядра испускаются позитрон (+1β-частица) и нейтрино (v). Атомный номер дочернего ядра уменьшается на единицу по сравнению с материнским:
ZX A →Z-1Y A ++1β 0 +vc) электронный захват. Один из атомных электронов взаимодействует с ядром (чаще всего с К-уровня, но может и сL-, M- уровней) и захватывается им. В результате протон ядра превращается в нейтрон:
ZX A +-1e 0 = Z-1Y A + v
Явление γ-излучения ядер состоит в том, что ядро (A,Z) испускает g квант без изменения массового числа А и заряда ядра Z. Испускание γ-излучения обычно происходит после α- или β-распадов атомных ядер, если образовавшееся ядро образуется в возбужденном состоянии.
При́нципПа́ули (принцип запрета) — один из фундаментальных принципов квантовой механики, согласно которому два и более тождественных фермиона (частиц с полуцелым спином) не могут одновременно находиться в одном квантовом состоянии. Распределение электронов в атоме происходит по принципу Паули, который может быть сформулирован для атома в простейшем виде: в одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел: n, l,m,ms
Металлические свойства элементов в группе сверху вниз усиливаются, т.к. увеличивается количество энергетических уровней, отсюда увеличивается радиус атома , ослабевает притяжение электронов последнего энергетического уровня, уменьшается электроотрицательность, и следовательно усиливаются металлические свойства.
В периоде от начала периода к концу металлические свойства ослабевают Т.К. возрастает заряд ядра атома элемента, усиливается притяжение электронов последнего энергетического уровня , возрастает электроотрицательность и ослабевают металлические свойства.
38Соотношение неопределенностей и его физический смысл

Если имеется несколько (много) идентичных копий системы в данном состоянии, то измеренные значения координаты и импульса будут подчиняться определённомураспределению вероятности — это фундаментальный постулат квантовой механики. Измеряя величину среднеквадратического отклонения координаты и среднеквадратического отклонения импульса, мы найдем что: где ħ — приведённая постоянная Планка. Предыдущие математические результаты показывают, как найти соотношения неопределённостей между физическими переменными, а именно, определить значения пар переменных и , коммутатор которых имеет определённые аналитические свойства.
самое известное отношение неопределённости — между координатой и импульсом частицы в пространстве:
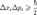
отношение неопределённости между двумя ортогональными компонентами оператора полного углового момента частицы:
где различны и обозначает угловоймомент вдоль оси .следующее отношение неопределённости между энергией и временем часто представляется в учебниках физики, хотя его интерпретация требует осторожности, так как не существует оператора, представляющего время:
Следует подчеркнуть, что для выполнения условий теоремы, необходимо, чтобы оба самосопряженных оператора были определены на одном и том же множестве функций. Примером пары операторов, для которых это условие нарушается, может служить оператор проекции углового момента и оператор азимутального угла . Первый из них является самосопряженным только на множестве 2π-периодичных функций, в то время как оператор , очевидно, выводит из этого множества. Для решения возникшей проблемы можно вместо взять , что приведет к следующей форме принципа неопределенности [** 1] :
Однако, при условие периодичности несущественно и принцип неопределенности принимает привычный вид:
39 Заряд,масса и размеры атомных ядер.Зарядовые и массовые числа.Механический момент импульса ядра и его магнитный момент.Составядра.Нуклоны.атомные ядра имеют размеры примерно 10 -14 -10 -15 м (линейные размеры атома примерно 10~ 10 м). Атомное ядро состоит из элементарных частиц - протонов и нейтронов(протон-но-нейтронная модель ядра была предложена российским физиком Д. Д. Иваненко (р. 1904), а впоследствии развита В. Гейзенбергом).
Ядро обозначается тем же символом, что и нейтральный атом: A ZХ, где X - символ химического элемента, Z - атомный номер (число протонов в ядре), А - массовое число (число нуклонов в ядре).
Орбитальный механический момент импульса атома равен геометрической (векторной) сумме орбитальных моментов всех электронов атома: , Z – число электронов.
40 Радиоактивность. Закон радиоактивного распада.Закономерностипроисхождения α- β-и γ-излучения атомных ядер.Правила смещения
РАДИОАКТИВНОСТЬ-самопроизвольное превращение атомов одного элемента в атомы других элементов, сопровождающееся испусканием частиц и жесткого электромагнитного излучения.
Во всех случаях, когда отделяли один из радиоактивных продуктов и исследовали его активность независимо от радиоактивности вещества, из которого он образовался, было обнаружено, что активность при всех исследованиях уменьшается со временем по закону геометрической прогрессии.из чего с помощью теоремы Бернулли учёные сделали вывод [источник не указан 531 день] :
Скорость превращения всё время пропорциональна количеству систем, еще не подвергнувшихся превращению.
Существует несколько формулировок закона, например, в виде дифференциального уравнения:
которое означает, что число распадов −dN, произошедшее за короткий интервал времени dt, пропорционально числу атомов N в образце.
α-распад.Этот тип распада обычно наблюдается в тяжелых неустойчивых ядрах. При этом разрушается атомное ядро X ("материнское ядро"), образуется α-частица и новое ядро Y ("дочернее ядро"). α-частица представляет собой ядро гелия, имеющее два протона и два нейтрона:
ZX A →Z-2Y A-4 +2α 4 ;2α 4 =2He 4
β-распаднаблюдается в неустойчивых изотопах более легких ядер (гидроген, натрий, азот и т.п.). β -частица испускается материнским ядром и образуется дочернее ядро. Есть три типа β-распада: электронный β- распад, позитронный β- распад и электронный захват.
a) электронный β-распад: из материнского ядра образуется электрон (-1β 0 -частица). Атомный номер дочернего ядра повышается на единицу по сравнению с материнским ядром. Также образуется антинейтрино – незаряженная частица, практически не имеющая массы - v – :
ZX A →Z+1Y A +-1β 0 +v –
b) позитронный β- распад из материнского ядра испускаются позитрон (+1β-частица) и нейтрино (v). Атомный номер дочернего ядра уменьшается на единицу по сравнению с материнским:
ZX A →Z-1Y A ++1β 0 +vc) электронный захват. Один из атомных электронов взаимодействует с ядром (чаще всего с К-уровня, но может и сL-, M- уровней) и захватывается им. В результате протон ядра превращается в нейтрон:
ZX A +-1e 0 = Z-1Y A + v
Явление γ-излучения ядер состоит в том, что ядро (A,Z) испускает g квант без изменения массового числа А и заряда ядра Z. Испускание γ-излучения обычно происходит после α- или β-распадов атомных ядер, если образовавшееся ядро образуется в возбужденном состоянии.
Читайте также:
- Языковое насилие в современной российской прессе сковородников кратко
- Основные понятия нейропсихологии кратко
- Назовите волейбольные упражнения которые влияют на развитие физических способностей школьника кратко
- Технология приготовления капуста тушеная кратко
- Кружковая работа в доу в соответствии с фгос в средней группе

