Практическое применение газовых законов кратко
Обновлено: 08.07.2024
Выдох происходит аналогично: вследствие уменьшения объема легких давление воздуха в них становится больше, чем внешнее атмосферное, и за счет обратного перепада давлений он выходит наружу. Схематическое изображение процесса дыхания дано на рис. 1.
Важную роль в этом процессе играет плевральная полость, в которой при дыхании возникают разрежения. Если хирургическим путем открыть наружному воздуху (под нормальным атмосферным давлением) доступ в плевральное пространство, то атмосферное давление сожмет легкое, выключив его из процесса дыхания. Именно так делают при лечении легочного туберкулеза (метод пневмоторакса).
Но существует еще и понятие физических легких. Это не биологический орган, а физическая система, которая функционирует подобно биологическим легким. Благодаря физическим легким дышит водяной паук серебрянка. Его тело покрыто мелким несмачиваемым пушком. Когда паук погружается в воду, к телу пристают мельчайшие пузырьки воздуха, покрывая его сплошной воздушной оболочкой. В воде эта оболочка блестит, делая паука похожим на шарик ртути. Выставляя из воды кончик брюшка, паук забирает крупный пузырек воздуха и, придерживая его задними ножками, отправляется в глубину.
Дело в том, что в воде вокруг домика-пузырька также имеется воздух. Правда, в растворенном виде. По мере расходования кислорода в пузырьке уменьшается его парциальное давление по сравнению с давлением в воде, и растворенный в воде кислород диффундирует в пузырек. Углекислый же газ, наоборот, диффундирует из домика в воду, где его парциальное давление меньше. Конечно, этот газообмен не позволяет полностью компенсировать затраты кислорода на дыхание, но тем не менее паук получает возможность обновлять атмосферу значительно реже, минут через 30, а то и более. Если паук находится в состоянии анабиоза, то воздуха от одной ходки наверх хватает на очень длительное время.
Перейдем к проблеме измерения рабочего объема легких, т.е. объема воздуха, вдыхаемого (или выдыхаемого) при глубоком вдохе (выдохе). Известно, что он меньше полного объема легких. Следовательно, при каждом вдохе-выдохе в легких обновляется не весь воздух. По рабочему объему легких (вернее, по отношению рабочего объема к полному) можно сделать вывод о состоянии дыхательной системы человека. Различные заболевания (например астма), курение, а также малоподвижный образ жизни приводят к уменьшению рабочего объема.
В настоящее время полный объем легких обычно определяют расчетным путем, по формуле Дюбуа, которая устанавливает зависимость площади поверхности тела человека от его массы и роста:
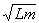
S = 0,167•
где m — масса тела в [кг], L — длина тела, рост в [м]. (Разумеется, для получения в свое время этой эмпирической формулы потребовались и вскрытия.) Следует сразу обратить внимание учащихся, что эта формула — только для чисел, т.е. единицы физических величин в ней не сходятся. Далее пользуются известной зависимостью, согласно которой на 1 м2 поверхности приходится у мужчин — 2,5 л, у женщин — 2 л полного объема легких.
В качестве примера можно рассчитать полный объем легких кого-нибудь из присутствующих. Кстати, ученики обычно предлагают кандидатуру. учителя! Этим стоит воспользоваться для того, чтобы затем кто-либо из учеников рассчитал и свой объем, если вспомнит массу и рост. Это в дальнейшем, по ходу урока, пригодится. Например, при массе 75 кг и росте 176 см площадь поверхности тела юноши составляет 1,92 м2. Следовательно, полный объем легких 4,8 л.
Теперь об измерении рабочего объема легких. С ним дела обстоят проще, поэтому можно организовать достаточно интересную дискуссию о том, какой должна быть конструкция прибора для таких измерений. К настоящему времени разработано достаточно много подходящих конструкций, но, несмотря даже на принципиальные различия, все эти приборы носят общее название спирометры. Разумеется, дискуссию надо направлять в нужное русло. Диалог с учениками может получиться, к примеру, следующим.
Учитель. Итак, давайте подумаем, как измерить объем воздуха, который выдыхает человек за один раз. Причем имейте в виду, что нужно получить значение объема воздуха при нормальном атмосферном давлении.
Ученик. Выдохнуть его в полиэтиленовый пакет и измерить объем.
Ученик. Хотя бы опустить в воду и измерить объем вытесняемой жидкости. Оболочка — тонкая, так что объем пакета с воздухом примерно равен объему одного воздуха.
Учитель. Но ведь пакет, погруженный в жидкость, будет испытывать давление жидкости. Кстати, как оно называется?
Ученик. . Гидростатическое. Ну тогда. не погружать, а измерить как-нибудь. Линейкой.
Учитель. А что, надутый полиэтиленовый пакет имеет форму параллелепипеда или шара? Только в этих случаях достаточно было бы линейки и соответствующих формул.
Ученик. Ну тогда выдохнуть в воздушный шарик. Он-то круглый!
Учитель. Да, но только при надувании резина.
Учитель. . и оказывает давление на воздух. И давление воздуха будет больше атмосферного, а объем соответственно меньше. (Ученики задумываются.)
Учитель. Воздух будет испытывать давление жидкости, если только воздушный пузырь будет погружен в нее. А если не погружать. Просто придержать выдохнутый воздух у поверхности воды.
Учитель. А вот чем? Думайте.
Ученик. Каким-нибудь поплавком или перевернутым стаканчиком.
Учитель. Идея неплохая, но поясните, что дальше-то. Каков объем воздуха в поплавке?
Ученик. Чем больше воздуха, тем сильнее поплавок всплывает.
Учитель. В общем, верно. И как в этот поплавок выдохнуть воздух?
Ученик. Подвести трубочку снизу, и через нее.
Учитель. Но ведь поплавок своей надводной частью тоже будет давить на воздух.
Ученик. Надо сделать поплавок из тонкого и легкого материала, чтобы он почти совсем не давил. Хотя бы тот же полиэтилен.
Учитель. Хорошо. А как по высоте всплытия будем определять объем?
Ученик. Нанесем шкалу на поплавок.
Учитель. Верно, но показания будут правильными, если поплавок будет сохранять строго вертикальное положение. Как обеспечить вертикальность?
Ученик. Пусть поднимается внутри какой-нибудь трубки, по диаметру такой же.
Учитель. А еще лучше, если этой трубкой будет сам сосуд с водой. А поплавок — его невесомой и поднимающейся крышкой. Осталось только сделать так, чтобы между сосудом и поплавком-крышкой не было.
Учитель. Прекрасно! Итак, мы с вами сформулировали основные принципы построения спирометра. Давайте сделаем рисунок.
Учащиеся зарисовывают схему, показанную на рис. 2, в тетрадь. Затем говорим, что первые медицинские спирометры были именно такой конструкции. Но она громоздкая, хрупкая, неудобная: при резком перемещении прибора вода может вылиться. Поэтому сейчас чаще всего можно встретить так называемые турбинные спирометры типа ССП. Наверняка, многие имели дело с ними на диспансеризации. Лучше всего, если удастся такой спирометр попросить на время в каком-нибудь медицинском учреждении для демонстрации. С ним легко работать, он маленький, легкий, а главное — принцип работы предельно прост: поток выдыхаемого воздуха давит на лопасти турбинки, вал которой соединен через передаточный механизм со стрелкой, скользящей вдоль шкалы. Чем больше воздуха прошло через турбинку, тем больше оборотов она сделает, тем выше показания прибора.
Оборудование: Электроплитка, химический стакан, пробирка, прибор для изучения газовых законов, компьютер, проектор с экраном.
Ход урока
I. Разминка
– Да, – ответил гость.
– Вот и хорошо, – сказал хозяин, – сладкого?
–Да, – подтвердил Холмс.
– Я люблю горячий чай, поэтому кладу в него кусочки сахара только перед тем, как пить, – продолжил хозяин.
– Разумнее это делать раньше, сразу как вам налили чай, – посоветовал Шерлок Холмс.
Ответ: Прав. Если сахар положить сразу в горячий чай, его температура тут же понизится: чем меньше она будет отличаться от комнатной, тем медленней чай будет остывать. (тепловое равновесие)
б) Найти ошибки в рисунках, где m = const.


II. Повторение
а) изотермический процесс, изохорный процесс, изобарный процесс.
1. Работа с таблицей: Учащиеся имеют перед собой графики – для изотермического в координатах (р,V), для изохорного – (р,T), для изобарного – (V,T) и координатные системы без графиков. Учащиеся должны определить вид процесса , написать газовые законы и дорисовать остальные графики, а желающие – для двух различных значений. После выполнения работы графики проецируем на экран и каждый ученик проверяет работу своего соседа.
Графики должны иметь вид:


2. Показ опытов с помощью самодельного прибора: Перед учащимися создаем проблемную ситуацию - объяснить наблюдаемое явление.
а) Какие термодинамические параметры не изменяются?
б) Как происходит изменение других параметров?
в) Как называется данный процесс?
Для изучения процессов в газах применяем демонстрационную установку, показанную на следующем рисунке:
 | 1 – Медицинский шприц на 20 мл, 2 – жидкостный манометр, 3 – сосуд с воздухом, 4 – мультиметр М 838, 5 – электроплитка, 6 – термопара, 7 – демонстрационный манометр. |
Для успешной работы прибора должна быть обеспечена герметичность, а вместо мультиметра М 838 можно использовать другой, который измеряет температуру по шкале Цельсия.
- Демонстрация изотермического процесса. Рукой медленно поднимаем и опускаем поршень шприца, а температура остается постоянной.
- Демонстрация изохорного процесса. Жидкостный манометр заменяем демонстрационным манометром и включаем электроплитку. Наблюдаем повышение температуры и давления газа.
- Демонстрация изобарного процесса. Продолжаем нагревание. Когда сила давления газа на поршень будет достаточной, начнется изобарное расширение газа – поршень поднимается. Отмечаем неизменность показаний манометра, хотя температура газа растет.
Установка может служить моделью тепловой машины. На ней можно показать основные элементы любой тепловой машины, продемонстрировать простой цикл машины. Нагревателем служит электроплитка, холодильником – окружающий воздух, рабочим телом – газ в колбе и в шприце под поршнем. Опишем цикл машины, состоящий их двух изохор и из двух изобар.

Исходное состояние – поршень в нижнем положении, на котором стоит груз массой 10-20 г. Включаем электроплитку. Давление и температура газа начинают расти, что фиксируются манометром и мультиметром. Объем газа остается при этом остается постоянным до тех пор, пока сила давления на поршень не превышает веса поршня и груза. Рабочее тело совершает процесс (участок 1-2). Далее поршень поднимается при постоянном давлении газа (участок 2-3), показания манометра не меняются. Температура же продолжает расти. Рабочее тело на участке 1-2-3 получило от нагревателя некоторое количество теплоты Q1. Выключаем и убираем электроплитку. Убираем груз. Рабочее тело отдаст холодильнику некоторое количество теплоты Q2. При этом давление газа сначала уменьшится изохорно (участок 3-4) (пока сила давления газа больше веса поршня), потом изобарно (участок 4-1). Обращаем внимание учащихся на то, что давление на участке 4-1 меньше, чем на участке 2-3. Это четко видно из показаний манометра. Температура снова становится комнатной, что наблюдается по показаниям мультиметра. Цикл завершен, совешена работа по поднятию груза.
3. Решение экспериментальной задачи: Показываем следующий опыт – на электроплитку ставим высокий химический стакан с водой. Внутри воды находится перевернутая пробирка, частично заполненная водой. Резинкой отмечаем первоначальный уровень воды в пробирке. Можно сделать подсвет, ставя между установкой и лампой подсвета лист ватмана. По мере нагревания пробирка всплывает, охлаждается, касаясь с наружным воздухом и опускается на дно. Учащихся просим объяснить этот опыт.

(После нагревания воздуха в пробирке, он расширяется и вытесняет часть воды из пробирки. В результате уменьшается сила тяжести системы состоящей из пробирки и воды в ней. Как только сила тяжести станет меньше выталкивающей силы, пробирка всплывает.)
Этот опыт показываем ещё раз при изучении принципа действия тепловых машин.
IV. Применение газовых законов в жизни
Изобарным можно считать расширение газа при нагревании его в цилиндре с подвижным поршнем. Постоянство давления в цилиндре обеспечивается атмосферным давлением на внешнюю поверхность поршня.
Изохорным можно считать увеличение давления газа в любой емкости или в электрической лампочке при нагревании.
V. Фронтальный опрос
Работу выполняют на тех же листах, где учащиеся работали с графиками, на обратной стороне. Задачи решаются полностью.
Когда в длинное колено наливали ртуть, то она сжимала воздух, заключенный в коротком колене, тем значительнее, чем более налито было ртути в другом. Когда ртуть в коротком колене доходила до уровня AB, в длинном она была на уровне CD, значит, упругость сжатого воздуха была такова, что он мог поддерживать давление ртутного столба высотою от AB до CD. А так как эта высота в первых опытах Р. Бойля была равна высоте ртути в барометре, то этим доказывалось, что в барометре ртутный столб поддерживался атмосферным возду хом. Наливая различные, все большие и большие количества ртути в длинное колено трубки, Р. Бойль записывал высоты ртутного столба и соответственные объемы сжатого воздуха, но сначала не обратил внимания на численные их соотношения. Его ученик Ричард Тоунлей, просматривая числа таблицы, заметил, что объемы запертого воздуха обратно пропорциональны давлениям, на него производимым. Если воздух занимал сначала 12 дюймов длины в трубке, причем ртуть в обоих коленах была на одной высоте, то когда в длинное колено было прилито столько ртути, что воздух занял только 6 дюймов длины, оказалось, что высота поддерживаемого столба ртути была 29 англ. дюймов. Вначале воздух, запертый в коротком колене, имел упругость одинаковую с атмосферой, которая могла поддерживать в барометре ртуть на 29 дюймов высоты. А во втором случае запертый воздух подвержен был давлению атмосферы и давлению ртутного столба в 29 дюйм, т.е. в сумме – давлению 29×2 дюйма: значит, когда объем воздуха стал вдвое меньше, его упругость сделалась вдвое больше. После этого Бойль многократно повторял и разнообразил опыты и доказал, что тот же закон приложим к случаям увеличения объема воздуха.

Может быть, еще справедливее было бы присоединить имя и Р. Тоунлея. Во всяком случае, Э. Мариотт так известен своими другими трудами, что, несмотря на свидетельство цифр, трудно его подозревать в несамостоятельности работ, приведших ко вторичному открытию важного физического закона. История физики показывает, что очень важные законы, открытые в одной стране, могли долгое время быть неизвестными в другой.
Пример 2– Равенство температурных коэффициентов.Опыты показали, что приращение объема газа пропорционально приращению температуры. Поэтому тепловое расширение газа можно, так же как и для других тел, охарактеризовать при помощи температурного коэффициента объемного расширения α. Оказалось, что для газов этот закон выполняется гораздо лучше, чем для твердых и жидких тел, так что температурный коэффициент объемного расширения газов есть величина, практически постоянная даже при очень значительных изменениях температуры, тогда как для жидких и твердых тел это постоянство соблюдается лишь приблизительно:
Опыты Ж.Л. Гей-Люссака и других обнаружили замечательный результат. Оказалось, что температурный коэффициент объемного расширения α у всех газов одинаков (точнее, почти одинаков) и равняется 1/273 о С -1 . Объем некоторой массы газа при нагревании на 1 о С при постоянном давлении увеличивается на 1/273 часть объема, который эта масса газа имела при 0 о С (закон Гей-Люссака).
Как видно, температурный коэффициент объемного расширения газов α совпадает с их температурным коэффициентом давления β.
Следует отметить, что тепловое расширение газов весьма значительно, так что объем газа V0 при 0 о С заметно отличается от объема при иной, например при комнатной, температуре. Поэтому в случае газов нельзя без заметной ошибки заменить в формуле (1) объем V0 объемом V. В соответствии с этим формуле расширения для газов удобно придать следующий вид. За начальный объем принимают объем V0 при температуре 0 о С. В таком случае приращение температуры газа t равно температуре t отсчитанной по шкале Цельсия. Следовательно, температурный коэффициент объемного расширения будет равным:
Формула (2) может служить для вычисления объема при температуре как выше 0 о С, так и ниже 0 о С. В последнем случае t будет иметь отрицательные значения. Следует, однако, иметь в виду, что закон Гей-Люссака не оправдывается, когда газ сильно сжат или настолько охлажден, что он приближается к состоянию сжижения. В этом случае пользоваться формулой (2) нельзя.
Совпадение коэффициентов α и β, входящих в закон Шарля и закон Гей-Люссака, не случайно. Легко видеть, что, так как газы подчиняются закону Бойля-Мариотта, то α и β должны быть равны между собой. Действительно, пусть некоторая масса газа имеет при температуре 0 о С объем V0 и давление р0. Нагреем ее до температуры t при неизменном объеме. Тогда давление ее, согласно закону Шарля, будет равно: .
С другой стороны, нагреем ту же массу газа до температуры t при неизменном давлении. Тогда, согласно закону Гей-Люссака, объем ее станет равным: .
Итак, данная масса газа может иметь при температуре t объем V0 и давление или объем и давление р0. Тогда согласно закону Бойля-Мариотта: т.е. . Следовательно .
Пример 3 – История изобретения термометров.В далекой древности люди измеряли температуру, только используя параметры холодно, тепло, горячо. Не было приборов, которые бы точно показывали уровень температуры окружающей среды, веществ, тела человека. Путь создания данных приборов был достаточно долгим и трудным.
Изобретателем термометра принято считать Г. Галилея. В его собственных сочинениях нет описания этого прибора, но его ученики В. Вивиани (1622-1703) и др. засвидетельствовали, что уже в 1597 году он устроил нечто вроде термобароскопа (термоскоп). Г. Галилей изучал в это время Герона Александрийского (10-75 гг. н.э.), у которого уже описано подобное приспособление, но не для измерения степеней тепла, а для поднятия воды при помощи нагревания.
В 1702 г. был изобретен воздушный термоскоп постоянного объема (рис. 1.6). Воздух в шаре (его диаметр примерно 8 см) отсечен от внешнего воздуха ртутью, находящейся в нижней части шара и в узкой трубке (ее диаметр примерно 1 мм). Давление в шаре изменялось, когда изменялась температура. Происходило это практически при постоянном объеме воздуха. Современные гелиевые термометры работают тоже при постоянном объеме.
Первый прибор для наблюдений за изменением температуры термоскоп придумал итальянский ученый Галилео Галилей примерно в 1597 г. Этот прибор представлял собой небольшой стеклянный шарик с припаянной к нему стеклянной трубкой. Шарик слегка нагревали, и конец трубки опускали в сосуд с водой. Через некоторое время воздух в шарике охлаждался, его давление уменьшалось, и вода под действием атмосферного давления поднималась по трубке вверх на некоторую высоту. В дальнейшем при потеплении давление воздуха в шарике увеличивалось, и уровень воды в трубке понижался; при охлаждении же вода в ней поднималась. Следовательно, при помощи этого прибора можно было судить только об изменении степени нагретости тела: числовых значений температуры он не показывал, ибо не имел шкалы. Кроме того, уровень воды в трубке зависел не только от температуры, но и от атмосферного давления.
В 1657 г. термоскоп Галилея был усовершенствован флорентийскими учеными. Они снабдили прибор шкалой из бусин и откачали воздух из резервуара (шарика) и трубки. Это позволило не только качественно, но и количественно сравнивать температуры тел.
Позже прибор был изменен. Его перевернули шариком вниз, в трубку вместо воды налили спирт и удалили сосуд. Действие этого прибора основывалось на расширении спирта при нагревании, причем показания прибора не зависели от атмосферного давления. Это был один из первых термометров.
Постоянные точки термометра были установлены в XVIII веку. К этому времени уже было известно, что при атмосферном давлении температуры таяния льда и кипения воды постоянны. Эти сведения использовались при усовершенствовании термометров.
В 1714 г. голландский ученый Д. Фаренгейт (1686–1736) изготовил ртутный термометр. Погрузив его в смесь льда и поваренной соли, ученый обозначил 0 o F. Затем он принял точку таяния льда за 32 o F, а точка кипения воды оказалась равной 212 o F. Термометром Фаренгейта пользуются в наше время в США.
Таким образом, ученые XVIII века называли температурой то, что показывал их собственный термометр. В разных странах были приняты различные температурные шкалы. Единство измерений температуры стало возможным лишь век спустя, благодаря усилиям английского физика У. Томсона.
Когда в длинное колено наливали ртуть, то она сжимала воздух, заключенный в коротком колене, тем значительнее, чем более налито было ртути в другом. Когда ртуть в коротком колене доходила до уровня AB, в длинном она была на уровне CD, значит, упругость сжатого воздуха была такова, что он мог поддерживать давление ртутного столба высотою от AB до CD. А так как эта высота в первых опытах Р. Бойля была равна высоте ртути в барометре, то этим доказывалось, что в барометре ртутный столб поддерживался атмосферным возду хом. Наливая различные, все большие и большие количества ртути в длинное колено трубки, Р. Бойль записывал высоты ртутного столба и соответственные объемы сжатого воздуха, но сначала не обратил внимания на численные их соотношения. Его ученик Ричард Тоунлей, просматривая числа таблицы, заметил, что объемы запертого воздуха обратно пропорциональны давлениям, на него производимым. Если воздух занимал сначала 12 дюймов длины в трубке, причем ртуть в обоих коленах была на одной высоте, то когда в длинное колено было прилито столько ртути, что воздух занял только 6 дюймов длины, оказалось, что высота поддерживаемого столба ртути была 29 англ. дюймов. Вначале воздух, запертый в коротком колене, имел упругость одинаковую с атмосферой, которая могла поддерживать в барометре ртуть на 29 дюймов высоты. А во втором случае запертый воздух подвержен был давлению атмосферы и давлению ртутного столба в 29 дюйм, т.е. в сумме – давлению 29×2 дюйма: значит, когда объем воздуха стал вдвое меньше, его упругость сделалась вдвое больше. После этого Бойль многократно повторял и разнообразил опыты и доказал, что тот же закон приложим к случаям увеличения объема воздуха.
Может быть, еще справедливее было бы присоединить имя и Р. Тоунлея. Во всяком случае, Э. Мариотт так известен своими другими трудами, что, несмотря на свидетельство цифр, трудно его подозревать в несамостоятельности работ, приведших ко вторичному открытию важного физического закона. История физики показывает, что очень важные законы, открытые в одной стране, могли долгое время быть неизвестными в другой.
Пример 2– Равенство температурных коэффициентов.Опыты показали, что приращение объема газа пропорционально приращению температуры. Поэтому тепловое расширение газа можно, так же как и для других тел, охарактеризовать при помощи температурного коэффициента объемного расширения α. Оказалось, что для газов этот закон выполняется гораздо лучше, чем для твердых и жидких тел, так что температурный коэффициент объемного расширения газов есть величина, практически постоянная даже при очень значительных изменениях температуры, тогда как для жидких и твердых тел это постоянство соблюдается лишь приблизительно:
Опыты Ж.Л. Гей-Люссака и других обнаружили замечательный результат. Оказалось, что температурный коэффициент объемного расширения α у всех газов одинаков (точнее, почти одинаков) и равняется 1/273 о С -1 . Объем некоторой массы газа при нагревании на 1 о С при постоянном давлении увеличивается на 1/273 часть объема, который эта масса газа имела при 0 о С (закон Гей-Люссака).
Как видно, температурный коэффициент объемного расширения газов α совпадает с их температурным коэффициентом давления β.
Следует отметить, что тепловое расширение газов весьма значительно, так что объем газа V0 при 0 о С заметно отличается от объема при иной, например при комнатной, температуре. Поэтому в случае газов нельзя без заметной ошибки заменить в формуле (1) объем V0 объемом V. В соответствии с этим формуле расширения для газов удобно придать следующий вид. За начальный объем принимают объем V0 при температуре 0 о С. В таком случае приращение температуры газа t равно температуре t отсчитанной по шкале Цельсия. Следовательно, температурный коэффициент объемного расширения будет равным:
Формула (2) может служить для вычисления объема при температуре как выше 0 о С, так и ниже 0 о С. В последнем случае t будет иметь отрицательные значения. Следует, однако, иметь в виду, что закон Гей-Люссака не оправдывается, когда газ сильно сжат или настолько охлажден, что он приближается к состоянию сжижения. В этом случае пользоваться формулой (2) нельзя.
Совпадение коэффициентов α и β, входящих в закон Шарля и закон Гей-Люссака, не случайно. Легко видеть, что, так как газы подчиняются закону Бойля-Мариотта, то α и β должны быть равны между собой. Действительно, пусть некоторая масса газа имеет при температуре 0 о С объем V0 и давление р0. Нагреем ее до температуры t при неизменном объеме. Тогда давление ее, согласно закону Шарля, будет равно: .
С другой стороны, нагреем ту же массу газа до температуры t при неизменном давлении. Тогда, согласно закону Гей-Люссака, объем ее станет равным: .
Итак, данная масса газа может иметь при температуре t объем V0 и давление или объем и давление р0. Тогда согласно закону Бойля-Мариотта: т.е. . Следовательно .
Пример 3 – История изобретения термометров.В далекой древности люди измеряли температуру, только используя параметры холодно, тепло, горячо. Не было приборов, которые бы точно показывали уровень температуры окружающей среды, веществ, тела человека. Путь создания данных приборов был достаточно долгим и трудным.
Изобретателем термометра принято считать Г. Галилея. В его собственных сочинениях нет описания этого прибора, но его ученики В. Вивиани (1622-1703) и др. засвидетельствовали, что уже в 1597 году он устроил нечто вроде термобароскопа (термоскоп). Г. Галилей изучал в это время Герона Александрийского (10-75 гг. н.э.), у которого уже описано подобное приспособление, но не для измерения степеней тепла, а для поднятия воды при помощи нагревания.
В 1702 г. был изобретен воздушный термоскоп постоянного объема (рис. 1.6). Воздух в шаре (его диаметр примерно 8 см) отсечен от внешнего воздуха ртутью, находящейся в нижней части шара и в узкой трубке (ее диаметр примерно 1 мм). Давление в шаре изменялось, когда изменялась температура. Происходило это практически при постоянном объеме воздуха. Современные гелиевые термометры работают тоже при постоянном объеме.
Первый прибор для наблюдений за изменением температуры термоскоп придумал итальянский ученый Галилео Галилей примерно в 1597 г. Этот прибор представлял собой небольшой стеклянный шарик с припаянной к нему стеклянной трубкой. Шарик слегка нагревали, и конец трубки опускали в сосуд с водой. Через некоторое время воздух в шарике охлаждался, его давление уменьшалось, и вода под действием атмосферного давления поднималась по трубке вверх на некоторую высоту. В дальнейшем при потеплении давление воздуха в шарике увеличивалось, и уровень воды в трубке понижался; при охлаждении же вода в ней поднималась. Следовательно, при помощи этого прибора можно было судить только об изменении степени нагретости тела: числовых значений температуры он не показывал, ибо не имел шкалы. Кроме того, уровень воды в трубке зависел не только от температуры, но и от атмосферного давления.
В 1657 г. термоскоп Галилея был усовершенствован флорентийскими учеными. Они снабдили прибор шкалой из бусин и откачали воздух из резервуара (шарика) и трубки. Это позволило не только качественно, но и количественно сравнивать температуры тел.
Позже прибор был изменен. Его перевернули шариком вниз, в трубку вместо воды налили спирт и удалили сосуд. Действие этого прибора основывалось на расширении спирта при нагревании, причем показания прибора не зависели от атмосферного давления. Это был один из первых термометров.
Постоянные точки термометра были установлены в XVIII веку. К этому времени уже было известно, что при атмосферном давлении температуры таяния льда и кипения воды постоянны. Эти сведения использовались при усовершенствовании термометров.
В 1714 г. голландский ученый Д. Фаренгейт (1686–1736) изготовил ртутный термометр. Погрузив его в смесь льда и поваренной соли, ученый обозначил 0 o F. Затем он принял точку таяния льда за 32 o F, а точка кипения воды оказалась равной 212 o F. Термометром Фаренгейта пользуются в наше время в США.
Таким образом, ученые XVIII века называли температурой то, что показывал их собственный термометр. В разных странах были приняты различные температурные шкалы. Единство измерений температуры стало возможным лишь век спустя, благодаря усилиям английского физика У. Томсона.
Газовые законы были открыты экспериментально, но все они могут быть получены из уравнения Менделеева-Клапейрона.
Рассмотрим каждый из них.
Закон Бойля-Мариотта (изотермический процесс)
Изотермическим процессомназывают изменение состояния газа, при котором его температура остаётся постоянной.
Для неизменной массы газа при постоянной температуре произведение давления газа на объем есть величина постоянная:
Этот же закон можно переписать в другом виде (для двух состояний идеального газа):
Этот закон следует из уравнения Менделеева – Клапейрона:
![]()
Очевидно, что при неизменной массе газа и при постоянной температуре правая часть уравнения остается постоянной величиной.
Графики зависимости параметров газа при постоянной температуре называются изотермами.
Обозначив константу буквой , запишем функциональную зависимость давления от объема при изотермическом процессе:
![]()
Видно, что давление газа обратно пропорционально его объему. Графиком обратной пропорциональности, а, следовательно, и графиком изотермы в координатах является гипербола (рис.1, а). На рис.1 б) и в) представлены изотермы в координатах и соответственно.

Рис.1. Графики изотермических процессов в различных координатах
Закон Гей-Люссака (изобарный процесс)
Изобарным процессомназывают изменение состояния газа, при котором его давление остаётся постоянным.
Для неизменной массы газа при постоянном давлении отношение объема газа к температуре есть величина постоянная:
![]()
Для двух состояний газа этот закон запишется в виде:
![]()
Этот закон также следует из уравнения Менделеева – Клапейрона:
![]()
Графики зависимости параметров газа при постоянном давлении называются изобарами.

Рассмотрим два изобарных процесса с давлениями и . В координатах и изобары будут иметь вид прямых линий, перпендикулярных оси (рис.2 а,б).
Определим вид графика в координатах .Обозначив константу буквой , запишем функциональную зависимость объема от температуры при изобарном процессе:
Видно, что при постоянном давлении объем газа прямо пропорционален его температуре. Графиком прямой пропорциональности, а, следовательно, и графиком изобары в координатах является прямая, проходящая через начало координат (рис.2, в). В реальности при достаточно низких температурах все газы превращаются в жидкости, к которым газовые законы уже неприменимы. Поэтому вблизи начала координат изобары на рис.2, в) показаны пунктиром.

Рис.2. Графики изобарных процессов в различных координатах
Закон Шарля (изохорный процесс)
Изохорным процессомназывают изменение состояния газа, при котором его объем остаётся постоянным.
Для неизменной массы газа при постоянном объеме отношение давления газа к его температуре есть величина постоянная:
![]()
Для двух состояний газа этот закон запишется в виде:
![]()
Этот закон также можно получить из уравнения Менделеева – Клапейрона:
![]()
Графики зависимости параметров газа при постоянном давлении называются изохорами.

Рассмотрим два изохорных процесса с объемами и . В координатах и графиками изохор будут прямые, перпендикулярные оси (рис.3 а, б).
Для определения вида графика изохорного процесса в координатах обозначим константу в законе Шарля буквой , получим:
Таким образом, функциональная зависимость давления от температуры при постоянном объеме является прямой пропорциональностью, графиком такой зависимости является прямая, проходящая через начало координат (рис.3, в).

Рис.3. Графики изохорных процессов в различных координатах
Примеры решения задач
| Задание | До какой температуры нужно изобарически охладить некоторую массу газа с начальной температурой , чтобы объем газа уменьшился при этом на одну четверть? |
| Решение | Изобарный процесс описывается законом Гей-Люссака: |
![]()
По условию задачи объем газа вследствие изобарного охлаждения уменьшается на одну четверть, следовательно:
![]()
![]()
откуда конечная температура газа:
![]()
![]()
.
![]()
| Задание | В закрытом сосуде находится газ под давлением 200 кПа. Каким станет давление газа, если температуру повысить на 30%? |
| Решение | Так как сосуд с газом закрытый, объем газа не меняется. Изохорный процесс описывается законом Шарля: |
![]()
По условию задачи температура газа повысилась на 30%, поэтому можно записать:
![]()
Подставив последнее соотношение в закон Шарля, получим:
![]()
![]()
Па.
![]()
| Задание | В кислородной системе, которой оборудован самолет, имеется кислорода при давлении Па. При максимальной высоте подъема летчик соединяет с помощью крана эту систему с пустым баллоном объемом . Какое давление установится в ней? Процесс расширения газа происходит при постоянной температуре. |
| Решение | Изотермический процесс описывается законом Бойля-Мариотта: |
откуда давление, установившееся в системе:
![]()
![]()
Читайте также:
- Правовое регулирование брака и развода с участием иностранных граждан и лиц без гражданства кратко
- Проблемы развития современного китая демография экология ресурсы социальная политика кратко
- Неологизмы в школе примеры
- Педсовет перспективы развития школы
- Развитие речи через дидактические игры в детском саду

