Понятие о константе михаэлиса кратко
Обновлено: 02.07.2024
Константа Михаэлиса (популяризированная работами Леонор Микаэлис (1875-1949) и Мод Ментен (1879-1960)), или K m , является константой, характеризующей ферментативную реакцию. Это один из двух параметров фермента, используемых в упрощенной модели ферментативной кинетики Михаэлиса-Ментен , другой - каталитическая константа фермента k cat (также называемая числом оборотов , или TON). В К м соответствует значению концентрации субстрата , для которых ферментативная скорость реакции равна половинемаксимальная скорость V макс .
Эта константа , которая имеет размерность концентрации ( моль / л ) связана с константой диссоциации в фермента для его субстрата , но , как правило , не является строго равняться фермента / субстрата константы диссоциации, но выше , чем это.
Резюме
K m и ферментативная активность
Константа Михаэлиса K m представляет собой концентрацию субстрата, при которой начальная скорость реакции составляет половину максимальной начальной скорости . Эта константа представляет собой концентрацию, у нее та же единица: моль л -1 .
Константа Михаэлиса является характеристикой фермента . Часто K m различных ферментов адаптированы к внутриклеточной концентрации их субстратов.
- Чем больше , тем Kм является высоким , чем выше концентрация субстрата требуется для значительной активности фермента является высокой. Обычно это отражает низкое сродство фермента к субстрату. Это наблюдается для ферментов, субстраты которых находятся в высокой концентрации в окружающей их среде или которые имеют широкий спектр субстратов и относительно высокий K m . Например протеазы .
- Чем больше , тем Kм является низким , тем больше активность фермента максимальна достигается при низкой концентрации субстрата. Сродство фермента к субстрату сильное. Обычно они являются селективными и / или очень активными ферментами. Это, например, случай с пероксидазами , которые должны разлагать токсичные соединения при очень низких уровнях концентрации. [исх. нужно]
Модель Михаэлис-Ментен
Рассмотрим кинетическую схему: . Является : E + S ⇌ E S → E + п
- E + S → ES , реакция 1, константа скорости второго порядка k1 ;
- ES → E + S , реакция -1, константа скорости первого порядка k-1 ;
- ES → E + P , реакция 2, константа скорости первого порядка k2 (иногда также называемая kcat , потому что это каталитическая стадия);
где E обозначает фермент, S - субстрат, ES - комплекс фермент / субстрат и P - продукт.
Мы стремимся вычислить скорость реакции V i = d [ P ] / dt = k 2 [ ES ] в начале реакции ( начальная скорость ) и в условиях, когда эта скорость является стационарной (независимо от времени).
- В начале реакции концентрация субстрата еще не успела существенно измениться, поэтому ее можно считать постоянной, что упрощает расчеты. Кроме того, концентрация продукта реакции еще мала, что позволяет пренебречь обратной реакцией и, возможно, ингибированием фермента продуктом.
- Если скорость реакции постоянна (стационарна), это означает, что [ ES ] постоянна, то есть d [ ES ] / dt = 0. Это приближение называется приближением квазистационарного состояния (AEQS). Это предположение оправдано тем фактом, что концентрация фермента мала по сравнению с концентрациями субстрата и продукта, и поэтому концентрация любого каталитического промежуточного соединения мала, и эта концентрация не может сильно варьироваться по абсолютной величине.
Если поза V max = k 2 [ E ] T , то:
- [ S ] : Концентрация субстрата (в моль / л);
- V я \, \!> : начальная скорость (то есть в отсутствие продукта) ферментативной реакции для концентрации субстрата (в мкмоль / мин); [ S ]
- V м в Икс \, \!> : Максимальная начальная скорость, измеренная для насыщающей концентрации субстрата (в мкмоль / мин);
- Кинетическая константа k 2 также называется каталитической константой k cat , или частотой оборота фермента. Это максимальное количество реакций, которые молекула фермента может катализировать в секунду.
- K м \, \!> : Ферментоспецифическая константа Михаэлиса . Это концентрация субстрата, при которой начальная скорость реакции равна (в моль / л). Это соответствует кажущейся константе диссоциации субстрата. Однако следует отметить, что постоянная Михаэлиса не является строго константой равновесия. Согласно вышеуказанному механизму, константа Михаэлиса равна Km = (k-1 + k2) / k1 , и поэтому ее значение отклоняется от значения константы диссоциации k-1/ k1 . V м в Икс 2 \ over 2>>
Графически уравнение Михаэлиса представляет собой ветвь гиперболы .
Константа Михаэлиса и ингибиторы
Конкурентный ингибитор увеличивает константу Михаэлиса и , следовательно , уменьшает сродство.
Чистый неконкурентный ингибитор не изменяет константу Михаэлиса, но меняет v max .
Смешанный (или неконкурентный) ингибитор может увеличивать или уменьшать константу Михаэлиса и изменять v max .
Уравне́ние Михаэ́лиса — Ме́нтен — основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и фермента. Простейшая кинетическая схема, для которой справедливо уравнение Михаэлиса:

Уравнение имеет вид:

,
Вывод уравнения
Вывод уравнения был впервые предложен Бриггсом и Холдейном. Вывод уравнения скорости ферментативной реакции, описываемой схемой Михаэлиса-Ментен.
Обозначения констант скоростей:
k1 — константа скорости реакции образования фермент-субстратного комплекса из фермента и субстрата
k-1 — константа скорости реакции диссоциации фермент-субстратного комплекса на фермент и субстрат
k2 — константа скорости реакции превращения фермент-субстратного комплекса в фермент и продукт
Для фермент-субстратного комплекса применим метод квазистационарности, так как в подавляющем большинстве реакций константа скорости превращения фермент-субстратного комплекса в фермент и продукт много больше, чем константа скорости образования ферменто-субстратного комплекса из фермента и субстрата. Иными словами:
![\frac<d[ES]></p>
<p>=k_1[E][S]-(k_+k_2)[ES]=0](https://dic.academic.ru/pictures/wiki/files/48/02b5886d69e6deaba5cd43c5b0248e64.jpg)
Учтем тот факт, что фермент, изначально находившийся только в свободной форме, в процессе реакции находится как в виде фермент-субстратного комплекса, так и в виде молекул свободного фермента. Таким образом:
[E]0 = [E] + [ES]
Преобразуем это к виду:
[E] = [E]0 − [ES]
И подставим в первое уравнение. После раскрытия скобок и группировки слагаемых получим следующее:
![\frac<d[ES]></p>
<p>=k_1[E]_0[S]-(k_1[S]+k_+k_2)[ES]=0](https://dic.academic.ru/pictures/wiki/files/48/03bcdc18008b4c1717c76ca5273fdd1e.jpg)
Выразим отсюда концентрацию фермент-субстратного комплекса:
![[ES]=\frac<k_1[E]_0[S]></p>
<p>+k_2>](https://dic.academic.ru/pictures/wiki/files/56/84ac85c4d84f17b6e345db349a7f94c0.jpg)
Скорость ферментативной реакции в целом (то есть скорость образования продукта) представляет собой скорость распада фермент-субстратного комплекса по реакции первого порядка с константой k2:
v = k2[ES]
Подставим в эту формулу выражение, которое мы получили для концентрации ES. Получим:
![v=\frac<k_1k_2[E]_0[S]></p>
<p>+k_2>](https://dic.academic.ru/pictures/wiki/files/97/a01829c7ce20f315f1be56ee18d1d078.jpg)
Разделим числитель и знаменатель на k1. В результате:
![v=\frac<k_2[E]_0[S]></p>
<p>+k_2>+[S]>](https://dic.academic.ru/pictures/wiki/files/50/25081437a58534023595c0d5813ae249.jpg)
Выражение в знаменателе — (k-1+k2)/k1 — называется константой Михаэлиса (Km). Это кинетическая константа (с размерностью концентрации), которая равняется такой концентрации субстрата, при которой скорость ферментативной реакции составляет половину от максимального значения.
Для начальной стадии реакции можно пренебречь уменьшением концентрации субстрата. Тогда выражение для начальной скорости реакции будет выглядеть так:
![v_0=\frac<k_2[E]_0[S]_0></p>
<p>](https://dic.academic.ru/pictures/wiki/files/102/f66ebb2be2637d79f9569c65822ac22b.jpg)
Если k-1>k2, то на первой стадии ферментативной реакции с течением времени устанавливается равновесие (квазиравновесный режим протекания реакции), и в выражение для скорости ферментативной реакции входит уже не константа Михаэлиса, а субстратная константа KS, характеризующая взаимодействие фермента с субстратом в равновесных условиях:
[S]>" width="" height="" />
; >=\frac" width="" height="" />
По значению KS можно судить о химическом сродстве субстрата к ферменту.
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Константа Михаэлиса" в других словарях:
константа Михаэлиса — Кинетический параметр ферментативной реакции, численно равный концентрации субстрата, при которой скорость реакции составляет половину максимальной; К.М. характеризует сродство фермента к субстрату. [Арефьев В.А., Лисовенко Л.А. Англо русский… … Справочник технического переводчика
константа Михаэлиса — Michaelis constant, Km константа Михаэлиса. Kинетический параметр ферментативной реакции, численно равный концентрации субстрата, при которой скорость реакции составляет половину максимальной; К.М. характеризует сродство фермента к субстрату.… … Молекулярная биология и генетика. Толковый словарь.
Константа Михаэлиса — КОНСТÁНТА МИХАЭ́ЛИСА, Km, один из кинетических параметров ферментативной реакции. Численно равна концентрации субстрата, при к рой скорость реакции составляет половину от максимальной. Является функцией неск. констант скорости; в нек рых случаях… … Биологический энциклопедический словарь
Михаэлиса константа — Уравнение Михаэлиса Ментен основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и фермента. Простейшая кинетическая схема, для которой справедливо уравнение… … Википедия
Михаэлиса константа — один из важнейших параметров кинетики ферментативных реакций, введённый немецкими учёными Л. Михаэлисом (L. Michaelis) и М. Ментен в 1913; характеризует зависимость скорости ферментативного процесса от концентрации субстрата. Согласно… … Большая советская энциклопедия
Уравнение Михаэлиса — Ментен — Диаграмvа скорости реакции V как функции от концентрации [S]. Уравнение Михаэлиса Ментен основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и… … Википедия
Уравнение Михаэлиса-Ментен — Уравнение Михаэлиса Ментен основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и фермента. Простейшая кинетическая схема, для которой справедливо уравнение… … Википедия
Уравнение Михаэлиса — Диаграмма скорости реакции V как функции от концентрации [S]. Уравнение Михаэлиса Ментен основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и… … Википедия
Ферментативный инигибитор — ≠ Рис. 1: Общая схема ингибирования фермента Ферментативный ингибитор вещество, замедляющее протекание ферментативной реакции. Различают обратимые и необратимые ингибиторы. Обратимые делятся на … Википедия
Характер зависимости ферментативной реакции от рН определяется тем, что этот показатель оказывает влияние на:
a) ионизацию аминокислотных остатков, участвующих в катализе,
b) ионизацию субстрата,
c) конформацию фермента и его активного центра.
Ингибирование ферментов
Скорость ферментативной реакции может быть снижена действием ряда химических веществ, называемых ингибиторами. Некоторые ингибиторы являются для человека ядами, например, цианиды, другие – используются в качестве лекарственных препаратов.
Ингибиторы можно разделить на два основных типа: необратимые и обратимые. Необратимые ингибиторы (I) связываются с ферментом с образованием комплекса, диссоциация которого с восстановлением активности фермента невозможна:
E + I EI.
Примером необратимого ингибитора является диизопропилфторфосфат (ДФФ). ДФФ ингибирует фермент ацетилхолинэстеразу, играющего важную роль в передаче нервного импульса. Этот ингибитор взаимодействует с серином активного центра фермента, блокируя тем самым активность последнего. Вследствие этого нарушается способность отростков нервных клеток нейронов проводить нервный импульс. ДФФ является одним из первых веществ нервно-паралитического действия. На его основе создан ряд относительно нетоксичных для человека и животных инсектицидов - веществ, ядовитых для насекомых.
Обратимые ингибиторы, в отличие от необратимых, при определенных условиях могут быть легко отделены от фермента. Активность последнего при этом восстанавливается:
.
Среди обратимых ингибиторов выделяют конкурентные и неконкурентные ингибиторы.
Конкурентный ингибитор, являясь структурным аналогом субстрата, взаимодействует с активным центром фермента и таким образом перекрывает доступ субстрата к ферменту. При этом ингибитор не подвергается химическим превращениям и связывается с ферментом обратимо. После диссоциации комплекса EI фермент может связаться либо с субстратом и преобразовать его, либо с ингибитором (рис. 34.). Поскольку и субстрат и ингибитор конкурируют за место в активном центре, такое ингибирование называется конкурентным.
Рис. 34. Механизм действия конкурентного ингибитора.
Конкурентные ингибиторы используются в медицине. Для борьбы с инфекционными болезнями ранее широко применялись сульфаниламидные препараты. Они близки по своей структуре к пара-аминобензойной кислоте (ПАБК), необходимому фактору роста многих патогенных бактерий. ПАБК является предшественником фолиевой кислоты, которая служит кофактором ряда ферментов. Сульфаниламидные препараты выступают в качестве конкурентного ингибитора ферментов синтеза фолиевой кислоты из ПАБК и тем самым подавляют рост и размножение патогенных бактерий.
Неконкурентные ингибиторы по структуре не сходны с субстратом и при образовании EI взаимодействуют не с активным центром, а с другим участком фермента. Взаимодействие ингибитора с ферментом приводит к изменению структуры последнего. Образование EI-комплекса является обратимым, поэтому после его распада фермент вновь способен атаковать субстрат (рис. 35).
Рис. 35. Механизм действия неконкурентного ингибитора
В качестве неконкурентного ингибитора может выступать цианид CN - . Он связывается с ионами металлов, входящими в состав простетических групп и подавляет активность этих ферментов. Отравления цианидами крайне опасны. Они могут привести к летальному исходу.
Аллостерические ферменты
Рис. 36. Структура аллостерического фермента.
Регуляция мультиферментных систем
Некоторые ферменты действуют согласованно, объединяясь в мультиферментные системы, в которых каждый фермент катализирует определенную стадию метаболитического пути:
В мультиферментной системе есть фермент, который определяет скорость всей последовательности реакций. Этот фермент, как правило, бывает аллостерическим и находится в начале матаболитического пути. Он способен, получая различные сигналы, как повышать, так и понижать скорость катализируемой реакции, тем самым регулируя скорость всего процесса.
Одним из характерных проявлений жизни является удивительная способность живых организмов кинетически регулировать химические реакции, подавляя стремление к достижению термодинамического равновесия. Ферментативная кинетика занимается исследованием закономерностей влияния химической природы реагирующих веществ (ферментов, субстратов) и условий их взаимодействия (концентрация, рН среды, температуры, присутствие активаторов или ингибиторов) на скорость ферментативной реакции. Главной целью изучения кинетики ферментативных реакций является получение информации, которая может способствовать выяснению молекулярного механизма действия фермента.
Общие принципы кинетики химических реакций применимы и к ферментативным реакциям. Известно, что любая химическая реакция характеризуется константой термодинамического равновесия. Она выражает состояние химического равновесия, достигаемого системой, и обозначается Кр. Так, для реакции:
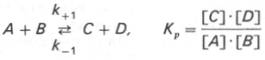
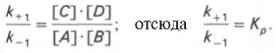
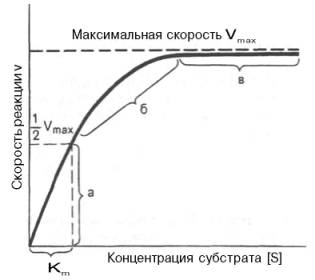
Рис. 4.12. Теоретический график зависимости скорости ферментативной реакции от концентрации субстрата при постоянной концентрации фермента.
а - реакция первого порядка (при [ S ]
Таким образом, константа равновесия равна отношению констант скоростей прямой и обратной реакций. Величину, обратную константе равновесия, принято называть субстратной константой, или, в случае ферментативной реакции, константой диссоциации фермент–субстратного комплекса, и обозначать символом KS. Так, в реакции
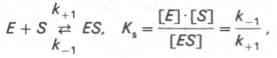
т.е. KSравна отношению произведения концентрации фермента и субстрата к концентрации фермент-субстратного комплекса или отношению констант скоростей обратной и прямой реакций. Следует отметить, что константа KSзависит от химической природы субстрата и фермента и определяет степень их сродства. Чем ниже значение KS, тем выше сродство фермента к субстрату.
При изучении кинетики ферментативных реакций следует учитывать одну важную особенность этих реакций (не свойственную обычным химическим реакциям), связанную с явлением насыщения фермента субстратом. При низкой концентрации субстрата зависимость скорости реакции от концентрации субстрата (рис. 4.12) является почти линейной и подчиняется кинетике первого порядка. Это означает, что скорость реакции S —> Р прямо пропорциональна концентрации субстрата S и в любой момент времени t определяется следующим кинетическим уравнением:
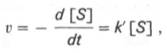
где [S] – молярная концентрация субстрата S; –d[S]/dt – скорость убыли субстрата; k' – константа скорости реакции, которая в данном случае имеет размерность, обратную единице времени (мин –1 или с –1 ).
При высокой концентрации субстрата скорость реакции максимальна, становится постоянной и не зависящей от концентрации субстрата [ S ] . В этом случае реакция подчиняется кинетике нулевого порядка v = k" (при полном насыщении фермента субстратом) и целиком определяется концентрацией фермента. Различают, кроме того, реакции второго порядка, скорость которых пропорциональна произведению концентраций двух реагирующих веществ. В определенных условиях при нарушении пропорциональности говорят иногда о реакциях смешанного порядка (см. рис. 4.12).
Изучая явление насыщения, Л. Михаэлис и М. Ментен разработали общую теорию ферментативной кинетики. Они исходили из предположения, что ферментативный процесс протекает в виде следующей химической реакции:
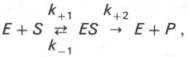
т.е. фермент Е вступает во взаимодействие с субстратом S с образованием промежуточного комплекса ES, который далее распадается на свободный фермент и продукт реакции Р. Математическая обработка на основе закона действующих масс дала возможность вывести уравнение, названное в честь авторов уравнением Михаэлиса–Ментен, выражающее количественное соотношение между концентрацией субстрата и скоростью ферментативной реакции:
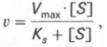
Из уравнения Михаэлиса–Ментен следует, что при высокой концентрации субстрата и низком значении KSскорость реакции является максимальной, т.е. v = Vmax(реакция нулевого порядка, см. рис. 4.12). При низкой концентрации субстрата, напротив, скорость реакции оказывается пропорциональной концентрации субстрата в каждый данный момент (реакция первого порядка).
Следует указать, что уравнение Михаэлиса–Ментен в его классическом виде не учитывает влияние на скорость ферментативного процесса продуктов реакции, например в реакции
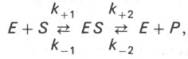
и носит несколько ограниченный характер. Поэтому были предприняты попытки усовершенствовать его. Так, было предложено уравнение Бриггса-Холдейна:
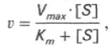
где Кm представляет собой константу Михаэлиса, являющуюся экспериментально определяемой величиной. Она может быть представлена следующим уравнением:
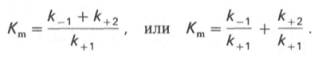
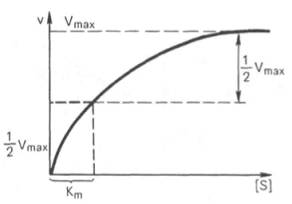
Рис. 4.13. Кривая уравнения Михаэли-са-Ментен: гиперболическая зависимость начальных скоростей катализируемой ферментом реакции от концентрации субстрата.
В числителе представлены константы скоростей распада комплекса ES в двух направлениях (в сторону исходных Е и S и в сторону конечных продуктов реакции Е и Р). Отношение k–1/ k+1представляет собой константу диссоциации ферментсубстратного комплекса KS, тогда:
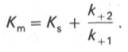
Отсюда вытекает важное следствие: константа Михаэлиса всегда больше константы диссоциации фермент-субстратного комплекса KSна величину
Для определения численного значения Кm обычно находят ту концентрацию субстрата, при которой скорость ферментативной реакции v составляет половину от максимальной Vmax, т.е. если v = 1 /2 Vmaх. Подставляя значение v в уравнение Бриггса–Холдейна, получаем:
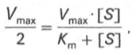
разделив обе части уравнения на Vmах, получим
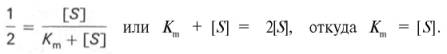
Таким образом, константа Михаэлиса численно равна концентрации субстрата (моль/л), при которой скорость данной ферментативной реакции составляет половину от максимальной.
Определение величины Кm имеет важное значение при выяснении механизма действия эффекторов на активность ферментов и т.д. Константу Михаэлиса можно вычислить по графику (рис. 4.13). Отрезок на абсциссе, соответствующий скорости, равной половине максимальной, будет представлять собой Кm.
Пользоваться графиком, построенным в прямых координатах зависимости начальной скорости реакции v0 от начальной концентрации субстрата [S0], неудобно, поскольку максимальная скорость Vmaxявляется в данном случае асимптотической величиной и определяется недостаточно точно.
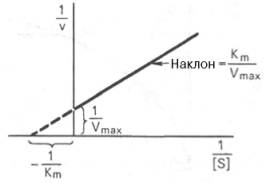
Рис. 4.14. График Лайнуивера-Бэрка.
Для более удобного графического представления экспериментальных данных Г. Лайнуивер и Д. Бэрк преобразовали уравнение Бриггса–Хол-дейна по методу двойных обратных величин исходя из того принципа, что если существует равенство между двумя какими-либо величинами, то и обратные величины также будут равны. В частности, если
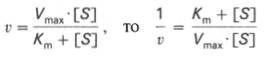
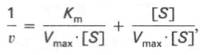
то после преобразования получаем уравнение:
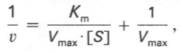
которое получило название уравнения Лайнуивера–Бэрка. Это уравнение прямой линии: у = ах + b. Если теперь в соответствии с этим уравнением построить график в координатах 1/v (y) от l/[S] (x), то получим прямую линию (рис. 4.14), тангенс угла наклона который будет равен величине Km/Vmax; отрезок, отсекаемый прямой от оси ординат, представляет собой l/Vmax(обратная величина максимальной скорости). Если продолжить прямую линию за ось ординат, тогда на абсциссе отсекается отрезок, соответствующий обратной величине константы Михаэлиса – 1/Кm (см. рис. 4.14). Таким образом, величину Кm можно вычислить из данных наклона прямой и длины отрезка, отсекаемого от оси ординат, или из длины отрезка, отсекаемого от оси абсцисс в области отрицательных значений.
Следует подчеркнуть, что значения Vmax, как и величину Кm, более точно, чем по графику, построенному в прямых координатах, можно определить по графику, построенному по методу двойных обратных величин. Поэтому данный метод нашел широкое применение в современной энзимологии. Предложены также аналогичные графические способы определения Кm и Vmaxв координатах зависимости v от v/[S] и [S]/v от [S].
Следует отметить некоторые ограничения применения уравнения Ми-хаэлиса–Ментен, обусловленные множественными формами ферментов и аллостерической природой фермента. В этом случае график зависимости начальной скорости реакции от концентрации субстрата (кинетическая
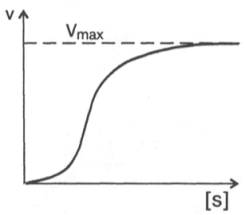
Рис. 4.15. Сигмоидная кинетическая кривая насыщения субстратом.
кривая) имеет не гиперболическую форму, а сигмоидный характер (рис. 4.15) наподобие кривой насыщения гемоглобина кислородом. Это означает, что связывание одной молекулы субстрата в одном каталитическом центре повышает связывание субстрата с другим центром, т.е. имеет место кооперативное взаимодействие, как и в случае присоединения кислорода к 4 субъединицам гемоглобина. Для оценки концентрации субстрата, при которой скорость реакции составляет половину максимальной, в условиях сигмоидного характера кинетической кривой обычно применяют преобразованное уравнение Хилла:
Читайте также:

