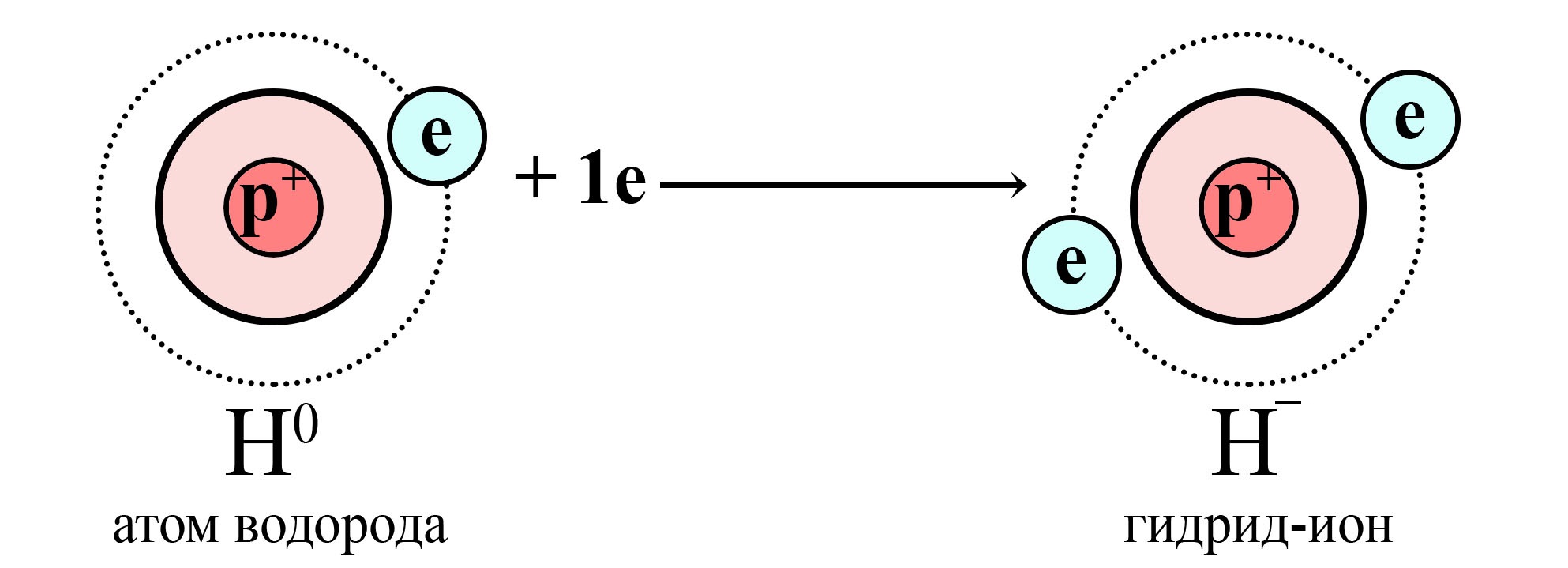Положение водорода в периодической системе менделеева кратко
Обновлено: 05.07.2024
Водород – первый элемент и один из двух представителей первого периода системы. Особенность строения электронной оболочки атома водорода (как и гелия) не позволяет однозначно решить, в какой группе периодической системы он должен находиться.
По электронной формуле 1s 1 он формально относится к s-элементам и является аналогом элементов I группы. С щелочными металлами его объединяет сходство атомного спектра, способность давать в растворах гидратированный положительно заряженный ион (H + ) (отсюда и восстановительная активность, в частности, способность вытеснять неактивные металлы из различных соединений, например под давлением из растворов их солей или при нагревании из оксидов). Водород и элементы IA группы проявляют степень окисления +1, являются типичными восстановителями и во всех соединениях одновалентны. Однако во многом водород отличается от щелочных металлов:
- В состоянии свободного иона H + водород не имеет ничего общего с ионами щелочных металлов. Протон на несколько порядков меньше катионов любых других элементов, обладает исключительно высоким поляризующим действием и благодаря высокой энергии ионизации атома водорода в соединениях практически не содержится.
- У атома водорода отсутствует эффект экранирования.
- Единственный электрон атома водорода является кайносимметричным.
- Энергия ионизации атома водорода намного больше энергии ионизации атомов щелочных металлов, что следует из пунктов 2 и 3:
В то же время водород схож и с галогенами, с которыми его связывает большое число признаков:
- Для завершения внешнего электронного слоя атому водорода, как и атомам галогенов не хватает одного электрона.
- Близкие значения энергии ионизации:
Можно провести много других аналогичных примеров линейной взаимосвязи свойств в ряду H2 – F2.
-
Большая энергия связи:
Как это неудивительно водород напоминает и элементы IV группы тем, что внешняя электронная оболочка атома заполнена как раз наполовину, как например у углерода.
Эти аналогии при некотором желании можно обнаружить и в химических свойствах, но, видимо, все же лучше признать, что из-за совершенно особенного строения атома настоящих аналогов в периодической системе химических элементов водород не имеет. Не случайно только для соединений водорода в степени окисления +1 имеет место специфический вид связи – водородной. Все это свидетельствует о том, что в периодической системе водороду должно быть отведено особое место. И некоторые авторы (Я. А. Угай) располагают его в одной протяженной клетке над элементами второго периода (исключая неон). И это вполне логично, т.к. первый период содержит всего 2 элемента, один из которых – инертный газ.
В то же время по аналогии с галогенами и щелочными металлами его условно располагают в VII и I группе периодической системы.
Водород находится в 1-м периоде, I группе, главной (А) подгруппе. Химический знак водорода обычно проставляют и в VII группе.
Это связано с тем, что ядро атома водорода представляет из себя протон (элементарную частицу), заряд его равен +1. Электронная оболочка имеет один уровень, на котором расположен один электрон. Водород, как и металлы I группы, легко окисляется. Валентность водорода равна I.
В то же время водороду недостает только одного электрона, чтобы заполнить внешний электронный уровень (т.к. на I уровне может разместиться только 2 электрона). В этом он сходен с галогенами. Водород-простое вещество, как и галогены, является неметаллом. Поэтому химический знак водорода помещают также в VII группу.
Молекула водорода состоит из двух атомов, связанных ковалентной неполярной связью.
Водород – газ, без цвета и запаха, легче воздуха. Растворимость в воде очень мала.
- Водород горит, образуется вода; смесь водорода с воздухом сгорает со взрывом:
2H2 + O2 = 2H2O - Водород продолжает гореть в атмосфере хлора (т.е. реагирует с хлором при нагревании), образуется хлороводород:
H2 + Cl2 = 2HCl
Сходным образом протекают реакции со многими неметаллами. - Водород восстанавливает металлы из их оксидов:
H2 + CuO = Cu + H2O
В этих трех реакциях водород является восстановителем.
Водород может выступать в роли окислителя при нагревании со щелочными металлами:
2Na + H2 = 2NaH (образуется гидрид натрия)
В лаборатории водород получают взаимодействием цинка с соляной кислотой:
Водород собирают в сосуд, перевернутый кверху дном.
Чтобы проверить его на чистоту, пробирку с водородом подносят к пламени спиртовки. Чистый водород сгорает со звонким хлопком. Если водород смешан с воздухом, сгорает со взрывом.
Водород можно получить взаимодействием натрия, кальция с водой:
2Na + 2HOH = 2NaOH + H2↑
При отсутствии этих реактивов практикуется получение водорода взаимодействием алюминиевой стружки и воды (с добавлением щелочи, чтобы разрушить оксидную пленку).
В промышленности водород получают при разложении природного газа.
Перспективным считается получение водорода при разложении воды электрическим током, но этот метод дорого обходится из-за больших затрат электроэнергии.
- Синтез аммиака NH3 (производство азотной кислоты и азотных удобрений), соляной кислоты
- Получение металлов высокой чистоты (например, порошка железа для школьной химической лаборатории)
- Газовая резка и сварка металлов
Водород считается перспективным экологически чистым топливом для автомобильного и воздушного транспорта. Запасы нефти и газа на Земле исчерпаемы, а водород можно получать из воды.
Водород находится в 1-м периоде, I группе, главной (А) подгруппе. Химический знак водорода обычно проставляют и в VII группе.
Это связано с тем, что ядро атома водорода представляет из себя протон (элементарную частицу), заряд его равен +1. Электронная оболочка имеет один уровень, на котором расположен один электрон. Водород, как и металлы I группы, легко окисляется. Валентность водорода равна I.
В то же время водороду недостает только одного электрона, чтобы заполнить внешний электронный уровень (т.к. на I уровне может разместиться только 2 электрона). В этом он сходен с галогенами. Водород-простое вещество, как и галогены, является неметаллом. Поэтому химический знак водорода помещают также в VII группу.
Молекула водорода состоит из двух атомов, связанных ковалентной неполярной связью.
Водород – газ, без цвета и запаха, легче воздуха. Растворимость в воде очень мала.
- Водород горит, образуется вода; смесь водорода с воздухом сгорает со взрывом:
2H2 + O2 = 2H2O - Водород продолжает гореть в атмосфере хлора (т.е. реагирует с хлором при нагревании), образуется хлороводород:
H2 + Cl2 = 2HCl
Сходным образом протекают реакции со многими неметаллами. - Водород восстанавливает металлы из их оксидов:
H2 + CuO = Cu + H2O
В этих трех реакциях водород является восстановителем.
Водород может выступать в роли окислителя при нагревании со щелочными металлами:
2Na + H2 = 2NaH (образуется гидрид натрия)
В лаборатории водород получают взаимодействием цинка с соляной кислотой:

Водород собирают в сосуд, перевернутый кверху дном.
Чтобы проверить его на чистоту, пробирку с водородом подносят к пламени спиртовки. Чистый водород сгорает со звонким хлопком. Если водород смешан с воздухом, сгорает со взрывом.
Водород можно получить взаимодействием натрия, кальция с водой:
2Na + 2HOH = 2NaOH + H2↑
При отсутствии этих реактивов практикуется получение водорода взаимодействием алюминиевой стружки и воды (с добавлением щелочи, чтобы разрушить оксидную пленку).
В промышленности водород получают при разложении природного газа.
Перспективным считается получение водорода при разложении воды электрическим током, но этот метод дорого обходится из-за больших затрат электроэнергии.
- Синтез аммиака NH3 (производство азотной кислоты и азотных удобрений), соляной кислоты
- Получение металлов высокой чистоты (например, порошка железа для школьной химической лаборатории)
- Газовая резка и сварка металлов
Водород считается перспективным экологически чистым топливом для автомобильного и воздушного транспорта. Запасы нефти и газа на Земле исчерпаемы, а водород можно получать из воды.
Водород, его положение в периодической системе химических элементов Д.И.Менделеева, строение его атома и молекулы, физические и химические свойства, получение, применение.
- Элемент водород:
- положение в п.с.
- строение атома
- распространённость в природе
- Строение молекулы водорода
- Физические свойства водорода
- Химические свойства:
- взаимодействие с неметаллами
- взаимодействие с металлами
- восстановление металлов из оксидов
- Получение:
- в лаборатории
- в промышленности
- Применение
Водород – первый элемент в периодической системе. Он находится в первом периоде первой группе главной подгруппе. Заряд ядра атома водорода + 1, в атоме один электронный слой и на нём находится один электрон. Этот электрон находится на s-подуровне:
Водород проявляет во всех соединениях валентность 1, возможные степени окисления: - 1, 0, + 1. как элемент с характерной степенью окисления + 1 водород располагается в I группе.
Учитывая способность водорода существовать в форме двухатомных молекул Н2 и проявлять степень окисления – 1, водород ставят в седьмую группу главную подгруппу.
В природе существует три изотопа водорода: 1 Н – водород, 2 Н – дейтерий ( 1 Н : 2 Н = 6800 : 1), 3 Н – тритий (радиоактивный; на земле 2 кг).
Молекула водорода состоит из двух атомов, связанных ковалентной неполярной связью:
? Н : Н, Н – Н, ? -связь Н2 – газ, без цвета, без запаха, легче воздуха в 14,5 раз, tкип. = - 252,6 0 С, tпл. = - 259,1 0 С. Очень плохо растворяется в воде, но способен растворяться в некоторых металлах.
Химические свойства:
- При комнатной температуре водород химически малоактивен. Без нагревания реагирует только со фтором: Н2 + F2 = 2HF. С кислородом и хлором реагирует при поджигании: 2H2 + O2 = 2H2O;
H2 + Cl2 = 2HCl. С серой водород реагирует при нагревании до 150 – 200 0 С: H2 + S = H2S.
В жёстких условиях водород реагирует с азотом с образованием аммиака: 3H2 + N2 = 2NH3.
- При нагревании водород реагирует с некоторыми металлами, образуя гидриды:
Са + Н2 = СаН2 -1 .
- Водород способен восстанавливать железо и менее активные, чем железо металлы из их оксидов: Fe3O4 + 2H2 = 3Fe + 2H2O CuO + H2 = Cu + H2O.
Получение:
В лаборатории водород получают взаимодействием цинка с серной или соляной кислотами в аппарате Киппа: Zn + H2SO4 = ZnSO4 + H2.
Основной источник получения водорода в промышленности – метан. Наиболее распространённый способ получения водорода – взаимодействие метана с водяным паром. Реакцию проводят при 400 0 С, давлении 2 – 3 МПа в присутствии алюмоникелевых катализаторов:
СН4 + 3Н2О = 3Н2 + СО. Для некоторых синтезов используют полученную смесь. Если нужен чистый водород, то оксид углерода(II) окисляют водяным паром, используя катализаторы:
СО + Н2О = СО2 + Н2. Oт углекислого газа можно освободиться, пропуская смесь через раствор щёлочи.Водород в промышленности образуется при электролизе водного раствора хлорида натрия:
2NaCl + 2H2O = 2NaOH + H2 + Cl2; и при разложении воды электрическим током: 2H2O = O2 + H2.Применение:
Водород используют для синтеза аммиака, получения хлороводорода, восстановления некоторых металлов (W Мо и др.) из их оксидов, для гидрирования органических веществ.
![Водород как элемент Периодической системы]()
0,050 – приблизительный радиус атома водорода, 2,1 – электроотрицательность по шкале Полинга
В некоторых периодических системах можно наблюдать, что водород располагается как в первой, так и в седьмой группе. К первой группе водород относят из-за наличия у него всего одного валентного электрона на внешнем электронном уровне. Это обуславливает существование катионов водорода H + (протонов водорода), которые образуются аналогично катионам металлов IА-группы.
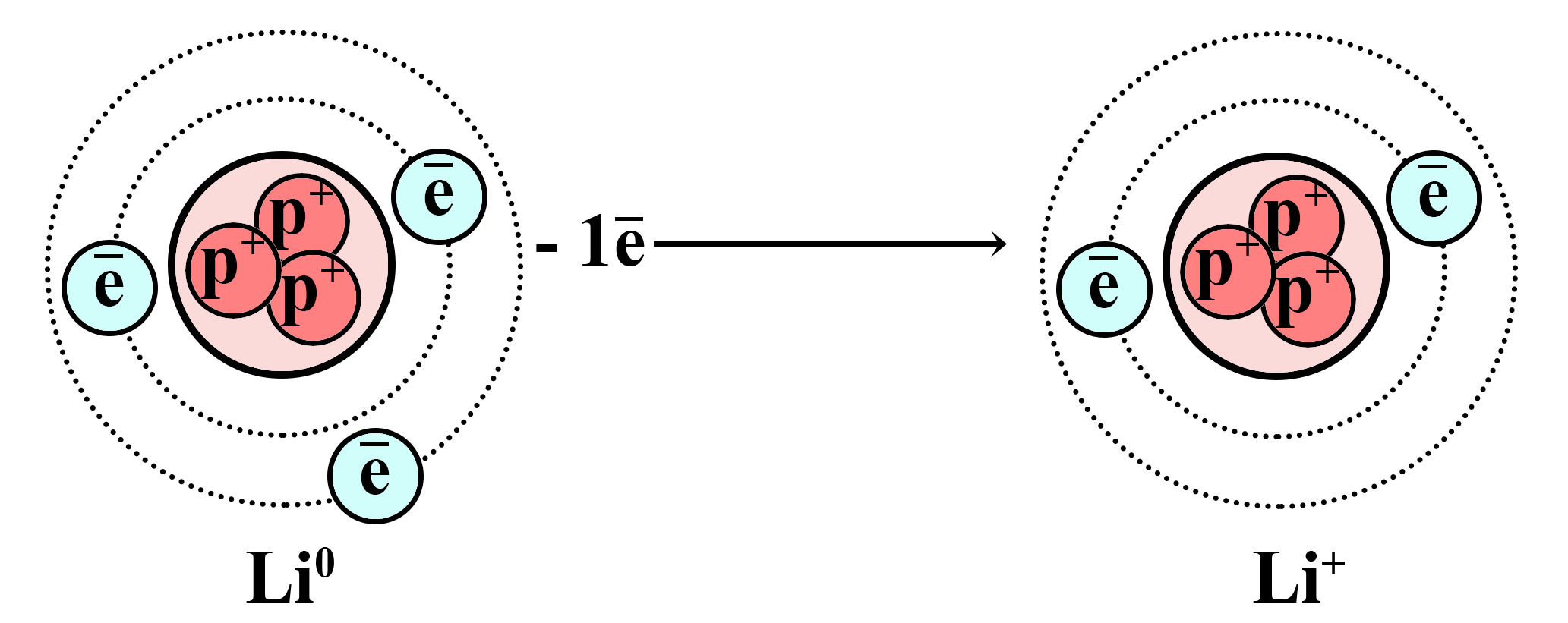
Окисление атома лития и образование катиона лития
![Окисление атома лития и образование катиона лития]()
Отдав один электрон внешнего слоя, литий превращается в катион
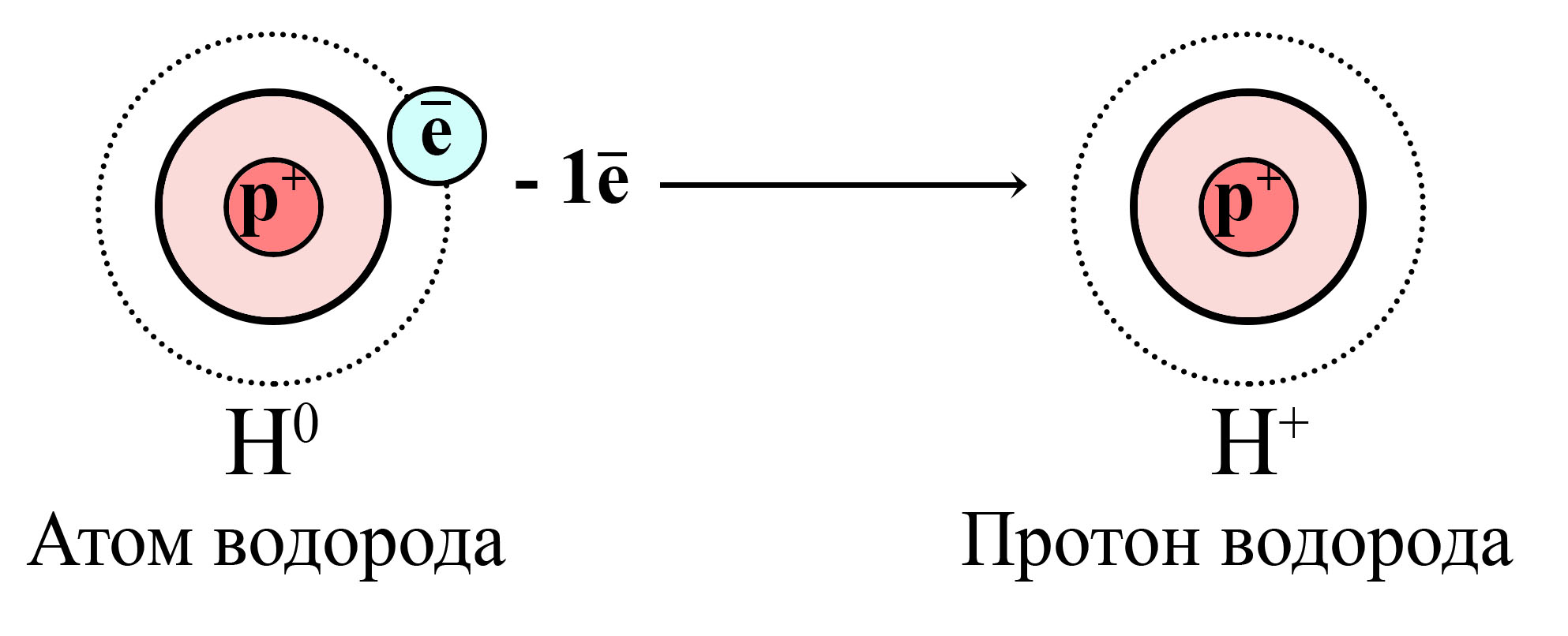
Окисление атома водорода и образование катиона (протона) водорода
![Окисление атома водорода и образование катиона (протона) водорода]()
Атом водорода отдает свой единственный электрон, от атома остается только протон
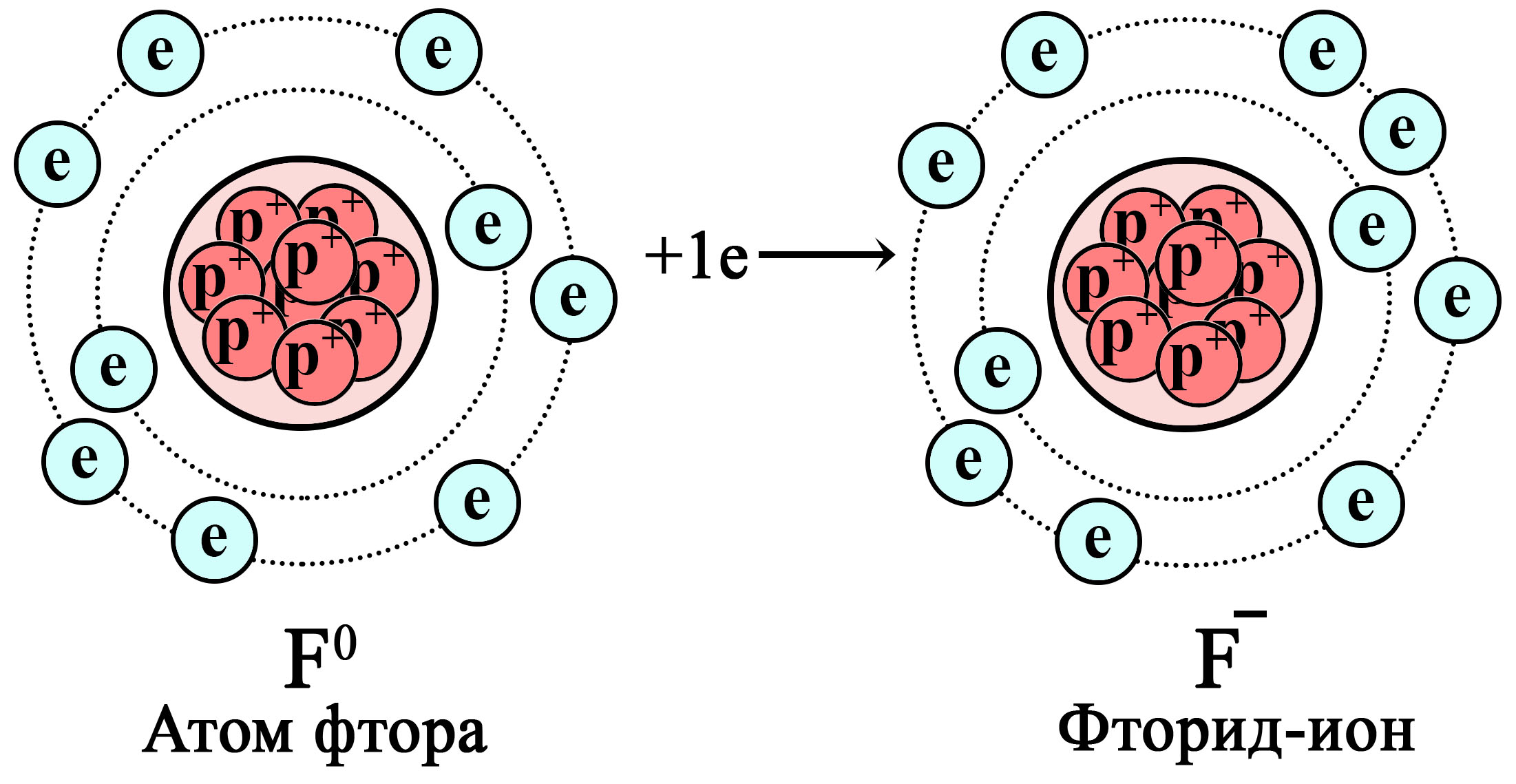
Восстановление атома фтора до фторид-иона
![Восстановление атома фтора до фторид-иона]()
Атом фтора притягивает дополнительный электрон, становясь фторид-ионом
Внешний уровень водорода является еще и первым (ближайшим к ядру), на котором максимально помещается два электрона. До завершения этого уровня атому водорода требуется принять всего один электрон, это роднит его с галогенами. Этим и обосновано расположение водорода в ПС в VIIА-группе. Получая один электрон, водород приобретает конфигурацию благородного газа (гелия).
Водороду не хватает одного электрона до завершенного электронного уровня
![Водороду не хватает одного электрона до завершенного электронного уровня]()
Атом водорода получает электрон от сильного восстановителя и становится гидрид-ионом
Таким образом, водород можно рассматривать как элемент первой группы, так как его электронная конфигурация может быть выражена как ns 1 (это совпадает с электронной конфигурацией внешнего уровня всех щелочных металлов) и как элемент седьмой группы, так как до завершения внешнего электронного уровня не хватает всего одного электрона.
Задание в формате ЕГЭ с ответом:
Водород имеет конфигурацию благородного газа в следующих соединениях:
Пояснение: Водород приобретает конфигурацию благородного газа, превращаясь в гидрид-ион. Гидриды образуются при взаимодействии водорода с активными металлами (металлами IА-группы и кальцием, стронцием, барием).
Химические свойства водорода
Водород проявляет восстановительные свойства при взаимодействии с неметаллами.
Молекулярный водород состоит из двух атомов, между которых образуется одна, но очень прочная σ-связь, что обеспечивает устойчивость молекулы. Поэтому при нормальных условиях водород малоактивен. Но при нагревании, облучении или использовании катализаторов водород реагирует с большинством неметаллов, а также со щелочными и щелочноземельными металлами.
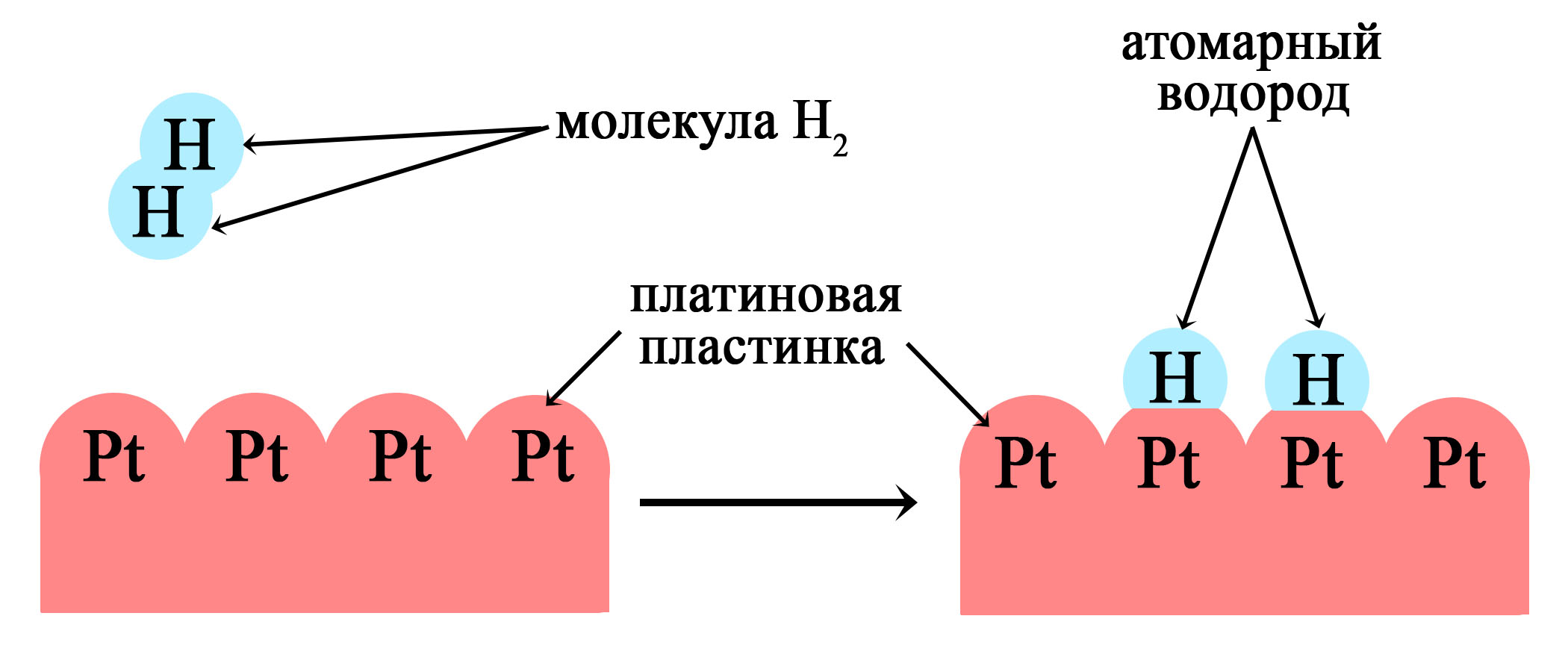
В качестве катализатора используется платина или никель. Водород, растворяясь в этих металлах переходит из молекулярного в более активное атомарное состояние.
Платина используется как катализатор в реакциях гидрирования
![Платина используется как катализатор в реакциях гидрирования]()
При растворении водорода в металлах он становится атомарным, более химически активным
- Взаимодействие водорода с галогенами (с элементамиVIIА-подгруппы).
При комнатной температуре водород реагирует только со фтором:
Полученный фтороводород – прозрачный газ с резким запахом, при растворении в воде образует слабую плавиковую кислоту.
При облучении реагирует с бромом и хлором:
Образовавшийся бромоводород и хлороводород – газы, образующие при растворении сильные кислоты.
При нагревании водород реагирует с йодом:
Образовавшийся йодоводород – газ, при растворении которого в воде образуется очень сильная кислота.
Кислотные свойства водородных соединений увеличивается в ПС (Периодической системе) слева-направо и сверху-вниз. Поэтому плавиковая кислота слабая, а йодоводородная – сильная.
Пример задания из КИМ ЕГЭ:
Установите последовательность веществ в порядке увеличения кислотности этих соединений:
Реакция с чистым кислородом происходит при 400º, с кислородом на воздухе – при 600º, но если использовать платиновый катализатор, то реакция между водородом и кислородом происходит при комнатной температуре:
Данная реакция сопровождается выделением большого количества теплоты, поэтому может быть использована в целях получения энергии в двигателях.
Смесь двух объёмов водорода и одного объёма кислорода называется гремучим газом, она крайне взрывоопасна.
С бором, кремнием и фосфором водород непосредственно не реагирует.
- Взаимодействие водорода с металлами.
Водород проявляет окислительные свойства в реакция со щелочными и щелочноземельными металлами. Принимает от металла один электрон и превращается в гидрид-ион:
Задание по образцу ФИПИ:
Из предложенного перечня металлов выберите три, с которыми водород может взаимодействовать:
Попробуйте решить задание ЕГЭ:
Из предложенного перечня выберете три вещества, с которыми водород не реагирует.
Запишите в поле ответа номера выбранных веществ.
- Взаимодействие со сложными веществами
Водород используют для восстановления металлов из их оксидов. Таким образом получают средние и малоактивные металлы (в основном металлы побочных подгрупп):
Если металл в оксиде может иметь более низкую промежуточную степень окисления, то восстановление происходит не полностью:
Так как в условиях недостатка водорода восстанавливается не весь оксид железа III, в продукте может образоваться не оксид железа II, а смесь оксида железа II и III (закись-окись железа).
Также неполно восстанавливается и оксид свинца IV.
Для полного восстановления требуется большой избыток водорода.
Закись-окись марганца, входящая в состав минерала гаусманита, является двойным оксидом (MnO·Mn2O3) с общей формулой Mn3O4 восстанавливается аналогично:
Водород не восстанавливает металл из оксида:
Подобным образом восстанавливаются галогениды:
С оксидами и галогенидами активных металлов водород не реагирует.
При 1000ºС водород может восстановить сульфат до сульфида:
Водород восстанавливает не только металлы, но и некоторые неметаллы из их оксидов:
Восстановление также может происходить не полностью:
Физические свойства
Водород является газом без цвета и запаха, не имеет вкуса. Это самый легкий газ, его не может удержать земная атмосфера и свободный водород выходит в космос. В земной атмосфере водород остаётся в связанном виде, то есть в составе более тяжелых молекул.
Водород плохо растворяется в воде и во многих других растворителях, но может медленно диффундировать в металлах.
Получение водорода
Водород получают взаимодействием 20%-ной серной кислоты с цинком в аппарате Киппа:
Из-за использования загрязненного цинка (цинковые руды загрязнены мышьяком и сурьмой), выход продукта уменьшается, вместе с водородом образуются ядовитые AsH3 и SbH3.
Для получения более чистого водорода используют реакции растворения кремния или алюминия в щелочах:
Из предложеных пар веществ выберите три, взаимодействие которых приводит к образованию водорода:
Водород можно получить при реакции железа нагретого до температуры красного каления (900-1000º) с перегретым водяным паром:
Взаимодействием щелочных металлов с водой:
Водород можно получить, растворив в холодной воде металл:
Реакция является экзотермической – происходит с выделением большого количества тепла. Активные металлы горят и даже взрываются при взаимодействии с водой.
Водород получают гидролизом гидридов или взаимодействием гидрида с кислотой:
KH + HOH = KOH + H2↑
KH + HCl = KCl + H2↑
- Промышленные способы получения водорода:
В промышленности используют электролиз воды и растворов солей активных металлов.
Катодный процесс: 2HOH + 2ē → H2 + 2OH ‒
Анодный процесс: 2Cl ‒ ‒ 2ē → Cl2↑
Водород можно получить электролизом:
Водород можно получить при разложении метана при 350ºС на железном или никелевом катализаторе:
Наибольшее количество водорода получают воздействием на антрацит (ископаемый уголь с наибольшей массовой долей углерода) перегретым водяным паром (1000ºC):
Или конверсией метана перегретым водяным паром (1100ºС):
Смесь угарного газа и водорода, получаемая в этих реакциях, называется синтез-газом. Он используется в органическом синтезе, главным образом для получения метанола и в синтезе Фишера-Тропша для получения алканов:
Также водород получают глубоким охлаждением коксового газа до ‒196ºС, при такой температуре только водород остаётся газообразным.
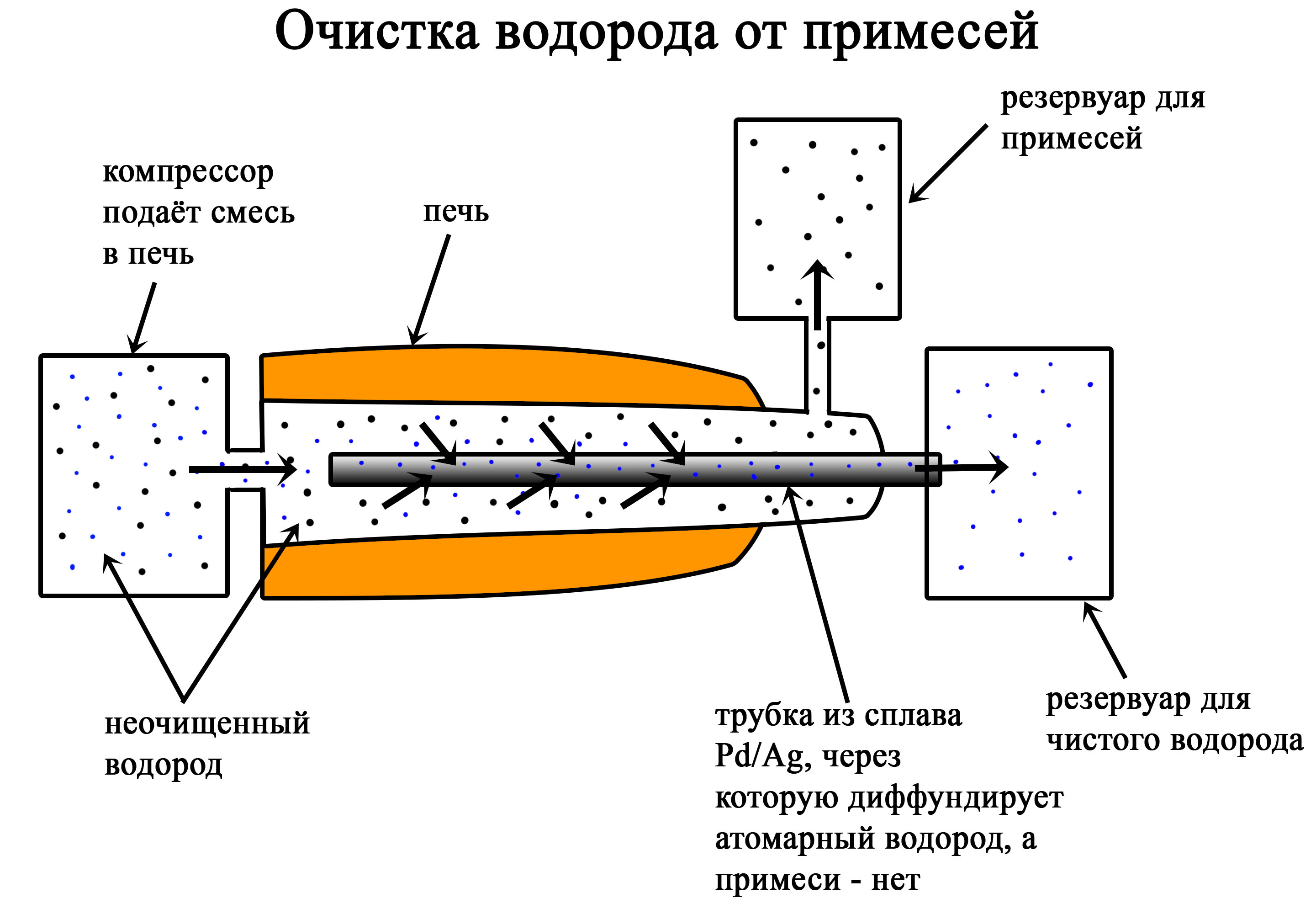
Многие описанные методы приводят к получению не чистого водорода, а его смеси с другими газами. Одним из методов отделения водорода от примесей является пропускание газовой смеси через прибор, содержащий трубку из сплава палладия и серебра. Смесь пропускают через прибор под большим давлением. Из-за давления и способности водорода диффундировать в металлах, он попадает в трубку из сплава Pd/Ag, другие газы в эту трубку попасть не могут.
Очистка водорода от примесей
![Очистка водорода от примесей]()
Водород под давлением диффундирует через металлическую трубку
Применение водорода
Наибольшее количество водорода используется в производстве аммиака, хлороводорода и соляной кислоты, восстановление металлов, гидрирование органических соединений, получении метанола.
Жидкий водород используется в качестве ракетного топлива.
Водород используется для очистки нефти от серы.
Использованная литература:
Репетитор по химии / под ред. А. С. Егорова. – Изд. 29-е. – Ростов н/Д : Феникс, 2010. – 762.
Шрайвер Д., Эткинс П. Неорганическая химия. В 2-х т. Т.1/Пер. с англ. М. Г. Розовой, С. Я. Истомина, М. Е. Тамм. – М.: Мир, 2004.
Читайте также: