Перфузия кислорода это определение кратко
Обновлено: 06.07.2024
метод подведения и пропускания крови, кровезамещающих растворов и биологически активных веществ через сосудистую систему органов и тканей организма. Кроме того, перфузией называют кровоснабжение органов в естественных условиях (см. Кровообращение).
В зависимости от целей и методики проведения различают несколько видов П.: полную П. — временную замену насосной функции сердца и газообменной функции легких с помощью экстракорпорального кровообращения для поддержания газообмена, метаболизма, терморегуляции, доставки к органам и тканям питательных и лекарственных веществ (см. Искусственное кровообращение), частичную П. — Вспомогательное кровообращение, которое осуществляют для поддержания оксигенации, частичного замещения функции сердца, а также перфузионные методы (гемодиализ, лимфосорбция, гемосорбция), направленные на поддержание и коррекцию метаболизма, детоксикацию; регионарную П., применяемую для подведения лекарственных веществ к органам и тканям, относительно изолированным от общего кровотока (например, к конечностям) с целью создания высоких концентраций лекарств в патологическом очаге и снижения их токсического действия на организм. Кроме того, существует П. изолированных органов и тканей (через сосудистую систему изолированного органа прогоняют перфузионную жидкость с целью консервации в трансплантологии, для научно-исследовательских целей); П. органов в организме с целью химиотерапии при опухолевых процессах Под П. тканей подразумевают проточное смывание культуры клеток в специальных камерах.
Полная и частичная временная П. показана при операциях на открытом сердце в условиях нормотермии и гипотермии, при интенсивной терапии крайне тяжелых форм острой дыхательной недостаточности с включением в перфузионную систему оксигенатора. Перфузионные методы детоксикации заключаются в пропускании крови через специальный аппарат (диализатор, колонка с сорбентом) или через сосуды донорской печени с целью удаления эндо- и экзотоксинов и продуктов метаболизма (см. Гемосорбция, Гемодиализ, Лимфодренирование).
Регионарная П. применяется при лечении тромбооблитерирующих заболеваний сосудов конечностей, гнойных поражений конечности, газовой гангрены, опухолевых заболеваний, укусах змей. В этом случае через канюлированные сосуды конечности определенное время (от 10 до 120 мин) перфузируют лекарственные препараты с помощью специальных аппаратов (АИК-РП-64, ИСЛ-3). Основу перфузата составляет кровь, кристаллоидные и коллоидные растворы, в которые добавляют необходимые компоненты (антибиотики, цитостатики, сосудорасширяющие препараты и др.). В зависимости от используемых при П. кровеносных сосудов различают артериовенозную, вено-венозную, артерио-артериальную и веноартериальную П.
При П. возможны осложнения, которые целятся на 3 группы: 1) общехирургические послеоперационные (нагноения, кровотечение и др.), 2) связанные с техникой перфузии: тромбоз, тромбоэмболия, повреждение магистральных сосудов, спазм сосудов конечности, свертывание крови в перфузионной системе, кровотечения в послеоперационном периоде, трудно корригируемый отек конечности при так называемой сверхперфузии (при увеличении объемного кровотока); 3) связанные с действием высоких концентраций химиопрепаратов на регионарные органы и ткани, а также с общесистемным действием лекарственных веществ (общий и местный токсический эффект, аллергические реакции).
Библиогр.: Гравитационная хирургия крови, под ред. О.К. Гаврилова и А.Г. Федотенкова, М., 1983; Лопухин Ю.М. и Молоденков М.И. Гемосорбция, М., 1985; Савельев В.С., Затевахин И.И. и Степанов Н.В. Острая непроходимость бифуркации аорты и магистральных артерий конечностей, М., 1987; Сердечно-сосудистая хирургия, под ред. В.И. Бураковского и Л.А. Бокерия, с. 18, M., 1989.
1) продолжительное (постоянное или периодическое) нагнетание жидкости (например, крови) с лечебной или экспериментальной целью в кровеносные сосуды органа, части тела или всего организма;
Перфузия легких кровью. Влияние гравитации на вентиляцию легких. Влияние гравитации на перфузию легких кровью.
Эффективность выполнения основной функции дыхательной системы зависит от соответствия перфузии (кровотока) в регионах легких с их вентиляцией. Так, хороший кровоток будет недостаточным для газообмена в регионах легких, если они слабо вентилируются воздухом с низким содержанием кислорода, при этом незначительный объем вентиляции легких не позволит удалить из крови углекислый газ. Соответственно, при слабом кровотоке в регионах легких возрастает объем функционального мертвого пространства, и перфузия легких кровью будет недостаточной для транспорта в ней нормального количества газов. Наконец, перфузия кровью регионов легких с недостаточной вентиляцией этих же отделов называется шунтированием, и это состояние является неадекватным для нормального газообмена. При шунтировании венозная кровь в легких не обогащается кислородом, что снижает его содержание в крови организма. В нормальных физиологических условиях фактор гравитации оказывает наиболее выраженный эффект на вентиляцию и перфузию регионов легких кровью.
Эффект гравитации на вентиляцию и перфузию легких кровью
Легкие окружены плевральным пространством, отрицательное давление в котором изменяется от —5 до —10 см водн. ст. в различные фазы дыхательного цикла. Этот фактор взаимодействует с эффектом гравитации на жидкие среды, прежде всего кровь, содержащуюся в артериальных и венозных сосудах тканей легких. В результате под действием силы тяжести на ткань легких величина внутриплеврального давления на уровне основания легких у человека в положении стоя менее отрицательная относительно атмосферного, чем в области верхушек легкого. Поэтому альвеолы верхушек легких имеют большие размеры, а стенка их растянута и более напряжена, чем у альвеол нижних участков легких. Альвеолы на уровне основания легких растянуты в незначительной степени и имеют значительно больше потенциальные возможности для растягивания и вентиляции, чем в области верхушек. Поэтому растянутые альвеолы верхушки легких вентилируются меньше, чем альвеолы основания (рис. 10.13). Эти различия в вентиляции отделов легких приводят к тому, что вдыхаемый воздух неравномерно распределяется в отделах альвеолярного пространства. Особенности распределения воздуха, вдыхаемого в легкие, дополняется разницей в величине кровотока на уровне верхушек и основания легких. Относительно положения тела в пространстве кровоток в верхних и нижних отделах легкого различается под влиянием фактора гравитации.
У человека в вертикальном положении тела величина легочного кровотока на единицу объема ткани легкого линейно убывает в направлении снизу вверх, и меньше всего снабжаются кровью верхушки легких. Соответственно в положении тела человека на спине кровоток в нижних (дорсальных) отделах легких становится выше, чем в верхних (вентральных). Это обусловлено тем, что артериальная кровь, поступающая в легкие из правого желудочка, проходит по сосудам легких из областей низкого внутриплеврального давления в области тонкостенных капилляров, которые окружены альвеолами, содержащими воздух под давлением, близким к атмосферному. Поэтому в зависимости от соотношения давления в альвеолах (РА), мелких артериях (Ра) и мелких легочных венах (Pv) легкие разделены на функциональные зоны Веста (рис. 10.14).
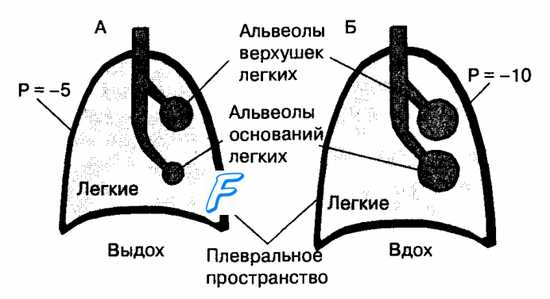
Рис. 10.13. Влияние внутриплеврального давления и фактора гравитации на размеры альвеол верхних и нижних отделов легких. Между верхушками и основанием легких имеется градиент внутриплеврального давления, возникающий под влиянием гравитации на массу жидких сред и ткань легких. В результате размеры альвеол в верхушках легких больше, чем в основании (А). Альвеолы в нижних отделах легких имеют большие потенциальные возможности для увеличения в них вентиляции легких при вдохе, чем альвеолы в области верхних отделов легких (Б).
В верхушках легких (зона 1) могут возникнуть области с давлением в легочных капиллярах (особенно в фазу диастолы) ниже альвеолярного (Ра > Ра > Pv)- Капилляры в таких зонах могут спадаться, и кровоток через них становится невозможным. Такие участки легких вентилируются, но не участвуют в газообмене и формируют альвеолярное мертвое пространство.
В средних отделах легких (зона 2) под действием гравитации давление в альвеолах, как правило, превышает венозное (Ра > РА > Pv). Поэтому величину кровотока в зоне 2 по Весту определяет разность между артериальным и альвеолярным давлениями. В зоне 2 практически не возникает альвеолярное мертвое пространство.
В нижних отделах легких (зона 3) давление в легочных венах выше альвеолярного (Ра > Pv > Ра) и величина кровотока, как и в обычных сосудах, определяется разницей между артериальным и венозным давлениями.
Величина зон Веста динамично изменяется в зависимости от положения тела в пространстве или глубины дыхания. При выдохе на уровне функциональной остаточной емкости примерно 2/з объема легких может занимать зона 2. После глубокой экспирации (на уровне остаточного объема) большая часть легких по соотношению перфузии кровью и вентиляции соответствует зоне 3 Веста. Относительная однонаправленность изменения градиента внутриплеврального давления и влияния гравитации на кровоток в легких от верхних отделов легких к нижним теме не менее не сопряжены в каждом отдельном регионе легких.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Человеческий организм является аэробным. Это значит, что все процессы клеточного метаболизма зависят от уровня молекул кислорода, которые поддерживают основные функции организма. Несмотря на то, что организму необходим кислород, клинически определить субоптимальные потребности очень тяжело и невозможно подсчитать. У пациентов с недостаточной оксигенацией могут наблюдаться цианоз, одышка, сердцебиение, потеря сознания, парестезии, усиление диуреза, гипотермия или боль. pH крови может быть понижен, а уровень лактата повышен в результате анаэробного метаболизма. Все или ни одного из этих признаков могут присутствовать, однако это дело лечащего врача подозревать гипоксию и выявлять ее причину.
В этой статье авторы обсуждают определение гипоксемии, обозревают анатомию легочной системы и этапы доставки кислорода и описывают четыре основные причины гипоксемии с примерами из практики. В заключении будет описан пятый механизм гипоксии, который у человека встречается очень редко. Вследствие того, что поместить кислород в кровоток человека это еще только полдела, авторы описали еще и механизм гипоксии тканей при адекватном обмене кислорода в легких.
Гипоксемия против гипоксии
Гипоксемия – это состояние, при котором парциальное давление кислорода в артериальной крови (РаО2) меньше нормального (менее 60 мм рт. ст.). Если пациент, дышит кислородом, но РаО2 у него ниже, чем ожидается, то необходимо исключить гипоксемию, даже если уровень РаО2 выше 60 мм рт. ст. Гипоксемия возникает вследствие непопадания кислорода в кровь. Гипоксия тканей возникает вследствие того, что клеткам не хватает кислорода для выполнения функции метаболизма. Хотя гипоксемия (слишком маленькое поступление кислорода в кровь) обычно является причиной гипоксии тканей, существуют другие состояния, которые прерывают поступление кислорода в кровь и приводят к гипоксии.
Для того чтобы понять обстоятельства, которые приводят к гипоксемии или гипоксии, необходимо представить путь, который проходят молекулы кислорода из воздуха в ткани, где они используются как топливо для клеток. Во время спонтанного дыхания мозг генерирует сигнал, который ведет к сокращению диафрагмы и расширению грудной клетки. При этом создается отрицательное давление в грудной полости, вследствие чего воздух проникает по дыхательным путям в альвеолы. Молекулы кислорода диффундируют через стенку альвеол в капилляры. В крови большинство кислорода переносится гемоглобином в эритроцитах, в то время как небольшой процент растворяется в плазме. Кровь перекачивается через легкие из правого желудочка сердца и после этого возвращается в левое предсердие и желудочек для того, чтобы оттуда разойтись по телу. По ходу того, как артерии разделяются на более мелкие капилляры, кислород освобождается из гемоглобина и поступает в ткани для питания клеток. Углекислый газ, который является продуктом клеточного метаболизма, диффундирует из тканей в капилляры и проходит по венозной системе в правое сердце. Кровь, насыщенная углекислым газом, проходит в легкие. Таким образом, углекислый газ может диффундировать через альвеолярно–капиллярный барьер, чтобы выйти из организма во время выдоха.
Данный путь может прерываться в любом месте, вызывая тем самым гипоксию тканей. Таким образом, существует достаточно много причин, которые могут привести к гипоксии. Вследствие того, что гипоксемия является наиболее частой причиной гипоксии, то необходимо решить имеет ли гипоксемия место в данном случае. Если у пациента наблюдается гипоксемия, то должен присутствовать один из 4-х основных механизмов гипоксемии (низкий FiO2 , гиповентиляция, нарушение вентиляции–перфузии, сброс крови). Альвеолярно–артериальная разница Р(А-а)О2 является полезным показателем движения кислорода из альвеолярного пространства в кровоток. Оценка Р(А-а)О2 позволяет быстро вычеркнуть из 4-х механизмов 2. Как только механизм гипоксемии установлен, необходимо провести дифференциальную диагностику, выполнить необходимые анализы и назначить необходимую терапию, даже если диагноз еще точно не установлен. (Рис. 1).
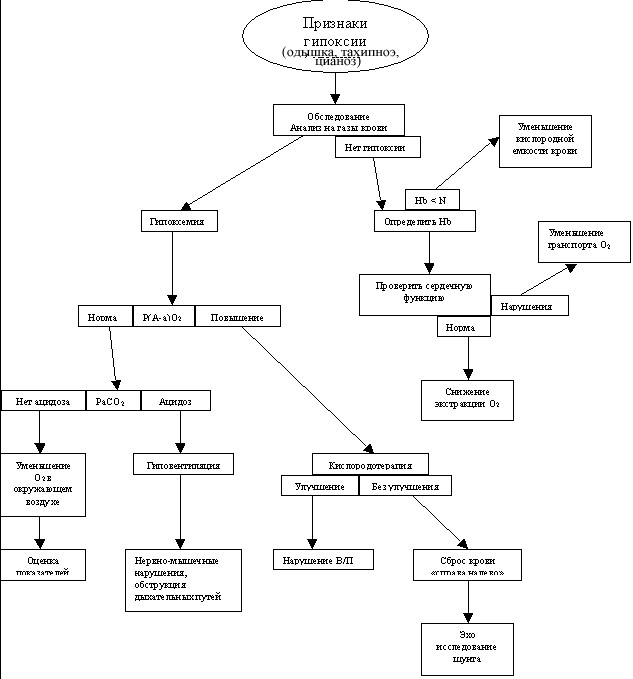 |
| Рисунок 1. |
Таблица 1. Механизмы гипоксии
Гипоксемия с нормальным Р(А-а)О2
- Уменьшение уровня кислорода
- Гиповентиляция
Гипоксемия с увеличением Р(А-а)О2
- Нарушение вентиляции–перфузии
- Сброс крови (справа налево)
- Уменьшение диффузии
Гипоксия тканей без гипоксемии
- Неадекватная кислородная емкость крови
- Неадекватный транспорт кислорода
- Неадекватный захват кислорода тканями
Механизмы гипоксемии
Уменьшение кислорода в окружающем воздухе
Неадекватное давление кислорода в окружающем воздухе, несомненно, приведет к недостаточной оксигенации крови. Таким образом, первый механизм гипоксемии возникает при наличии неблагоприятной окружающей среды. Низкое давление вдыхаемого кислорода возникает как результат: (1) уменьшения фракции вдыхаемого кислорода ( FiO2) по сравнению с нормой ( FiO2 3+ , то гемоглобин теряет способность связываться с кислородом. Данное состояние называется метгемоглобинемией. Как и карбоксигемоглобин, метгемоглобин уменьшает транспорт кислорода, и тем самым кривая диссоциации смещается влево. Состояние, которые приводят к метгемоглобинемии, включают в себя наследственные факторы. Например, недостаточность цитохром b5 редуктазы и, так называемые, М вариации гемоглобина. Приобретенная метгомоглобинемия возникает при использовании следующих веществ: нитриты, нитраты, сульфаниламиды, лидокаин, фенацитин, анилиновые красители и т.д. У пациента с метгемоглобинемией признаки гипоксии возникают прямо пропорционально уровню окисленного гемоглобина. Лечение тяжелой метгемоглобинемии заключается во внутривенном введении метиленовой синьки, которая уменьшает количество гемоглобина на 50% в течение первого часа.
Неадекватный транспорт кислорода
Если кислород попал в кровь и связался с гемоглобином, то доставка кислорода к тканям начинает зависеть от сердечного выброса. Отношение сердечного выброса (Qt) и транспорта кислорода (DO2) показано в таблице 2. Уменьшение сердечного выброса может привести к внутренней сердечной дисфункции или внешним сердечным нарушениям. В результате уменьшения или нарушения сердечного выброса развивается гипоксия тканей.
Внутренняя сердечная дисфункция
Первичные заболевания сердца зачастую возникают вследствие патологии коронарных сосудов и ишемической кардиомиопатии. Однако гипертензия, патология клапанов сердца, нарушения ритма и кардиомиопатии неишемической этиологии (алкоголь, вирус) также играют большую роль в дисфункции сердца. У пациентов с признаками гипоксии, при нормальном анализе крови на содержание кислорода, сердечная дисфункция является наиболее частой причиной данного состояния. Хотя при сердечной дисфункции чаще всего пациента госпитализируют, скрытые заболевания сердца часто обостряют основную причину заболевания. Сепсис может ухудшить тканевую гипоксию, связанную с гипотонией. Пациентам необходимо выполнить эхокардиографию, коронарную ангиографию, провести функциональные исследования, такие как стресс тест при подозрении на первичную патологию сердца.
Внешние сердечные нарушения
Внешние факторы также могут влиять на сердечную функцию и вызывать гипоксию тканей. В норме, сократительная способность кардиомиоцитов зависит от их длины в покое. Гиповолемия приводит к субмаксимальному наполнению желудочка, и таким образом кардиомиоциты укорачиваются и не сокращаются с нужной силой. У пациентов с ИВЛ приложение положительного end - expiratory давления (РЕЕР) повышает альвеолярное давление, что приводит к увеличению внутриплеврального давления. Увеличение внутриплеврального давления приводит к усилению давления в верхней и нижней полых венах в грудной полости. Данное увеличение давления приводит к уменьшению венозного возврата к сердцу, что приводит к субмаксимальному заполнению желудочков и уменьшению сердечного выброса. У пациентов с ИВЛ сердечный выброс также может снижаться засчет перерастяжения легких. Ацидоз и гиперкапния уменьшают сократительную способность сердечной мышцы, а также неблагоприятно действуют на кривую оксигенации гемоглобина. Бета-адреноблокаторы, блокаторы кальциевых каналов, прокаинамид, барбитураты, алкоголь, местные и общие анестетики также могут уменьшать сердечный выброс.
Неадекватная периферическая экстракция кислорода
Даже если кислород полностью связался с гемоглобином и был доставлен к тканям, то существует два обстоятельства, при которых нарушается утилизация кислорода клетками. Первым является тот факт, что кислород может быть сильно связан с гемоглобином, что препятствует переходу в ткани. Вторым является обстоятельство, при котором происходит интоксикация митохондрий, с помощью которых в клетке происходят процессы метаболизма.
Сродство гемоглобина к кислороду
Сродство гемоглобина к кислороду определяется по форме и позиции кривой диссоциации оксигемоглобина (рис. 6).
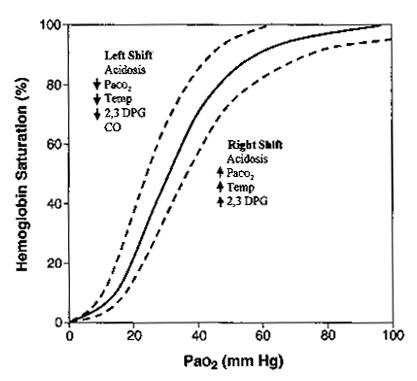 |
| Рисунок 6. Кривая диссоциации гемоглобина. Данная кривая показывает взаимоотношение РаО2 (по горизонтальной оси) с сатурацией гемоглобина (вертикальная ось). Существуют несколько факторов, которые влияют на способность гемоглобина связываться с кислородом. Кривая будет смещаться вправо, указывая на уменьшение связывания кислорода в легких или облегчение отдачи кислорода тканям. Данная картина встречается при ацидозе, гиперкапнии, гипертермии, повышения 2,3-дифосфоглицерата (2,3-ДФГ). Кривая будет отклоняться влево, увеличивая насыщение кислорода в легких и уменьшая отдачу кислорода тканям. Это встречается при алкалозе, гипокапнии, гипотермии, уменьшении 2,3-ДФГ, отравлении угарным газом. |
Когда кривая смещается вправо, сродство снижается и кислорода на грамм гемоглобина становится меньше, хотя на периферии кислород отсоединяется более легко. Когда кривая смещается влево и кверху сродство к кислороду увеличивается. Больше кислорода захватывается в легких где показатель РаО2 высокий, но на уровне тканей, где РаО2 низкий количество доступного кислорода снижается. Алкалоз, гипотермия, гипокапния, уменьшение 2,3-ДФГ приводят к сдвигу кривой влево. При переливании цельной крови происходит уменьшение 2,3-ДФГ, тем самым выражается вредное действие массивных гемотрансфузий. Так как 2,3-ДФГ вырабатывается эритроцитами, эффект обычно кратковременный. Угарный газ не сдвигает кривую влево, но занимает гемоглобиновые мостики и тем самым приводит к гипоксии.
Интоксикация митохондрий
Комплекс цитохром оксидазы (цитохром аа3) является большим энзимным комплексом, который располагается на внутренней мембране митохондрий. 90% всего кислорода в клетках циркулирует через эту систему. Любой яд, который действует на цитохром аа3, негативно влияет на аэробный метаболизм. Цианид, азиды, угарный газ связываются с цитохромом аа3 крепко, но обратимо.
Отравления цианидом включают в себя 3 клинических проявления. Первое, прием пищи, при попытки самоубийства, передозировки наркотиками. Второе, вдыхание паров, при пожаре, задымлении, курении. Третье, он является продуктом распада нитропруссида, препарата, который уменьшает постнагрузку при лечении гипертензии. Цианид метаболизируется эндогенной rhodonase , энзимом, который является посредником в транспортировки серы от тиосульфата к молекуле цианида с образованием тиоцианата, который выделяется с мочой. Так как в организме содержится небольшое количество серы, лечение отравления цианидом заключается в увеличении количества серы для выведения цианида.
Заключение
Чурсин В.В. Клиническая физиология кровобращения. Методические материалы к практическим и семинарским занятиям, – 2011. - 44 с.
Содержит информацию о физиологии кровообращения, нарушениях кровообращения и их вариантах. Также представлена информация о методах клинической и инструментальной диагностики нарушений кровообращения.
Данные материалы являются переработанным вариантом предыдущих изданий (1999г., 2003г.), первым автором которых являлся В.Ф.Туркин – доцент кафедры анестезиологии и реаниматологии АГИУВ.
Предназначается для врачей всех специальностей, курсантов ФПК и студентов медвузов.
Введение
Исходя из этого пояснения, можно отметить, что значение клинической физиологии любой системы предполагает:
Более образно это можно представить в следующем виде (рисунок 1).
Приспособительные реакции обеспечивают компенсацию, а патологические реакции обуславливают декомпенсацию страдающего органа или страдающей системы. В общем виде отличием (границей) между нормой и приспособлением является изменение свойств приспосабливающего органа или приспосабливающейся системы.
Границей между приспособлением и патологией является резкое изменение ("излом") приспособительной реакции по направлению и величине.
Различают срочные приспособительные реакции и долговременные. Врачам интенсивной терапии чаще приходится иметь дело с острыми расстройствами, поэтому необходимы знания срочных приспособительных реакций и их переход в патологические.
Кровообращение – определение, классификация
Кровообращение - это непрерывное движение (обращение) крови по замкнутой системе, именуемой сердечно-сосудистой.
- 2 - аорта и крупные артерии, имеют много эластических волокон, представляются как буферные сосуды, благодаря им резко пульсирующий кровопоток превращается в более плавный;
- 3 - прекапиллярные сосуды, это мелкие артерии, артериолы, метартериолы, прекапиллярные жомы (сфинктеры), имеют много мышечных волокон, которые могут существенно изменить свой диаметр (просвет), они определяют не только величину сосудистого сопротивления в малом и большом кругах кровообращения (поэтому и называются резистивными сосудами), но и распределение кровопотока;
- 4 - капилляры, это обменные сосуды, при обычном состоянии открыто 20-35% капилляров, они образуют обменную поверхность в 250-350 кв.м., при физической нагрузке максимальное количество открытых капилляров может достигать 50-60%;
- 5 - сосуды - шунты или артериоло-венулярные анастомозы, обеспечивают сброс крови из артериального резервуара в венозный, минуя капилляры, имеют значение в сохранении тепла в организме;
- 7 - вены, крупные вены, они обладают большой растяжимостью и малой эластичностью, в них содержится большая часть крови (поэтому и называются емкостными сосудами), они определяют "венозный возврат" крови к желудочкам сердца, их заполнение и (в определенной мере) ударный объём (УО).
Объем циркулирующей крови (ОЦК)
Вопрос объема имеет важное значение. Прежде всего потому, что определяет наполнение камер сердца и таким образом влияет на величину УО.
По классическому представлению ОЦК составляет у мужчин 77 и у женщин 65 мл/кг массы тела 10%. В среднем берётся 70 мл/кг.
Последствием этого является наиболее наблюдаемые недостаточности – церебральная, дыхательная и кишечная.
Физиологи на сегодняшний день считают, что практически у среднего человека номинальной величиной ОЦК принимается 5 литров или 5000 см 3 . В ОЦК различают две составных части: объем заполнения (U) и объем растяжения (V) сосудистой системы. U составляет 3300 см., V составляет 1700 см 3 . Последний, объем растяжения имеет непосредственное отношение к давлению крови и скорости объемного потока крови в сосудах.
Избыточная, особенно быстрая, инфузия растворов ведет к увеличению объема, прежде всего в сосудах легких, чем в других органах. При быстрой инфузии, особенно крупномолекулярных растворов (декстраны, ГЭК, СЗП, альбумин) жидкость не успевает переместиться в интерстиций, и при этом жидкость депонируется в первую очередь в легочных венах. Имеются сведения о том, что легочные вены могут дополнительно вместить еще примерно 53% общего легочного объема крови. При дальнейшей избыточной инфузии в действие вступает рефлекс Китаева. При этом рефлексе импульсы с рецепторов перерастянутых легочных вен, возбуждающе действуя на мускулатуру легочных артериол, суживают их, предотвращая таким образом переполнение легочных венозных сосудов.
Из-за спазма легочных артериол при дальнейшей избыточной инфузии наступает объемная перегрузка правых отделов сердца, в первую очередь правого желудочка. При его чрезмерной перегрузке в действие вступает рефлекс Ярошевича. Импульсы с рецепторов легочных артерий, возбуждающе действуя на мускулатуру в устьях полых вен, суживают их, предотвращая таким образом переполнение правых отделов сердца.
Здесь граница, за которой далее приспособление может перейти в патологию. В случае продолжения избыточной инфузии - вследствие избыточного давления в правом предсердии и его перерастяжения возникают следующие условия.
Во-первых ухудшается отток в правое предсердие значительной части крови из коронарных вен. Затруднение оттока по коронарным венам приводит к затруднению притока крови по коронарным артериям и доставки кислорода к миокарду (боль в области сердца).
Во-вторых, может возникнуть рефлекс Бейнбриджа (подробнее - раздел регуляции кровообращения), он вызывает тахикардию, которая всегда увеличивает потребность миокарда в кислороде.
У лиц со скрытой коронарной недостаточностью (что почти никогда не выявляется у больных перед операцией из-за недостаточного обследования) и у лиц с явной ишемической болезнью сердца (ИБС) все это может обусловить возникновение острой коронарной недостаточности вплоть до возникновения острого инфаркта миокарда (ОИМ) с дальнейшим развитием острой сердечной лево-желудочковой недостаточности (ОСЛН).
По современным представлениям отмечаются следующие приспособительные изменения функции сердечно-сосудистой системы.
Когда ОЦК снижается на 10-20%, то такая кровопотеря представляется компенсируемой. При этом первой приспособительной реакцией является уменьшение емкости венозных сосудов за счёт сдавления их окружающими тканями. Вены из округлых становятся сплющенными или почти полностью спадаются, и таким образом емкость сосудов приспосабливается к изменившемуся объему циркулирующей крови. Венозный приток крови к сердцу и его УО поддерживаются на прежнем уровне. Компенсаторную реакцию организма можно сравнить с ситуацией, когда содержимое неполной 3-х литровой банки переливают в 2-х литровую и она оказывается полной.
Компенсаторным механизмом является и перемещение жидкости из интерстиция за счёт уменьшения венозного давления и увеличения скорости кровотока (укорочения времени изгнания даже без развития тахикардии) – жидкость как бы засасывается из интерстиция. Этот компенсаторный механизм можно наблюдать у доноров при донации, когда экстракция 500 мл крови не приводит к каким-либо изменениям кровообращения.
С уменьшением ОЦК до 25-30% (а это уже потеря растягивающей части ОЦК - V) кровопотеря представляется не компенсируемой за счёт критического уменьшения ёмкости венозной системы. Начинает уменьшаться венозный приток к сердцу и страдает УО. При этом развивается приспособительная (компенсаторная) тахикардия. Благодаря ей поддерживается достаточный уровень сердечного выброса (СВ за минуту = МСВ) за счёт уменьшенного УО и более частых сердечных сокращений. Одновременно с тахикардией развивается сужение периферических артериальных сосудов – централизация кровообращения. При этом ёмкость сосудистой системы значительно уменьшается, подстраиваясь под уменьшенный ОЦК. При сниженном УО и суженных периферических артериальных сосудах поддерживается достаточный уровень среднего артериального давления (АДср) в сосудах, направляющих кровь к жизненно важным органам (мозг, сердце и лёгкие). Именно от величины АДср зависит степень перфузии того или иного органа. Таким образом, развивается приспособительная централизация кровообращения за счет уменьшения кровоснабжения периферических тканей (кожа, скелетные мышцы и т.д.). Эти ткани могут переживать ишемию (I фазу нарушения микроциркуляции) и кислородную недостаточность в течение более продолжительного времени.
Эта реакция аналогична процессу воспаления, при котором организм, образуя грануляционный вал и отторгая омертвевшее, жертвует частью во имя сохранения целого.
Когда ОЦК снижается более чем на 30-40% и восполнение кровопотери задерживается, то такая кровопотеря переходит в разряд некомпенсированной и может стать необратимой. При этом несмотря на тахикардию, СВ уменьшается и снижается АДср. Из-за недостаточного транспорта кислорода в организме усиливается метаболический ацидоз. Недоокисленные продукты метаболизма парализуют прекапиллярные сфинктеры, но периферический кровоток не восстанавливается из-за сохраняющегося спазма посткапиллярных сфинктеров.
Развивается II фаза нарушений микроциркуляции – застойной гипоксии. При этом за счёт ацидоза повышается проницаемость капилляров – плазматическая жидкость уходит в интерстиций, а форменные элементы начинают сладжироваться, образуя микротромбы – развивается ДВС-синдром. К моменту, когда на фоне нарастающего ацидоза парализуются и посткапиллярные сфинктеры (III фаза нарушений микроциркуляции) капиллярное русло уже необратимо блокировано микротромбами.
Наступает несостоятельность тканевой перфузии. Во всех случаях затянувшегося синдрома малого СВ присоединяется преренальная анурия. Всё это клиническая форма шока с классической триадой: синдром сниженного СВ, метаболический ацидоз, преренальная анурия. При этом во многих органах, как отмечает профессор Г.А.Рябов, "наступают необратимые изменения и даже последующее восполнение кровопотери и восстановление ОЦК не всегда предотвращает смертельный исход из-за осложнений, связанных с необратимыми изменениями в некоторых органах" – развивается полиорганная недостаточность (ПОН) или мультиорганная дисфункция (МОД).
Последовательность в нарушениях гомеостаза при кровопотере схематически представлена на рисунке 2 (Р.Н.Лебедева и сотр., 1979 г.).
Таким образом, при абсолютном снижении ОЦК практически любого происхождения границей перехода приспособления в декомпенсацию является увеличение частоты сердечных сокращений (ЧСС) с одновременным снижением СВ и АДср.
Данное положение не применимо к случаям, когда имеется относительное уменьшение ОЦК за счет патологической вазодилятации.
Следует учитывать и то, что очень часто острая кровопотеря сопровождается болью и это вносит разлад в последовательность компенсаторных механизмов – раньше чем нужно и в большем количестве выбрасываются эндогенные катехоламины. Централизация развивается быстрее и времени на спасение больного остается меньше.
Читайте также:
- Реформа сельского управления в дагестане кратко
- Аттестация учителя дефектолога на 1 категорию в детском саду
- Самоанализ учителя трудового обучения коррекционной школы
- Социально нравственное воспитание в школе
- Подарок маме на день матери в детском саду средняя группа в нетрадиционной техники рисование

