Основные законы массообмена при адсорбции кратко
Обновлено: 05.07.2024
Адсорбцию применяют при очистке воды от органических и хлорорганических соединений, нефтепродуктов, аммиака и поверхностно-активных веществ при низких концентрациях загрязнений на стадии глубокой очистки. В статье рассмотрены основные математические модели адсорбции на твердых адсорбентах. Изучены теоретические аспекты процесса адсорбции из воды органических веществ на твердых адсорбентах. Приведен расчет аппаратов для проведения адсорбции, а также даны их основные технические характеристики.
Адсорбцией называется поглощение загрязнений поверхностью твердого адсорбента, осуществляемое за счет взаимодействия молекул загрязнителей с поверхностью адсорбента и последующей диффузии молекул веществ через пленку, окружающую частицы адсорбента, к его поверхности, скорость которой определяется строением адсорбента, наличием пор и размером молекул сорбируемого вещества. Лучшими сорбентами для удаления из воды растворенных органических веществ признаны активированные угли различных марок, получаемые в результате пиролиза твердых древесных и каменноугольных материалов, эффективность которых определяется наличием в них микропор, а также цеолиты, представляющие собой алюмосиликаты натрия, калия или других элементов.
Адсорбция является частным случаем сорбции — поглощения загрязнений поверхностью твердого тела, которая происходит за счет диффузии молекул органических веществ через жидкостную пленку, окружающую частицы сорбента, к его поверхности и далее внутренней диффузии молекул, скорость которой определяется строением сорбента, наличием в нем пор и размером молекул сорбируемого вещества [1].

Адсорбция сопровождается уменьшением давления пара поглощаемого вещества в исходной смеси и выделением теплоты. Поэтому в соответствии с принципом Ле-Шателье количество адсорбированного вещества возрастает с понижением температуры и повышением давления
Физическая адсорбция обратима, а хемосорбция может быть необратимой. Отличительные признаки хемосорбции — необратимость процесса, высокие тепловые эффекты (сотни кДж/моль) и активированный характер, закономерности химических реакций (осуществляется со значительной энергией активации), экзотермический или эндотермический эффект реакции, с повышением температуры ее скорость возрастает по закону Аррениуса и др. [3].
Адсорбция сопровождается уменьшением давления пара поглощаемого вещества в исходной смеси и выделением теплоты. Поэтому в соответствии с принципом Ле-Шателье количество адсорбированного вещества возрастает с понижением температуры и повышением давления [4]. Понижение давления и повышение температуры способствуют обратному процессу — десорбции. Количество выделяющейся при адсорбции теплоты [кДж/кмоль] определяется экспериментально.
Количественно адсорбция может быть охарактеризована с помощью нескольких величин:
- Величиной α, представляющую собой количество адсорбтива в объеме адсорбционного слоя на единицу массы адсорбента, или количество адсорбтива на единицу поверхности адсорбента. Единицы измерения — моль/г, моль/м 2 .
- Введенной Гибсом величиной Г, представляющей собою избыток числа молей адсорбтива в объеме поверхностного слоя площадью 1 см 2 по сравнению с числом его молей в том же объеме, если бы у межфазной границы не происходило изменение концентрации адсорбтива. При малых концентрациях адсорбтива гибсовская адсорбция Г близка к поверхностной концентрации α, при больших концентрациях адсорбтива величина Г отличается от α.
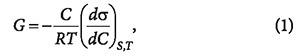
где σ — поверхностное натяжение; C — объемная концентрация адсорбтива; S — величина поверхности границы раздела фаз; T — температура.
Для каждого растворителя существуют вещества, которые снижают поверхностное натяжение: dσ/dC 0. Граница раздела фаз обогащается растворенным веществом, и такие вещества называются поверхностно-активными. Вещества, для которых dσ/dC > 0 и Г 2 .
Зависимости, описываемые уравнениями (7) и (8), называются изотермами адсорбции и используются в теоретических расчетах. В основу их построения положена модель Ленгмюра: поверхность адсорбента представляет собой набор энергетически одинаковых активных центров, на которых адсорбируются (локализуются) молекулы адсорбтива; на одном центре адсорбируется только одна молекула, то есть при адсорбции образуется только один адсорбционный слой (монослой); адсорбция на данном центре не влияет на адсорбцию на других центрах, то есть взаимодействием адсорбированных молекул можно пренебречь.
На основании химической термодинамики получены конкретные выражения изотерм адсорбции, называемые изотермами Ленгмюра-Фрейндлиха:

где xp — концентрация поглощенного адсорбентом вещества (емкость адсорбента), кг на 1 кг адсорбента; a — предельная концентрация поглощенного компонента в адсорбенте, достигаемая при p/ps = 1 (ps — давление насыщенного пара при заданной температуре); b — адсорбционный коэффициент, обратный константе равновесия Кр -1 ; k и n — эмпирические константы и показатель степени, зависящие от природы адсорбента, адсорбируемого вещества и температуры, определяемые опытным путем; р — равновесное давление адсорбента в парогазовой смеси, Н/м 2 .
Зависимости (7) и (8), называются изотермами адсорбции и используются в теоретических расчетах. В основе их построения — модель Ленгмюра: поверхность адсорбента представляет собой набор энергетически одинаковых активных центров, на которых адсорбируются молекулы адсорбтива
Константа равновесия определяется следующим уравнением:

Равновесное давление адсорбента пропорционально р, а концентрация свободных активных центров — величине (ат - а), где ат — полное число активных центров, а — число занятых активных центров. В области очень малых давлений bр = 1 и а = (amb) p, что отвечает уравнению Генри, в котором Кн = атb (ат — поверхностная концентрация адсорбтива при заполнении им всех активных центров). В области очень больших давлений (bр ≥ 1 и а ≈ ат) адсорбция перестает зависеть от давления. При очень малых заполнениях поверхности адсорбента уравнение изотермы адсорбции приобретает вид уравнения Генри:
где Кн — коэффициент Генри.
Вид изотерм адсорбции зависит от множества следующих факторов: удельной площади поверхности адсорбента, объема пор, структуры адсорбента, поглощаемого вещества и его свойств, а также от температуры.
На рис. 1 показаны пять основных типов изотерм адсорбции. Тип 1 характерен для микропористых адсорбентов. Начальные выпуклые участки изотерм типов 2 и 4 определяются наличием микропор. Дальнейшую форму изотерм определяют полимолекулярная адсорбция и капиллярная конденсация.
Существуют различные математические модели адсорбции — мономолекулярная адсорбция, полимолекулярная адсорбция, капиллярная конденсация, каждая из которых описывает экспериментальные данные, полученные в определенных условиях.
Предпринимались попытки учесть в модели Ленгмюра также взаимодействия между адсорбированными молекулами. Так, Т. Хилл и Я. де Бур, предположив, что уравнение состояния адсорбционного слоя является двухмерным аналогом уравнения Ван-дер-Ваальса, получили уравнение изотермы адсорбции:
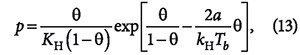
где θ = а/ат (а и b — константы уравнения Ван-дер-Ваальса). В свою очередь, Фаулер и Э. Гуггенгейм, учитывая взаимодействие адсорбированных молекул, вывели уравнение:
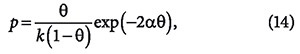
где α — константа, связанная с парным взаимодействием молекул.
Принципиально отличную модель адсорбции (потенциальная адсорбция), предложил М. Поляни [6]. Согласно этой модели, вблизи поверхности адсорбента формируется потенциальное адсорбционное силовое поле, убывающее с расстоянием от поверхности. Вследствие этого давление адсорбтива, равное p вдали от поверхности, вблизи нее возрастает и на некотором расстоянии достигает значения ps, при котором адсорбтив конденсируется.
Объем слоя между поверхностью раздела и геометрическим местом точек, в которых р = ps, заполнен жидкостью, которая характеризуется нормальными значениями физических свойств объемной жидкости.
Обратимая изотермическая работа адсорбционных сил выражается уравнением ε = RT ln(p/ps), и обозначается адсорбционным потенциалом. При заданной величине объема V адсорбционного слоя потенциал е не зависит от температуры (вследствие независимости дисперсионных сил от температуры). Такая температурная инвариантность дает возможность пересчитывать адсорбцию с одной температуры на другую, хотя уравнения изотермы адсорбции на основе излагаемой теории получить не удалось.
Принято различать молекулярную, кнудсеновскую и поверхностную диффузии. Молекулярная диффузия осуществляется, если длина свободного пробега молекул в порах адсорбента меньше размера пор, кнудсеновская — если эта длина превышает размер пор
Советским физико-химиком М.М. Дубининым [7] разработана теория объемного заполнения пор (ТОЗП) и получены уравнения адсорбции для газов и паров для широкого диапазона температур, характеризующие зависимость равновесной концентрации адсорбтива от структуры пор адсорбента. Эти уравнения имеют сложный характер и применимы только к микропористым сорбентам с размерами пор ≤ 1 нм:
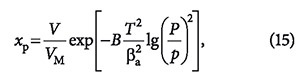
где V — суммарный объем пор адсорбента; VM — объем адсорбированного вещества в жидком состоянии; В — константа, определяемая структурой адсорбента; Т — абсолютная температура пара; βа — коэффициент аффинности, равный отношению мольных объемов в жидком состоянии в порах данного вещества и стандартного; Р — давление насыщаемого пара адсорбтива; р — парциальное давление пара адсорбтива при температуре адсорбции.
Кроме вышеописанных, существует еще один механизм, приводящий к дополнительной адсорбции адсорбтивов ниже их критической температуры на пористых адсорбентах, — капиллярная конденсация [8]. Этот тип адсорбции обусловлен наличием у адсорбента мелких пор. Пары адсорбата в данном случае конденсируются в таких порах при давлениях, меньших давления насыщенного пара ps над плоской поверхностью, вследствие образования в капиллярах вогнутых менисков.
Адсорбция- процесс поглощения одного ИЛИ нескольких компонентов из газовой смеси или раствора твердым веществом— адсорбентом. Поглощаемое вещество носит название адсорбата, или адсорбтива.
Процессы адсорбции (как и другие процессы массопередачи) избирательны и обычно обратимы. Благодаря их обратимости становится возможным выделение поглощенных веществ из адсорбента, или проведение процесса десорбции.
Механизм процесса адсорбции отличается от механизма абсорбции, вследствие того, что извлечение веществ осуществляется твердым, а не жидким поглотителем. Каждый из этих сорбционных процессов имеет свои области применения, где его использование дает больший технико-экономический эффект.
Адсорбция применяется главным образом при небольших концентрациях поглощаемого вещества в исходной смеси, когда требуется достичь практически полного извлечения адсорбтива. В тех случаях, когда концентрация поглощаемого вещества в исходной смеси велика, обычно выгоднее использовать абсорбцию.
Процессы адсорбции широко применяются в промышленности при очистке и осушке газов, очистке и осветлении растворов, разделении смесей газов или паров, в частности при извлечении летучих растворителей из их смеси с воздухом или другими газами (рекуперация летучих растворителей).
Различают физическую и химическую адсорбцию. Физическая адсорбция обусловлена взаимным притяжением молекул адсорбата и адсорбента под действием сил Ван-дер-Ваальса и не сопровождается химическим взаимодействием адсорбированного вещества с поглотителем. При химической адсорбции, или хемосорбции, в результате химической реакции между молекулами поглощенного вещества и поверхностными молекулами поглотителя возникает химическая связь.
При поглощении паров адсорбция иногда сопровождается заполнением пор адсорбента жидкостью, образующейся в результате конденсации паров (капиллярная конденсация). Конденсация происходит вследствие понижения давления пара над вогнутым под действием сил поверхностного натяжения мениском жидкости в капиллярах.
Вопрос 37. Адсорбция. Характеристики адсорбентов
В качестве адсорбентов применяются пористые твердые вещества с большой удельной поверхностью, обычно относимой к единице массы вещества. Адсорбенты имеют различные по диаметру капиллярные каналы —- поры, которые условно могут быть разделены на макропоры (более 2·10 -4 мм), переходные поры (6·10 -6 -2·10 -4 мм), микропоры (2·10 -6 -6·10 -6 мм). Характер процесса адсорбции определяется размером пор.
Удельная поверхность макропор относительно очень мала, поэтому на их стенках адсорбируется ничтожное количество вещества. Макропоры играют роль лишь транспортных каналов для адсорбируемых молекул.
На поверхности переходных пор, размеры которых обычно значительно превышают размеры адсорбируемых молекул, в процессе адсорбции образуются слои поглощенного вещества. Возможно образование слоев толщиной в одну молекулу (мономолекулярная адсорбция) и в несколько молекул (полимолекулярная адсорбция).
Размеры микропор приближаются к размерам адсорбируемых молекул, и адсорбция в микропорах приводит к заполнению их объема. Вследствие этого предположение об. образовании слоев поглощенного вещества на поверхности микропор не имеет физического смысла. Обычно микропоры пересекаются макро— и переходными порами, что сокращает путь, проходимый адсорбируемыми молекулами, и приводит к ускорению адсорбции.
В больших порах диаметром более 2·10 -4 мм и малых порах, сравнимых с диаметром молекул поглощаемого вещества, явление капиллярной конденсации отсутствует. Адсорбенты характеризуются своей поглотительной, или адсор6ционной, способностью, определяемой концентрацией адсорбтива в единице массы или объема адсорбента.
Поглотительная способность адсорбента по отношению к данному веществу зависит от температуры и давления, при которых производится адсорбция, и от концентрации поглощаемого вещества. Максимально возможная при данных условиях поглотительная способность адсорбента условно называется его равновесной активностью.
В промышленности в качестве поглотителей применяют главным образом активные угли и минеральные адсорбенты (силикагель, цеолиты и др.), а также синтетические ионообменные смолы (иониты).
Активные угли. Высокопористые активные угли получают путем сухой перегонки различных углеродсодержащих веществ (дерева, костей и др.) и активирования полученных углей для повышения их пористости. Активирование осуществляют прокаливанием угля при температурах 2 /г. Применение углей того или иного вида зависит от разновидности процесса адсорбции, в котором они используются (поглощение газов, рекуперация летучих растворителей и т. д.). Активные угли лучше поглощают пары органических веществ, чем воды, однако с повышением содержания влаги в активных углях их способность поглощать пары органических веществ снижается. Они применяются обычно для рекуперации летучих растворителей. Недостатком активных углей является их горючесть.
Силикагели. Эти адсорбенты представляют собой продукты обезвоживания геля кремневой кислоты, получаемые путем обработки раствора силиката натрия (растворимого стекла) минеральными кислотами или кислыми растворами их солей. Удельная поверхность силикагелей изменяется от 400 до 770 м 2 /г. Размер гранул колеблется от 0,2 до 7 мм, насыпная плотность составляет 400—800 г/л. Силикагели применяются главным образом для осушки газов. Поглотительная способность силикагелей по отношению к парам органических веществ сильно снижается в присутствии влаги. Достоинством силикагелей является их негорючесть и большая механическая прочность, чем у активных углей.
Цеолиты. Эти адсорбенты представляют собой природные или синтетические минералы, которые являются водными алюмосиликатами катионов элементов первой и второй групп периодической системы Д. И. Менделеева. В качестве промышленных адсорбентов применяются главным образом искусственные (синтетические) цеолиты. Относительно недавно были получены цеолиты, обладающие весьма однородной структурой пор, размеры которых соизмеримы с размерами адсорбируемых молекул. Эти цеолиты проявляют молекулярно-ситовое действие, которое заключается в их способности не поглощать молекулы, диаметр которых больше диаметра пор. Молекулярно-ситовыми свойствами обладают также некоторые природные цеолиты, например, натролит. Молекулярно-ситовое действие цеолитов часто используют в промышленной практике для разделения некоторых веществ, например, нормальных и изопарафиновых углеводородов.
Цеолиты отличаются высокой поглотительной способностью по отношению к воде и являются высокоэффективными адсорбентами для осушки и очистки газов и жидкостей, в частности для глубокой осушки газов, содержащих небольшие количества влаги. Размер гранул цеолитов составляет от 2 до 5 мм.
Иониты. Эти адсорбенты представляют собой как природные, так и синтетические неорганические и органические вещества. К природным ионитам относятся цеолиты, глинистые минералы, ископаемые угли и др. Синтетическими ионитами являются плавленые цеолиты и молекулярные сита (цеолиты с правильной кристаллической структурой), ионообменные смолы, активированные минералы и органические вещества и др. Иониты практически нерастворимы в воде, а также в обычных растворителях и обладают подвижными ионами, способными обмениваться на эквивалентное количество ионов (с зарядом того же знака) из раствора электролита, с которым поглотитель контактирует.
Иониты, содержащие кислые активные группы и обменивающиеся с раствором электролита подвижными анионами, называются анионитами, а иониты, содержащие основные активные группы и обменивающиеся недвижными катионами, - катионитами. Существуют также амфотерные иониты, способные к катионному и анионному обмену одновременно.
Вопрос 38. Адсорбция. Равновесие при адсорбции
Количество вещества, адсорбированное единицей массы или объема данного поглотителя при достижении состояния равновесия, зависит от температуры и концентрации поглощаемого вещества в парогазовой смеси или растворе. Соответственно зависимость между равновесными концентрациями фаз при адсорбции имеет вид:
Или при постоянной температуре
Где -относительная концентрация адсорбтива в адсорбенте (величина адсорбции), равновесная с концентрацией адсорбтива в газовой или жидкой фазе, кг адсорбтива/кг адсорбента; -относительная концентрация адсорбтива в фазе, из которой адсорбируется вещество, кг адсорбтива/кг носителя газовой смеси или раствора.
Концентрация поглощаемого вещества может быть заменена его парциальным давлением p в паро-газовой смеси. Тогда
Зависимости (63) и (63а) представляют собой выраженные в самом общем виде уравнения линии равновесия при адсорбции, или изотермы адсорбции.
Изотермы адсорбции определяются опытным путем. Вид изотермы адсорбции зависит от многих факторов: удельной поверхности адсорбента, объема пор, их распределения по размерам и других характеристик структуры адсорбента, свойств поглощаемого вещества, а также от температуры процесса.
Адсорбция сопровождается уменьшением давления пара поглощаемого компонента в исходной смеси и заметным выделением тепла. Поэтому, в соответствии с принципом Ле-Шателье‚ количество адсорбированного вещества возрастает с понижением температуры и повышением давления. Таким образом, повышение температуры и понижение давления отрицательно влияют на процесс адсорбции, способствуя десорбции поглощенного вещества из адсорбента. Количество выделяющегося при адсорбции тепла определяется экспериментально; теплоты адсорбции различных веществ приводятся в справочной литературе. При отсутствии опытных данных о равновесии (или данных, полученных путем обработки эмпирических уравнений) построение изотермы равновесия возможно при использовании уравнений, выведенных на основе того или иного механизма, или теории процесса адсорбции.
Вопрос 39. Адсорбция Скорость адсорбции. м одель послойной фронтальной отработки слоя адсорбента
Характер протекания процесса адсорбции во времени зависит от того, проводится процесс периодически или непрерывно. Деление промышленных процессов адсорбции на периодические и непрерывные связано, главным образом, с состоянием слоя адсорбента — является он соответственно неподвижным или движущимся.
Процессы адсорбции не отличаются по механизму от других процессов массопередачи с участием твердой фазы и следуют одинаковым с ними общим закономерностям. Однако периодические процессы адсорбции характеризуются специфическими особенностями.
Если бы скорость поглощения была бесконечно большой, то адсорбция в последующих слоях происходила бы только после полного насыщения предыдущих. Однако скорость массопередачи конечна, и распределение адсорбтива по высоте слоя происходит плавно, с образованием так называемого фронта адсор6ции. Изменение фронта адсорбции во времени схематично показано на рисунке 35‚ где приведены кривые распределения относительной концентрации адсорбтива в газе (или растворе) по длине l неподвижного слоя адсорбента, причем τ1 Вопрос 40. Особенности массопередачи с твердой фазой. Массопроводность, коэффициент массопроводности
Массопередача в системах с твёрдой фазой представляет собой особенно сложный процесс. В этом процессе, кроме массоотдачи от поверхности раздела фазы в поток жидкости (газа, пара), имеет место и перемещение вещества в твёрдой фазе массопроводностью .
Количество вещества, переместившегося в твёрдой фазе за счёт массопроводности, пропорционально градиенту концентрации, площади, перпендикулярной направлению потока вещества, и времени , то есть:
В этом уравнении коэффициент пропорциональности К (м 2 /ч) , имеющий размерность коэффициента диффузии, может быть назван коэффициентом массопроводности .
Коэффициент массопроводности зависит от природы проходящего процесса (адсорбция, сушка, выщелачивание), от ряда факторов, определяющих величину коэффициента молекулярной диффузии, и от структуры твёрдого пористого тела.
Изучение особенностей применения адсорбции в пищевой промышленности. Классификация массообменных аппаратов. Равновесие при адсорбции. Определение высоты слоя активного угля и диаметра адсорбера для поглощения паров этилового спирта из паровоздушной смеси.
| Рубрика | Производство и технологии |
| Вид | курсовая работа |
| Язык | русский |
| Дата добавления | 15.09.2018 |
| Размер файла | 756,7 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Министерство сельского хозяйства и продовольствия Республики Беларусь
Кафедра технического обеспечения производства и переработки продукции животноводства
Массообменные процессы. Абсорбция и адсорбция
Специализация 1-49 01 02 02 Технология молока и молочных продуктов
Руководитель проекта И.С. Леонович
Выполнил А.В. Калистратов
1. ОПИСАНИЕ И АНАЛИТИЧЕСКОЕ ИССЛЕДОВАНИЕ ПРОЦЕССА
1.1 Основы массопередачи
1.3 Кинетика процесса адсорбции
2. ОПИСАНИЕ И АНАЛИЗ АППАРАТОВ ПРОЕКТИРУЕМОГО ПРОЦЕССА
2.1 Классификация массообменных аппаратов
2.2 Аппараты для проведения процесса абсорбции
3. ИНЖЕНЕРНО-ТЕХНОЛОГИЧЕСКИЕ РАСЧЕТЫ
СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ
В ВЕДЕНИЕМассообменными называются такие технологические процессы, скорость протекания которых определяется скоростью переноса вещества (массы) из одной фазы в другую конвективной молекулярной диффузией. К ним относятся абсорбция, перегонка и ректификация, экстракция, сушка, адсорбция, кристаллизация и др. Аппараты, в которых протекают эти процессы, называются массообменными.
При адсорбции происходит избирательное поглощение газов, паров или растворенных в жидкостях веществ твердым поглотителем -- адсорбентом, способным поглощать один или несколько компонентов из их смеси. Процесс используется во многих производствах, где из смеси газов, паров или растворенных веществ необходимо извлечь тот или иной компонент. Вещества переходят из газовой или жидкой фазы в твердую.
При абсорбции наблюдается селективное поглощение газов или паров жидкими поглотителями -- абсорбентами, т. е. вещество переходит из газовой или паровой фазы в жидкую.
При перегонке и ректификации жидкая смесь разделяется на составляющие компоненты. Вещество переходит из жидкой фазы в паровую и из паровой в жидкую.
При экстракции происходит извлечение одного или нескольких веществ из растворов или твердых веществ при помощи растворителей. При этом в системе жидкость--жидкость вещество переходит из одной жидкой фазы в другую жидкую фазу.
1. ОПИСАНИЕ И АНАЛИТИЧЕСКОЕ ИССЛЕДОВАНИЕ ПРОЦЕССА1.1 Основы массопередачи
Процессами массообмена называют такие процессы, в которых основную роль играет перенос вещества из одной фазы в другую. Движущей силой этих процессов является разность химических потенциалов. Как и в любых других процессах, движущая сила массообмена характеризует степень отклонения системы от состояния динамического равновесия. В пределах данной фазы вещество переносится от точки с большей к точке с меньшей концентрацией. Поэтому обычно в инженерных расчетах приближенно движущую силу выражают через разность концентраций, что значительно упрощает расчеты массообменных процессов [1].
Массопередача - процесс перехода вещества (или нескольких веществ) из одной фазы в другую в направлении достижения равновесия. Перенос в пределах одной фазы называют массоотдачей. В массобмене участвуют, как минимум, три вещества: распределяющее вещество (или вещества), составляющее первую фазу G; распределяющее вещество (или вещества), составляющее вторую фазу L; распределяемое вещество (или вещества), которое переходит из одной фазы в другую M (рис. 1.1).
адсорбция массообменный равновесие промышленность
Рисунок 1.1 ? Схема массообмена между фазами.
Пусть распределяемое вещество находится первоначально только в фазе G и имеет концентрацию y. В фазе L в начальный момент распределяемое вещество отсутствует, т.е. концентрация его в этой фазе x=0. Если фазы G и L привести в соприкосновение друг с другом, начинается переход распределяемого вещества из фазы G в фазу L, и с появлением вещества M в фазе L начинается обратный переход его из фазы L в фазу G.
Со временем скорости перехода вещества станут одинаковыми, и наступит состояние равновесия. При этом устанавливается определенная зависимость между концентрациями распределяемого вещества в обеих фазах: любой концентрации x этого вещества в фазе L соответствует равновесная концентрация его yp в фазе G, т.е. yp= f(x).
Разность между фактической и равновесной концентрациями, характеризующая степень не достижения равновесия, является движущей силой массообменных процессов:
а) движущая сила массообмена через концентрации распределяемого компонента в фазе G: ;
б) движущая сила массообмена через концентрации распределяемого компонента в фазе L: .
В массообменных процессах (массопередаче) движущая сила может быть рассчитана по одному из двух вариантов - а) или б). Основной закон массопередачи, исходя из общих кинетических закономерностей, формулируется следующим образом: скорость (интенсивность) процесса прямо пропорциональна движущей силе и обратно пропорциональна сопротивлению процесса:
где - количество вещества, перешедшего из одной фазы в другую;
- элементарная поверхность фазового контакта;
- движущая сила процесса ( или , или разность, выраженная через другие концентрации);
Если вместо принять обратную величину - коэффициент скорости процесса (коэффициент массопередачи) и записать уравнение относительно количества вещества, перешедшего из одной фазы в другую, то
Уравнения (1.1) и (1.2) называют основными уравнениями массопередачи.
В аппаратуре, используемой для проведения массообменных процессов, равновесные концентрации не достигаются. Рабочие концентрации распределяемого компонента всегда отличаются от равновесных.
Разность между рабочими равновесными и рабочими концентрациями или, наоборот, характеризующими степень отклонения от равновесия, представляет собой движущую силу массообменных процессов.[2]
Процесс поглощения одного или нескольких компонентов из смеси газов, паров или жидких растворов поверхностью твердого вещества -- адсорбента называется адсорбцией. Процесс адсорбции подобно процессу абсорбции избирателен, т. е. из смеси поглощаются только определенные компоненты. Как и при абсорбции поглощенное вещество может быть выделено из адсорбента, например, при нагревании. Этот процесс регенерации -- обновления абсорбента называется десорбцией.
В пищевой промышленности адсорбция применяется при очистке водно-спиртовых смесей в ликеро-водочном производстве, при очистке и стабилизации вин, соков и других напитков. В свеклосахарном производстве адсорбцией обеспечивается основная очистка диффузионного сока в процессе его сатурации, а также обесцвечивание сахарных сиропов перед кристаллизацией.[5]
Адсорбенты, применяемые в промышленных условиях, должны отвечать следующим основным требованиям:
- обладать избирательностью (селективностью) - способность поглощать только тот компонент (те компоненты), которые необходимо выделить или удалить из смеси;
- иметь максимальную адсорбционную емкость (активность) - количество адсорбтива, поглощенного единицей массы или объема адсорбента;
- обладать способностью предельно десорбироваться, необходимой для регенерации адсорбента;
- иметь достаточную прочность гранул адсорбента, так как их разрушение ухудшает гидродинамику процесса:
- обладать химической инертностью по отношению к поглощаемым веществам;
- иметь низкую стоимость.
На практике в полной мере удовлетворить все требования (в ряде случаев они противоречивы) не удается, приходится выбирать компромиссные варианты.
Соответственно требованию высокой поглотительной способности, адсорбенты чаще всего - высокопористые твердые вещества, используемые, как правило, в виде зерен размером от долей миллиметра до нескольких миллиметров. Пористость зерен обеспечивает внутреннюю поверхность в сотни и даже тысячи квадратных метров на один грамм адсорбента, что на несколько порядков выше его наружной поверхности некоторые адсорбенты могут поглощать адсорбат в количествах, соизмеримых с собственной массой.
Промышленные адсорбенты могут содержать поры разных размеров. Соответственно преобладанию пор тех или иных типов говорят о микропористых, мезопористых и макропористых адсорбентах. При наличии в зернах адсорбента различных пор в соизмеримых долях адсорбенты относятся к смешанным.
В пищевых производствах широко используют следующие адсорбенты: активные угли, силикагели (гель кремниевой кислоты), алюмогели (гидроксид алюминия), цеолиты, глины и другие природные адсорбенты. Адсорбенты, которые непосредственно контактируют с продуктами, должны быть биологически безвредными, т. е. они должны быть нетоксичными и прочными, не засорять продукт.
Адсорбенты характеризуются большой удельной площадью поверхности, отнесенной к единице массы вещества. Они имеют различные по диаметру поры, которые можно разделить на макропоры (более 2·10 -4 мм), переходные поры (6 •10 -6 . 2 · 10 - 4 ) и микропоры размером от 2 • 10 -6 до 6 • 10 -6 мм. От размера пор в большой степени зависит характер адсорбции. При адсорбции возможно образование слоев молекул поглощенного вещества толщиной в одну молекулу (мономолекулярная адсорбция), толщиной в несколько молекул, так называемая полимолекулярная адсорбция.
Адсорбенты характеризуются поглотительной способностью (активностью), определяемой количеством вещества, поглощенного единицей массы или объема адсорбента.
Различают статическую и динамическую поглотительную способность. Статическая поглотительная способность определяется максимально возможным количеством вещества, поглощенного единицей массы (объема) адсорбента.
Максимальная поглотительная способность адсорбента при определенных температуре, давлении и концентрации адсорбируемого вещества называется равновесной активностью. В промышленности используют адсорбенты в виде гранул размером 2. 7 мм либо в порошкообразном состоянии с частицами размером 50. 200 мкм.
Активные угли получают при сухой перегонке углесодержащих веществ, таких, как дерево, торф, кости и др. Активирование проводят в основном прокаливанием углей при температурах свыше 900 °С.
В спиртовом и ликероводочном производствах используют активные угли растительного происхождения (березовый БАУ, буковый).
Эффективность адсорбционной очистки во многом определяется пористой структурой адсорбента, решающая роль принадлежит микропорам. Рекомендуется применять угли с предельным объемом адсорбционного пространства 0,3 см 3 /г. Размеры микропор определяют скорость каталитических реакций в адсорбированной фазе. Оптимальными являются активные угли с микропорами размером 0,8. 10 мкм.
Активные угли обычно используют для очистки промышленных газовых выбросов. В спиртовом и ликероводочном производствах активные угли применяют для извлечения из сортировки (смесь спирта с водой) и спирта-ректификата альдегидов, кетонов, сложных эфиров, карбоновых кислот и высокомолекулярных веществ (сивушных масел). Уголь извлекает глюкозу и фруктозу, содержащиеся в некоторых сортах водки. Активный уголь используют для осветления пива и фруктовых соков. Для обесцвечивания сахарных сиропов применяют активный уголь, полученный на базе костяного угля. Типичным мелкозернистым углем для обесцвечивания сахарных сиропов, коньяков, вин, фруктовых соков, эфирных масел, желатина является уголь деколар. В некоторых случаях одновременно с обесцвечиванием происходит удаление запаха, привкуса, коллоидных и других примесей.
Силикагели представляют собой продукты обезвоживания геля кремниевой кислоты. Их получают обработкой раствора силиката натрия минеральными кислотами или растворами их солей. Удельная площадь поверхности силикагелей составляет 400. 780 м 2 /г, их насыпная плотность--100. 800кг/м 3 . Диаметр гранул силикагеля достигает 7 мм.
Силикагели используют для осушки воздуха, осветления пива и фруктовых соков.
Цеолиты -- водные алюмосиликаты природного или синтетического происхождения. Размер пор синтетических цеолитов соизмерим с размерами сорбируемых молекул, поэтому они могут адсорбировать молекулы, проникающие в поры. Такие цеолиты называются молекулярными ситами. Цеолиты некоторых марок используют для концентрирования соков.
Цеолиты характеризуются высокой поглотительной способностью, их применяют для осушки газов и жидкостей, выпускают в гранулированном виде, диаметр гранул 2. 5 мм.
Глины и другие природные глинистые адсорбенты -- бентонитовые глины на основе монтмориллонита и отбеливающие глины 434 гумбрин, асканит и др. -- являются высокодисперсными системами со сложным химическим составом. В них входят Si02, А12Оз, Fe203, CaO, MgO и другие оксиды металлов.
Наиболее распространенный метод активации природных глин -- обработка их минеральными кислотами. При этом удаляются оксиды кальция, магния, железа, алюминия и других металлов, образуются дополнительные поры.
Удельная площадь поверхности глин составляет 20. 100м 2 /г, средний радиус пор 3. 10 мкм.
Отбеливающая способность активных глин повышается с увеличением катионообменной емкости. Высокая отбеливающая способность бентонитовых глин связана с их кислотными свойствами--содержанием в обменном положении ионов Н + и А1 + . Удаление соединений из жидкостей происходит вследствие хемосорбции на кислотных центрах поверхности абсорбентов.
Глинистые материалы применяют в основном для очистки различных жидких сред от примесей, например окрашенных веществ, в результате чего продукт обесцвечивается, поэтому природные глинистые адсорбенты иногда называют отбеливающей землей.
Глинистые адсорбенты используют в пищевой промышленности для осветления вин, пива, фруктовых соков, рафинирования растительных масел, воды и для других целей. Для осветления пива широко применяют бентонитовые глины.
Натриевый бентонит не только осветляет и стабилизирует вина, но и ускоряет срок созревания и выдержки. Окислительно-восстановительные и другие реакции, происходящие в винах, катализируются минералами и катионами, входящими в состав бентонита.
Теории адсорбции [8]:
1. Физическая (потенциальная) теория, М. Поляни, 1914 г. (Брунауэр, Эммет, Теллер, Эйкен).
Над поверхностью твёрдого тела существует поле действия сил притяжения (адсорбционное поле), попадая в которое молекулы компонента притягиваются к поверхности с силой, пропорциональной потенциалу адсорбционного поля в данной точке и располагаются в нем многими слоями. Полимолекулярная теория адсорбции.
2. Теория объёмного заполнения микропор, академик М.М. Дубинин и его школа, 1947 г.
Адсорбционное поле существует во всём объеме микропор, что вызывает их объёмное заполнение в процессе адсорбции (развитие потенциальной теории).
3. Химическая теория, Дж. Дэнгмор, 1918г.
Предполагается возникновение химической связи между адсорбентом и адсорбтивом с образованием нестойкого комплексного соединения. Мономолекулярная теория адсорбции.
В пользу этой теории указывает тот факт, что адсорбция - экзотермический процесс (выделение тепла). Теплота адсорбции определяется опытным путём.
Равновесие при адсорбции и материальный баланс. Количество вещества, адсорбированное единицей массы или объема данного поглотителя при достижении состояния равновесия зависит от температуры и концентрации поглощаемого вещества в парогазовой смеси или растворе.
Соответственно зависимость между равновесными концентрациями фаз при адсорбции имеет вид
или при постоянной температуре
где: - относительная концентрация адсорбтива в адсорбенте, равновесная с концентрацией адсорбтива в газовой или жидкой фазе, кг адсорбтива/кг адсорбента;
- относительная концентрация адсорбтива, кг/кг носителя газовой смеси или раствора.
Концентрация поглощаемого компонента может быть заменена его парциальным давлением растворов парогазовой смеси, тогда:
Представленные две зависимости представляют собой выраженные в самом общем виде уравнения линии равновесия при адсорбции, или изотермы адсорбции.
Несмотря на сложность и своеобразие процесса, основные закономерности для процесса адсорбции имеют сходство с закономерностями абсорбционного процесса. Так, для адсорбции будет справедливо, как и для абсорбции уравнение материального баланса:
где: - начальное содержание сорбтива, отнесенное к единице веса сорбента;
- конечное содержание сорбтива, по окончании цикла работы аппарата.
Следует иметь в виду, что при проведении процесса адсорбции адсорбент находится чаще всего в неподвижном состоянии, а газ профильтровывается через слой адсорбента. В этом уравнении под следует понимать не часовой расход адсорбента, а количество его, которое загружено в аппарат.
В последнее время стали применять адсорберы непрерывного действия, в которых адсорбент движется навстречу газовой смеси. В этом случае уравнение вполне идентично уравнению материального баланса процесса абсорбции.
Количество адсорбированного вещества за время может быть по аналогии с процессом абсорбции найдено из уравнения
где - коэффициент адсорбции;
- поверхность адсорбента, м 2 ;
- движущая сила выражаемая разностью концентраций.
Величину коэффициента адсорбции рассчитывают, используя известное уравнение критериальной зависимости между диффузионными критериями Нуссельта и Прандтля:
Величину коэффициента и показателей степеней и определяют экспериментально. Так при поглощении паров активированным углем при ориентировочных расчетах можно принять:
Из уравнения можно определить необходимую поверхность адсорбента и расход адсорбента. Далее рассчитываются размеры аппарата, для которого была подобрана требуемая поверхность массообмена.
1.3 Кинетика процесса адсорбции
Процесс диффузии поглощаемого вещества в адсорбенте зависит от суммарного объема пор, температуры и давления пара адсорбтива, а также от изменения концентрации вещества в процессе адсорбции.
Рисунок 1.2 - Кривые распределения относительной концентрации адсорбтива по высоте h слоя адсорбента
где -коэффициент защитного действия слоя;
ф - потеря времени защитного действия слоя.
Для расчета скорости перемещения фронта адсорбции предложено уравнение
где 0 - фиктивная скорость потока, равная ' ( ' - скорость потока в каналах между частицами адсорбента);
е - порозность слоя адсорбента;
- концентрация адсорбтива в слое адсорбента.
Высота слоя адсорбента h0 из основного уравнения массопередачи
где - общее число единиц переноса по газовой или жидкой фазе;
где kyv- объемный коэффициент массопередачи.
Тепловой эффект адсорбции [5]
В процессе адсорбции выделяется определенное количество теплоты, (Дж/кмоль), которое находится опытным путем; при отсутствии опытных данных эту величину вычисляют по уравнению
где р1 и р2 - равновесные давления поглощаемого вещества над адсорбентом, соответствующие абсолютным температурам Т1 и Т2.
Технологические процессы, скорость протекания которых определяется скоростью переноса вещества (массы) из одной фазы в другую, называют массообменными, а аппараты для проведения этих процессов – массообменными аппаратами.
Классификация массообменных процессов
В пищевой технологии применяют в основном следующие процессы массопередачи: между газовой (паровой) и жидкой, газовой и твердой, а также между двумя жидкими фазами.
Ректификация – разделение жидкой смеси, состоящей из компонентов различной летучести, на чистые или обогащенные составляющие в результате противоточного взаимодействия потоков пара и жидкости. Ректификация применяется при получении этилового спирта и разделении эфирных масел. При перегонке и ректификации одни вещества переходят из жидкости в пар, другие – из пара в жидкость.
Абсорбция – избирательное поглощение газов или паров жидкими поглотителями – абсорбентами.
Процесс применяется при производстве газированных вод, пива и некоторых сортов вина, сульфитации виноградного сусла и сока с целью предотвращения забраживания, при сатурации свекловичного сока с образованием нерастворимого углекислого кальция.
Адсорбция – избирательное поглощение газов, паров или растворенных в жидкостях веществ поверхностью твердого поглотителя – адсорбента.
Процесс применяется для осветления вина, очистки водноспиртовых растворов от красящих веществ и других примесей, для обесцвечивания соков и сиропов в сахарном производстве.
Обратный процесс – десорбция – проводится после адсорбции и часто используется для регенерации поглощенного вещества из поглотителя.
Сушка – удаление влаги из влажных материалов путем ее испарения. Этот процесс применяется во всех отраслях пищевой промышленности, где влажные природные вещества до их переработки должны быть обезвожены или должен быть обезвожен готовый продукт. При проведении процесса сушки влага переходит в пар или газ.
Кристаллизация – процесс выделения твердой фазы в виде кристаллов из растворов или расплавов.
Процесс применяется при производстве сахара и кристаллической глюкозы, лимонной кислоты, глюканата натрия. В процессе кристаллизации наблюдается перемещение вещества к поверхности кристалла и его переход из жидкого состояния в кристаллическое. Обратный процесс – переход твердой кристаллической фазы в раствор называется растворением.
Основные понятия
Переход вещества (или нескольких веществ) из одной фазы в другую через их границу в направлении достижения равновесия называют массообменном, или массопередачей.
Переход вещества из фазы к границе раздела фаз или в обратном направлении, т. е. в пределах одной фазы, называется массоотдачей.
В массообмене участвуют в большинстве случаев три вещества: распределяющее вещество (или вещества), составляющее первую фазу; распределяющее вещество (или вещества), составляющее вторую фазу; распределяемое вещество (или вещества), которое переходит из одной фазы в другую.
Назовем первую фазу G (газовая фаза), вторую L(жидкая фаза), а распределяемое вещество М. Поскольку все рассматриваемые массообменные процессы обратимы, распределяемое вещество может переходить из фазы G в Lи наоборот, в зависимости от концентрации этого вещества в распределяющих фазах.
Допустим, что распределяемое вещество находится вначале только в фазе G и имеет концентрацию .В фазе Lв начальный момент распределяемого вещества нет и, следовательно, концентрация его в этой фазе = 0.

Если распределяющие фазы привести в соприкосновение, начнется переход распределяемого вещества из фазы Gв фазу L, и в последней обнаружится определенная концентрация распределяемого вещества > 0.С момента появления вещества Мв фазе L начинается и обратный переход его в фазу G, но до некоторого момента число частиц М, переходящих в единицу времени через единицу поверхности соприкосновения из фазы Gв фазу L, больше, чем число частиц, переходящих из фазы Lв G; конечным итогом процесса является переход Миз фазы G в фазу L.
Через определенный промежуток времени скорости перехода распределяемого вещества из фазы Gв фазу L и обратно становятся одинаковыми. Такое состояние называется равновесным. В состоянии равновесия в каждом конкретном случае существует строго определенная зависимость между концентрациями распределяемого вещества, которые при равновесии системы называются равновесными. Равновесные концентрации очень важны для определения скорости течения процесса.
Основные законы массопередачи
Законами, которым подчиняется перенос распределяемого вещества из одной фазы в другую, являются закон молекулярной диффузии,массоотдачи и массопроводности.
Закон молекулярной диффузии (первый закон Фика).Молекулярная диффузия в неподвижных газах и растворах жидкостей происходит в результате хаотического движения молекул. В этом случае имеет место перенос молекул распределяемого вещества из областей высоких концентраций в область низких концентраций. Кинетика переноса подчиняется в этом случае первому закону Фика, формулировка которого аналогична закону теплопроводности: количество продиффундировавшего вещества пропорционально градиенту концентраций, площади, перпендикулярной направлению диффузионного потока, и времени:

, (1)
где dM – количество продиффундировавшего вещества; D – коэффициент пропорциональности, или коэффициент диффузии; ¶C/¶x – градиент концентрации в направлении диффузии; dF – элементарная площадка, через которую происходит диффузия; dt – продолжительность диффузии.
Коэффициент диффузии показывает, какое количество вещества диффундирует через площадь поверхности 1 м 2 в течение 1 с при разности концентраций на расстоянии 1 м, равной единице.
Знак минус в правой части (1) указывает, что при молекулярной диффузии в направлении перемещения вещества концентрация убывает.
Дифференциальное уравнение молекулярной диффузии (второй закон Фика).Он выражает закон распределения концентрации данного компонента в неподвижной среде при неустановившемся процессе массообмена

. (2)
Закон массоотдачи (закон Щукарева).Основной закон массоотдачи, или конвективной диффузии, был впервые сформулирован Щукаревым при изучении кинетики растворения твердых тел. Следует заметить, что этот закон является аналогом закона теплоотдачи для твердого тела, сформулированного Ньютоном (как законы Фика являются аналогами законов теплопроводности, сформулированных Фурье).
Закон Щукарева может быть выражен так: количество вещества, перенесенного от поверхности раздела фаз в воспринимающую фазу, пропорционально разности концентраций у поверхности раздела фаз и в ядре потока воспринимающей фазы, поверхности фазового контакта и времени:

, (3)
где b – коэффициент массоотдачи, характеризующий перенос веществ конвективными и диффузионными потоками одновременно; – концентрация в воспринимающей фазе у поверхности раздела фаз; – концентрация в ядре потока воспринимающей фазы – остальные обозначения прежние.
Для установившегося процесса уравнение (30) примет вид

. (4)
Важно отметить, что концентрация на границе рассматривается как равновесная концентрация.

Если принять единицы измерений [M] = [кг], [F] = [м 2 ], [t] = [c], [ ]=[кг/м 3 ], то единица измерения b будет:

.
Коэффициент массоотдачи показывает, какое количество вещества передается от поверхности раздела фаз в воспринимающую фазу через 1 м 2 поверхности фазового контакта в течение 1 с при разности концентраций, равной единице.
Коэффициент массоотдачи является не физической константой, а кинетической характеристикой, зависящей от физических свойств фазы (плотности, вязкости и др.) и гидродинамических условий в ней (ламинарный или турбулентный режим течения), связанных, в свою очередь, с физическими свойствами фазы, а также с геометрическими факторами, определяемыми конструкцией и размерами массообменного аппарата. Таким образом, величина b является функцией многих переменных, что значительно осложняет расчет или опытное определение коэффициентов массоотдачи. Величинами последних учитывается как молекулярный, так и конвективный перенос вещества в фазе.
По своему смыслу коэффициент массоотдачи является аналогом коэффициента теплоотдачи в процессах переноса тепла, а основное уравнение массоотдачи идентично по структуре основному уравнению теплоотдачи.
В ряде случаев при расчетах конкретных установившихся процессов принимают, что коэффициент массоотдачи сохраняет постоянное значение вдоль поверхности раздела фаз, и для этих условий уравнение (31) записывают в следующем виде:

. (5)
Читайте также:

