Основные стадии химического производства кратко
Обновлено: 04.07.2024
Наука – концентрация человеческого разума в этом мире. Свет надежды. Использование научных принципов приводит к улучшению результатов. Это в полной мере относится и к химическому производству.
Научные принципы химического производства
Они делятся на общие и частные принципы. Первые формулируют направления работы научной философии, вторые – концентрируются на решениях конкретных вызовов.
Общие принципы
Частные принципы
Создание оптимальных условий для химических реакций
- Прямоток веществ.
- Противоток веществ.
- Увеличивается площадь поверхности соприкосновения.
- Повышение давления.
- Использование катализатора.
- Повышение концентрации реагирующих веществ.
Комплексное полное использование сырья
- Циркуляция процесса.
- Создание смежных производств, перерабатывающих отходы.
Использование теплоты химических реакций
- Теплообмен процесса.
- Утилизация теплоты реакций.
- Механизация производства.
- Автоматизация производства.
Защита окружающей среды
- Утилизация отходов.
- Нейтрализация выбросов в атмосферу.
- Герметизация аппаратов.
- Автоматизация вредных производств.
Как же эти принципы воплощаются? Чтобы дать ответ на этот вопрос, будут рассмотрены процессы создания химических веществ.
Производство аммиака
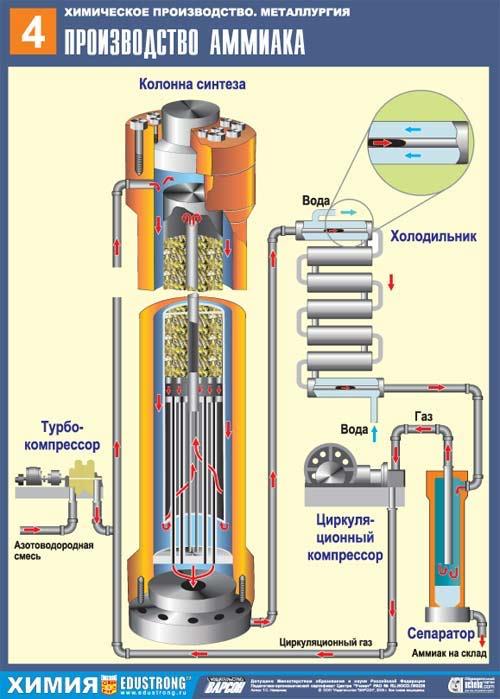
Рис. 1. Производство аммиака
Первый шаг – получение из азота и водорода азотоводородной смеси. Азот получается посредством фракционной перегонки жидкого воздуха. Источником водорода выступает процесс паровой природного газа или угля.
Турбокомпрессор сжимает смесь, пока не будет получено давление в 25*10 6 Па. Температура для протекания требуемых химических реакций находится в диапазоне: 400-500 °С. Для ускорения используется катализатор – пористое железо, содержащее примеси K2O и Al2O3.
Данный химический процесс является равновесным: при изменении условий происходит изменение количество продукта реакции, поэтому при проведении данного процесса нужно следить за внешними факторами, которые влияют на протекание химического процесса.
Создаваемый аммиак отделяют от непрореагировавшего водорода и азота в холодильнике процессом сжижения. Непрореагировавшая смесь возвращается в колонну синтеза. Процесс циркулирует непрерывно, пока не будет истрачен требуемый исходный материал. Применяется получаемый аммиак для производства взрывчатых веществ, азотных удобрений, пластических масс и ещё ряда продукции химического производства.
Производство серной кислоты

Рис. 2.

Рис. 3. Производство серной кислоты
Серная кислота относится к числу сильных кислот. Для получения используется очищенный измельченный влажный пирит (другое название – серный колчедан). Сырьё сверху засыпается в печь, чтобы обжечь вещество. Снизу, по принципу противотока, пропускается воздух, обогащенный кислородом.
Результат обжига в печи: SO2, пары воды и мельчайшие частицы оксида железа (огарок). Газ очищается от примесей. Твёрдые частицы задерживает электрофильтр и циклон. Для водных паров предусматривается сушильная башня.
Контактный аппарат окисляет сернистый газ с помощью катализатора пятиокиси ванадия. Процесс окисления обратим, для чего подбирают оптимальные условия, способствующие протеканию прямой реакции: повышается давление и поддерживается температура на свыше отметки в 500 °С.
Производство метанола

Для производства метанола используется реакция взаимодействия угарного газа и водорода. Технологическая цепочка практически повторяет ту, что используется для получения аммиака. Схожесть обусловлена частичным сходством проходимых реакций. И аммиак, и метанол – это экзотермические, обратимые, каталитические реакции, процесс протекания которых предусматривает уменьшение объема газообразных веществ.
Для синтеза метанола используются следующие приёмы:
- Применение в колонне синтеза катализатора.
- Использование высокого давления, повышающего уровень выхода продукта.
- Принципы теплообмена и циркуляции.
- Для увеличения скорости реакции используется высокая температура.
Химическое загрязнение окружающей среды и его последствия
Недостаток химического производства – загрязнение окружающей среды, вредоносное влияние на здоровье и жизнь человека и местной флоры с фауной. Негативные последствия накапливаются, приводя к ухудшению самочувствия. При размещении химического предприятия окружающая обстановка может кратно ухудшиться. Падает уровень жизни и удовлетворенность.
Чтобы не допустить этого, с химическим загрязнением окружающей среды борются. Это достигается с помощью следующих мер:
- Создание новых технологий и технических объектов, ориентированных на ресурсосбережение и малоотходность.
- Получение наибольшего объема продукции требуемого качества с наименьшими вложениями.
- Стремление к полному использованию исходного сырья.
- Поддержание экологической безопасности на предприятии.
Государство заинтересовано в поддержания благоприятной экологической обстановки. Для стимулирования уменьшения химического загрязнения окружающей среды и последствий используется налоговая экологическая политика, привязанная к объему выбросов и уровню опасности.
Рис 1. , Рис. 2, Рис. 3 — Назарова, Т.С. Серия 7: Химическое производство. Металлургия: учеб. пособ. / Т.С. Назарова, Н.С. Куприянова.
Значительная химическая активность металлов (взаимодействие с кислородом воздуха, другими неметаллами, водой, растворами солей, кислотами) приводит к тому, что в земной коре они встречаются главным образом в виде соединений: оксидов, сульфидов, сульфатов, хлоридов, карбонатов.
В свободном виде встречаются металлы, расположенные в ряду напряжений правее водорода (Ag,Hg,Pt,Au,Cu), хотя гораздо чаще медь и ртуть в природе можно встретить в виде соединений.
Минералы и черные породы, содержащие металлы и их соединения, из которых выделение чистых металлов технически возможно и экономически целесообразно, называют рудами.
Получение металлов из руд — задача металлургии.
Металлургия — это и наука о промышленных способах получения металлов из руд, и отрасль промышленности.
Любой металлургический процесс — это процесс восстановления ионов металла с помощью различных восстановителей. Суть его можно выразить так:
Чтобы реализовать этот процесс, надо учесть активность металла, подобрать восстановитель, рассмотреть технологическую целесообразность, экономические и экологические факторы. В соответствии с этим существуют следующие способы получения металлов: пирометаллургический, гидрометаллургический, электрометаллургический.
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов — алюминия, магния.
Например, олово восстанавливают из касситерита SnO2, а медь — из куприта Cu2O прокаливанием с углем (коксом):
Сульфидные руды предварительно подвергают обжигу при доступе воздуха, а затем полученный оксид восстанавливают углем:
| 2ZnS |
| сфалерит(цинковая обманка) |
Из карбонатных руд металлы выделяют также путем прокаливания с углем, т.к. карбонаты при нагревании разлагаются, превращаясь в оксиды, а последние восстанавливаются углем:
| FeCO3 |
| сидерит(шпатовый железняк) |
Восстановлением углем можно получить Fe,Cu,Zn,Cd,Ge,Sn,Pb и другие металлы, не образующие прочных карбидов (соединений с углеродом).
В качестве восстановителя можно применять водород (а) или активные металлы (б):
а) MoO3+3H2=Mo+3H2O (водородотермия).
К достоинствам этого метода относится получение очень чистого металла.
б) TiO2+2Mg=Ti+2MgO (магниотермия),
Чаще всего в металлотермии используют алюминий, теплота образования оксида которого очень велика (2Al+1.5O2=Al2O3+1676 кДж/моль). Электрохимический ряд напряжений металлов нельзя использовать для определения возможности протекания реакций восстановления металлов из их оксидов. Приближенно установить возможность этого процесса можно на основании расчета теплового эффекта реакции (Q), зная значения теплот образования оксидов:
где Q1 — теплота образования продукта, Q2 — теплота образования исходного вещества.
Гидрометаллургия — это восстановление металлов из их солей в растворе. Процесс проходит в два этапа: 1) природное соединение растворяют в подходящем реагенте для получения раствора соли этого металла; 2) из полученного раствора данный металл вытесняют более активным или восстанавливают электролизом. Например, чтобы получить медь из руды, содержащей оксид медиCuO, ее обрабатывают разбавленной серной кислотой:
Затем медь либо извлекают из раствора соли электролизом, либо вытесняют из сульфата железом:
Электрометаллургия — восстановление металлов в процессе электролиза растворов или расплавов их соединений.
Производство аммиака и метанола
Основные стадии химического производства
I. Подготовка сырья и подвод реагирующих веществ в зону реакции.
II. Химические процессы.
III. Отвод продуктов и непрореагировавших веществ из зоны реакции.
Сравним два химических производства: синтез аммиака и синтез метанола. Оба процесса очень похожи по условиям их проведения и источникам сырья. Их осуществляют на аналогичных установках, которые часто монтируют на одном предприятии.
Все аппараты этих производств максимально герметичны, используется только энергия экзотермических реакций. Благодаря циклической (замкнутой) схеме синтеза эти производства служат примерами малоотходных, почти не имеющих выбросов в окружающую среду. Затраты на производство существенно снижены за счет осуществления непрерывного процесса: исходные вещества постоянно поступают в реактор, а продукты постоянно из него выводятся. Непрерывность процесса позволяет его полностью автоматизировать.

Производства аммиака и метанола считаются наиболее передовыми с точки зрения химической технологии.
Аммиак в дальнейшем используют для получения азотной кислоты, которая идет на производство удобрений, лекарств, красителей, пластмасс, искусственных волокон, взрывчатых веществ. Большие количества аммиака расходуются на получение мочевины, являющейся прекрасным азотным удобрением, да и сам жидкий аммиак и его водный раствор — это жидкие удобрения. На легком сжижении и последующем испарении с поглощением теплоты основано его применение в холодильных установках.
Метанол используют для получения большого количества разных органических веществ, в частности, формальдегида и метилметакрилата , которые используют в производстве фенолформальдегидных смол и полиметилметакрилата (органическое стекло) соответственно. Помимо этого, метанол используют как растворитель, экстрагент, а в ряде стран — в качестве моторного топлива, т. к. его добавление к бензину повышает октановое число топлива и снижает количество вредных веществ в выхлопных газах.
Понятие о металлургии: общие способы получения металлов
Значительная химическая активность металлов (взаимодействие с кислородом воздуха, другими неметаллами, водой, растворами солей, кислотами) приводит к тому, что в земной коре они встречаются главным образом в виде соединений: оксидов, сульфидов, сульфатов, хлоридов, карбонатов.
В свободном виде встречаются металлы, расположенные в ряду напряжений правее водорода (Ag,Hg,Pt,Au,Cu), хотя гораздо чаще медь и ртуть в природе можно встретить в виде соединений.
Минералы и черные породы, содержащие металлы и их соединения, из которых выделение чистых металлов технически возможно и экономически целесообразно, называют рудами.
Получение металлов из руд — задача металлургии.
Металлургия — это и наука о промышленных способах получения металлов из руд, и отрасль промышленности.
Любой металлургический процесс — это процесс восстановления ионов металла с помощью различных восстановителей. Суть его можно выразить так:
Чтобы реализовать этот процесс, надо учесть активность металла, подобрать восстановитель, рассмотреть технологическую целесообразность, экономические и экологические факторы. В соответствии с этим существуют следующие способы получения металлов: пирометаллургический, гидрометаллургический, электрометаллургический.
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов — алюминия, магния.
Например, олово восстанавливают из касситерита SnO2, а медь — из куприта Cu2O прокаливанием с углем (коксом):
Сульфидные руды предварительно подвергают обжигу при доступе воздуха, а затем полученный оксид восстанавливают углем:
| 2ZnS |
| сфалерит(цинковая обманка) |
Из карбонатных руд металлы выделяют также путем прокаливания с углем, т.к. карбонаты при нагревании разлагаются, превращаясь в оксиды, а последние восстанавливаются углем:
| FeCO3 |
| сидерит(шпатовый железняк) |
Восстановлением углем можно получить Fe,Cu,Zn,Cd,Ge,Sn,Pb и другие металлы, не образующие прочных карбидов (соединений с углеродом).
В качестве восстановителя можно применять водород (а) или активные металлы (б):
а) MoO3+3H2=Mo+3H2O (водородотермия).
К достоинствам этого метода относится получение очень чистого металла.
б) TiO2+2Mg=Ti+2MgO (магниотермия),
Чаще всего в металлотермии используют алюминий, теплота образования оксида которого очень велика (2Al+1.5O2=Al2O3+1676 кДж/моль). Электрохимический ряд напряжений металлов нельзя использовать для определения возможности протекания реакций восстановления металлов из их оксидов. Приближенно установить возможность этого процесса можно на основании расчета теплового эффекта реакции (Q), зная значения теплот образования оксидов:
где Q1 — теплота образования продукта, Q2 — теплота образования исходного вещества.
Гидрометаллургия — это восстановление металлов из их солей в растворе. Процесс проходит в два этапа: 1) природное соединение растворяют в подходящем реагенте для получения раствора соли этого металла; 2) из полученного раствора данный металл вытесняют более активным или восстанавливают электролизом. Например, чтобы получить медь из руды, содержащей оксид медиCuO, ее обрабатывают разбавленной серной кислотой:
Затем медь либо извлекают из раствора соли электролизом, либо вытесняют из сульфата железом:
Электрометаллургия — восстановление металлов в процессе электролиза растворов или расплавов их соединений.
Производство аммиака и метанола
Основные стадии химического производства
I. Подготовка сырья и подвод реагирующих веществ в зону реакции.
II. Химические процессы.
III. Отвод продуктов и непрореагировавших веществ из зоны реакции.
Сравним два химических производства: синтез аммиака и синтез метанола. Оба процесса очень похожи по условиям их проведения и источникам сырья. Их осуществляют на аналогичных установках, которые часто монтируют на одном предприятии.
Все аппараты этих производств максимально герметичны, используется только энергия экзотермических реакций. Благодаря циклической (замкнутой) схеме синтеза эти производства служат примерами малоотходных, почти не имеющих выбросов в окружающую среду. Затраты на производство существенно снижены за счет осуществления непрерывного процесса: исходные вещества постоянно поступают в реактор, а продукты постоянно из него выводятся. Непрерывность процесса позволяет его полностью автоматизировать.
Производства аммиака и метанола считаются наиболее передовыми с точки зрения химической технологии.
Аммиак в дальнейшем используют для получения азотной кислоты, которая идет на производство удобрений, лекарств, красителей, пластмасс, искусственных волокон, взрывчатых веществ. Большие количества аммиака расходуются на получение мочевины, являющейся прекрасным азотным удобрением, да и сам жидкий аммиак и его водный раствор — это жидкие удобрения. На легком сжижении и последующем испарении с поглощением теплоты основано его применение в холодильных установках.
Метанол используют для получения большого количества разных органических веществ, в частности, формальдегида и метилметакрилата , которые используют в производстве фенолформальдегидных смол и полиметилметакрилата (органическое стекло) соответственно. Помимо этого, метанол используют как растворитель, экстрагент, а в ряде стран — в качестве моторного топлива, т. к. его добавление к бензину повышает октановое число топлива и снижает количество вредных веществ в выхлопных газах.
Многие химические реакции, с которыми вы познакомились в лабораторных условиях, или аналогичные им осуществляют в промышленных условиях при производстве важнейшей для повседневной жизни химической продукции.
Пластмассы, синтетические волокна, фармацевтические препараты, удобрения, мыла и моющие средства, красители, пестициды, косметика и парфюмерные изделия и даже компоненты пищи — все это только некоторые виды продукции, выпуск которой полностью или частично зависит от химической промышленности.
Одиннадцать первых мест по объему производства принадлежит веществам, формулы которых: H2SO4, NH3, N2, СаО, O2, С2Н4, NaOH, Cl2, НСl, H3PO4, HNO3. Эти-то вещества и используют в больших количествах далее для получения столь необходимых видов продукции, как названные выше.
Главная задача химии и химической технологии — производство разнообразных веществ и материалов с определенным комплексом механических, физических, химических и биологических свойств.
Любое химическое производство создается на основе общих научных принципов (табл. 21).
Таблица 21
Научные принципы организации
химических производств
Несмотря на огромное многообразие химических производств веществ и материалов, все они включают составляющие, указанные на схеме 13.
Схема 13
Важнейшие составляющие химического производства

Сырье
Сырьем называют природные материалы (природные ресурсы), используемые в промышленности для получения различных продуктов и еще не прошедшие промышленной переработки. Иногда используют вторичное сырье — это изделия, отслужившие свой срок, или отходы каких-либо производств, которые экономически выгодно снова переработать в химические продукты.
Сырье химической промышленности классифицируют по различным признакам.
По составу сырье делят на минеральное и органическое (растительное и животное).
По агрегатному состоянию различают твердое (руды, горные породы, твердое топливо), жидкое (нефть, рассолы) и газообразное (природный и попутный газы, воздух) сырье.
К минеральному сырью относят руды (из них получают металлы) и нерудные ископаемые: сера, фосфориты, калийные соли, поваренная соль, песок, глины, слюда (из них получают неметаллы, удобрения, соду, щелочи, кислоты, керамику, цемент, стекло и другие продукты).
К органическому сырью относится ископаемое горючее: торф, уголь, нефть, природный и попутный нефтяной газы — это ценное энергетическое сырье и сырье для химических синтезов. К органическому сырью также относится сырье растительного и животного происхождения, его дают сельское, лесное и рыбное хозяйство. В основном оно идет для производства продуктов питания, но частично, к сожалению, является и техническим сырьем. Кроме природных веществ, на химических заводах применяют полупродукты и отходы предприятий, а также вспомогательные материалы: воду, топливо, окислители, растворители, катализаторы (схема 14).
Схема 14
Классификация химического сырья

В связи с бурным развитием промышленности растет и объем потребления полезных ресурсов. Это приводит к тому, что многие сырьевые источники быстро истощаются, поэтому необходимо решать проблему бережного и рационального использования сырья.
Особое место среди природных ресурсов занимает вода. Она играет важную роль в химической промышленности.
В ряде производств это сырье и реагент, непосредственно участвующий в основных химических реакциях, например при получении водорода, серной, азотной и фосфорной кислот, щелочей; в реакциях гидратации и гидролиза.
Будучи универсальным растворителем и одним из наиболее распространенных катализаторов, вода дает возможность осуществлять многие химические реакции с большой скоростью в растворах или в присутствии ее следов. В химической, металлургической, пищевой и легкой промышленности воду используют как растворитель твердых, жидких, газообразных веществ. Часто ее применяют для перекристаллизации, для очистки различных продуктов производства от примесей.
Вода используется как теплоноситель из-за ее большой теплоемкости, доступности и безопасности в применении. Ею охлаждают реагирующие массы, нагретые в результате экзотермических реакций. Водяным паром или горячей водой подогревают взаимодействующие вещества для ускорения реакций или проведения эндотермических процессов.
Современные химические комбинаты расходуют миллионы кубических метров воды в сутки. Например, для получения 1 т аммиака требуется 1500 м 3 воды. Поэтому химические предприятия, нефтехимические заводы строят рядом с водными источниками.
Задачу сокращения расхода воды химическими предприятиями решают в трех основных направлениях: широкое применение оборотного водоснабжения (вода, используемая в теплообменных аппаратах, охлаждается и снова поступает в теплообменные аппараты, и так повторяется многократно), замена водяного охлаждения воздушным, очистка сточных вод и их повторное использование.
Энергия
Вы знаете, что большинство химических процессов требует затраты энергии. В химическом производстве энергию также расходуют на проведение вспомогательных операций: транспортировку сырья и готовой продукции, сжатие газов, дробление твердых веществ, контрольно-измерительное обслуживание и др. Химическая промышленность относится к одной из самых энергоемких. Средний расход только электрической энергии на производство 1 т аммиачной селитры NH4NO3 равен 11 000 кВт•ч; 1т синтетического аммиака — 3200; 1 т фосфора — 16 500; 1 т алюминия — 19 000.
В химической промышленности используют различные виды энергии: электрическую, тепловую, ядерную, химическую и световую.
Электрическую энергию используют для проведения электролиза расплавов и растворов веществ, нагревания, в операциях, связанных с электростатическими явлениями, например, в электрофильтрах при производстве серной кислоты для очистки оксида серы (IV). Электроэнергию вырабатывают тепловые (ТЭС), атомные (АЭС) электростанции и гидроэлектростанции (ГЭС).
Тепловая энергия в химической промышленности необходима для нагревания реагирующих веществ при проведении химических реакций, а также для сушки, плавления, дистилляции, выпаривания и других операций. Ее источником в производстве цемента, стекла, керамики служат различные виды топлива (твердого, жидкого, газообразного). Большинство же химических предприятий используют тепловую энергию в виде пара, горячей воды, получаемых из котельных установок или ТЭЦ.
Ядерную энергию используют главным образом для получения электроэнергии. Но такие реакции, как полимеризация, синтезы фенола и анилина, отверждение полимеров, проводят с помощью радиоактивного излучения.
Химическая энергия выделяется в виде теплоты в результате экзотермических реакций. Ее используют для предварительного подогрева исходных веществ, получения горячей воды, водяного пара. Химическая энергия может превращаться в электрическую, например, в аккумуляторах. А есть такие производства, в которых за счет энергии химических реакций покрывают собственные потребности, а излишки отпускают другим потребителям.
При получении 1 т серной кислоты из серы выделяется 5 МДж теплоты, а общие затраты на ее производство составляют всего 0,36 МДж. Излишки поступают к другим потребителям в виде пара и электроэнергии.
Световую энергию (ультрафиолетовое, инфракрасное, лазерное излучение) используют при синтезе хлороводорода, галогенировании органических веществ, реакциях изомеризации.
Ученые разрабатывают способы использования солнечной энергии, например фотохимическое разложение воды.
Защита окружающей среды и охрана труда
С точки зрения защитников окружающей среды, у химической промышленности плохая репутация. С чем это связано? Попробуем разобраться.
Все отрасли химической промышленности выпускают полезную продукцию. Вы можете сомневаться в необходимости тех или иных продуктов, но экономически они полезны и нужны, иначе бы их не производили.
Например, кому-то может быть неясно, зачем существует производство хлора, зато все согласны с необходимостью строительства завода по выпуску труб из поливинилхлорида.
Некоторые виды химической продукции действительно не вызывают особой симпатии: взрывчатые вещества для мин и снарядов, отравляющие вещества-пестициды, т. е. препараты для борьбы с сорняками, вредителями, возбудителями болезней.
С одной стороны, производство пестицидов возрастает, так как необходимо производить все больше продуктов питания для непрерывно увеличивающегося населения Земли. Но с другой стороны, некоторые пестициды весьма устойчивы в окружающей среде и представляют реальную опасность для существующих экосистем: гибнут полезные насекомые, птицы, рыбы, звери, происходит отравление людей непосредственно пестицидами или продуктами, в которых они накопились.
Любое промышленное предприятие (и химическое, конечно) имеет отходы. Производство без отходов невозможно. Газы выбрасывают в атмосферу, жидкие отходы — в канализацию, а иногда и в реку, твердые и некоторые жидкие сжигают в специальных печах или захоранивают в специально оборудованных местах.
Эти вещества загрязняют окружающую среду, неблагоприятно влияют на здоровье людей.
Поэтому химические предприятия потенциально опасны, их не строят непосредственно в городах. На самих предприятиях существуют жесткие требования охраны труда, что делает работу на них иногда даже безопаснее, чем на строительстве.
Например, установлены безопасные для здоровья людей предельно допустимые концентрации (ПДК) вредных веществ в воздухе производственных помещений и на территории предприятий, а также в атмосфере населенных мест; предусмотрены строгие меры для предотвращения пожаров и быстрой ликвидации возможных возгораний; на некоторых производствах работники имеют индивидуальные средства защиты от вредных веществ. Выполнение правил охраны труда контролируют органы государственной инспекции, а также внутризаводская служба.
Наилучшим способом решения проблемы снижения вредности производства для людей и охраны окружающей среды служит применение безотходных или малоотходных технологий. Пример — синтез аммиака, в котором отходы (непрореагировавшие газы) многократно возвращают в производство.
В других случаях остро стоит вопрос об очистке отходов. К современным ее методам относят фильтрацию, пыле-, газоулавливание, обезвреживание (нейтрализация, поглощение газов жидкими и твердыми поглотителями), биологическую очистку (при помощи микроорганизмов), осаждение в специальных отстойниках, химические методы (перевод веществ в малорастворимые и нерастворимые соединения) и другие способы.
Очистные сооружения, конечно, требуют определенных материальных затрат, а некоторые руководители предприятий стараются избавиться от отходов самыми дешевыми способами. Такой подход, очевидно, объясняется невниманием к проблемам охраны окружающей среды от загрязнения, а может быть, связан с некомпетентностью в этом вопросе.
Характерная черта химической промышленности — сравнительно небольшое количество работающих. Это обусловлено высокой степенью механизации и автоматизации производств, что также способствует охране труда работников.
Производство аммиака и метанола
Любое химическое производство состоит из отдельных взаимосвязанных процессов-стадий (схема 15).
Схема 15
Основные стадии химического производства

Сравним два химических производства: синтез аммиака и синтез метанола. Оба процесса очень похожи по условиям их проведения и источникам сырья. Их осуществляют на аналогичных установках (рис. 50), которые часто монтируют на одном предприятии.

Рис. 50.
Схема установки, которую можно использовать в производстве аммиака и метанола
Все аппараты этих производств максимально герметичны, используется только энергия экзотермических реакций. Благодаря циклической (замкнутой) схеме синтеза эти производства служат примерами малоотходных, почти не имеющих выбросов в окружающую среду. Затраты на производство существенно снижены за счет осуществления непрерывного процесса: исходные вещества постоянно поступают в реактор, а продукты постоянно из него выводятся. Непрерывность процесса позволяет его полностью автоматизировать.
Производства аммиака и метанола считаются наиболее передовыми с точки зрения химической технологии (табл. 22).
Таблица 22
Производство аммиака и метанола
Основные стадии производства
I. Подготовка сырья. Подвод реагирующих веществ в зону реакции с помощью турбокомпрессора и циркуляционного компрессора
Реагирующие вещества: оксид углерода (II) СО и водород Н2 (их смесь называется синтез-газом). Синтез-газ получают конверсией метана водяным паром при высокой температуре:
- аммиак - 25—60 МПа,
- метанол - 25—30 МПа,
а затем смешивают с циркуляционным газом (о нем смотрите далее) и направляют в колонну синтеза
II. Химический процесс проходит в основном аппарате производства — колонне синтеза
Подбор оптимальных условий проведения этих синтезов осуществляют исходя из характеристики химических реакций:
- метанол - 2) смещению равновесия вправо способствует также увеличение концентрации водорода в исходной смеси по сравнению со стехиометрическим;
- аммиак - 450—500 °С
- метанол - 370—400 °С Уменьшение давления и увеличение температуры способствуют увеличению доли побочных продуктов
Исходную смесь газов сначала нагревают в теплообменнике за счет выходящих газов, движущихся противотоком, а затем в зоне экзотермической реакции. Противоток — движение различных веществ навстречу друг другу с целью создания наилучших условий для обмена энергией (в данном случае);
В обоих процессах реагенты и продукты реакции находятся в газовой фазе и образуют гомогенную систему. Реакции протекают на поверхности твердых катализаторов. Такие реакции составляют особый класс — гетерогенно-каталитических реакций.
Важное значение имеет площадь поверхности катализатора. Катализатор изготавливают в виде губчатых гранул или таблеток.
Так как активность катализатора сильно снижается от присутствия примесей, то реагирующие газы подвергают тщательной очистке (от воды, соединений серы и др.);
5) при всех указанных условиях проведения реакций равновесный выход продукта составляет не более 20%. Поэтому синтез продукта осуществляют по способу многократной циркуляции, т. е. непрореагировавшую смесь газов многократно возвращают в производство после отделения от нее полученного продукта
III. Отвод продуктов и непрореагировавших веществ из зоны реакции производят через холодильник с последующим разделением в сепараторе
- аммиак - N2, Н2 и NH3,
- метанол - СО, Н2 и СН3ОН,
Аммиак в дальнейшем используют для получения азотной кислоты, которая идет на производство удобрений, лекарств, красителей, пластмасс, искусственных волокон, взрывчатых веществ. Большие количества аммиака расходуются на получение мочевины, являющейся прекрасным азотным удобрением, да и сам жидкий аммиак и его водный раствор — это жидкие удобрения. На легком сжижении и последующем испарении с поглощением теплоты основано его применение в холодильных установках.
Метанол используют для получения большого количества разных органических веществ, в частности формальдегида


которые используют в производстве фенолформальдегидных смол и полиметилметакрилата (органического стекла) соответственно. Помимо этого, метанол используют как растворитель, экстрагент, а в ряде стран — в качестве моторного топлива, так как добавка его к бензину повышает октановое число топлива и снижает количество вредных веществ в выхлопных газах.
![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите "Нет".
Укажите реальные данные, иначе мы не сможем с вами связаться! Отправляя форму, Вы принимаете Условия использования и даёте Согласие на обработку персональных данных
Подготовка к Единому Государственному экзамену по химии 2021 г.

Дорогие друзья! Если Вы готовитесь к ЕГЭ по химии, то можете воспользоваться этим курсом. Курс является бесплатным и предназначен для самообучения.
Курс состоит из разделов, каждый из которых соответствует вопросам ЕГЭ. Названия разделов Вы можете увидеть в левом, навигационном меню. В каждом разделе есть соответствующие тренировочные онлайн-тесты для закрепления знаний.
Если Вам потребуются консультации по вопросам, вызывающим наибольшие затруднения, то Вы всегда можете обратиться ко мне за помощью.
С уважением, преподаватель высшей квалификационной категории, почетный работник среднего профессионального образования Российской Федерации, Вера Васильевна Быстрицкая.

Демо - 2017 Пройди тест - проверь свои знания
FOR-DLE.ru - Всё для твоего DLE ;)
Привет, я Стас ! Я занимаюсь так называемой "вёрсткой" шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и "статейки" для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
ГДЗ Химия 9 класc Габриелян О.С. , Остроумов И.Г., Сладков С.А., 2018, §11 ПОЛУЧЕНИЕ ВАЖНЕЙШИХ ХИМИЧЕСКИХ СОЕДИНЕНИЙ
Упражнение 2. Охарактеризуйте основные методы и принципы химической технологии: метод кипящего слоя, принципы теплообмена, циркуляции, противотока.
Метод кипящего слоя основан на принципе противотока, когда сверху в печь подают измельчённое твердое вещество почти до состояния пыли, а затем снизу через него пропускают второе вещество, как правило, газ (например, воздух) через множество трубок под давлением, которое отрегулировано так, чтобы частицы не распылялись и не слёживались, создавая иллюзию кипящей жидкости.
Принцип теплообмена заключается в том, что теплота выходящих продуктов реакции из реакционного аппарата, используется для подогрева реагентов поступающих в место проведения реакции.
Циркуляцией называется технологический принцип, в котором непрореагировавшие вещества отделяются от продуктов реакции и вновь возвращаются в реакционный аппарат.
Принцип противотока основан на противонаправленном движении взаимодействующих веществ и используют для создания большей поверхности соприкосновения в гетерогенных реакциях для увеличенния их скорости .
Упражнение 3. Напишите уравнения химических реакций, лежащих в основе получения серной кислоты из серы.
I стадия: S + O2 = SO2 + Q
II стадия: 2SO2 + O2 ⇄ 2SO3 + Q
III стадия: SO3 + H2O = H2SO4 + Q
Какая из реакций является обратимой? Реакция окисления оксида серы (IV) до оксида серы (VI) , поскольку реакция протекает одновременно в двух противоположных направлениях.
В обратимых реакциях вместо знака равенства часто используют две противоположно направленные стрелки — знак обратимости
Как в химической технологии решается вопрос максимального использования непрореагировавших исходных веществ? Технологическим принципом, который называется циркуляцией.
Упражнение 4 Напишите уравнение химической реакции, лежащей в основе производства аммиака. Дайте характеристику этой реакции по всем известным вам признакам классификации.
N2 (г) + 3H2 (г) ⇄ 2NH3 + Q
1. Реакция соединения (N2 и H2 ― простые вещества, NH3 ― сложное вещество) .
2. Гомогенная ( N2, H2 ― газообразные вещества) .
3. Прямая реакция ― э кзотермическая (тепло выделяется, Q>0).
4. Обратимая (одновременно в одинаковых условиях протекают в двух взаимно противоположных направлениях, то есть образования и разложения аммиака) .
5. Окислительно-восстановительная (изменение степеней окисления атомов химических элементов, образующих вещества).
Восстановитель H2 0 -2e → 2H +1 ― процесс окисления
Окислитель N2 0 +6е → 2N -3 ― процесс восстановления
6. Каталитическая (присутствует катализатор) .
ПРИМЕНИТЕ СВОИ ЗНАНИЯ
Упражнение 1 На сернокислотном заводе из 1 т серного колчедана получают 360 кг 100%-ной серной кислоты. Рассчитайте массовую долю выхода продукта реакции (22,1%).
Дано: m(FeS2)=1 т=1000 кг, mпракт.(H2SO4)=360 кг
Найти: η-?
Решение
1. Количество вещества серного колчедана массой 1000 кг рассчитываем по формуле: ʋ=m/M, где M —молярная масса .
Mr(FeS2)=Ar(Fe)+2Ar(S)=56+2•32=120, поэтому M(FeS2)=120 кг/кмоль
ʋ( FeS2 )=m( FeS2 )/M( FeS2 )=1000 кг : 120 кг/кмоль=8,33 кмоль
2. Составим химическое уравнение обжига колчедана:
4FeS2 + 11O2 = 2Fe2O2 + 8SO2
По уравнению реакции ʋ(FeS2)/4=ʋ(SO2)/8, поэтому:
ʋ( SO2 )=8 • ʋ(FeО2):4=8 •8,33 кмоль:4=16,66 кмоль
3. Составим химическое уравнение окисления оксида:
2SО2 + O2 = 2SO3
2 кмоль 2 кмоль
По уравнению реакции ʋ(SO2)/2=ʋ(SO3)/2, поэтому:
ʋ(SO3)=2 • ʋ(SО2):2=2 • 16,66 кмоль:2=16,66 кмоль
4. Составим химическое уравнение образования серной кислоты:
SО3 + Н2О = Н2SO4
По уравнению реакции ʋ(SO3)/1=ʋ(H2SO4)/1 , поэтому:
ʋ(Н2SO4)=ʋ(SО3)=16,66 кмоль
5. Массу серной кислоты количеством 16,66 кмоль рассчитываем по формуле: m=ʋ•M.
Mr(H2SO4)= 2 • Ar(H)+ Ar(S)+4 • Ar(O)= 2 •1+32 +4 •16 =98, M(H2SO4)=98 кг/кмоль
mтеорет.( Н2SO4 )=ʋ( Н2SO4 )•M( Н2SO4 )=16,66 кмоль • 98 кг/кмоль=1632,68 кг
6. Рассчитываем массовую долю выхода серной кислоты:
η = mпракт.( Н2SO4 ): mтеор. ( Н2SO4 )•100%=360 кг : 1632,68 кг•100%=22,1%
Ответ: 22,1%
Упражнение 2 Какое количество теплоты выделится при взаимодействии 500 л азота с 1200 л водорода (н.у.), если тепловой эффект реакции равен 46 кДж на 1 моль аммиака (1,64 мДж)?
Дано: V(N2)=500 л, V(H2)=1200 л, Q1=46 кДж/моль
Найти: Q2-?
Решение
1. Рассчитаем количество вещества азота объёмом 500 л и водорода объёмом 1200 л по формуле ʋ=V/VM.
ʋ(N2)=V(N2)/VM=500 л : 22,4 л/моль=22,32 моль
ʋ(Н2)=V(Н2)/VM=1200 л : 22,4 л/моль=53,57 моль
2. Запишем термохимическое уравнению реакции синтеза аммиака:
N2 (г) + 3H2 (г) ⇄ 2NH3 + 46 кДж
По уравнению реакции ʋ(N2)/1=ʋ(H2)/3, подставив численные значения, получим 22,32 /1 > 53,57/3 (22,32>17,85) , следовательно, азот в избытке, то есть реагирует не полностью, поэтому расчеты будем проводить по данным водорода.
По уравнению реакции ʋ(H2)/3=ʋ(NH3)/2, поэтому
ʋ( NH3 )=2•ʋ(Н2):3=2•53,57 моль:3=35,7 моль
3. Составляем пропорцию и решаем её:
по термохимическому уравнению реакции с 1 моль NH3 выделяется 46 кДж теплоты,
по условию задачи с 35,7 моль NH3 ― х кДж теплоты.
х=35,7 кДж ● 46 кДж : 1 моль=1642,2 кДж=1,64 мДж
Ответ: 1,64 мДж
Читайте также:

