Основные понятия термодинамики кратко презентация
Обновлено: 30.06.2024
Работа в термодинамике Работа газа: Работа внешних сил:
Работа газа в изопроцессах При изохорном процессе ( V=const) : Δ V = 0 работа газом не совершается: P V Изохорное нагревание
При изобарном процессе (Р= const) : P V V 1 V 2 P Изобарное расширение 1 2
Изобарный процесс ( ) V 1 V 2 p 0 p V 2 1 Работа в термодинамике численно равна площади фигуры под графиком процесса в координатах р( V)
При изотермическом процессе (Т= const) : P V Изотермическое расширение Р 2 1 2 V 1 V 2
Количество теплоты – часть внутренней энергии, которую тело получает или теряет при теплопередаче Процесс Формула Нагревание или охлаждение С – удельная теплоёмкость вещества [ Дж/кг 0 К ], m – масса [ кг ], Δ T – изменение температуры [ 0 K]. Кипение или конденсация r – удельная теплота парообразования [ Дж/кг ] Плавление или кристаллизация λ - удельная теплота плавления вещества [ Дж/кг ] Сгорание топлива q – удельная теплота сгорания топлива [ Дж/кг ]
Если в изолированной системе происходит теплообмен между несколькими телами, то - уравнение теплового баланса
Первый закон термодинамики
Первый закон термодинамики Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе: Если А - работа внешних сил, а А' - работа газа, то А = - А' (в соответствии с 3-м законом Ньютона). Тогда: другая форма записи первого закона термодинамики
Применение первого закона термодинамики к различным процессам Процесс Постоянный параметр Первый закон термодинамики Изохорный V = const A '=0, Δ U = Q Изотермический Т = const Δ U =0, Q = A ' Изобарный p = const Q = Δ U + A' Адиабатный – процесс, проходящий без теплообмена с окружающей средой Q = const Q =0, Δ U = -A'
Второй закон термодинамики
Формулировка закона: Невозможно перевести тепло от более холодной системы к более горячей при отсутствии других одновременных изменений в обеих системах или в окружающих телах
КПД тепловых двигателей
Тепловые двигатели – это устройства, превращающие внутреннюю энергию топлива в механическую работу
Тепловые двигатели Машины, преобразующие внутреннюю энергию в механическую работу, называют тепловыми двигателями
Принцип действия тепловых двигателей Т 1 – температура нагревателя Т 2 – температура холодильника Q 1 – количество теплоты, полученное от нагревателя Q 2 – количество теплоты, отданное холодильнику
А Q х Рабочее тело (Газ) Нагреватель Т н Холодильник Т х Q н КПД тепловых машин
Презентация на тему: " Основные понятия и законы термодинамики Термодинамика - один из важнейших разделов физики и физической химии, предметом изучения которого являются: а)" — Транскрипт:
1 Основные понятия и законы термодинамики Термодинамика - один из важнейших разделов физики и физической химии, предметом изучения которого являются: а) основные соотношения, позволяющие рассчитать количество выделенного или поглощенного тепла в физических и химических превращениях и совершаемую при этом работу; б) выявление возможного самопроизвольного течения процессов в определенном направлении, их равновесие.
2 Термодинамика исследует также переходы энергии из одной формы в другую. Термодинамика построена на двух основных законах, называемых первым и вторым началами, и на постулате Планка, который часто рассматривают как третий закон термодинамики. Общая характеристика термодинамического метода сводится к следующему. Термодинамика базируется на небольшом числе крупных логических обобщений научной и практической деятельности людей. Ни один из ныне известных фактов не противоречит этим обобщениям. На их основе, используя богатый физико-математический аппарат, выводят ряд отдельных законов и физико-химических соотношений, пригодных для решения более частных и многочисленных физико-химических задач. Таким образом, термодинамика покоится на методе дедуктивного мышления (от общего - к частному).
3 Термодинамика в классической форме дает ответ лишь о направлении протекания процессов, условиях равновесия системы, ничего не сообщая о скорости процесса, времени достижения равновесия. Термодинамика приложима только к системе с достаточно большим числом атомов или молекул, для которой действительны статистические законы. Однако ее нельзя применять к Вселенной, ибо термодинамика создана на основании обобщения опытных данных для закрытых систем и только для них безоговорочно справедлива. Возникновение термодинамики как самостоятельной дисциплины относится к середине прошлого века, хотя некоторые ее закономерности (закон Гесса, принцип Карно) были установлены значительно раньше. Развитие различных прикладных направлений термодинамики постепенно привело, к их превращению в самостоятельные разделы, из которых можно выделить общую, техническую и химическую термодинамику. В курсе технолого-экологических основ природопользования в большей степени, чем остальное, востребуется обычно знание химической термодинамики.
6 Изолированные системы - это системы, имеющие постоянный объем, через границы которых не происходит обмена веществом или анергией с окружающей средой. В противном случае мы имеем дело с неизолированной системой. Закрытые системы не обмениваются веществом с другими системами. Их взаимодействие с ними ограничивается только передачей теплоты и работы. Предметом термодинамического изучения являются только закрытые системы.
7 Состояние системы определяется ее свойствами (термодинамическими параметрами). Свойства системы зависят только от ее начального и конечного состояния и не зависят от пути перехода из одного состояния в другое. Различают интенсивные и экстенсивные свойства. Экстенсивные свойства пропорциональны количеству вещества. К их числу относятся масса и объем системы. Если к веществу массой 1 кг или объемом 1 л добавить еще такую же массу и объем, то масса и объем объединенной системы составят 2 кг и 2 л. Другими словами, экстенсивные свойства системы являются аддитивными, т.е. суммирующимися. Интенсивные свойства не зависят от количества вещества, не аддитивны. К ним относятся температура, давление, плотность. Наиболее важными и часто используемыми свойствами системы являются давление, объем, температура и состав.
8 Переход системы из одного состояния в другое называют процессом. Если при его проведении изменяется состав, то такой процесс именуют химической реакцией. К весьма важным в термодинамике относятся понятия теплоты и работы. Они не являются функциями состояния и проявляются только при проведении процесса, служат формами передачи энергии (общей меры всех видов движения) от системы к окружающей среде и обратно. Не будучи функцией состояния, работа и теплота зависят от пути проведения процесса. В соответствии с современными термодинамическими представлениями работа есть упорядоченная форма передачи энергии, а теплота является неупорядоченной формой ее передачи. Одним из наиболее фундаментальных термодинамических понятий является внутренняя энергия U. Она относится к параметрам состояния и в физическом смысле характеризует общий запас энергии системы, включая энергию: поступательного и вращательного движения молекул; внутримолекулярного колебательного движения атомов и атомных групп, составляющих молекулы; вращения электронов в атоме; ядер атомов и т.д., но без учета кинетической энергии тела в целом и его потенциальной энергии положения.
9 Изменение внутренней энергии является термодинамическим параметром системы. Величина ΔU принимается положительной, если в рассматриваемом процессе она возрастает. Первый закон термодинамики устанавливает связь между количеством получаемой или выделяемой теплоты, количеством произведенной или полученной работы и изменением внутренней энергии системы при проведении термодинамического процесса. Во всех случаях в закрытой термодинамической системе отношение поглощенного тепла Q к совершенной работе А есть величина постоянная. Q/A= const Это отношение не зависит от свойств системы и пути ее перехода из одного со стояния в другое, т.е. является термодинамическим параметром, и составляет 427 кгм/ккал. При измерении Q и А в одинаковых единицах Q/A =1, в том числе и в круговом процессе.
10 Одна из наиболее ярких формулировок первого закона термодинамики: вечный двигатель первого рода невозможен. Имеются и другие, равноценные, формулировки первого закона. Одна из них - формулировка закона сохранения энергии: если в каком-либо процессе энергия одного вида исчезает, то вместо нее в строго эквивалентном количестве появляется энергия другого вида. Математическое выражение первого закона термодинамики может быть дано в различных формах. Наиболее общая: ΔU = Q – A Для процессов, связанных с бесконечно малыми изменениями, уравнение принимает вид dU = δQ - δA где dU - полный дифференциал внутренней энергии системы; δQ и δА - бесконечно малые количества теплоты и работы.
11 Второй закон термодинамики показывает, в каком направлении в заданных условиях (температура, давление, концентрация и т.д.) может протекать самопроизвольно, т.е. без затраты работы извне, тот или иной процесс. Во- вторых, закон определяет предел возможного самопроизвольного течения процессов, т.е. его равновесное в данных условиях состояние. Для изолированных систем критерием, определяющим самопроизвольное течение процесса, служит термодинамический параметр, получивший название энтропии S. В этих системах при протекании необратимых процессов энтропия возрастает и достигает максимальных значений при равновесии процесса: S2 – S1 > 0
12 В неизолированных системах о направлении процесса судят по изменению термодинамических потенциалов, также являющихся функциями состояния. Второй закон термодинамики указывает направление возможного процесса, но ничего не сообщает о его скорости.
13 Основной смысл третьего закона сводится к утверждению, что при абсолютном нуле температуры энтропия правильно образованного кристалла любого соединения в чистом состоянии равна нулю. При любом другом состоянии вещества его энтропия больше нуля.
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.

Описание презентации по отдельным слайдам:


Цели урока: Сформировать основные понятия термодинамики Сформулировать первый закон термодинамики Рассмотреть принцип действия тепловых двигателей и их КПД Выявить отрицательное воздействие тепловых двигателей на окружающую среду и наметить пути решения этой проблемы


ОСНОВЫ ТЕРМОДИНАМИКИ. Это теория о наиболее общих свойствах макроскопических тел. На первый план выступают тепловые процессы и энергетические преобразования Ядром являются два начала (закона) термодинамики

ИЗ ИСТОРИИ РАЗВИТИЯ ТЕРМОДИНАМИКИ АВТОРСУТЬ ВВЕДЕННЫХ ПРЕДСТАВЛЕНИЙ Д. Фаренгейт (1685-1736) голливудский физик, мастер-стеклодувВ 1710 – 1714 годах предложил шкалу и термометр: 0° - температура смеси воды, льда и поваренной соли, 32° - температура смеси воды и льда, 212° - температура кипения воды, 96° - температура тела человека. А. Цельсий (1701 – 1744), шведский физик и астроном.В 1742 году предложил стоградусную шкалу температур: 0° - температура таяния льда, 100° - температура кипение воды Ж. Понселе (1788 – 1867), французский физик и инженер.В 1826 году ввел понятие работы и единицы её измерения. С. Карно (1796 – 1832), французский физик и инженер.Ввел представление об идеальной тепловой машине, а в 1824 году фактически дал формулировку второго начала термодинамики, связал тепло с движение частиц тела. Б. Клапейрон (1799 – 1864), французский физик и инженер.В 1834 году вывел уравнение состояния идеального газа, обобщенное в дальнейшем Д. И. Менделеевым.

ИЗ ИСТОРИИ РАЗВИТИЯ ТЕРМОДИНАМИКИ АВТОРСУТЬ ВВЕДЕННЫХ ПРЕДСТАВЛЕНИЙ Р. Майер (1818 – 1878), немецкий врач и естествоиспытатель.В 1842 году одним из первых сформулировал закон сохранения и превращения энергии. Дж. Джоуль (1818 – 1889), английский физикВ 1843 году первый вычислил механический эквивалент теплоты и пришел к закону сохранения энергии. Г. Гельмгольц (1821 – 1894), немецкий физик и естествоиспытательВ 1847 году дополнив идеи Майера и опыты Джоуля, сформулировал и математически обосновал закон сохранения и превращения энергии. Р. Клаузиус (1822 – 1888), немецкий физик-теоретик.В 1850 году сформулировал второе начало термодинамики, а в 1854 г. дал математическую формулировку первого начала. У. Томсон (Кельвин) (1824 – 1907), английский физик.В 1848 году ввел понятие абсолютной температуры, в 1851 году сформулировал второе начало термодинамики.

ЧТО ИЗУЧАЕТ ТЕРМОДИНАМИКА? Возникла как наука тепловых процессов, рассматриваемых с точки зрения энергетических преобразований. Не рассматривает явления с точки зрения движения молекул. Изучает наиболее общие свойства макроскопических систем, находящихся в равновесном состоянии, и процессы их перехода из одного состояния в другое. Термодинамический метод широко используется в других разделах физики, химии, биологии. Как и любая физическая теория или раздел физики, имеет свои границы применимости.

ГРАНИЦЫ ПРИМЕНИМОСТИ ТЕРМОДИНАМИКИ Неприменима к системе из нескольких молекул. Не может быть применима ко всей Вселенной, слишком сложной и неопределенной физической системе.

ТЕРМОДИНАМИЧЕСКАЯ СИСТЕМА Любая совокупность макроскопических тел, которые взаимодействуют между собой и с внешними объектами посредством передачи энергии и вещества. ИЗОЛИРОВАННЫЕ СТАТИЧЕСКИЕ Не обмениваются с другими системами ни веществом ни энергией При отсутствие взаимодействия параметры системы остаются неизменными ВЗАИМОДЕЙСТВИЕ ОТКРЫТАЯ ЗАКРЫТАЯ С окружающей средой веществом не обменивается, но обменивается энергией Обменивается и энергией Живой организм утюг

ТЕРМОДИНАМИЧЕСКИЕ ПАРАМЕТРЫ Совокупность физических величин, характеризующих свойства термодинамической системы.

Внутренняя энергия Определение: Внутренняя энергия тела – это сумма кинетической энергии хаотического теплового движения частиц (атомов и молекул) тела и потенциальной энергии их взаимодействия Обозначение: U Единицы измерения: [Дж]

Внутренняя энергия идеального одноатомного газа число молекул кинетическая энергия одной молекулы (NAk = R)

Внутренняя энергия идеального одноатомного газа

Внутренняя энергия идеального двухатомного газа

Так как - уравнение Менделеева–Клапейрона, то внутренняя энергия: - для одноатомного газа - для двухатомного газа.

В общем виде: где i – число степеней свободы молекул газа (i = 3 для одноатомного газа и i = 5 для двухатомного газа)

Изменение внутренней энергии тела ΔU Совершение работы А над самим телом телом ΔU ΔU Теплообмен Q теплопроводность конвекция излучение

Работа в термодинамике Работа газа: Работа внешних сил:

I ЗАКОН ТЕРМОДИНАМИКИ Изменение внутренней энергии U системы равно сумме работы A совершенной внешними телами над системой, и сообщенного ей количества теплоты Q. U=A+Q A*=-A Q=A*+ U Количество теплоты Q, переданное системе, расходуется на увеличение её внутренней энергии U и совершение системой работы A* над внешними телами. (Закон сохранения и превращения энергии в применении к тепловым процессам)

Первый закон термодинамики Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе Количество теплоты, переданное системе, идёт на изменение её внутренней энергии и на совершение системой работы над внешними телами

ТЕРМОДИНАМИКА ИЗОПРОЦЕССОВ. Процессы, происходящие при постоянном значении одного из параметров состояния (T,V или P) с данной массой газа называются изопроцессами. ИЗОТЕРМИЧЕСКИЙ ИЗОХОРНЫЙ ИЗОБАРНЫЙ АДИАБАТНЫЙ

ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС Процесс, происходящий при постоянной температуре. T=const U=0 Q+A=0 Q=-A=A*

При изотермическом процессе (Т=const): P V Изотермическое расширение Р2 1 2 V1 V2

ИЗОХОРНЫЙ ПРОЦЕСС Процесс, происходящий при постоянном объёме. V=const Q= U A=0

Работа газа при изопроцессах При изохорном процессе (V=const): ΔV = 0 работа газом не совершается: P V Изохорное нагревание

ИЗОБАРНЫЙ ПРОЦЕСС Процесс, происходящий при постоянном давлении. A*=p ( + ) U=A+Q Q=A*+ U

При изобарном процессе (Р=const): P V V1 V2 P Изобарное расширение 1 2

АДИАБАТНЫЙ ПРОЦЕСС Процесс, происходящий без теплообмена с внешней средой.(Обычно отсутствие теплообмена обусловлено быстротой процесса: теплообмен не успевает произойти) Q=0 U=-A*

Геометрическое истолкование работы: Работа, совершаемая газом в процессе его расширения (или сжатия) при любом термодинамическом процессе, численно равна площади под кривой, изображающей изменение состояния газа на диаграмме (р,V). P V V1 V2 P P V Р2 1 2 V1 V2 S S Р1

Количество теплоты – часть внутренней энергии, которую тело получает или теряет при теплопередаче Процессформула Нагревание или охлаждениеС – удельная теплоёмкость вещества [ Дж/кг 0К], m – масса [кг], ΔT – изменение температуры [ 0K]. Кипение или конденсацияr – удельная теплота парообразования [ Дж/кг ] Плавление или кристаллизацияλ- удельная теплота плавления вещества [ Дж/кг ] Сгорание топливаq – удельная теплота сгорания топлива [ Дж/кг ]

Применение первого закона термодинамики к различным процессам ПроцессПостоянный параметрПервый закон термодинамики ИзохорныйV = constΔU = Q ИзотермическийТ = constQ = A' ИзобарныйР = constQ = ΔU + A' АдиабатныйQ = constΔU = -A'

II ЗАКОН ТЕРМОДИНАМИКИ Тепловые процессы необратимы. Не возможно перевести теплоту от более холодной системы к более горячей при отсутствии других одновременных изменений в обеих системах или окружающих телах. Не возможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара. Не возможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела более нагретому.

Тепловые двигатели – устройства, превращающие внутреннюю энергию топлива в механическую. Виды тепловых двигателей

ТЕПЛОВОЙ ДВИГАТЕЛЬ – ГЛАВНЫЙ ДВИГАТЕЛЬ СОВРЕМЕННОЙ ЭНЕРГЕТИКИ Периодически действующий двигатель, совершающий работу за счет полученной извне теплоты. НАГРЕВАТЕЛЬ (Т1) РАБОЧЕЕ ТЕЛА ХОЛОДИЛЬНИК (Т2) Q1 Q2 A* A*=Q1 – Q2 Виды двигателей: Паровая и газовая турбины Карбюраторный двс Дизель двс Ракетный двигатель

Принцип действия тепловых двигателей Т1 – температура нагревателя Т2 – температура холодильника Q1 – количество теплоты, полученное от нагревателя Q2 – количество теплоты, отданное холодильнику

Коэффициент полезного действия (КПД) теплового двигателя – отношение работы А’, совершаемой двигателем, к количеству теплоты, полученному от нагревателя:

где работа, совершаемая двигателем тогда КПД всегда меньше единицы, так как у всех двигателей некоторое количество теплоты передаётся холодильнику При двигатель не может работать

Максимальное значение КПД тепловых двигателей (цикл Карно):

Отрицательные последствия использования тепловых двигателей: Потепление климата Загрязнение атмосферы Уменьшение кислорода в атмосфере Решение проблемы: Вместо горючего использовать сжиженный газ. Бензин заменить водородом. Электромобили. Дизели. На тепловых электростанциях использовать скрубберы, в которых сера связывается с известью. Сжигание угля в кипящем слое. КПД тепловых двигателей ДвигательКПД, % Паровая машина1 Паровоз8 Карбюрато- рный двигатель20 - 30 Газовая турбина36 Паровая турбина35 - 46 Ракетный двигатель на жидком топливе47

ВЕЧНЫЙ ДВИГАТЕЛЬ Первого рода Второго рода Целиком превращал бы в работу теплоту, извлекаемою из окружающих тел Будучи раз пущен в ход, совершал бы работу неограниченно долгое время, не заимствуя энергию извне НЕВОЗМОЖНЫ Противоречит закону сохранения и превращения энергии Противоречит второму началу термодинамики


Тест по ТЕРМОДИНАМИКЕ На сколько отделов делится термодинамика как предмет? а) на трив) на пять б) на четырег) на шесть Кем была предложена температурная шкала, которой мы пользуемся в повседневной жизни? а) Кельвиномв) Карно б) Цельсиемг) Джоулем Что изучает термодинамика? а) тепловые процессыв) звуковые явления б) движение молекулг) механические явления Термодинамическая система, которая не взаимодействует с другими системами называется: а) закрытойв) статической б) изолированнойг) открытой Процессы, происходящие при постоянной температуре называются: а) адиабатнымив) изобарными б) изотермическимиг) изохорными

Тест по ТЕРМОДИНАМИКЕ (продолжение) При каком изопроцессе работа не совершается? а) при изотермическомв) адиабатном б) изохорномг) изобарном 7. Согласно второму началу термодинамики тепловые процессы: а) обратимыв) необратимы б) изолированыг) закрыты 8. Какой двигатель не является тепловым? а) паровая турбинав) ракетный двигатель б) водяная турбинаг) дизель 9. Энтропия в термодинамически необратимых процессах: а) возрастаетв) не изменяется б) уменьшатсяг) равна нулю 10. Тепловая смерть Вселенной наступит, если: а) температура всех тел сравняется; б) температура всех тел станет равной нулю; в) температура всех тел будет повышаться; г) температура всех тел будет понижаться.
3. Основные понятия и определения
Основные понятия и определения
Термодинамика – наука о закономерностях превращения
энергии. В термодинамике широко используется понятие
термодинамической системы.
Термодинамической системой называется совокупность
материальных тел, взаимодействующих, как между собой, так
и с окружающей средой.
Все тела находящиеся за пределами границ рассматриваемой
системы называются окружающей средой.
Поскольку одно и тоже тело, одно и тоже вещество при разных
условиях может находится в разных состояниях, (пример: лед –
вода – пар , одно вещество при разной температуре) вводятся,
для удобства, характеристики состояния вещества – так
называемые параметры состояния.
4. Перечислим основные параметры состояния вещества:
Соотношение для перехода от градусов Цельсия к градусам Кельвина:
T [K] = t [°C] + 273.15
где: T - температура в Кельвинах, t – температура в градусах Цельсия.
Соотношение между единицами:
1 бар = 105 Па
1 кг/см2 (атмосфера) = 9.8067×104 Па
1мм рт. ст. (миллиметр ртутного столба) = 133 Па
1 мм вод. ст. (миллиметр водного столба) = 9.8067 Па
Плотность – отношение массы вещества к объему занимаемому эти
веществом.
Удельный объем - величина обратная плотности т.е. отношения объема
занятого веществом к его массе.
5. Термодинамические процессы
Если в термодинамической системе меняется хотя бы один из
параметров любого входящего в систему тела, то в системе
происходит термодинамический процесс.
Основные термодинамические параметры состояния Р, V, Т
однородного тела зависят один от другого и взаимно связаны
уравнением состояния: F (P, V, Т). Для идеального газа уравнение
состояния записывается в виде:
P×v=R×T
где: P - давление; v – удельный объем; T – температура; R –
газовая постоянная (у каждого газа свое значение).
Если известно уравнение состояния, то для определения
состояния простейших систем достаточно знать две независимые
переменные из трех Р = f1 (v, т); v = f2 (Р, Т); Т = f3 (v, Р)
5
Изохорный
Рассмотрим термодинамическую систему, состоящую из
одного тела – какого либо газа в сосуде с поршнем, причем
сосуд и поршень в данном случае является внешней
средой. Пусть, для примера, происходит нагрев газа в
сосуде, возможны два случая: если поршень зафиксирован
и объем не меняется, то произойдет повышение давления
в сосуде. Такой процесс называется изохорным (v=const),
идущий при постоянном объеме.
Изохорные процессы в P – T координатах (v1>v2>v3).
Изобарный
eсли поршень свободен то нагреваемый газ будет
расширятся при постоянном давлении такой процесс
называется изобарным (P=const), идущим при
постоянном давлении.
Изобарные процессы в v – T координатах P1>P2>P3
Изотермический
Если, перемещая поршень, изменять объем газа в сосуде то,
температура газа тоже будет изменяться, однако можно
охлаждая сосуд при сжатии газа и нагревая при расширении
можно достичь того, что температура будет постоянной при
изменениях объема и давления, такой процесс называется
изотермическим (Т=const).
Изотермические процессы в P – v координатах T1>T2>T3
Адиабатический
Процесс, при котором отсутствует теплообмен между системой
и окружающей средой, называется адиабатным, при этом
количество теплоты в системе остается постоянными
(Q=const). Адиабатический процесс - это такое изменение
состояний газа, при котором он не отдает и не поглощает извне
теплоты. Следовательно, адиабатический процесс
характеризуется отсутствием теплообмена газа с окружающей
средой. Адиабатическими можно считать быстро протекающие
процессы.
10. Внутренняя энергия
Сумма кинетических энергий хаотического движения всех
частиц тела относительно центра масс тела (молекул, атомов) и
потенциальных энергий их взаимодействия друг с другом
называется внутренней энергией.
U W k W p
Кинетическая энергия частиц определяется скоростью, а значит
- температурой тела.
Потенциальная - расстоянием между частицами, а значит объемом.
Следовательно: U=U(T,V) - внутренняя энергия зависит от
объема и температуры.
11. Внутренняя энергия одноатомного идеального газа
Для идеального газа: U=U(T), т.к. взаимодействием на расстоянии
пренебрегаем
3
3m
3m
3
3
U NE N kT
N A kT
RT RT pV
2
2M
2M
2
2
Внутренняя энергия одноатомного идеального газа:
3
U RT
2
или
3
U pV
2
12. Способы изменения внутренней энергии
Совершение работы (А)
над телом
( U увелич.)
самим телом
(U уменьш.)
Теплопередача (Q)
Виды теплопередачи:
теплопроводность
конвекция
излучение
13. Работа в термодинамике
Работа газа:
A F s cos F , d
p s h p V
По третьему закону Ньютона:
Работа внешних сил над газом:
F F
A A p V
14. Геометрический смысл работы
Работа численно равна
площади под графиком
процесса на диаграмме
(p, V).
Величина работы зависит от того, каким путем совершался
переход из начального состояния в конечное.
15. Работа газа
16. Количество теплоты
Q = cm(t02-t01) – нагревание (охлаждение)
Q= m - плавление (отвердевание)
Q = Lm - парообразование (конденсация)
Q = qm – сгорание топлива
17. Первый закон термодинамики
Обмен энергией между термодинамической
системой и окружающими телами в результате
теплообмена и совершаемой работы
18. Первый закон термодинамики
Изменение внутренней энергии системы при переходе
ее из одного состояния в другое равно сумме работы
внешних сил и количества теплоты, переданного
системе:
U Q A
Если А - работа внешних сил, а А' - работа газа, то
А = - А' (в соответствии с 3-м законом Ньютона). Тогда:
Q U A
19. Энтальпия
Энтальпия это сумма внутренней энергии тела и произведения
давления на объем.
I = U + PV
где: I – энтальпия; U –внутрення энергия; P – давление; V объем.
Удельная энтальпия i это отношение энтальпии тела к его
массе. Удельная энтальпия это параметр состояния. Значение
удельной энтальпии пара и воды при определенном давлении и
температуре можно найти в справочнике. Пользуясь этими
данными, можно определить количество теплоты участвующее
в процессе или работу процесса.
19
20. Энтропия
Теплота q не является функцией состояния, количество
теплоты выделившейся или поглотившейся в процессе зависит
от самого процесса. Функцией состояния является энтропия
обозначается S размерность [Дж/К]
dS = dQ/T
где dS – дифференциал энтропии; dQ – дифференциал
теплоты; Т – абсолютная температура;
Удельная энтропия - отношение энтропии тела к его массе.
Удельная энтропия s является справочной величиной. Удельная
энтропия - функция состояния вещества, принимающая для
каждого его состояния определенное значение:
s = f (Р, v, Т) [Дж/(кг x K)]
21. Тепловые двигатели
Машины, преобразующие внутреннюю энергию в
механическую работу, называют тепловыми
двигателями
Тепловые
двигатели
Двигатели
внутреннего
сгорания
Карбюраторные
(внешнее
смесеобразование)
Паровые
двигатели
Дизельные
(внешнее
смесеобразование)
Имя
Турбины
Паровые
Газовые
22. Термодинамический цикл
23. Тепловой двигатель
КПД теплового двигателя
A Q1 Q 2
Q2
1
1
Q1
Q1
Q1
Энергетическая схема тепловой
машины: 1 – нагреватель; 2 –
холодильник; 3 – рабочее тело,
совершающее круговой
процесс.
Кпд реальных двигателей:
турбореактивный - 20 -30%;
карбюраторный - 25 -30%,
дизельный - 35-45%.
24. Идеальная тепловая машина
Идеальная тепловая машина - машина Карно
(Сади Карно, Франция, 1815)
Теорема Карно: кпд реальной
тепловой машины не может быть
больше кпд идеальной машины,
работающей в том же интервале
температур.
Машина работает на идеальном газе.
1 - 2 - при тепловом контакте с
нагревателем газ расширяется
изотермически.
2 -3 - газ расширяется адиобатно.
После контакта с холодильником:
3 -4 - изотермическое сжатие.
4 -1 - адиабатное сжатие.
КПД идеальной машины:
T1 T2
T2
1
T1
T1
25. Цикл Карно
Удельную энтропию можно применять совместно с одним из
основных параметров для графического изображения процессов.
Аналогично тому как мы строили изменение объема в зависимости
от изменения температуры мы можем изобразить некоторый
процесс изменения энтропии и температуры в Т- S координатах. В
этом случае любая точка на графической плоскости соответствует
определенному состоянию рабочего тела, а линия от точки 1 до
точки 2 отображает некий термодинамический процесс.
Особенностью Т- S координат является то, что площадь под
линией процесса соответствует количеству энергии отданной или
полученной рабочим телом. Т – S диаграмма цикла Карно.
На данной диаграмме представлен некий замкнутый цикл. Система последовательно
переходит из точки 1 в 2 затем 3, 4 и снова в 1. Из графика видно, что процесс 1 => 2
является изотермическим (происходит при Т1 = const) и процесс 3 => 4, также является
изотермическим (происходит при T2=const). Процессы 2 => 3 и 4 => 1 являются
адиабатными, поскольку в них не происходит изменение энтропии то dS = 0,
следовательно dQ = 0 или Q = const. Причем в процессе 2 => 3 происходит охлаждение
рабочего тела за счет совершения работы телом, а в процессе 4 => 2 происходит нагрев
рабочего тела, за счет совершения работы над телом.
Количество тепла подводимое к системе: Q1 = T1 × (S2-S1) - площадь прямоугольника 12-S2-S1-1 (вся область закрашенная голубым и зеленым).
Количество тепла отдаваемое системой: Q2 = T2 × (S2-S1) площадь прямоугольника 3-S2S1-4-3 (область закрашенная голубым цветом).
Работа цикла - разность подведенной и отведенной теплоты: L = Q1 - Q2 (область
закрашенная зеленым).
КПД цикла:
27. Второй закон термодинамики
Второй з-н термодинамики указывает направление возможных
энергетических превращений и тем самым выражает
необратимость процессов в природе.
Формулировка Р. Клаузиуса: невозможно перевести тепло от более
холодной системы к более горячей при отсутствии одновременных
изменений в обеих системах или окружающих телах.
Формулировка У. Кельвина: невозможно осуществить такой
периодический процесс, единственным результатом которого
было бы получение работы за счет теплоты, взятой от одного
источника.
Невозможен тепловой вечный двигатель второго рода, т.е.
двигатель, совершающий механическую работу за счет
охлаждения какого-либо одного тела.
28. Процессы, запрещаемые 1 законом термодинамики
Циклически работающие тепловые машины, запрещаемые
первым законом термодинамики: 1 – вечный двигатель 1 рода,
совершающий работу без потребления энергии извне; 2 –
тепловая машина с коэффициентом полезного действия η > 1
29. Процессы, запрещаемые 2 законом термодинамики
Процессы, не противоречащие первому закону термодинамики,
но запрещаемые вторым законом: 1 – вечный двигатель второго
рода; 2 – самопроизвольный переход тепла от холодного тела к
более теплому (идеальная холодильная машина)
30. Закон Дюлонга-Пти
Закон Дюлонга-Пти (Закон постоянства теплоёмкости) —
эмпирический закон, согласно которому молярная теплоёмкость
твёрдых тел при комнатной температуре близка к 3R:
Cv = 3R
где R — универсальная газовая постоянная.
Закон выводится в предположении, что кристаллическая решетка
тела состоит из атомов, каждый из которых совершает
гармонические колебания в трех направлениях, определяемыми
структурой решетки, причем колебания по различным направлениям
абсолютно независимы друг от друга. При этом получается, что
каждый атом представляет три осциллятора с энергией E,
определяемой следующей формулой:
E = kT
Формула вытекает из теоремы о равнораспределении
энергии по степеням свободы. Так как каждый
осциллятор имеет одну степень свободы, то его
средняя кинетическая энергия равна K = kT/2, а так
как колебания происходят гармонически, то средняя
потенциальная энергия равна средней кинетической,
а полная энергия - соответственно их сумме. Число
осцилляторов в одном моле вещества составляет 3Na
, их суммарная энергия численно равна
теплоемкости тела - отсюда и вытекает закон
Дюлонга-Пти.

№ слайда 1
Основы термодинамики Урок физики в 10 классе

№ слайда 2
Сформировать основные понятия термодинамикиСформулировать первый закон термодинамикиРассмотреть принцип действия тепловых двигателей и их КПДВыявить отрицательное воздействие тепловых двигателей на окружающую среду и наметить пути решения этой проблемы

№ слайда 3
Внутренняя энергияРабота в термодинамикеКоличество теплотыПервый закон термодинамикиПринцип действия тепловых двигателей. КПД_________Термодинамика – теория тепловых процессов, в которой не учитывается молекулярное строение тел.

№ слайда 4
Определение:Внутренняя энергия тела – это сумма кинетической энергии хаотического теплового движения частиц (атомов и молекул) тела и потенциальной энергии их взаимодействияОбозначение: UЕдиницы измерения: [Дж]
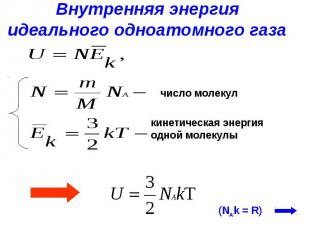
№ слайда 5
Внутренняя энергияидеального одноатомного газа число молекул кинетическая энергия одной молекулы

№ слайда 6
Внутренняя энергияидеального одноатомного газа

№ слайда 7
Внутренняя энергияидеального двухатомного газа

№ слайда 8
Так как- уравнение Клапейрона – Менделеева, то внутренняя энергия: - для одноатомного газа

№ слайда 9
В общем виде: где i – число степеней свободы молекул газа (i = 3 для одноатомного газа и i = 5 для двухатомного газа)
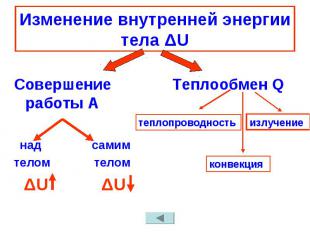
№ слайда 10
Изменение внутренней энергии тела ΔU Совершение работы А над самимтелом телом ΔU ΔU Теплообмен Q

№ слайда 11
Работа в термодинамике Работа газа:Работа внешних сил:

№ слайда 12
Работа газа при изопроцессах При изохорном процессе (V=const): ΔV = 0 работа газом не совершается:
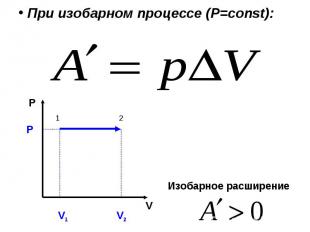
№ слайда 13
При изобарном процессе (Р=const): Изобарное расширение
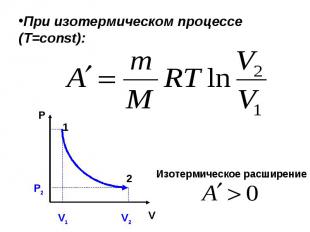
№ слайда 14
При изотермическом процессе (Т=const): Изотермическое расширение
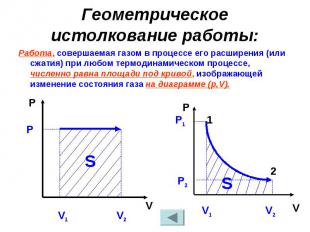
№ слайда 15
Геометрическое истолкование работы: Работа, совершаемая газом в процессе его расширения (или сжатия) при любом термодинамическом процессе, численно равна площади под кривой, изображающей изменение состояния газа на диаграмме (р,V).

№ слайда 16
Количество теплоты – часть внутренней энергии, которую тело получает или теряет при теплопередаче

№ слайда 17
Первый закон термодинамики Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе Количество теплоты, переданное системе, идёт на изменение её внутренней энергии и на совершение системой работы над внешними телами

№ слайда 18
Применение первого закона термодинамики к различным процессам
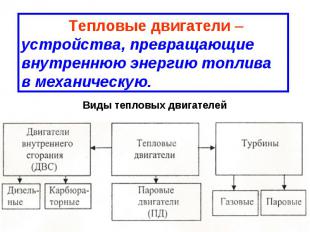
№ слайда 19
Тепловые двигатели – устройства, превращающие внутреннюю энергию топлива в механическую. Виды тепловых двигателей
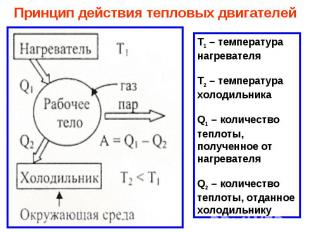
№ слайда 20
Принцип действия тепловых двигателей Т1 – температура нагревателяТ2 – температура холодильникаQ1 – количество теплоты, полученное от нагревателяQ2 – количество теплоты, отданное холодильнику

№ слайда 21
Коэффициент полезного действия (КПД) теплового двигателя – отношение работы А’, совершаемой двигателем, к количеству теплоты, полученному от нагревателя:

№ слайда 22
работа, совершаемая двигателем КПД всегда меньше единицы, так как у всех двигателей некоторое количество теплотыпередаётся холодильнику двигатель не может работать

№ слайда 23
Максимальное значение КПД тепловых двигателей (цикл Карно):

№ слайда 24
Отрицательные последствия использования тепловых двигателей:Потепление климатаЗагрязнение атмосферыУменьшение кислорода в атмосфереРешение проблемы: Вместо горючего использовать сжиженный газ. Бензин заменить водородом.Электромобили.Дизели.На тепловых электростанциях использовать скрубберы, в которых сера связывается с известью.Сжигание угля в кипящем слое.

№ слайда 25
Читайте также:

