Общая характеристика металлов кратко
Обновлено: 05.07.2024
Металлы – это химические элементы, атомы которых легко отдают электроны внешнего (а некоторые и предвнешнего) электронного слоя, превращаясь в положительные ионы.
Типичными металлами являются щелочные и щелочноземельные металлы, которые характеризуются небольшим (1-2) числом электронов на внешнем уровне их атомов и легкостью потери электронов, что отражает низкие значения электроотрицательности.
Алюминий, галлий, бериллий, германий, олово, свинец и сурьма проявляют уже амфотерные (то есть металлические и неметаллические – металлоидные) свойства. Подобное поведение характерно и для большинства элементов побочных подгрупп.
Для атомов металлов характерны небольшие значения электроотрицательности (от 0,7-1,9) и исключительно восстановительные свойства, то есть способность отдавать электроны.
В главных подгруппах периодической системы металлы находятся ниже диагонали бор-астат, а также в побочных подгруппах. В периодах и главных подгруппах действуют закономерности в изменении металлических, а значит, восстановительных свойств элементов.
Физические свойства:
Все металлы – твердые вещества (кроме ртути, которая при обычных условиях жидкая); вид связи – металлическая; обладают характерным металлическим блеском. Валентные электроны слабо связаны с конкретным атомом и в кристалле металла существует так называемый электронный газ. Поэтому все металлы обладают высокой электропроводностью (то есть они – проводники), особенно медь, серебро, золото, ртуть и алюминий; высока и теплопроводность металлов. Многие металлы обладают пластичностью (например, олово, алюминий), ковкостью.
Химические свойства:
Восстановительная способность. Щелочные металлы на воздухе сразу окисляются (даже самовоспламеняются), поэтому их хранят под слоем керосина или парафина. При окислении щелочных металлов, как правило, образуются не оксиды, а пероксиды металлов:
Другие металлы окисляются медленно при обычной температуре или при нагревании с образованием оксидов:
4Al + 3O2 = 2Al2O3
Серебро, золото и платина не окисляются даже при нагревании. Металлы взаимодействуют при тех или иных условиях с неметаллами:
Взаимодействие с водой. Активные щелочные и щелочно-земельные металлы с водой реагируют очень бурно с выделением водорода и образованием щелочи:
2Na + 2HOH = 2NaOH + H2
Менее активные металлы вытесняют водород из воды при нагревании. Металлы, стоящие в электрохимическом ряду напряжений металлов за водородом, с водой не взаимодействуют. - взаимодействие с кислотами. Металлы, находящиеся в ряду напряжений левее водорода вытесняют водород из растворов соляной и разбавленной серной кислот:
Zn + HCl = ZnCl2 + H2
При взаимодействии металлов с азотной и концентрированной серной кислотами водород никогда не выделяется. В зависимости от активности металла, степени концентрации кислоты и условий проведения реакции эти кислоты могут восстанавливаться до соединений, имеющих различную степень окисления.
При взаимодействии металлов (в зависимости от активности металла) с концентрированной H2SO4продуктами восстановления серной кислоты могут быть: SO2, S, H2S. Железо пассивируется.
Со щелочами могут реагировать металлы, оксиды и гидроксиды которых амфотерны (Zn, Al, Sn). При этом выделяется водород:
Zn + 2NaOH = Na2ZnO2 + H2
или более точная запись:
Zn + 2NaOH + H2O = Na2[Zn(OH)4] + H2
При взаимодействии металлов с азотной кислотой водород не выделяется, происходит восстановление N+5. B зависимости от активности металла и степени разбавления HNO3, продуктами могут быть: NO2, NO, N2O, N2, NH4NO3.
Взаимодействие с солями. При взаимодействии с водными растворами солей металлы, находящиеся в электрохимическом ряду напряжений металлов левее, восстанавливают металлы, находящиеся в этом ряду правее от них:
Fe + CuSO4 = Cu↓ + FeSO4
Металлы с сильными восстановительными свойствами (Li, Na, K, Ca и др ) в этих условиях будут восстанавливать водород воды, а не металл соответствующей соли.
Способы получения металлов:
Пирометаллурия – получение металлов из руд с помощью реакций восстановления, проводимых при высоких температурах.
2ZnS + 3O2 = 2ZnO + 2SO2↑
Восстановление углем (коксом) – проводят если металл совсем не образует карбидов или образует непрочные карбиды:

Cu2O + C = 2Cu + CO↑
Восстановление металла водородом (применяется в промышленных масштабах):
MoO3 + 3H2 = Mo + 3H2O
Металлотермия, например алюмотермия:
Cr2O3 + 2Al = Al2O3 + 2Cr
Гидрометаллургия (получение металлов из растворов их солей):
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + Fe = Cu + FeSO4
Электрометаллургия – электролиз – окислительно-восстановительный процесс протекающий при прохождении электрического тока через раствор или расплав электролита:
2NaCl → 2Na + Cl2↑
Металлы – это химические элементы, атомы которых легко отдают электроны внешнего (а некоторые и предвнешнего) электронного слоя, превращаясь в положительные ионы.
Типичными металлами являются щелочные и щелочноземельные металлы, которые характеризуются небольшим (1-2) числом электронов на внешнем уровне их атомов и легкостью потери электронов, что отражает низкие значения электроотрицательности.
Алюминий, галлий, бериллий, германий, олово, свинец и сурьма проявляют уже амфотерные (то есть металлические и неметаллические – металлоидные) свойства. Подобное поведение характерно и для большинства элементов побочных подгрупп.
Для атомов металлов характерны небольшие значения электроотрицательности (от 0,7-1,9) и исключительно восстановительные свойства, то есть способность отдавать электроны.
В главных подгруппах периодической системы металлы находятся ниже диагонали бор-астат, а также в побочных подгруппах. В периодах и главных подгруппах действуют закономерности в изменении металлических, а значит, восстановительных свойств элементов.
Физические свойства:
Все металлы – твердые вещества (кроме ртути, которая при обычных условиях жидкая); вид связи – металлическая; обладают характерным металлическим блеском. Валентные электроны слабо связаны с конкретным атомом и в кристалле металла существует так называемый электронный газ. Поэтому все металлы обладают высокой электропроводностью (то есть они – проводники), особенно медь, серебро, золото, ртуть и алюминий; высока и теплопроводность металлов. Многие металлы обладают пластичностью (например, олово, алюминий), ковкостью.
Химические свойства:
Восстановительная способность. Щелочные металлы на воздухе сразу окисляются (даже самовоспламеняются), поэтому их хранят под слоем керосина или парафина. При окислении щелочных металлов, как правило, образуются не оксиды, а пероксиды металлов:
Другие металлы окисляются медленно при обычной температуре или при нагревании с образованием оксидов:
4Al + 3O2 = 2Al2O3
Серебро, золото и платина не окисляются даже при нагревании. Металлы взаимодействуют при тех или иных условиях с неметаллами:
Взаимодействие с водой. Активные щелочные и щелочно-земельные металлы с водой реагируют очень бурно с выделением водорода и образованием щелочи:
2Na + 2HOH = 2NaOH + H2
Менее активные металлы вытесняют водород из воды при нагревании. Металлы, стоящие в электрохимическом ряду напряжений металлов за водородом, с водой не взаимодействуют. - взаимодействие с кислотами. Металлы, находящиеся в ряду напряжений левее водорода вытесняют водород из растворов соляной и разбавленной серной кислот:
Zn + HCl = ZnCl2 + H2
При взаимодействии металлов с азотной и концентрированной серной кислотами водород никогда не выделяется. В зависимости от активности металла, степени концентрации кислоты и условий проведения реакции эти кислоты могут восстанавливаться до соединений, имеющих различную степень окисления.
При взаимодействии металлов (в зависимости от активности металла) с концентрированной H2SO4продуктами восстановления серной кислоты могут быть: SO2, S, H2S. Железо пассивируется.
Со щелочами могут реагировать металлы, оксиды и гидроксиды которых амфотерны (Zn, Al, Sn). При этом выделяется водород:
Zn + 2NaOH = Na2ZnO2 + H2
или более точная запись:
Zn + 2NaOH + H2O = Na2[Zn(OH)4] + H2
При взаимодействии металлов с азотной кислотой водород не выделяется, происходит восстановление N+5. B зависимости от активности металла и степени разбавления HNO3, продуктами могут быть: NO2, NO, N2O, N2, NH4NO3.
Взаимодействие с солями. При взаимодействии с водными растворами солей металлы, находящиеся в электрохимическом ряду напряжений металлов левее, восстанавливают металлы, находящиеся в этом ряду правее от них:
Fe + CuSO4 = Cu↓ + FeSO4
Металлы с сильными восстановительными свойствами (Li, Na, K, Ca и др ) в этих условиях будут восстанавливать водород воды, а не металл соответствующей соли.
Способы получения металлов:
Пирометаллурия – получение металлов из руд с помощью реакций восстановления, проводимых при высоких температурах.
2ZnS + 3O2 = 2ZnO + 2SO2↑
Восстановление углем (коксом) – проводят если металл совсем не образует карбидов или образует непрочные карбиды:
Cu2O + C = 2Cu + CO↑
Восстановление металла водородом (применяется в промышленных масштабах):
MoO3 + 3H2 = Mo + 3H2O
Металлотермия, например алюмотермия:
Cr2O3 + 2Al = Al2O3 + 2Cr
Гидрометаллургия (получение металлов из растворов их солей):
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + Fe = Cu + FeSO4
Электрометаллургия – электролиз – окислительно-восстановительный процесс протекающий при прохождении электрического тока через раствор или расплав электролита:
2NaCl → 2Na + Cl2↑
Из \(118\) известных на данный момент химических элементов \(96\) образуют простые вещества с металлическими свойствами, поэтому их называют металлическими элементами .
Металлические химические элементы в природе могут встречаться как в виде простых веществ, так и в виде соединений. То, в каком виде встречаются металлические элементы в природе, зависит от химической активности образуемых ими металлов.
Металлические элементы, образующие химически активные металлы ( Li–Mg ), в природе чаще всего встречаются в виде солей (хлоридов, фторидов, сульфатов, фосфатов и других).
Соли, образуемые этими металлами, являются главной составной частью распространённых в земной коре минералов и горных пород.


В растворённом виде соли натрия, кальция и магния содержатся в природных водах. Кроме того, соли активных металлов — важная составная часть живых организмов. Например, фосфат кальция Ca 3 ( P O 4 ) 2 является главной минеральной составной частью костной ткани.
Металлические химические элементы, образующие металлы средней активности ( Al–Pb ), в природе чаще всего встречаются в виде оксидов и сульфидов.


Металлические элементы, образующие химически неактивные металлы ( Cu–Au ), в природе чаще всего встречаются в виде простых веществ.
 |  |  |
| Рис. \(7\). Самородное золото Au | Рис. \(8\). Самородное серебро Ag | Рис. \(9\). Самородная платина Pt |
Исключение составляют медь и ртуть, которые в природе встречаются также в виде химических соединений.

В Периодической системе химических элементов металлы занимают левый нижний угол и находятся в главных (А) и побочных (Б) группах.
Рис. \(13\). Положение металлов в Периодической системе. Знаки металлических химических элементов расположены ниже ломаной линии B — Si — As — Te
В электронной оболочке атомов металлов на внешнем энергетическом уровне, как правило, содержится от \(1\) до \(3\) электронов. Исключение составляют только металлы \(IV\)А, \(V\)А и \(VI\)А группы, у которых на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
Радиусы атомов металлов больше, чем у атомов неметаллов того же периода. В силу отдалённости положительно заряженного ядра атомы металлов слабо удерживают свои валентные электроны (электроны внешнего энергетического уровня).
Рис. \(14\). Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов металлов существенно больше, чем радиусы атомов неметаллов, находящихся в том же периоде
Главное отличительное свойство металлов — это их сравнительно невысокая электроотрицательность (ЭО) по сравнению с неметаллами.

Рис. \(15\). Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО металлических химических элементов уступает соответствующей величине неметаллических химических элементов
Атомы металлов, вступая в химические реакции, способны только отдавать электроны, то есть окисляться, следовательно, в ходе превращений могут проявлять себя в качестве восстановителей .

К металлам относится большая часть элементов периодической системы – 82 химических элементов. Какими свойствами они обладают, и чем отличаются от неметаллов?
Общая характеристика
Металлами называют группу элементов, в виде простых веществ, которые обладают металлическими свойствами (пластичность, ковкость, блеск, электронная проводимость и т. д.)
Основное отличие элементов-металлов – они обладают только восстановительными свойствами, а в реакциях могут только окисляться. В соединениях они могут иметь только положительные степени окисления как в элементарных положительно заряженных ионах, так и в сложных ионах, где они образуют положительные центры.
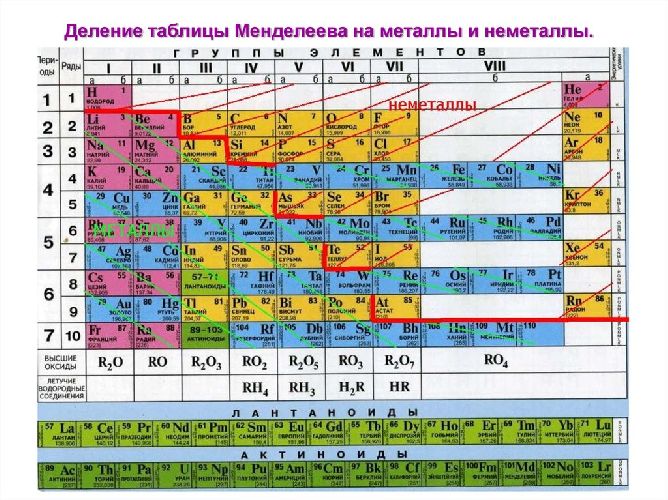
Рис. 1. Список металлов.
Как правило, на внешнем уровне элементов металлов находится небольшое число электронов (1-3), значения электроотрицательности невысокие. К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов. Образующиеся положительные ионы устойчивы, так как имеют завершенную внешнюю электронную оболочку.
Физические и химические свойства
Все металлы, кроме ртути, при нормальных условиях в виде простых веществ находятся в твердом агрегатном состоянии и образуют металлическую кристаллическую решетку.

Рис. 2. Металлы в таблице Д.И. Менделеева.
В следующей таблицы представлены группы основных металлов:
| Группа металлов | Металл |
| Щелочные | литий, натрий, калий и т.д. |
| Щелочноземельные | кальций, стронций, барий и т.д. |
| Переходные | уран, титан, железо, платина и т.д. |
| постпереходные | алюминий, свинец, олово и т.д. |
| Тугоплавкие | молибден, вольфрам |
| Цветные | медь, титан, магний и т.д. |
| Благородные | золото, серебро и т.д. |
Металлы пластичны и ковки, особенно если на внешнем электронном уровне атомов по одному электрону: слои атомов перемещаются относительно друг друга без разрушения кристаллической решетки (щелочные металлы, медь, серебро, золото). В атомах непластичных хрупких металлов хрома и марганца – большое число валентных электронов.
Плотность, твердость, температура плавления металлов изменяются в широком диапазоне и зависят от атомной массы, строения атома и геометрии кристаллической решетки. Самый легкий металл – литий (плотность 0,53 г/см 3 ), самый тяжелый – осмий (плотность 22,5 г/см 3 ). Металлы с плотностью больше 5 г/см 3 относят к тяжелым, меньше 5 г/см 3 – к легким металлам.
Самая низкая температура плавления у ртути (-39 градусов по Цельсию), самый тугоплавкий металл – вольфрам (температура плавления 3410 градусов по Цельсию.) Энергия атомизации вольфрама составляет 836 кДж/моль, а температура кипения его 5930 градусов.
Металлы вступают в реакцию как с простыми, так и со сложными веществами. Как типичные восстановители металлы реагируют почти со всеми неметаллами-окислителями (кислород, сера, азот и т. д.):
Также металлы реагируют с такими сложными веществами, как оксиды и гидроксиды, разбавленные растворы кислот, с растворенными в воде щелочами.
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются; в пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают

Рис. 3. Металлы главных подгрупп.
Нахождение металлов и способы их получения
Самый распространенный на земле элемент-металл – алюминий. За ним следуют железо, кальций, натрий.
Некоторые металлы встречаются в природе в самородном состоянии (золото, ртуть, платина), но в основном они находятся в природе в виде оксидов и солей.
Получение металлов происходит с помощью металлургии (получение из руд), пирометаллургии (получение с помощью реакции восстановления при высокой температуре), гидрометаллургии (извлечение из руд в виде растворимых соединений), электрометаллургии (получение металлов электролизом расплавов и растворов их соединений).
Что мы узнали?
Металлы – вещества, которые обладают высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В данной статье по химии 9 класса рассматриваются их физические и химические свойства, формулы класса металлов, а также способы получения.

Металлы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Из 118 химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
- 6 элементов в группе щелочных металлов,
- 6 в группе щёлочноземельных металлов,
- 38 в группе переходных металлов,
- 11 в группе лёгких металлов,
- 7 в группе полуметаллов,
- 14 в группе лантаноиды + лантан,
- 14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний,
- вне определённых групп бериллий и магний.
- Металлический блеск (характерен не только для металлов: его имеют и неметаллы иод и углерод в виде графита)
- Хорошая электропроводность
- Возможность лёгкой механической обработки
- Высокая плотность (обычно металлы тяжелее неметаллов)
- Высокая температура плавления (исключения: ртуть, галлий и щелочные металлы)
- Большая теплопроводность
- В реакциях чаще всего являются восстановителями.
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже приводится твёрдость некоторых металлов по шкале Мооса.
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы такие как золото, серебро, свинец, алюминий, осмий могут срастаться между собой, но на это может уйти десятки лет.
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
- С кислородом реагируют все металлы, кроме золота, платины. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:

оксид лития

пероксид натрия

надпероксид калия




- С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:



- С серой реагируют все металлы, кроме золота и платины:

- С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:


- С углеродом реагируют только наиболее активные металлы. При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.


Взаимодействие неокисляющих кислот с металлами, стоящими в электрическом ряду активности металлов до водорода














Читайте также:

