Образование разрушение и выведение продуктов обмена гемоглобина физиология кратко
Обновлено: 19.05.2024
Гемоглобин, освобождаемый из эритроцитов, сразу же связывается с гаптоглобином, белком плазмы крови (α2-глобулин), одна молекула которого может связывать две молекулы Hb. Образующийся комплекс адсорбируется ретикулоэндотелиальной системой (РЭС) из циркулирующей в печени, селезёнке, костном мозге и других органах крови.
Образовавшийся в клетках РЭС токсичный непрямой билирубин, будучи связанным с альбумином, током крови переносится в печень, где отделяется от
Выделение желчных пигментов.
Вместе с желчью прямой билирубин попадает в кишечник, где подвергается дальнейшим превращениям под действием бактерий (слайд №3). Сначала глюкуроновая кислота отщепляется от комплекса с билирубином, и освободившийся билирубин подвергается восстановлению в мезобилирубин, затем в мезобилиноген (уробилиноген) и стеркобилиноген, последний выводится с калом. В сутки человек выделяет от 250 до 300 мг стеркобилиногена, который легко окисляется под действием света и воздуха до стеркобилина. Лишь небольшая часть билирубина (от 5 до 20 мг) выводится с калом в неизменном виде.
Известно, что небольшая часть желчных пигментов (мезобилиноген и образующийся из него при окислении мезобилин) может всасываться в тонком кишечнике в кровь и по системе портальной вены возвращаются в печень с венозной кровью (энтерогепатическая циркуляция). В этом случае токсичный мезобилиноген обезвреживается гепатоцитами, распадаясь до три-, ди- и монопирролов, которые выводятся из организма с калом и мочой. Задержка в печени мезобилиногена (уробилиногена) и превращение его в дипиррольные соединения исключает возможность поступления его в норме в общий ток кровообращения и, следовательно, в мочу. Таким образом, моча здорового человека не содержит уробилиногена (слайд №4). Если же с мочой выделяется повышенное содержание уробилиногена (точнее мезобилиногена), то это является свидетельством недостаточности функции печени, например, при печёночной или гемолитической желтухаха, когда печень частично теряет способность извлекать этот пигмент из крови воротной вены. Небольшая часть стеркобилиногена (до 5%) после всасывания через систему нижних геморроидальных вен попадает в большой круг кровообращения, минуя печень, и в таком виде выводится почками с мочой (около 4 мг в сутки). Иногда ошибочно стеркобилиноген мочи называют уробилиногеном.
Из различных хромопротеинов наибольшее значение имеет гемоглобин. Поступающий с пищей гемоглобин в желудочно-кишечном тракте распадается на составные части – глобин и гем. Глобин как белок, гидролизуется на аминокислоты. Гем окисляется в гематин и выводится с калом. Таким образом, гемоглобин пищи не участвует в интенсивном метаболизме эндогенного гемоглобина. Уровень метаболизма эндогенного гемоглобина определяется тем, что период жизни эритроцита равен 126 дней, т.е. ежечасно обновляется примерно 6*10 9 эритроцитов, а, следовательно, и гемоглобина.
Строение гемоглобина. Гемоглобин в качестве белкового компонента содержит глобин, а небелкового – гем. Видовые различия гемоглобина обусловлены глобином, в то время как гем одинаков у всех видов гемоглобина.
Основу структуры простетической группы большинства гемосодержащих белков составляет порфириновое кольцо, являющееся в свою очередь производным тетрапиррольного соединения – порфирина. Последний состоит из четырех замещенных пирролов, соединенных между собой метиновыми мостиками (—СН=).
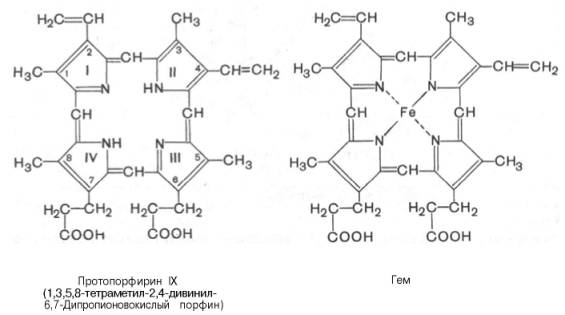
Незамещенный порфирин называется порфином. В молекуле гема порфин представлен в виде протопорфирина IX, содержащего четыре метильные группы (—СН3), две винильные группы (—СН=СН2) и два остатка пропионовой кислоты. Протопорфирин, присоединяя железо, превращается в гем.
Из формулы видно, что железо связано с двумя атомами азота молекулы протопорфирина ковалентно и с двумя другими – координационными связями, обозначенными пунктирными линиями.
Гем в виде гемпорфирина является простетической группой не только гемоглобина и его производных, но и миоглобина, каталазы, пероксидазы и цитохромов b, с и c1.
Структурная организация гемоглобина (и миоглобина) была расшифрована Дж. Кендрью и М. Перутц (Нобелевская премия 1962 г.). Дыхательная функция гемоглобина крови подробно рассматривается в курсе физиологии. Здесь следует указать на уникальную роль гемоглобина в траспорте кислорода от легких к тканям и диоксида углерода от тканей к легким. Это элементарное проявление жизни – дыхание, хотя и выглядит простым, основано на взаимодействии многих типов атомов в гигантской молекуле гемоглобина. Подсчитано, что в одном эритроците содержится около 340000000 молекул гемоглобина, каждая из которых состоит примерно из 10 3 атомов С, Н, О, N, S и 4 атомов железа.
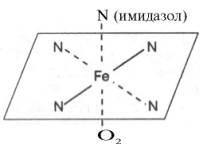
Рисунок 31 Координационные связи атома железа в молекуле гема. Все 4 связи с атомами азота пиррольных колец расположены в одной плоскости, 5-я и 6-я координационные связи (с атомом азота имидазольного кольца гистидина и с кислородом соответственно) – по разные стороны перпендикулярно к этой плоскости
В дополнение к основному гемоглобину HbA1в крови взрослого человека доказано существование мигрирующего с меньшей скоростью при электрофорезе гемоглобина НbА2, также состоящего из 4 субъединиц: двух α-цепей и двух δ-цепей. На долю НbА2 приходится около 2,5% от всего гемоглобина. Известен, кроме того, фетальный гемоглобин (гемоглобин новорожденных), обозначаемый HbF и состоящий из двух α-цепей и двух γ-цепей. Фетальный гемоглобин отличается от HbA1не только составом аминокислот, но и физико-химическими свойствами: спектральным показателем, электрофоретической подвижностью, устойчивостью к щелочной денатурации и др. Кровь новорожденного содержит до 80% HbF, но к концу 1-го года жизни он почти целиком заменяется на НbА (все же в крови взрослого человека открывается до 1,5% HbF от общего количества гемоглобина). Последовательность аминокислот в γ- и δ-цепях гемоглобинов окончательно не расшифрована.

Обмен гемоглобина. Как синтез, так и распад гемоглобина происходит в селезенке, печени, косном мозге.
Распад гемоглобина начинается с окисления гема, когда железо Fе 2+ превращается в Fе 3+ . Образующееся соединение называется вердоглобином (вещество зеленого цвета), который спонтанно распадается на составные части – глобин, железо и оставшаяся часть гема – биливердин (пигмент зеленого цвета). Биливердин восстанавливается в желто-красный билирубин, который поступает в печень. Для организма билирубин является токсичным и водонерастворимым. Поэтому в местах его образования происходит его обезвреживание и превращение в водорастворимую форму. Этот процесс происходит двумя путями:
1 С помощью глюкуроновой кислоты с которой билирубин образует моно- или диглюкурониды, комплекс билирубина с одной или двумя молекулами глюкуроновой кислоты. Такой билирубин является связанным (в лабораторной практике – прямой билирубин).
2 Образование комплекса с альбумином. В этом случае билирубин называют свободным (непрямым).
В крови содержится около 75% свободного билирубина и 25% связанного.
В печени комплекс билирубина с белками распадается, и освободившийся билирубин превращается в глюкуронид. В печени весь билирубин присутствует в форме связанной с глюкуроновой кислотой, т.е. в нетоксичной и водорастворимой форме. Из печени билирубин поступает в желчный пузырь, откуда под влиянием желчного пигмента поступает в кишечник. Там билирубин освобождается от глюкуроновой кислоты и подвергается различным превращениям с образованием в конце уробилиногена и стеркобилиногена. Первый всасывается в кровь, затем в печень, откуда поступает в мочу. На воздухе уробилиноген окисляется в уробилин. Второй выводится с калом (специфическая окраска) и кислородом окисляется до стрекобилина.
Синтез гемоглобина состоит из двух процессов:
1 синтез гема из глицина, янтарной кислоты и железа.
2 конденсация с глобином
N N оксимиооглобин
Гемоглобин состоит из четырех полипептидных цепей, аналогичных по строению миоглобину.
Оксигемоглобин выполняет функцию транспорта кислорода. Благодаря ему, литр крови переносит 250 мл кислорода в различные органы. Здесь оксигемоглобин отдает кислород, который диффундируют через плазму и стенки капилляров в ткани.
ННbСО ННb ННb О2
карбокигемоглобин Н2О оксигемоглобин
Анион анион анион
карбаминогемоглобина гемоглобина оксигемоглобина
Из многообразия производных гемоглобина, следует, прежде всего, указать на оксигемоглобин НbО2 – соединение молекулярного кислорода с гемоглобином. Кислород присоединяется к каждому гему молекулы гемоглобина при помощи координационных связей железа, причем присоединение одной молекулы кислорода к тетрамеру облегчает присоединение второй молекулы, затем третьей и т.д. Помимо кислорода, гемоглобин легко соединяется с другими газами, в частности с СО, NO и др. Так, при отравлении оксидом углерода гемоглобин прочно связывается с ним с образованием карбоксигемоглобина (НbСО). При этом вследствие высокого сродства к СО гемоглобин теряет способность связывать кислород и наступает смерть от удушья, недостаточного снабжения тканей кислородом При этом содержание его в крови в 210 раз больше, чем оксигемоглобина, поэтому наступает отравление угарным газом.. Однако при быстром повышении парциального давления кислорода во вдыхаемом воздухе можно добиться частичного вытеснения СО из связи с гемоглобином и предотвратить летальный исход. Норма содержания карбоксигемоглобина – 0,3 – 05%, у курильщиков – 4,7%. При легкой тяжести отравления – 10-15% - головная боль, слабость, тошнота. При средней – 25-30% - нарушение координации, синюшность лица и помутнение сознания. При тяжелых – 60% и более – потеря сознания и смерть.
При отравлении оксидами азота, парами нитробензола и другими соединениями часть гемоглобина окисляется в метгемоглобин (НbОН), содержащий трехвалентное железо. Метгемоглобин также теряет способность к переносу кислорода от легких к тканям, поэтому при метгемоглобинемии (вследствие отравления окислителями) в зависимости от степени отравления может наступить смерть от недостатка кислорода. Если вовремя оказать помощь, т.е. повысить парциальное давление кислорода (вдыхание чистого кислорода), то и в этом случае можно вывести больного из опасного состояния.
Установление первичной структуры субъединиц молекулы гемоглобина стимулировало исследования по расшифровке структуры так называемых аномальных гемоглобинов. В крови человека в общей сложности открыто около 150 различных типов мутантных гемоглобинов. Появляются мутантные формы гемоглобинов в крови вследствие мутации генов. Обычно мутации делят на 3 класса в соответствии с топографией измененного участка молекулы. Если замена аминокислоты происходит на поверхности молекулы гемоглобина, то это мутация первого класса; подобные мутации обычно не сопровождаются развитием тяжелой патологии, и болезнь протекает бессимптомно; исключение составляет серповидно-клеточная анемия. При замене аминокислоты вблизи гема нарушается связывание кислорода – это мутация второго класса, сопровождающаяся развитием болезни. И наконец, если замена происходит во внутреннем участке молекулы гемоглобина, говорят о третьем классе мутации; подобные мутации приводят к нарушению пространственной структуры и соответственно функции гемоглобина.
Аномальные гемоглобины, различающиеся по форме, химическому составу и величине заряда, были выделены при помощи электрофореза и хроматографии. Передающиеся по наследству изменения чаще всего являются результатом мутации единственного триплета, приводящей к замене одной какой-либо аминокислоты в полипептидных цепях молекулы гемоглобина на другую. В большинстве случаев происходит замена кислой аминокислоты на основную или нейтральную. Поскольку это замещение осуществляется в обеих полипептидных цепях одной из пар (α или β), образовавшийся аномальный гемоглобин будет отличаться от нормального величиной заряда и соответственно электрофоретической подвижностью.
Следует указать, что некоторые мутации, вызывающие существенное изменение структуры и соответственно функции гемоглобина, оказываются летальными, и индивидуумы с подобным гемоглобином умирают в раннем возрасте. Однако при ряде мутаций замена аминокислот не вызывает заметного изменения функции гемоглобина, в этих случаях болезнь протекает бессимптомно.
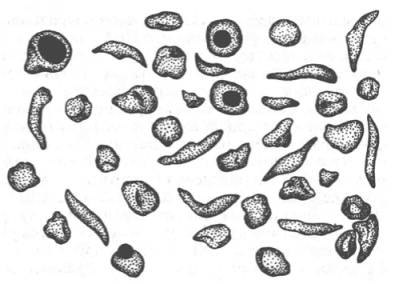
Рисунок 32 -Нормальные и серповидные эритроциты
Классическим примером наследственной гемоглобинопатии является серповидно-клеточная анемия, широко распространенная в странах Южной Америки, Африки и Юго-Восточной Азии. При этой патологии эритроциты в условиях низкого парциального давления кислорода принимают форму серпа (рис. 32). Гемоглобин S, как показали Л. Полинг и др., отличается рядом свойств от нормального гемоглобина: в частности, после отдачи кислорода в тканях он превращается в плохо растворимую дезоксиформу и начинает выпадать в осадок в виде веретенообразных кристаллоидов, названных тактоидами. Болезнь протекает остро, и дети, гомозиготные по мутантному гену, часто умирают в раннем возрасте.
Химический дефект при серповидно-клеточной анемии был раскрыт и сводится к замене единственной аминокислоты, а именно глутаминовой, в 6-м положении с N-конца на валин в β-цепях молекулы гемоглобина HbS. Это результат мутации в молекуле ДНК, кодирующей синтез β-цепи гемоглобина. Все остальные аминокислоты располагаются в той же последовательности и в таком же количестве, как и в нормальном гемоглобине НЬА:
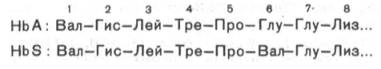
Одной этой замены оказалось достаточно не только для нарушения формы эритроцита, но и для развития тяжелой наследственной болезни – серповидно-клеточной анемии.
Из различных хромопротеинов наибольшее значение имеет гемоглобин. Поступающий с пищей гемоглобин в желудочно-кишечном тракте распадается на составные части – глобин и гем. Глобин как белок, гидролизуется на аминокислоты. Гем окисляется в гематин и выводится с калом. Таким образом, гемоглобин пищи не участвует в интенсивном метаболизме эндогенного гемоглобина. Уровень метаболизма эндогенного гемоглобина определяется тем, что период жизни эритроцита равен 126 дней, т.е. ежечасно обновляется примерно 6*10 9 эритроцитов, а, следовательно, и гемоглобина.
Строение гемоглобина. Гемоглобин в качестве белкового компонента содержит глобин, а небелкового – гем. Видовые различия гемоглобина обусловлены глобином, в то время как гем одинаков у всех видов гемоглобина.
Основу структуры простетической группы большинства гемосодержащих белков составляет порфириновое кольцо, являющееся в свою очередь производным тетрапиррольного соединения – порфирина. Последний состоит из четырех замещенных пирролов, соединенных между собой метиновыми мостиками (—СН=).

Незамещенный порфирин называется порфином. В молекуле гема порфин представлен в виде протопорфирина IX, содержащего четыре метильные группы (—СН3), две винильные группы (—СН=СН2) и два остатка пропионовой кислоты. Протопорфирин, присоединяя железо, превращается в гем.
Из формулы видно, что железо связано с двумя атомами азота молекулы протопорфирина ковалентно и с двумя другими – координационными связями, обозначенными пунктирными линиями.
Гем в виде гемпорфирина является простетической группой не только гемоглобина и его производных, но и миоглобина, каталазы, пероксидазы и цитохромов b, с и c1.
Структурная организация гемоглобина (и миоглобина) была расшифрована Дж. Кендрью и М. Перутц (Нобелевская премия 1962 г.). Дыхательная функция гемоглобина крови подробно рассматривается в курсе физиологии. Здесь следует указать на уникальную роль гемоглобина в траспорте кислорода от легких к тканям и диоксида углерода от тканей к легким. Это элементарное проявление жизни – дыхание, хотя и выглядит простым, основано на взаимодействии многих типов атомов в гигантской молекуле гемоглобина. Подсчитано, что в одном эритроците содержится около 340000000 молекул гемоглобина, каждая из которых состоит примерно из 10 3 атомов С, Н, О, N, S и 4 атомов железа.

Рисунок 31 Координационные связи атома железа в молекуле гема. Все 4 связи с атомами азота пиррольных колец расположены в одной плоскости, 5-я и 6-я координационные связи (с атомом азота имидазольного кольца гистидина и с кислородом соответственно) – по разные стороны перпендикулярно к этой плоскости
В дополнение к основному гемоглобину HbA1в крови взрослого человека доказано существование мигрирующего с меньшей скоростью при электрофорезе гемоглобина НbА2, также состоящего из 4 субъединиц: двух α-цепей и двух δ-цепей. На долю НbА2 приходится около 2,5% от всего гемоглобина. Известен, кроме того, фетальный гемоглобин (гемоглобин новорожденных), обозначаемый HbF и состоящий из двух α-цепей и двух γ-цепей. Фетальный гемоглобин отличается от HbA1не только составом аминокислот, но и физико-химическими свойствами: спектральным показателем, электрофоретической подвижностью, устойчивостью к щелочной денатурации и др. Кровь новорожденного содержит до 80% HbF, но к концу 1-го года жизни он почти целиком заменяется на НbА (все же в крови взрослого человека открывается до 1,5% HbF от общего количества гемоглобина). Последовательность аминокислот в γ- и δ-цепях гемоглобинов окончательно не расшифрована.
Обмен гемоглобина. Как синтез, так и распад гемоглобина происходит в селезенке, печени, косном мозге.
Распад гемоглобина начинается с окисления гема, когда железо Fе 2+ превращается в Fе 3+ . Образующееся соединение называется вердоглобином (вещество зеленого цвета), который спонтанно распадается на составные части – глобин, железо и оставшаяся часть гема – биливердин (пигмент зеленого цвета). Биливердин восстанавливается в желто-красный билирубин, который поступает в печень. Для организма билирубин является токсичным и водонерастворимым. Поэтому в местах его образования происходит его обезвреживание и превращение в водорастворимую форму. Этот процесс происходит двумя путями:
1 С помощью глюкуроновой кислоты с которой билирубин образует моно- или диглюкурониды, комплекс билирубина с одной или двумя молекулами глюкуроновой кислоты. Такой билирубин является связанным (в лабораторной практике – прямой билирубин).
2 Образование комплекса с альбумином. В этом случае билирубин называют свободным (непрямым).
В крови содержится около 75% свободного билирубина и 25% связанного.
В печени комплекс билирубина с белками распадается, и освободившийся билирубин превращается в глюкуронид. В печени весь билирубин присутствует в форме связанной с глюкуроновой кислотой, т.е. в нетоксичной и водорастворимой форме. Из печени билирубин поступает в желчный пузырь, откуда под влиянием желчного пигмента поступает в кишечник. Там билирубин освобождается от глюкуроновой кислоты и подвергается различным превращениям с образованием в конце уробилиногена и стеркобилиногена. Первый всасывается в кровь, затем в печень, откуда поступает в мочу. На воздухе уробилиноген окисляется в уробилин. Второй выводится с калом (специфическая окраска) и кислородом окисляется до стрекобилина.
Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита.
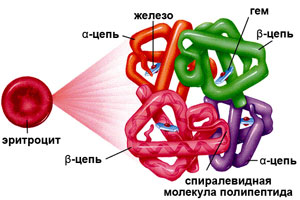
Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита. За счет своей структуры гемоглобин участвует в переносе кислорода от легких к тканям, и оксида углерода обратно.
Строение гемоглобина
Гемоглобин состоит из двух цепей глобина типа альфа и двух цепей другого типа (бета, гамма или сигма), соединенными с четырьмя молекулами гемма, содержащего железо. Структура гемоглобина записывается буквами греческого алфавита: α2γ2.
Обмен гемоглобина
Гемоглобин образуется эритроцитами в красном костном мозге и циркулирует с клетками в течение всей их жизни – 120 дней. Когда селезенкой удаляются старые клетки, компоненты гемоглобина удаляются из организма или поступают обратно в кровоток, чтобы включиться в новые клетки.
Типы гемоглобина
К нормальным типам гемоглобина относится гемоглобин А или HbA (от adult — взрослый), имеющий структуру α2β2, HbA2 (минорный гемоглобин взрослого, имеющий структуру α2σ2 и фетальный гемоглобин (HbF, α2γ2. Гемоглобин F – гемоглобин плода. Замена на гемоглобин взрослого полностью происходит к 4-6 месяцам (уровень фетального гемоглобина в этом возрасте менее 1%). Эмбриональный гемоглобин образовывается через 2 недели после оплодотворения, в дальнейшем, после образования печени у плода, замещается фетальным гемоглобином.
| Тип гемоглобина | Процент содержания у взрослого человека |
| HbA - взрослый гемоглобин | 98% |
| HbA2 – взрослый гемоглобин минорный | Около 2% |
| HbFi – фетальный гемоглобин | 0,5-1% |
| Эмбриональный гемоглобин | нет |
| HbA1C – гликированный гемоглобин | |
Аномальных гемоглобинов более 300, их называют по месту открытия.
Функция гемоглобина
Основная функция гемоглобина – доставка кислорода от легких к тканям и углекислого газа обратно.
Формы гемоглобина
- Оксигемоглобин – соединение гемоглобина с кислородом. Оксигемоглобин преобладает в артериальной крови, идущей от легких к тканям. Из-за содержания оксигемоглобина артериальная кровь имеет алый цвет.
- Восстановленный гемоглобин или дезоксигемоглобин (HbH) - гемоглобин, отдавший кислород тканям
- Карбоксигемоглобин – соединение гемоглобина с углекислым газом. Находится в венозной крови и придает ей темный вишневый цвет.
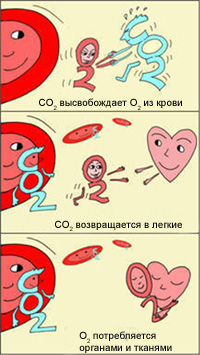
Эффект Бора
В легких, в условиях избытка кислорода, он соединяется с гемоглобином эритроцитов. Эритроциты с током крови доставляют кислород ко всем органам и тканям. В тканях организма с участием поступающего кислорода проходят реакции окисления. В результате этих реакций образуются продукты распада, в том числе, углекислый газ. Углекислый газ из тканей переносится в эритроциты, из-за чего уменьшается сродство к кислороду, кислород выделяется в ткани.

Какой уровень гемоглобина в норме?
В каждом миллилитре крови содержится около 150 мг гемоглобина! Уровень гемоглобина меняется с возрастом и зависит от пола. Так, у новорожденных гемоглобин значительно выше, чем у взрослых, а у мужчин выше, чем у женщин.
Что еще влияет на уровень гемоглобина?
Некоторые другие состояния также влияют на уровень гемоглобина, например, пребывание на высоте, курение, беременность.

- У беспозвоночных животных гемоглобин растворен в плазме крови.
- В сутки из легких в ткани переносится около 600 литров кислорода!
- Красный цвет крови придает гемоглобин, входящий в состав эритроцитов. У некоторых червей вместо гемоглобина хлорокруорин и кровь зеленая. А у каракатиц, скорпионов и пауков голубая, так как вместо гемоглобина – содержащий медь гемоцианин.
Продолжительность жизни эритроцитов составляет 120 дней, затем они разрушаются и освобождается гемоглобин. Главными органами, в которых происходят разрушение эритроцитов и распад гемоглобина, являются печень, селезенка и костный мозг, хотя в принципе оба процесса могут происходить и в клетках других органов. Распад гемоглобина в печени начинается с разрыва α-метиновой связи между I и II кольцами порфиринового кольца. Этот процесс катализируется НАДФ-содержащей ок-сидазой и приводит к образованию зеленого пигмента вердоглобина (холеглобина):
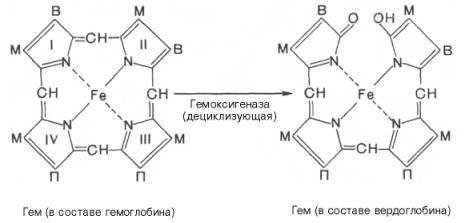
В приведенных структурных формулах здесь и далее в желчных пигментах М – метильная СН3-группа, В – (—СН=СН2) – винильная группа и П – (—СН2—СН2—СООН) – остаток пропионовой кислоты.
Как видно из приведенных формул, в молекуле вердоглобина еще сохраняются атом железа и белковый компонент. Имеются экспериментальные доказательства, что в этом окислительном превращении гемоглобина принимают участие витамин С, ионы Fe 2+ и другие кофакторы. Дальнейший распад вердоглобина, вероятнее всего, происходит спонтанно с освобождением железа, белка-глобина и образованием одного из желчных пигментов – биливердина. Спонтанный распад сопровождается перераспределением двойных связей и атомов водорода в пиррольных кольцах и метиновых мостиках. Образовавшийся биливердин ферментативным путем восстанавливается в печени в билирубин, являющийся основным желчным пигментом у человека и плотоядных животных:
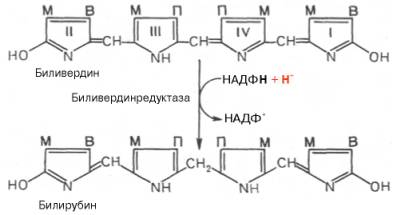
Основное место образования билирубина – печень, селезенка и, по-видимому, эритроциты (при распаде их иногда разрывается одна из метиновых связей в протопорфирине). Образовавшийся во всех этих клетках билирубин поступает в печень, откуда вместе с желчью попадает в желчный пузырь (см. главу 16). Билирубин, образовавшийся в клетках системы макрофагов, называется свободным, или непрямым, билирубином, поскольку вследствие плохой растворимости в воде он легко адсорбируется на белках плазмы крови и для его определения в крови необходимо предварительное осаждение белков спиртом. После этого билирубин вступает во взаимодействие с диазореактивом Эрлиха.
В крови взрослого здорового человека содержится относительно постоянное количество общего билирубина – от 4 до 26 мкмоль/л, в среднем 15 мкмоль/л. Около 75% этого количества приходится на долю непрямого билирубина. Повышение его концентрации в крови до 35 мкмоль/л приводит к желтухе. Более высокий уровень билирубина в крови вызывает явления тяжелого отравления. Непрямой билирубин, поступая с током крови в печень, подвергается обезвреживанию путем связывания с глюку-роновой кислотой. В этом процессе принимают участие особый фермент УДФ-глюкуронилтрансфераза и УДФ-глюкуроновая кислота, являющаяся донором глюкуроновой кислоты. При этом к билирубину присоединяются 2 остатка глюкуроновой кислоты с образованием сравнительно индифферентного комплекса – билирубин-диглюкуронида, хорошо растворимого в воде и дающего прямую реакцию с диазореактивом. В желчи всегда присутствует прямой билирубин. В крови количество прямого и непрямого билирубина, а также соотношение между ними резко меняются при поражениях печени, селезенки, костного мозга, болезнях крови и т.д., поэтому определение содержания обеих форм билирубина в крови имеет существенное значение при дифференциальной диагностике различных форм желтухи. При желчнокаменной болезни в составе желчных камней наряду с основным их компонентом – холестерином всегда обнаруживается непрямой билирубин. Вследствие плохой растворимости в воде он выпадает в осадок в желчном пузыре в виде билирубината кальция, участвующего в формировании камней.
Дальнейшая судьба желчных пигментов, точнее билирубина, связана с их превращениями в кишечнике под действием бактерий. Сначала глю-куроновая кислота отщепляется от комплекса с билирубином и освободившийся билирубин подвергается восстановлению в стеркобилиноген, который выводится из кишечника. В сутки человек выделяет около 300 мг стеркобилиногена. Последний легко окисляется под действием света и воздуха в стеркобилин. Механизм бактериальных превращений билирубина до стеркобилина до конца еще не расшифрован. Имеются данные, что промежуточными продуктами восстановления являются последовательно мезобилирубин и мезобилиноген (уробилиноген). После всасывания небольшая часть мезобилиногена поступает через воротную вену в печень, где подвергается разрушению с образованием моно- и дипиррольных соединений. Кроме того, очень небольшая часть стеркобилиногена после всасывания через систему геморроидальных вен попадает в большой круг кровообращения, минуя печень, и в таком виде выводится с мочой. Однако называть его уробилиногеном не совсем точно (см. главу 18). Суточное содержание стеркобилиногена в моче составляет около 4 мг, и, пожалуй, именно стеркобилиноген является нормальной органической составной частью мочи. Если с мочой выделяется повышенное содержание уробилиногена (точнее, мезобилиногена), то это является свидетельством недостаточности функции печени, например, при печеночной или гемолитической желтухе, когда печень частично теряет способность извлекать этот пигмент из крови воротной вены. Химически уробилиноген (мезо-билиноген) неидентичен стеркобилиногену (уробилиногену) мочи. Исчезновение стеркобилиногена (уробилиногена) из мочи при наличии билирубина и биливердина является свидетельством полного прекращения поступления желчи в кишечник. Такое состояние часто наблюдается при закупорке протока желчного пузыря (желчнокаменная болезнь) или общего желчного протока (желчнокаменная болезнь, раковые поражения поджелудочной железы и др.).
Таким образом, количественный и качественный анализ желчных пигментов в моче может представлять большой клинический интерес.
Читайте также:

