Наименование и характеристика ахов аммиак кратко
Обновлено: 30.06.2024
Аммиак почти вдвое легче воздуха, ПДКр.з. 20 мг/м3 — IV класс опасности (малоопасные вещества) по ГОСТ 12.1.007 [1] . Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды. В холодильной технике носит название R717, где R — Refrigerant (хладагент), 7 — тип хладагента (неорганическое соединение), 17 — молекулярная масса.
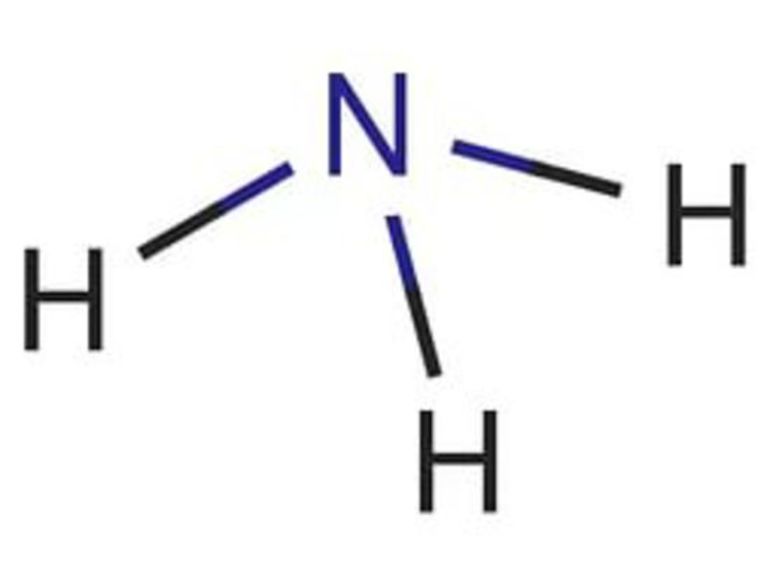
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4 + . Благодаря тому, что не связывающее двухэлектронное облако строго ориентировано в пространстве, молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
В жидком аммиаке молекулы связаны между собой водородными связями. Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (tкип −33,35 °C) и плавления (tпл −77,70 °C), а также более низкую плотность, вязкость (вязкость жидкого аммиака в 7 раз меньше вязкости воды), проводимость и диэлектрическую проницаемость. Это в некоторой степени объясняется тем, что прочность этих связей в жидком аммиаке существенно ниже, чем у воды, а также тем, что в молекуле аммиака имеется лишь одна пара неподелённых электронов, в отличие от двух пар в молекуле воды, что не дает возможность образовывать разветвлённую сеть водородных связей между несколькими молекулами. Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м³, сильно преломляющую свет. Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счёт образования водородных связей. Жидкий аммиак практически не проводит электрический ток. Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений. Твёрдый аммиак — бесцветные кубические кристаллы.
Содержание
Химические свойства
Амиды, имиды и нитриды ряда металлов образуются в результате некоторых реакций в среде жидкого аммиака. Нитриды можно получить нагреванием металлов в атмосфере азота.
Амиды металлов являются аналогами гидроксидов. Эта аналогия усиливается тем, что ионы ОН − и NH2 − , а также молекулы Н2O и NH3 изоэлектронны. Амиды являются более сильными основаниями, чем гидроксиды, а следовательно, подвергаются в водных растворах необратимому гидролизу:


Подобно водным растворам щелочей, аммиачные растворы амидов хорошо проводят электрический ток, что обусловлено диссоциацией:

Фенолфталеин в этих растворах окрашивается в красный цвет, при добавлении кислот происходит их нейтрализация. Растворимость амидов изменяется в такой же последовательности, что и растворимость гидроксидов: LiNH2 — нерастворим, NaNH2 — малорастворим, KNH2, RbNH2 и CsNH2 — хорошо растворимы.
- При нагревании аммиак проявляет восстановительные свойства. Так, он горит в атмосфере кислорода, образуя воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты:
На восстановительной способности NH3 основано применение нашатыря NH4Cl для очистки поверхности металла от оксидов при их пайке:

Окисляя аммиак гипохлоритом натрия в присутствии желатина, получают гидразин:
-
(хлор, йод) образуют с аммиаком опасные взрывчатые вещества — галогениды азота (хлористый азот, иодистый азот).
- С галогеноалканами аммиак вступает в реакцию нуклеофильного присоединения, образуя замещённый ион аммония (способ получения аминов):
- С карбоновыми кислотами, их ангидридами, галогенангидридами, эфирами и другими производными даёт амиды. С альдегидами и кетонами — основания Шиффа, которые возможно восстановить до соответствующих аминов (восстановительное аминирование).
- При 1000 °C аммиак реагирует с углём, образуя синильную кислоту HCN и частично разлагаясь на азот и водород. Также он может реагировать с метаном, образуя ту же самую синильную кислоту:
История названия
Жидкий аммиак
Жидкий аммиак, хотя и в незначительной степени, диссоциирует на ионы (автопротолиз), в чём проявлется его сходство с водой:

Константа самоионизации жидкого аммиака при −50 °C составляет примерно 10 −33 (моль/л)².
Жидкий аммиак, как и вода, является сильным ионизирующим растворителем, в котором растворяется ряд активных металлов: щелочные, щёлочноземельные, Mg, Al, а также Eu и Yb. Растворимость щелочных металлов в жидком NH3 составляет несколько десятков процентов. В жидком аммиаке NH3 также растворяются некоторые интерметаллиды, содержащие щелочные металлы, например Na4Pb9.
Разбавленные растворы металлов в жидком аммиаке окрашены в синий цвет, концентрированные растворы имеют металлический блеск и похожи на бронзу. При испарении аммиака щелочные металлы выделяются в чистом виде, а щелочноземельные — в виде комплексов с аммиаком [Э(NH3)6] обладающих металлической проводимостью. При слабом нагревании эти комплексы разлагаются на металл и NH3.
Растворенный в NH3 металл постепенно реагирует с образованием амида:

Получающиеся в результате реакции с аммиаком амиды металлов содержат отрицательный ион NH2 − , который также образуется при самоионизации аммиака. Таким образом, амиды металлов являются аналогами гидроксидов. Скорость реакции возрастает при переходе от Li к Cs. Реакция значительно ускоряется в присутствии даже небольших примесей H2O.
Металлоаммиачные растворы обладают металлической электропроводностью, в них происходит распад атомов металла на положительные ионы и сольватированные электроны, окруженные молекулами NH3. Металлоаммиачные растворы, в которых содержатся свободные электроны, являются сильнейшими восстановителями.
Комплексообразование
Благодаря своим электронодонорным свойствам, молекулы NH3 могут входить в качестве лиганда в комплексные соединения. Так, введение избытка аммиака в растворы солей d-металлов приводит к образованию их аминокомплексов:
" width="" height="" />
" width="" height="" />
Комплексообразование обычно сопровождается изменением окраски раствора. Так, в первой реакции голубой цвет (CuSO4) переходит в темно-синий (окраска комплекса), а во второй реакции окраска изменяется из зелёной (Ni(NO3)2) в сине-фиолетовую. Наиболее прочные комплексы с NH3 образуют хром и кобальт в степени окисления +3.
Биологическая роль
Аммиак является конечным продуктом азотистого обмена в организме человека и животных. Он образуется при метаболизме белков, аминокислот и других азотистых соединений. Он высоко токсичен для организма, поэтому большая часть аммиака в ходе орнитинового цикла конвертируется печенью в более безвредное и менее токсичное соединение — карбамид (мочевину). Мочевина затем выводится почками, причём часть мочевины может быть конвертирована печенью или почками обратно в аммиак.
Физиологическое действие
По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это человек и воспринимает как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени. Запах аммиака ощущается при концентрации 37 мг/м³ [2] .
Предельно допустимая концентрация в воздухе рабочей зоны производственного помещения (ПДКр.з.) составляет 20 мг/м³ [3] . В атмосферном воздухе населённых пунктов и в жилых помещениях среднесуточная концентрация аммиака (ПДКс.с.) не должна превышать 0,04 мг/м³ [4] . Максимальная разовая концентрация в атмосфере — 0,2 мг/м³. Таким образом, ощущение запаха аммиака свидетельствует о превышении допустимых норм.
Раздражение зева проявляется при содержании аммиака в воздухе 280 мг/м³, глаз — 490 мг/м³. При действии в очень высоких концентрациях аммиак вызывает поражение кожи: 7—14 г/м³ — эритематозный, 21 г/м³ и более — буллёзный дерматит. Токсический отёк лёгких развивается при воздействии аммиака в течение часа с концентрацией 1,5 г/м³. Кратковременное воздействие аммиака в концентрации 3,5 г/м³ и более быстро приводит к развитию общетоксических эффектов.
В мире максимальная концентрация аммиака в атмосфере (больше 1 мг/м³) наблюдается на Индо-Гангской равнине, в Центральной долине США и в Южно-Казахстанской области [5] .
Применение
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство достигает 150 млн тонн. В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя.
В медицине 10 % раствор аммиака, чаще называемый нашатырным спиртом, применяется при обморочных состояниях (для возбуждения дыхания), для стимуляции рвоты, а также наружно — невралгии, миозиты, укусах насекомых, для обработки рук хирурга. При неправильном применении может вызвать ожоги пищевода и желудка (в случае приёма неразведённого раствора), рефлекторную остановку дыхания (при вдыхании в высокой концентрации).
Применяют местно, ингаляционно и внутрь. Для возбуждения дыхания и выведения больного из обморочного состояния осторожно подносят небольшой кусок марли или ваты, смоченный нашатырным спиртом, к носу больного (на 0,5-1 с). Внутрь (только в разведении) для индукции рвоты. При укусах насекомых — в виде примочек; при невралгиях и миозитах — растирания аммиачным линиментом. В хирургической практике разводят в тёплой кипяченой воде и моют руки.
Поскольку аммиак является слабым основанием, при взаимодействии с кислотами он их нейтрализует.
Физиологическое действие нашатырного спирта обусловлено резким запахом аммиака, который раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров мозга, вызывая учащение дыхания и повышение артериального давления.
Противоморозная добавка для сухих строительных растворов, относящаяся к ускорителям. Рекомендуемая дозировка — 2…8 % массы компонентов сухой смеси в зависимости от температуры применения. Аммиачная вода — продукт (NH3*H2O), представляющий собой газообразный аммиак NН3, растворенный в воде.
Получение
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:

+ 91,84 кДж
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
Реакция происходит с выделением тепла и понижением объёма. Следовательно, исходя из принципа Ле-Шателье, реакцию следует проводить при возможно низких температурах и при высоких давлениях — тогда равновесие будет смещено вправо. Однако скорость реакции при низких температурах ничтожно мала, а при высоких увеличивается скорость обратной реакции. Проведение реакции при очень высоких давлениях требует создания специального, выдерживающего высокое давление оборудования, а значит и больших капиталовложений. Кроме того, равновесие реакции даже при 700 °C устанавливается слишком медленно для практического её использования.
Применение катализатора (пористое железо с примесями Al2O3 и K2O) позволило ускорить достижение равновесного состояния. Интересно, что при поиске катализатора на эту роль пробовали более 20 тысяч различных веществ.
Учитывая все вышеприведённые факторы, процесс получения аммиака проводят при следующих условиях: температура 500 °C, давление 350 атмосфер, катализатор. Выход аммиака при таких условиях составляет около 30 %. В промышленных условиях использован принцип циркуляции — аммиак удаляют охлаждением, а непрореагировавшие азот и водород возвращают в колонну синтеза. Это оказывается более экономичным, чем достижение более высокого выхода реакции за счёт повышения давления.
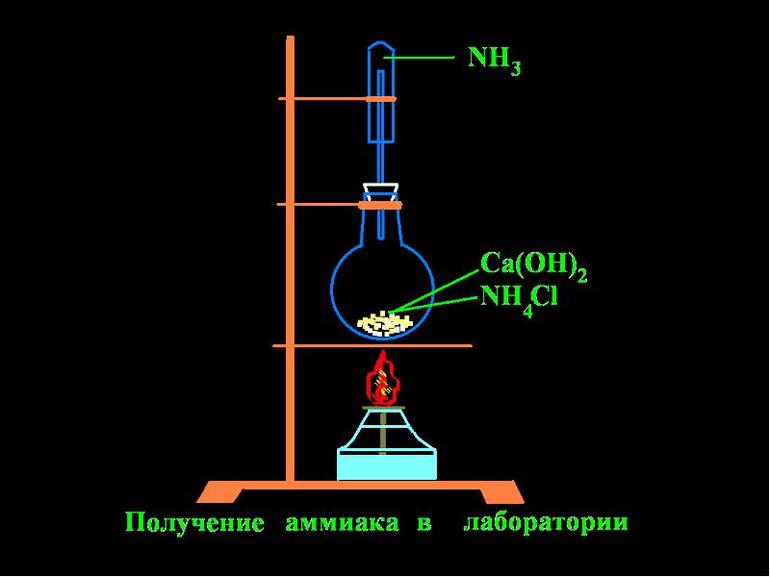
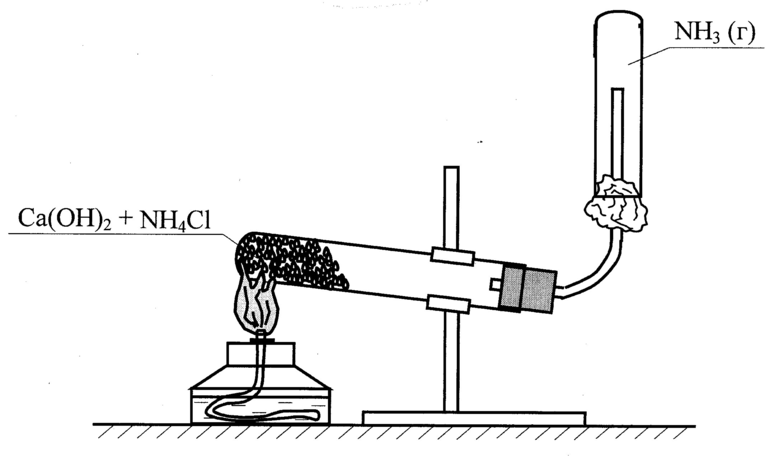
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:

Обычно лабораторным способом аммиак получают слабым нагреванием смеси хлорида аммония с гашеной известью.

Для осушения аммиака его пропускают через смесь извести с едким натром.
Очень сухой аммиак можно получить, растворяя в нём металлический натрий и впоследствии перегоняя. Это лучше делать в системе, изготовленной из металла под вакуумом. Система должна выдерживать высокое давление (при комнатной температуре давление насыщенных паров аммиака около 10 атмосфер) [6] . В промышленности аммиак осушают в абсорбционных колоннах.
Расходные нормы на тонну аммиака
На производство одной тонны аммиака в России расходуется в среднем 1200 нм³ природного газа, в Европе — 900 нм³ [7] [8] [9] [10] [11] .
Украинские производители потребляют от 750 нм³ [13] до 1170 нм³ [14] природного газа на тонну аммиака.
По технологии UHDE заявляется потребление 6,7 — 7,4 Гкал энергоресурсов на тонну аммиака [15] .
Аммиак в медицине
При укусах насекомых аммиак применяют наружно в виде примочек. 10 % водный раствор аммиака известен как нашатырный спирт.
Возможны побочные действия: при продолжительной экспозиции (ингаляционное применение) аммиак может вызвать рефлекторную остановку дыхания.
Местное применение противопоказано при дерматитах, экземах, других кожных заболеваниях, а также при открытых травматических повреждениях кожных покровов.
При случайном поражении слизистой оболочки глаза промыть водой (по 15 мин через каждые 10 мин) или 5 % раствором борной кислоты. Масла и мази не применяют. При поражении носа и глотки — 0,5 % раствор лимонной кислоты или натуральные соки. В случае приема внутрь пить воду, фруктовый сок, молоко, лучше — 0,5 % раствор лимонной кислоты или 1 % раствор уксусной кислоты до полной нейтрализации содержимого желудка.
Взаимодействие с другими лекарственными средствами неизвестно.
Производители аммиака
Производители аммиака в России
На долю России приходится около 9 % мирового выпуска аммиака. Россия — один из крупнейших мировых экспортеров аммиака. На экспорт поставляется около 25 % от общего объёма производства аммиака, что составляет около 16 % мирового экспорта.
Хорошо растворим в воде: р астворимость его в воде больше, чем у всех других газов: один объем воды поглощает при 20°С около 700 объемов аммиака.
Хранится и перевозится в сжиженном виде под давлением собственных паров (до 18 кг • с/см 2 ) и при низких температурах.
Мировое производство аммиака ежегодно составляет около 90 млн.т. Его используют при получении азотной кислоты, азотосодержащих солей, соды, мочевины, синильной кислоты, удобрений, диазотипных светокопировальных материалов.
Жидкий аммиак широко применяется в качестве рабочего вещества (хладагента) в холодильных машинах и установках.
Предельно допустимые концентрации (ПДК) в воздухе населенных мест: среднесуточная и максимально разовая - 0,2 мг/м 3 ,
в рабочем помещении промышленного предприятия - 20 мг/м 3 .

ПДК 0,37 — 0,5 г/м 3 опасна для жизни, смерть может наступить от сердечной слабости и остановки дыхания.
Аммиак вызывает поражение дыхательных путей. Его признаки: насморк, кашель, затрудненное дыхание, удушье, при этом учащается сердцебиение, нарушается частота пульса.
Пары сильно раздражают слизистые оболочки и кожные покровы, вызывают жжение, покраснение и зуд кожи, резь в глазах, слезотечение. При соприкосновении жидкого аммиака и его растворов с кожей возникает обморожение, жжение, возможен ожог с пузырями, изъязвления.
Если из опасной зоны выйти невозможно , останьтесь в помещении и произведите его экстренную герметизацию: плотно закройте окна, двери, вентиляционные отверстия, дымоходы, уплотните щели в окнах и на стыках рам.
Выйдя из опасной зоны , снимите верхнюю одежду, оставьте ее на улице, примите душ, промойте глаза и носоглотку.
Признаки отравления аммиаком : учащенное сердцебиение, а при сильном отравлении - тошнота, резь в глазах, слезотечение, насморк, кашель, затрудненное дыхание, нарушение координации движений, бредовое состояние.
Средства индивидуальной защиты : марлевая повязка, смоченная водой или 5% раствором лимонной или уксусной кислоты (2 чайных ложки на стакан воды), противогазы с дополнительным патроном.
Неотложная помощь : при поражении кожи обмыть чистой водой, примочки 5% раствором уксусной или лимонной кислоты, при попадании в глаза промыть водой, закапать 30% раствор альбуцида.
Пить теплое молоко с минеральной водой или содой.
При поражении органов дыхания: свежий воздух, теплые водяные ингаляции, (лучше с добавлением уксуса или лимонной кислоты), тепло на область шеи, при удушье - кислород.
Оказание первой помощи: Пострадавшего вынести из очага на чистый воздух, обеспечить тепло, покой; кожу и слизистые промыть водой или 2% раствором борной кислоты. В глаза закапать 2-3 капли 30% альбуцида, в нос – теплое растительное масло (лучше оливковое).
Наличие и концентрацию этого газа в воздухе позволяет определить универсальный газоанализатор УГ-2.
В случае аварии необходимо опасную зону изолировать, удалить людей и не допускать никого без средств защиты органов дыхания и кожи. Около зоны следует находиться с наветренной стороны. Место разлива нейтрализуют слабым раствором кислоты, промывают большим количеством воды. Если произошла утечка газообразного аммиака, то с помощью поливомоечных машин, авторазливочных станций, пожарных машин распыляют воду, чтобы поглотить пары.
Характеристика основных факторов, от которых зависит безопасность функционирования химически опасных веществ. Средства пожаротушения, используемые при возгорании аммиака. Методика определения предельно-возможной глубины зоны химического заражения.
| Рубрика | Безопасность жизнедеятельности и охрана труда |
| Вид | контрольная работа |
| Язык | русский |
| Дата добавления | 16.05.2017 |
| Размер файла | 43,1 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Проблема промышленной безопасности значительно обострилась с появлением крупномасштабных химических производств в первой половине нашего века. Основу химической промышленности составили производства непрерывного цикла, производительность которых не имеет, по существу, естественных ограничений. Постоянный рост производительности обусловлен значительными экономическими преимуществами крупных установок. Как следствие, возрастает содержание опасных веществ в технологических аппаратах, что сопровождается возникновением опасностей катастрофических пожаров, взрывов, токсических выбросов и других разрушительных явлений.
Безопасность функционирования химически опасных веществ (ХОВ) зависит от многих факторов: физико-химических свойств сырья, полупродуктов и продуктов, от характера технологического процесса, от конструкции и надежности оборудования, условий хранения и транспортирования химических веществ, состояния контрольно-измерительных приборов и средств автоматизации, эффективности средств противоаварийной защиты и т.д.
1. Характеристика АХОВ - аммиака
Аммиак - бесцветный газ с резким запахом, температура плавления равна -78°С, температура кипения -33°С, хорошо растворяется в воде, спирте и ряде других органических растворителей, аммиак легче воздуха почти в два раза Синтезируют из азота и водорода. В природе образуется при разложении азотсодержащих органических соединений.
Резкий запах аммиака известен человеку с доисторических времен, так как этот газ образуется в значительных количествах при гниении, разложении и сухой перегонке, содержащих азот органических соединений, например мочевины или белков. Не исключено, что на ранних стадиях эволюции Земли в ее атмосфере было довольно много аммиака. Однако и сейчас ничтожные количества этого газа всегда можно обнаружить в воздухе и в дождевой воде, поскольку он непрерывно образуется при разложении животных и растительных белков. На некоторых планетах Солнечной системы ситуация иная: астрономы считают, что значительная часть масс Юпитера и Сатурна приходится на твердый аммиак.
Впервые аммиак был получен в чистом виде в 1774 английским химиком Джозефом Пристли. Он нагревал нашатырь (хлорид аммония) с гашеной известью (гидроксид кальция). Реакцию 2NH4Cl + Ca(OH)2 > NH3 + CaCl2 до сих пор используют в лабораториях, если требуется получить небольшие количества этого газа; другой удобный способ получения аммиака - гидролиз нитрида магния: Mg3N2 + 6H2O > 2NH3 + 3Mg(OH)2.
Аммиак - бесцветный газ, который легко сжижается при охлаждении до -33,3°С или при комнатной температуре при повышении давления примерно до 10 атм. Замерзает аммиак при охлаждении до -77,7°С. Молекула NH3 имеет форму трехгранной пирамиды с атомом азота в вершине. Однако, в отличие от пирамиды, склеенной, к примеру, из бумаги, молекула NH3 с легкостью "вывертывается наизнанку", наподобие зонтика, и при комнатной температуре она проделывает такое превращение с огромной частотой - почти 24 млрд. раз в секунду.
Аммиак химически довольно активен и вступает во взаимодействие со многими веществами. В чистом кислороде он сгорает бледно-желтым пламенем, превращаясь, в основном, в азот и воду. Смеси аммиака с воздухом при его содержании от 15 до 28% взрывоопасны. В присутствии катализаторов реакция с кислородом приводит к оксидам азота. При растворении аммиака в воде образуется щелочной раствор, который иногда называют гидроксидом аммония. Однако это название не вполне точное, поскольку в растворе сначала образуется гидрат NH3·H2O, который затем частично распадается на ионы NH4+ и OH-. Условно NH4OH считают слабым основанием, при расчете его степени диссоциации предполагается, что весь аммиак в растворе находится в виде NH4OH, а не в виде гидрата.
По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100 миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде водного раствора - аммиачной воды, которая обычно содержит 25% NH3. Огромные количества аммиака далее используются для получения азотной кислоты, которая идет на производство удобрений и множества других продуктов. Аммиачную воду применяют также непосредственно в виде удобрения, а иногда поля поливают из цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого хладагента в промышленных холодильных установках.
Аммиак используется также для получения синтетических волокон, например, нейлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка, шерсти и шелка. В нефтехимической промышленности аммиак используют для нейтрализации кислотных отходов, а в производстве природного каучука аммиак помогает сохранить латекс в процессе его перевозки от плантации до завода. Аммиак используется также при производстве соды по методу Сольве. В сталелитейной промышленности аммиак используют для азотирования - насыщения поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
2. Прогнозирование масштабов заражения аммиака при химической аварии
1. Расчет продолжительности испарения АХОВ:
где В - толщина слоя разлившихся АХОВ; Рв - плотность АХОВ, т/м3; К2 - коэффициент, зависящий от физико-химических свойств; К4 - коэффициент, рассчитывающий скорость ветра; К7 - коэффициент, учитывающий температуру воздуха.
2. Расчет количества АХОВ в первичном облаке:
где К1 - коэффициент, определяющий условия хранения вещества; К3 - коэффициент, равный отношению пороговой токсодозы аммиака к пороговой токсодозе данного вещества; К5 - коэффициент вертикальной устойчивости воздуха; М0 - количество аварийного вещества, т.
3. Расчет количества АХОВ во вторичном облаке:
где К6 - коэффициент, зависящий от времени испарения вещества,
К6 = 1,3620,8 = 1,28
4. Расчет глубины зоны заражения первичным и вторичным облаком, Г1 и Г2: для нахождения Г1 и Г2 делаем интерполяцию по количеству АХОВ в первичном и вторичном облаке соответственно и по скорости ветра:
Скорость ветра 1 м/с
Скорость ветра 1 м/с
5. Расчет полной глубины зоны заражения, Гт:
6. Расчет предельно-возможной глубины зоны заражения, Гп:
где Сп - скорость переноса облака ветром, км/ч;
7. Определение окончательной глубины зоны заражения:
за окончательную глубину принимаем меньшую из Гт или Гп:
8. Определение формы площади зоны заражения:
если Vв = 0,5 м/с или меньше, то получаем форму круга,
если Vв = 1 м/с - получаем форму полукруга,
если Vв = 2 м/с - сектор с углом 90°.
9. Расчет зоны площади заражения, SЗХЗ:
где ц° - угловые размеры зоны заражения.
10. Расчет времени подхода облака к заданному объекту, tпод:
Рис. 1. Схема зоны химического заражения
химический опасный аммиак пожаротушение
3. Защита населения от аварийно химически-опасного вещества - аммиака
Вследствие производственных аварий или стихийных бедствий на объектах промышленного производства из резервуаров, трубопроводов или цистерн может произойти выброс (разлив) аммиака в виде газа или жидкости в окружающую среду. Жидкий аммиак быстро вскипает. Образуется облако заражённого воздуха с высокой концентрацией паров, которое распространяется по направлению ветра. В результате возникает зона химического заражения (ЗХЗ) включающая территорию, подвергшуюся непосредственному воздействию аммиака, и территорию, над которой распространяются его пары в поражающих концентрациях.
Признаки поражения аммиаком: насморк, кашель, раздражение и жжение слизистых оболочек, покраснение и зуд кожи, резь в глазах и слезотечение, затруднённое дыхание, удушье, сердцебиение. При соприкосновении жидкого аммиака и его растворов с кожей возможен ожог с образованием пузырей и изъязвлений. В лёгких случаях отравления наблюдается лёгкое раздражение глаз и слизистой носа, чихание, сухость и першение в горле, охриплость голоса, слюнотечение, лёгкая тошнота, головная боль, покраснение лица, потливость, боль в груди. При отравлении средней степени тяжести появляется жгучая боль в горле, сильный кашель, чувство удушья. Возможно развитие отёка гортани. При тяжелых поражениях отмечаются ожоги глаз, кожных покровов, сильное возбуждение, головокружение, тошнота, боли в желудке, рвота, координаторные нарушения, спазм голосовой щели, удушье, возможен бред, задержка мочи, потеря сознания, судороги и смертельный исход (из-за сердечной слабости или остановки дыхания). Летальный исход чаще наступает через несколько часов или дней в результате развившегося отека гортани или лёгких.
При возгорании аммиака и пожаре используют средства пожаротушения: инертные газы, углекислотные огнетушители (при опасности поражения электрическим током), воздушно-механическую пену, пожарную машину, мотопомпупрогнозирование зон поражения по конкретной обстановке; оповещение об опасности поражения работающих на данном объекте и близко расположенного жилого сектора (в радиусе 2,5 км от химически опасного объекта); ведение химической разведки, обозначение границ очага химического заражения (границ с уровнем смертельной концентрации), что позволяет принять решение на использование соответствующих средств и способов защиты; немедленное начало работы по локализации и ликвидации химических очагов; оцепление зон заражения с целью прекращения доступа на территорию с поражающими концентрациями аммиака (изолируется район в радиусе 100 метров); у входов на объект с наветренной стороны выставляется КПП; зоны заражения обозначаются предупредительными знаками; проверяется отсутствие людей в загазованной зоне и её помещениях; высылаются оперативные машины по направлению распространения зараженного воздуха; использование средств индивидуальной защиты всеми находящимися в зоне заражения; укрытие населения в убежищах, а при их отсутствии - в верхних этажах зданий в течение 1-1,5 часов после возникновения аварии (обязательна предварительная герметизация помещений, в производственных помещениях, оказавшихся в загазованной зоне, выключают приточную вентиляцию); эвакуация рабочих, служащих и населения из очага химического поражения и зоны химического заражения; проведение неотложных аварийно-технических мероприятий по предотвращению дальнейшего разлива аммиака и распространения аварии; локализация очага химического поражения путём нейтрализации вылитого аммиака и постановки водяных завес на направлении распространения зараженного воздуха; тщательный химический контроль производственных помещений и особенно мест возможного застоя паров; проведение личному составу, участвующему в ликвидации химического очага, гигиенической помывки и медицинского осмотра; организация сбора, анализа и получение данных об обстановке, доклады по подчинённости, подготовка предложений по организации и проведению работ.
Главным поражающим фактором при авариях на химически опасных объектах с выбросом (разливом) аммиака является заражение воздуха, приводящее к поражению людей, находящихся в зоне химического заражения.
Для защиты от паров аммиака эффективны промышленные фильтрующие противогазы марки "К" и "М", при смеси аммиака с сероводородом - марки "ВК".
Чаще используются промышленные противогазы марки "КД" (коробка окрашена в серый цвет) и "КД 8". При отсутствии точных данных о концентрации аммиака время защитного действия противогазов "КД" не должно быть более 120 мин. При отсутствии в воздухе органических веществ можно использовать противогазы марки "М" с защитным временем 90 минут. Для защиты кожных покровов следует использовать защитные прорезиненные костюмы, резиновые сапоги и перчатки.
В качестве подручных средств защиты применяют полотенце или марлю, смоченные 5% раствором лимонной кислоты (столовым уксусом или слабым раствором соляной кислоты).
При организации защиты населения нужно учитывать, что аммиак хоть и легче воздуха, при разливе или утечке, увлажняясь, образует холодный аэрозоль, который распространяется по оврагам, канавам и ложбинам, причём такое движение может не совпадать с основным направлением ветра. Население не должно выходить на улицу. Нужно подняться как можно выше и закрыть окна, перекрыть вентиляционные устройства. Следует иметь в виду, что концентрация аммиака в закрытом помещении, при прохождении аэрозольного облака, во много раз ниже чем в самом облаке, а время существования облака обычно невелико.
Порядок оказания медицинской помощи в очаге поражения аммиаком: в течение первого часа с момента аварии, в очаге химического поражения и в зоне химического заражения, первая медицинская помощь пострадавшим, как правило, оказывается в порядке само- и взаимопомощи, силами объектовых аварийно-спасательных подразделений, спасателями МЧС, а также медицинским персоналом пострадавших объектов, санитарными дружинами (постами) работающей смены. Роль поликлиники (здравпункта, медсанчасти) аварийного объекта заключается в организации и руководстве оказания помощи поражённым, выделения бригад врачей и медсестер для работы в очаге поражения и организации пунктов сбора пораженных вне зоны заражения. Первую медицинскую помощь вначале оказывают пострадавшим, находящимся вне завалов и пожаров, затем пострадавшим по мере их розыска и извлечения. Оказание первой медицинской помощи пострадавшим возлагается на медицинских работников соответствующих объектов и спасателей МЧС, координирующих свои действия с администрацией, другими службами объектов и командирами формирований, а при их отсутствии на последних. В химическом очаге любого масштаба все пострадавшие дети должны переноситься на носилках, им оказывается помощь в первую очередь (особенно детям грудного возраста).
Итак, в данной работе мы охарактеризовали АХОВ - аммиак. Также дали определение аммиака - бесцветный газ с чрезвычайно острым, характерным, вызывающим слезы запахом, состоящий из 1 объема азота и 3 объемов водорода, а потому отвечающий формуле NH3.
Далее прогнозировали масштаб заражения аммиака при химической аварии. Выяснили, что продолжительность испарения АХОВ примерно составит 1 час 21 мин, зона заражения составляет 8,22 км2.
Также, указали, как защитить население от аварийно химически-опасного вещества - аммиака и порядок оказания медицинской помощи в очаге поражения аммиаком.
1. Малина И.К. "Развитие исследований в области синтеза аммиака", М., Химия, 1973.
Аммиак (от латинского Ammonia) — химический элемент в виде газа без цвета, обладающий неприятным запахом в естественных условиях. Он легче воздушного потока, ядовит для живых организмов, отличается высоким коэффициентом растворимости в воде. Молекулярная формула представляет собой строение в виде тригональной пирамиды с тремя микрочастицами азота, расположенными вверху. За счет неспаренных частиц азота связь полярная с водородом и неопределенная — с четвертой парой электронов.

Описание элемента

В жидкой форме аммиака молекулы соединены водородной связью. Температура, вязкость и плотность аммиака по сравнению с водой значительно ниже. Процесс кипения начинается от 33 градусов, а процесс горения или плавления — от 77 градусов по Цельсию. Показатели проводимости и диэлектрической проницаемости аммиака низкие. Следовательно, прочность связей в состоянии жидкости низкая.
Аналогично воде, аммиак в жидком состоянии ассоциирован из-за наличия водородной связи. Переход химического состава в состояние жидкости, не имеющей цвета, с плотностью 681 килограмм на метр кубический, быстрый. Проводимость тока в этом состояние практически отсутствует.
Химические свойства
По свойствам аммиак замечательный растворитель для разнообразных органических и неорганических составов. В твёрдом состоянии представляет собой кристаллы, не имеющие цвета. Может взаимодействовать с кислородом, хлоридом, серной кислотой, а также реагировать на водные и соляные растворы.
Аммиак обладает следующими химическими свойствами:
- Играет роль нуклеофила или комплексообразователя в химических реакциях. При присоединении протона образовывает аммоний: NH3 + H + → NH4 + .
- В жидком растворе происходит слабая щелочная реакция из-за протекающего процесса: NH 3 + H2О → NH4 + +ОН - .
- При воздействии кислот получается соль аммония, что демонстрирует уравнение: NH3 + HNO3 → NH4NO3.
- В соединении с металлами за счет кислотных свойств образует амиды: 2NH3 +2К →2КNH2 +Н2.
Состав амида, имида и нитрида металла образуют за счет реакции с аммиаком в жидком состоянии. Нитрид получают посредством прогревания металла в азотной атмосфере.
Амиды имеют идентичные свойства гидроксидам (за счет неэлектронных ионов ОН, NH2 и молекулы воды). Основание амида сильнее гидроксида, поэтому он подвержен гидролизу, который необратим.
Растворы амидов на основе аммиака проводят ток и подвержены диссоциации: MNH2 → M + + NH2.
Фенолфталеин в составе раствора приобретает красный оттенок, но после добавления кислот наступает процесс нейтрализации.
Аммиаку в жидком состоянии свойственны ионизирующие функции растворителя, который способен растворить щелочные металлы и щелочноземельные. При этом он приобретает синий цвет. Концентрированный раствор отличается блеском металла. Во время испарения металлы из щелочи получают в целом виде, а щёлочноземельные образуют с аммиаком комплексы со свойствами проводимости металлов.

В результате происходит распадение металлических атомов на ионы, которые положительно заряжены и электроны, сульфатированные в окружении молекул NH 3. Растворы с наличием свободных электронов имеют свойства сильнейших восстановителей.
За счет электронодонорного свойства частицы аммиака могут присутствовать в комплексных соединениях в виде лигандов. Для образования аминокомплексов вводят избыточное количество аммиака в солевой раствор металла.
Химическая реакция вызывает изменение цвета реагентов. Прочными связями комплекса обладают соединения с наличием хрома и кобальта, степень окисления которого +3.
Физическое воздействие
По физическим свойствам аммиак относится к веществам, обладающим удушающими характеристиками и действием на нервную систему. При попадании в область дыхательных путей способен токсинами поразить легкие и вызвать отек с поражением разных систем живого организма. По виду действия может быть местного применения и резорбтивного.
Аммиачные пары раздражает слизистую оболочку глаза и кожные покровы. Процесс протекает с сильным неприятным запахом. Вследствие воздействия пара происходит обильное выделение слез и боли в области лица. В результате появляется ожог роговицы глаза. Зрение человека ухудшается или происходит полная его потеря. Следом наступает приступ кашля, изменение цвета кожного покрова с сильным раздражением.
Во время попадания раствора на кожу происходит жжение пораженной поверхности и образование пузырей и изъязвлений. По своим свойствам в сжатом состояние во время процесса испарения поглощает тепло. Попадая на кожу, химический элемент способен вызвать отморожение разной степени. Наличие запаха ощущается при концентрации 37 миллиграмм на метр кубический.
Норма концентрации аммиака на рабочем месте не должна превышать 20 миллиграмм на метр кубический. Работать при более тяжелых условиях без средств индивидуальной защиты запрещено.
Раздражение глаз проявляется при 490 миллиграммах концентрации в воздухе, а зева — 280. Токсичное отравление и лёгочный отек происходит при концентрации состава в 1,5 грамма на метр кубический (если находиться в области облака испарений в течение двух часов).
Применение и использование
Аммиак входит в большое количество веществ в промышленности. Объемы изготовления этого химического элемента достигают 150 миллионов тонн. Чаще всего производят:

- азотные удобрения (аммоний и мочевина);
- вещества на взрывчатой основе;
- азотные кислоты.
Возможно применение аммиака в роли растворителя. В холодильной промышленности встречается в виде холодильного агента (R 717).
В области медицины аммиак или нашатырный спирт (более привычное название — нашатырь) выводит человека из состояния обморока, стимулирует рвотный рефлекс. Для наружного применения используют в качестве обеззараживания укусов насекомых и при обрабатывании рук врачей. При неосторожном использовании возможно получить ожог органов пищеварения, остановку работы легких.

Применение при дерматите, кожных заболеваниях, а также повреждениях кожи в результате травмы категорически запрещено. Местное использование разрешено на здоровой области кожи. При неаккуратном применении и попадании раствора на слизистую часть глазного яблока следует обработать пострадавшую область водой или борной кислотой. Обработку необходимо повторять каждые 10 минут.
Применять вещества на масляной основе и различные мази нельзя. При попадании на область носа следует промыть ее лимонной кислотой или соком из натуральных фруктов. При попадании в область рта рекомендуется обильное употребление воды, фруктового сока.
Способы получения
Аммиак производят при водородном и азотном взаимодействии молекул в промышленности. Техника производства называется процессом Габера. Вся реакция протекает с выбросом тепла и уменьшением объема. Таким образом, реакция проводится при пониженной температуре окружающей среды и повышенном давлении. Равновесие смещается вправо. В этих условиях скорость прохождения реакции маленькая, а при повышении показаний температуры скорость начинает увеличиваться. Для безопасного проведения реакции требуется специальное оборудование, поддерживающее повышенное давление.
Для ускорения получения состояния равновесия используют катализаторные материалы — железо с пористым составом и некоторым процентом добавок.
По всем свойствам процесс получения аммиака происходит при температуре в 500 градусов по Цельсию и при наличии высокого давления, достигающего 350 атмосфер. Процент добычи при соблюдении этих факторов составит 30 процентов. В промышленности процесс зациклен. Происходит охлаждение состава и удаление аммиака, а непрореагировавший азот и водород возвращают для повторного синтеза обратно. Этот способ добычи аммиака в промышленности считается самым экономичным.
В условиях лаборатории аммиак добывают за счет действия щелочей. Химический элемент получают путем нагревания аммония с известью. Для сушки аммиака используют известь с натром.
Благодаря физическим и химическим свойствам аммиака его успешно используют в промышленности, производстве, медицине, химии и многих других областях человеческой деятельности.

Особенно опасными некоторые вещества становятся в случае аварии. На этом уроке мы охарактеризуем такие вещества, а также расклассифицируем их в соответствии с их поражающими факторами.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Характеристика АХОВ и их поражающих факторов"
Вы уже знаете определение химически опасного объекта и аварийно-химически опасного вещества.
· Наиболее распространённые АХОВ: аммиак, хлор, сернистый ангидрид, сероводород, синильная кислота.
· Химически опасный объект (ХОО) — это производственный объект, где используют, хранят, перерабатывают или перевозят опасные химические вещества.
· Аварийно-химически опасные вещества (АХОВ) — это вещества, которые способны вызвать отравления людей или животных, а также нанести ущерб экосистеме.
Поражение этими веществами нарушает нормальную жизнедеятельность людей, вызывает болезни, а порой и смерть. Поэтому, в случае аварии на предприятии, необходимо действовать быстро и четко, чтобы спасти как можно больше людей и как можно быстрее ликвидировать последствия аварии.
Чтобы правильно оказать медицинскую помощь, необходимо определить характер выброса и вида ядовитого вещества. Рассмотрим основные показатели аварийно-химически опасных веществ, с помощью которых их характеризуют и распознают.
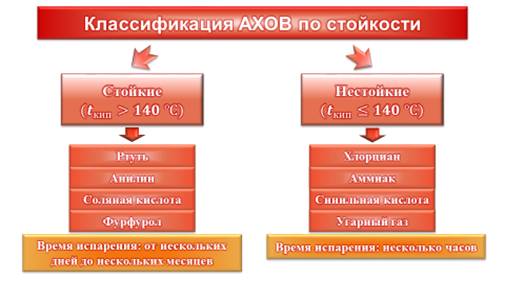
Аварийно-химически опасные вещества подразделяются на стойкие и нестойкие. Стойкие – это АХОВ, которые имеют температуру кипения выше ста сорока градусов Цельсия. Соответственно, к нестойким АХОВ относятся те вещества, которые имеют температуру кипения не более ста сорока градусов Цельсия. Дело в том, что температура кипения косвенно указывает на то, насколько быстро происходит испарение тех или иных веществ. Примерами стойких веществ являются ртуть, анилин, соляная кислота, фурфурол и другие. Эти вещества сохраняют поражающее действие на поверхности земли в течение нескольких дней или даже недель (а иногда и месяцев). Примерами нестойких веществ могут послужить хлорциан, аммиак, синильная кислота или угарный газ. Нестойкие вещества испаряются довольно быстро (буквально в течение часа).
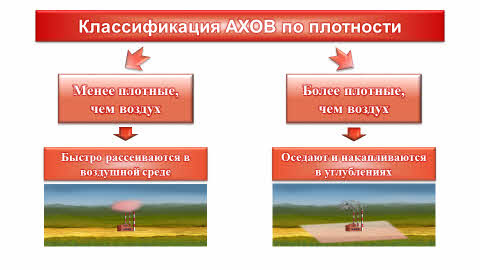
Аварийно-химически опасные вещества также характеризуются своей плотностью по отношению к воздуху (то есть, менее плотные, чем воздух и более плотные, чем воздух). Дело в том, что если плотность АХОВ меньше плотности воздуха, то они достаточно быстро рассеиваются в воздушной среде. В противном случае, газ, наоборот будет оседать и накапливаться в различных углублениях, таких, как подвалы или овраги. Таким образом, газ будет более длительное время удерживаться у поверхности земли.
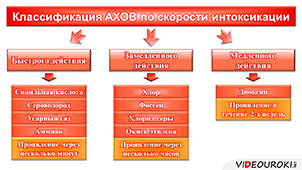
И, конечно, АХОВ характеризуются скоростью интоксикации, то есть скоростью поражения людей своим воздействием. Выделяют три группы: АХОВ быстрого действия, АХОВ замедленного действия и АХОВ медленного действия. К аварийно-химически опасным веществам быстрого действия относятся синильная кислота, сероводород, угарный газ, аммиак и другие. Интоксикация происходит практически сразу, и признаки проявляются через несколько минут. К АХОВ замедленного действия относятся хлор, фосген, хлорид серы, окись этилена и другие. Признаки интоксикации этими веществами проявляются в течение нескольких часов. Наконец, существуют АХОВ медленного действия (например, диоксин). Признаки поражения такими веществами могут проявляться в течение двух недель.
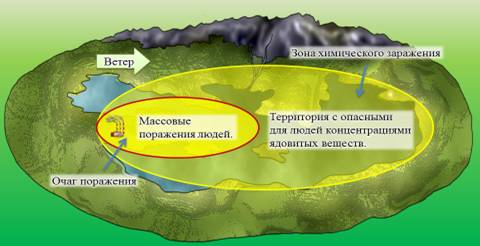
Власти, в первую очередь, стараются локализовать ЧС, то есть, в данном случае, предотвратить дальнейшее распространение ядовитых веществ. Для этого определяется зона химического заражения. Зона химического заражения – это территория с опасными для людей концентрациями ядовитых веществ. Если в зоне химического заражения произошли массовые поражения людей, то эта зона определяется как очаг поражения. Для ликвидации последствий аварии, а также для проведения спасательных операций, в зону химического заражения, как правило, высылают батальон химической защиты (военное подразделение с соответствующей экипировкой и подготовкой).
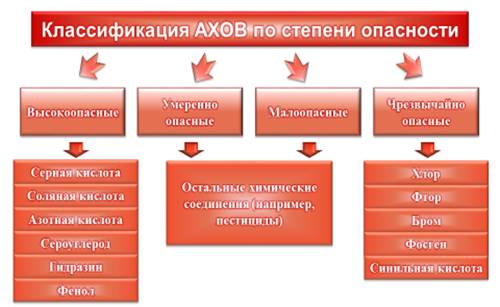
Химические вещества классифицируются по степени опасности для человеческого организма. Выделяют четыре класса: чрезвычайно опасные, высокоопасные, умеренно опасные и малоопасные. Чем меньшее количество вещества влечет за собой отравление или даже гибель людей или животных, тем более опасным оно считается. Также, к наиболее опасным веществам относятся вещества, способные быстро рассеиваться в воздухе (поскольку это приводит к массовым поражениям людей). Примерами чрезвычайно опасных веществ являются: хлор, фтор, бром, фосген и синильная кислота. К высокоопасным химическим веществам относятся различные кислоты (например, серная, соляная или азотная). К этим веществам можно отнести некоторые щелочи, а также сероуглерод, гидразин и фенол. Все остальные соединения относятся к умеренно опасным и малоопасным веществам (например, пестициды – препараты для борьбы с вредителями или сорняками).
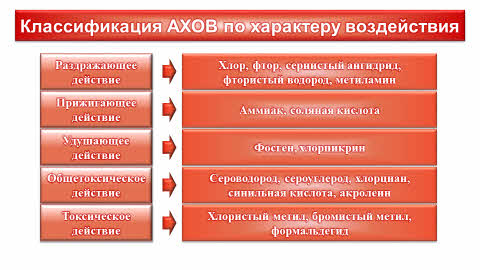
Аварийно-химически опасные вещества также подразделяются по характеру воздействия на организм человека. Раздражающее действие оказывают такие вещества, как хлор, фтор, сернистый ангидрид, фтористый водород, метиламин и другие. Следующий класс – это вещества прижигающего действия: к ним относятся аммиак и соляная кислота. Удушающее действие оказывают такие вещества как фосген и хлорпикрин. Далее следуют еще более опасные вещества, которые оказывают общетоксическое действие. К ним относятся сероводород, сероуглерод, хлорциан, синильная кислота, акролеин и другие. Наконец, в качестве примеров веществ токсического действия, можно привести хлористый и бромистый метил и формальдегид.
В качестве примера химического загрязнения, рассмотрим уже упомянутую нами техногенную катастрофу близ городка Колонтар. Из-за взрыва на заводе по производству алюминия, был разрушен резервуар с ядовитыми отходами. В результате произошла утечка приблизительно одного миллиона кубометров токсичного вещества, которое называется красный шлам. Из-за выброса такого количества ядовитого вещества был почти полностью уничтожен растительный и животный мир двух рек: Тиса и Самош. Кроме того, погибло десять человек, и ещё сто сорок серьёзно пострадало. Подобные аварии не только приносят беды людям, но и наносят огромный вред экологии. Об этом мы подробно поговорим на следующем уроке.

В заключение сегодняшнего урока, отметим следующее: главный поражающий фактор при авариях на химически опасных объектах – это заражение приземного слоя атмосферы. Это приводит к массовым поражениям людей в зоне действия аварийно-химически опасных веществ. Чтобы предотвратить распространение и правильно организовать спасательные работы, определяется зона химического заражения. В эту зону отправляются подразделения химической защиты, которые и проводят спасательные операции, а также ликвидацию последствий аварии.
Итоги урока:
· Заражение приземного слоя атмосферы является главным поражающим фактором при авариях на ХОО.
· Аварии с выбросом АХОВ приводят к массовым поражениям людей.
· Зона химического заражения — это территория с опасными для людей концентрациями ядовитых веществ.
Читайте также:

