Методы получения коллоидных растворов кратко
Обновлено: 05.07.2024
Условием получения коллоидного раствора является практическая нерастворимость вещества в выбранном растворителе. Способы получения делятся на конденсационные и дисперсионные.
I. Дисперсионные методы по способу измельчения дисперсной фазы делятся:
- на коллоидных мельницах;
1. На коллоидных мельницах вещество размельчают до размера коллоидных частиц. Этим методом пользуются в пищевой и фармацевтической промышленности. Получают краски, коллоидный графит.
2.Электродиспергирование применяют для распыления различных металлов. Между двумя электродами возбуждают электрическую дугу.
При этом материал электродов распыляется в окружающую среду (воду). Для лучшей устойчивости золя к воде добавляют щёлочь. Метан переходит в парообразное состояние и конденсируется, образуя золь (гидрозоли золота, серебра, платины и.т.д.).
II. Конденсационные методы основаны на химических реакциях, приводящих к образованию нерастворимых веществ, например: гидролиз хлорного железа в горячей воде:
III. Заменой растворителя также можно получать золи из истинных растворов.
В природных и сточных водах гидрозоли образуются самопроизвольно из гуминовых веществ, соединений железа и т.д.
Свойства коллоидных систем.
Коллоиды – гетерогенные системы состоящие из двух (или более) фаз. Коллоиды занимают промежуточное положение между взвесями и истинными растворами. От взвесей отличаются тем, что осаждаются со временем, а от истинных растворов тем, что задерживаются специальными мембранами из коллодия или бычьего пузыря.
Молекулярно-кинетические свойства коллоидных систем.
1. Броуновское движение препятствует оседанию коллоидных частиц. Причиной броуновского движения является невидимое движение молекул растворителя, сталкивающихся с коллоидными частицами.
2. Так как коллоидные частицы обладают тепловым движением, то для них характерно явление диффузии.
где - среднее смещение частицы;
D – коэффициент диффузии;
– отрезок времени, за которое произошло смещение частицы.
Коэффициент диффузии равен количеству вещества, проходящему за секунду через сечение 1 см 2 , когда разность концентрации на расстоянии 1 см равна единице:
где R – газовая постоянная;
T – температура системы, К;
r – радиус частицы;
ŋ – вязкость среды;
Na - число Авогадро.
3. Осмотическое давление золя мало по сравнению с истинными растворами. Если взять для приготовления истинного и коллоидного раствора одно и то же количество вещества, то в коллоидном растворе частичек будет меньше, так как они крупнее.
Концентрация коллоидного раствора характеризуется числом частиц в единице объёма (частичная концентрация ν). Кроме этого есть грам-частичная концентрация:
Малая грам-частичная концентрация коллоидного раствора ведёт к уменьшению осмотического давления.
4. В коллоидных системах наблюдается распределение коллоидных частиц по высоте. В нижних слоях их больше, в высоких - меньше. Такое распределение частиц называется перреновским седиментационным равновесием (аналогично распределению газа в атмосфере).
Скорость установившегося седиментационного равновесия мала, но оно может сохраняться сколь угодно долго.
Как правило, коллоидные растворы представляют собой абсолютно прозрачную жидкость. В зависимости от состава, она может быть бесцветной или окрашенной. На первый взгляд золи ничем не отличаются от истинных растворов. Изучением подобного рода субстанций занимается целый раздел – коллоидная химия.

Общая характеристика
Любой раствор представляет собой однофазную систему, включающую два компонента или более. В отличие от него, суспензия или эмульсия менее устойчивы. В жидких растворах при хранении может выпасть осадок, если, например, они помещены в негерметично закрытую тару и происходит испарение жидкости. В остальных случаях это инертная система, где компоненты не вступают в реакцию друг с другом, и поэтому она может оставаться неизменной в течение длительного времени.
Свойства коллоидных растворов

Молекулы вещества равномерно распределяются по всему растворителю, однако они постоянно совершают броуновское (колебательное) движение. Вследствие этого происходит полное перемешивание компонентов системы. Свойства коллоидных растворов в данном процессе немного другие. Частицы такой системы называются мицеллами. Они диффундируют из одного слоя жидкости в другой медленнее (в 100 раз). Причиной низкой скорости является больший объем мицелл по сравнению с молекулами истинных растворов.
В зависимости от размера частиц, их количества, коллоидные растворы отличаются по вязкости. Часто встречаются системы, переходящие в гелеобразное состояние при понижении температуры. Наличие слишком крупных мицелл и превышение предела растворимости приводит к помутнению.
Частицы коллоида, в отличие от молекул, имеют более крупные размеры и поэтому способны рассеивать свет. Таким образом, можно отличить эти растворы от истинных. При прохождении через такую систему пучок света будет виден.
Структура мицелл
Получение коллоидных растворов зиждется на образовании мицелл, которые должны пребывать для сохранения свойств системы в стабильном состоянии. Частица имеет сложную структуру, состоит из ядра, которое образуется малорастворимым веществом. Вокруг него распределяется слой потенциалоопределяющих ионов. Обычно они являются такими же, что и в малорастворимом веществе, расположенном в центре мицеллы (правило Панета–Фаянса). Такие ионы определяют заряд ядра.
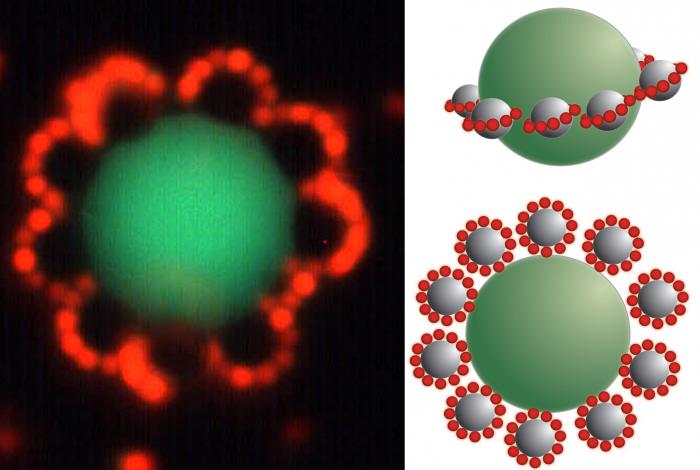
Например, при взаимодействии иодида калия и нитрата серебра образуются мицеллы. Ядром таких частиц является иодид серебра (AgI). Если преобладает второй компонент, то потенциалоопределяющими ионами будут Ag + , если первый - I - . Следующим слоем являются противоионы того вещества, которое было взято в избытке. Они образуют две зоны. Первая расположена близко к поверхности ядра, входит в состав адсорбированного слоя. Вторая входит в состав диффузионного слоя, состоит из ионов, свободно перемещающихся вблизи поверхности.
Коллоидной частицей называется ядро с адсорбированным слоем, который включает потенциалопределяющие ионы и противоионы. Данное образование имеет заряд. Мицелла включает коллоидную частицу и диффузионный слой противоионов и является нейтральной.
Как происходит образование мицеллы
Любые методы получения коллоидных растворов основаны на взаимодействии молекул труднорастворимого соединения с электролитом. Например, AgNO3 (нитрат серебра) с KI (иодидом калия). В результате реакции получается AgI и KNO3 (нитрат калия). Структуру мицеллы можно изобразить схематически. Есть 2 варианта образования коллоидных частиц из вышеуказанных соединений:
Вначале указывается ядро, потом потенциалоопределяющие ионы и противоионы адсорбированного и диффузионного слоя. Электрокинетический потенциал, который определяет заряд коллоидной частицы, обозначается буквой "x". Он возникает в силу разницы поверхностной энергии ядра частицы с потенциалоопределяющими ионами.
Стабильность

Коллоидные растворы способны сохраняться в неизменном состоянии достаточно долго. Стабильность таких систем является следствием одноименности зарядов мицелл, что приводит к их отталкиванию друг от друга. Однако при слишком больших размерах и высокой концентрации частицы могут сталкиваться и объединяться. Устойчивость коллоидных растворов – относительное понятие. Они могут храниться в неизменном состоянии достаточно долго.
Коагуляция коллоидных растворов представляет собой процесс слипания мицелл друг с другом. При стабильном состоянии системы данное явление происходит медленно, что позволяет ей сохраняться длительное (до 100 лет) время в однофазном состоянии. Такое явление получило название агрегативная неустойчивость.
Скорость коагуляции
Скорость агрегации частиц и, как следствие, разделения фаз зависит от многих факторов, в том числе от размера и концентрации мицелл, температуры хранения. К ускорению процесса коагуляции приводит добавление электролита. Данное явление наблюдается в гидрофильных системах. Известны методы замедления процесса агрегации частиц. Например, смешение липофильного коллоида с гидрофильным. На утрату стабильного состояния золей может повлиять нагрев или охлаждение, механическое воздействие.
Коагуляция коллоидных растворов с помощью электролитов
Существуют определенные закономерности влияния электролитов на коллоидный раствор. Так, для начала процесса нужна определенная концентрация последнего, не ниже определенного уровня - порог коагуляции. Электролит – вещество, способное проводить электрический ток в результате диссоциации в растворе или расплава на ионы. На состояние коллоидного раствора влияет ион, заряд которого противоположен таковому у мицеллы. Действие усиливается со степенью заряда (правило Шульце-Гарди).
Другой фактор, определяющий степень влияния ионов, – их гидратируемость. Частицы с одноименным зарядом оказывают разный уровень действия на процесс коагуляции. При разделении коллоидного раствора ионы, вызвавшие коагуляцию, присутствуют в осадке. При добавлении смеси электролитов ее компоненты могут ослаблять действие друг друга (антагонизм) или, наоборот, усиливать (синергизм). Реже наблюдается независимое (аддитивное) влияние.
Способы получения

Методы получения коллоидных растворов сводятся к двум. Одним из вариантов является диспергирование (измельчение) крупных частиц до размеров, соответствующих коллоидным. Такой процесс можно осуществлять, например, с использованием ультразвуковых приборов (механическое измельчение). Разновидностью дисперсных методов является формирование коллоидных частиц в результате добавления электролитов, которые адсорбируются на поверхности коллоидных ядер и переводят частицы в растворенное состояние.
Противоположным дисперсионному методу является конденсационный, заключающийся в агрегации мелких частиц в более крупные. Такое явление происходит, например, при замене растворителя. Каким образом можно добиться такого эффекта? Наблюдается резкое снижение растворимости в силу изменения среды. Далее вещество образует коллоидную частицу. В ее формировании участвуют молекулы растворителя, с которым оно лучше смешивается. Такой эффект, например, достигается при постепенном добавлении канифоли, растворенной в этаноле, к воде.
Различного рода конденсационные реакции, в том числе описанные выше, также относятся к методам агрегации. Другими примерами может являться гидролиз солей металлов, в частности хлорида железа (FeCl3), реакция нейтрализации в результате взаимодействия гидроксида бария (Ba(OH)2) с серной кислотой (H2SO4).
Солюбилизация
Значение коллоидных растворов в жизни человека велико в связи со способностью поверхностно-активных веществ повышать растворение гидрофобных соединений в воде. Такое явление получило название "солюбилизация". По своей сути данный процесс представляет растворение соединений в мицеллах. Благодаря этому явлению порошки способны удалять загрязнение с тканей, получаются устойчивые эмульсии углеводородов и красителей в воде.
Солюбилизация может проходить разными способами. Так, неполярные углеводороды проникают в ядро мицеллы, в то время как соединения, имеющие гидрофильную и гидрофобную часть (амины, спирты), встраиваются так, что первая находится снаружи, а вторая уходит вглубь коллоидной частицы. Существует также такое явление, как обратная солюбилизация, заключающаяся в растворении воды в маслах. В случае неионогенных ПАВов выделяют еще один способ повышения растворимости гидрофобных соединений – прикрепление к поверхности мицеллы посредством химических связей (водородных в частности).
Повсеместное распространение
Коллоидные растворы присутствуют неизменно внутри человека и вокруг него. К ним относятся кровь, лимфа, часто используемые в различных строительных и отделочных работах клеи и краски. Из коллоидных растворов в результате коагуляции и осаждения получают гели. К таковым можно, например, отнести холодец, мармелад, агар-агар, желатин, каррагинаны. Последние используются для улучшения структуры продуктов, в частности паштетов. Везде в организме человека присутствуют коллоидные растворы, обогащенные белками.
Использование в медицине

В медицине коллоидные растворы применяются повсеместно. Вот несколько примеров их использования. Коллоидное серебро, представляющее собой мелкие частицы металла, диспергированные в воде, применяется при лечении ожогов, язвенных болезней желудка и двенадцатиперстной кишки, для промывания слизистой носа в целях предотвращения распространения вирусных инфекций.
Применение в быту и промышленности
Коллоидные растворы составляют основу моющих и чистящих ПАВов. Загрязнения проникают внутрь мицеллы и таким образом удаляются с поверхности.
Другой важный аспект применения мицеллообразующих ПАВов – производство полимеров, в частности латексов, поливинилового спирта, клеев растительного происхождения. Различные пластмассы, кожзаменители получены на основе эмульсии. ПАВы применяются также при очистке сточных вод и питьевой воды.
Для получения коллоидных систем, применяют, в основном, 2 метода:
- Дисперсионный метод – используют дробление твердого вещества до частиц, размером, соответствующих коллоидам. Измельчение производят:
- механически при помощи шаровых мельниц, гомогенизаторов или ультразвуковых дезинтеграторов;
- с помощью физико-химических способов, таких как пептизация, добавление поверхностно–активных веществ.
- Конденсационный метод — укрупнение частиц путем агрегации молекул или ионов, до размеров, соответствующих коллоидам. Это можно реализовать следующими способами:
- испарение растворителя;
- замена растворителя;
- осуществление реакций, в результате которых образуются малорастворимые или нерастворимые вещества – реакции окисления – восстановления, разложения, гидролиза и др.
Способы очистки коллоидных систем
Коллоидные растворы могут содержать примеси, снижающие их стабильность, вследствие чего производят их очистку. Для этого используют такие методы, как диализ, электродиализ, фильтрация и ультрафильтрация.

- Диализ — удаление низкомолекулярных соединений с помощью мембран, способных задерживать коллоидные частицы и пропускать частицы меньшего размера. Прибор, используемый в этих целях, называют диализатором: Диализатор
Коллоидный раствор наливают в сосуд, в нижней части которого находится мембрана и помещенный в емкость с водой. В растворитель проникают лишь ионы и молекулы низкомолекулярных примесей.
Процесс диализа протекает медленно и для его ускорения используют электрическое поле.
- Электродиализ – используется для увеличения скорости диализа посредством электрического поля. Прибор, используемый для проведения электродиализа, называют электродиализатором. Он состоит из трех частей: средняя часть отделена полупроницаемыми мембранами от соседних частей, соединенных с электродами. Коллоидный раствор помещается в среднюю часть электродиализатора. При создании электрического поля, находящиеся в коллоидном растворе катионы, начинают движение через мембрану к катоду, а анионы – к аноду. Электродиализатор
- Фильтрация и Ультрафильтрация – это процесс отделения примесей от коллоидных частиц путем фильтрования коллоидного раствора через полупроницаемые мембраны под давлением. Ультрафильтрация
Чистые вещества в природе встречаются очень редко. Смеси разных веществ в различных агрегатных состояниях могут образовывать гетерогенные и гомогенные системы — дисперсные системы и растворы.
Дисперсными называют гетерогенные системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объеме другого.
То вещество, которое присутствует в меньшем количестве и распределено в объеме другого, называют дисперсной фазой . Она может состоять из нескольких веществ.
Вещество, присутствующее в большем количестве, в объеме которого распределена дисперсная фаза, называют дисперсионной средой . Между ней и частицами дисперсной фазы существует поверхность раздела, поэтому дисперсные системы называют гетерогенными (неоднородными).
И дисперсионную среду, и дисперсную фазу могут представлять вещества, находящиеся в различных агрегатных состояниях — твердом, жидком и газообразном.
В зависимости от сочетания агрегатного состояния дисперсионной среды и дисперсной фазы можно выделить 9 видов таких систем.
По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делят на грубодисперсные (взвеси) с размерами частиц более 100 нм (1 нм = 10 -9 м) и тонкодисперсные (коллоидные растворы или коллоидные системы) с размерами частиц от 100 до 1 нм. Если же вещество раздроблено до молекул или ионов размером менее 1 нм, образуется гомогенная система — раствор. Она однородна (гомогенна), поверхности раздела между частицами и средой нет.
Уже беглое знакомство с дисперсными системами и растворами показывает, насколько они важны в повседневной жизни и в природе.
Судите сами: без нильского ила не состоялась бы великая цивилизация Древнего Египта; без воды, воздуха, горных пород и минералов вообще бы не существовала живая планета — наш общий дом — Земля; без клеток не было бы живых организмов и т. д.
Классификация дисперсных систем и растворов
Взвеси
Взвеси — это дисперсные системы, в которых размер частиц фазы более 100 нм. Это непрозрачные системы, отдельные частицы которых можно заметить невооруженным глазом. Дисперсная фаза и дисперсионная среда легко разделяются отстаиванием. Такие системы разделяют на:
1) эмульсии (и среда, и фаза — нерастворимые друг в друге жидкости). Это хорошо известные вам молоко, лимфа, водоэмульсионные краски и т. д.;
3) аэрозоли — взвеси в газе (например, в воздухе) мелких частиц жидкостей или твердых веществ. Различают пыли, дымы, туманы. Первые два вида аэрозолей представляют собой взвеси твердых частиц в газе (более крупные частицы в пылях), последний — взвесь мелких капелек жидкости в газе. Например, природные аэрозоли: туман, грозовые тучи — взвесь в воздухе капелек воды, дым — мелких твердых частиц. А смог, висящий над крупнейшими городами мира, также аэрозоль с твердой и жидкой дисперсной фазой. Жители населенных пунктов вблизи цементных заводов страдают от всегда висящей в воздухе тончайшей цементной пыли, образующейся при размоле цементного сырья и продукта его обжига — клинкера. Аналогичные вредные аэрозоли — пыли — имеются и в городах с металлургическими производствами. Дым заводских труб, смоги, мельчайшие капельки слюны, вылетающие изо рта больного гриппом, также вредные аэрозоли.
Аэрозоли играют важную роль в природе, быту и производственной деятельности человека. Скопления облаков, обработка полей химикатами, нанесение лакокрасочных покрытий при помощи пульверизатора, распыление топлив, выработка сухих молочных продуктов, лечение дыхательных путей (ингаляция) — примеры тех явлений и процессов, где аэрозоли приносят пользу. Аэрозоли — туманы над морским прибоем, вблизи водопадов и фонтанов, возникающая в них радуга доставляет человеку радость, эстетическое удовольствие.
Для химии наибольшее значение имеют дисперсные системы, в которых средой является вода и жидкие растворы.
Природная вода всегда содержит растворенные вещества. Природные водные растворы участвуют в процессах почвообразования и снабжают растения питательными веществами. Сложные процессы жизнедеятельности, происходящие в организмах человека и животных, также протекают в растворах. Многие технологические процессы в химической и других отраслях промышленности, например получение кислот, металлов, бумаги, соды, удобрений, протекают в растворах.
Коллоидные системы
Коллоидные системы — это такие дисперсные системы, в которых размер частиц фазы от 100 до 1 нм. Эти частицы не видны невооруженным глазом, и дисперсная фаза и дисперсионная среда в таких системах отстаиванием разделяются с трудом.
Их подразделяют на золи (коллоидные растворы) и гели (студни).
1. Коллоидные растворы, или золи. Это большинство жидкостей живой клетки (цитоплазма, ядерный сок — кариоплазма, содержимое органоидов и вакуолей) и живого организма в целом (кровь, лимфа, тканевая жидкость, пищеварительные соки, гуморальные жидкости и т. д.). Такие системы образуют клеи, крахмал, белки, некоторые полимеры.
Читайте также:

