Контроль качества псо кратко
Обновлено: 03.07.2024
В современных условиях высокого уровня инфицированности населения возбудителями гемоконтактных инфекций особенно актуальной является проблема обеспечения безопасности пациентов и персонала лечебно-профилактических организаций. Медицинская помощь сопряжена с необходимостью проведения многочисленных инвазивных манипуляций, при этом технологии не всегда позволяют использовать одноразовый медицинский инструментарий.
Как известно, инфицированные инструменты и материалы являются приоритетными факторами передачи гемоконтактных инфекций. Снижение риска заражения достигается применением одноразовых расходных материалов, а также путем трехступенчатой обработки медицинских изделий многоразового использования (дезинфекция, предстерилизационная очистка, стерилизация).
II. Организация дезинфекционных и стерилизационных мероприятий в организациях, осуществляющих медицинскую деятельность
2.1. Медицинские изделия многократного применения подлежат последовательно: дезинфекции, предстерилизационной очистке, стерилизации, последующему хранению в условиях, исключающих вторичную контаминацию микроорганизмами.
Наиболее критичным этапом обработки является предстерилизационная очистка, предусматривающая непосредственный контакт персонала с изделием. Именно на этом этапе довольно часто возникают аварийные ситуации (уколы, порезы), которыми нередко пренебрегают, поэтому не принимают экстренных мер профилактики. Однако инструментарий, прошедший только один этап обработки — дезинфекцию, не является биологически безопасным. Докажем это утверждение, перечислив типичные ошибки, допускаемые при дезинфекции:
•использование неразрешенных к применению средств и методов дезинфекции (на средство не оформлена необходимая разрешительная документация либо оно не может использоваться в лечебно-профилактических организациях, является фальсификатом и др.);
•нарушение условий хранения и транспортировки дезинфекционных средств (несоблюдение температурного режима хранения, воздействие прямых солнечных лучей, истекший срок годности исходного препарата и др.);
•неправильный выбор средства дезинфекции (не предназначено для уничтожения возбудителей вирусных гепатитов В, С и ВИЧ);
•неправильно выбранный режим дезинфекции (не обеспечивает гибель возбудителей гемоконтактных инфекций);
•некорректно проведенная дезинфекция (при изготовлении раствора дезинфектанта допущена ошибка в расчете концентрации, не выдержано время экспозиции, истек срок годности рабочего раствора и др.).
III. Требования к осуществлению дезинфекционной деятельности
3.6.5. Не допускается применение для обеззараживания изделий медицинского назначения дезинфицирующих средств, не обладающих вирулицидным действием.
Наличие одной или нескольких ошибок сводит качество дезинфекции практически к нулю, как следствие, на этапе предстерилизационной очистки персонал имеет дело с опасным в биологическом плане инструментарием.
Кроме того, риск заражения персонала на втором этапе обработки инструментария обусловлен следующими факторами:
•непосредственный контакт персонала с медицинскими изделиями. В большей степени это относится к очистке вручную, однако и при механизации процесса персонал контактирует с изделиями при их перекладывании и сортировке;
•пренебрежение средствами индивидуальной защиты, в первую очередь перчатками.
Еще одна проблема связана с недостаточной информированностью персонала. Большинство современных средств дезинфекции содержат моющий компонент и предназначаются для проведения дезинфекции, совмещенной с предстерилизационной очисткой. Однако это не значит, что при погружении в раствор такого средства изделие одновременно проходит два этапа обработки. По окончании времени дезинфекции обязательно должна быть проведена очистка каждого изделия ручным или механизированным способом. Ручной способ подразумевает обработку каждого изделия в моющем растворе ершом или ватно-марлевым тампоном в течение 0,5–1 минуты. Механизированная очистка осуществляется с использованием специального оборудования, разрешенного к применению на территории Российской Федерации, имеющего сертификат соответствия и инструкцию по эксплуатации.
В чем же заключается суть совмещения дезинфекции с предстерилизационной очисткой? Ответ прост: между двумя этапами не требуется смена раствора дезинфектанта, содержащего моющий компонент. Иными словами, предстерилизацияонная очистка изделий осуществляется в том же растворе, в котором проводилась их дезинфекция. Все это, как правило, отражается в инструкции по применению средств дезинфекции, однако на практике ошибки в совмещении двух этапов обработки все же встречаются.
На схемах 1, 2, 3 представлены этапы предстерилизационной очистки, осуществляемой ручным способом, а также совмещенной с дезинфекцией.
Схема 1. Этапы проведения предстерилизационной очистки ручным способом[3]
Промывание проточной водой после дезинфекции
Замачивание в моющем растворе при полном погружении изделия в разобранном виде с заполнением всех каналов и полостей на 15–60 минут в зависимости от применяемого средства
Мойка каждого изделия в моющем растворе ершом или ватно-марлевым тампоном в течение 0,5–1 минуты (обращаем внимание на температуру раствора моющего средства, если данное условие оговаривается в инструкции по применению моющего средства)
Ополаскивание проточной водой в течение времени, предусмотренного инструкцией к применяемому средству (раковина для ополаскивания инструментов не должна применяться для мытья рук медицинского персонала)
Ополаскивание дистиллированной водой с последующей сушкой горячим воздухом
Схема 2. Этапы проведения предстерилизационной очистки, совмещенной с дезинфекцией, ручным способом
Замачивание в растворе средства, обладающего дезинфицирующими и моющими свойствами
Мойка каждого изделия в моющем растворе ершом или ватно-марлевым тампоном в течение 0,5–1 минуты (обращаем внимание на температуру раствора, если данное условие оговаривается в инструкции по применению средства)
Ополаскивание проточной водой в течение времени, предусмотренного инструкцией к применяемому средству (раковина для ополаскивания инструментов не должна применяться для мытья рук медицинского персонала)
Ополаскивание дистиллированной водой с последующей сушкой горячим воздухом
Схема 3. Этапы проведения предстерилизационной очистки, совмещенной с дезинфекцией, механизированным способом
Помещение изделий в оборудование, предназначенное для дезинфекции и предстерилизационной очистки. Используются средства дезинфекции с моющим эффектом; или отдельно средства дезинфекции и моющие средства; или только моющие средства, а дезинфекция осуществляется термическим способом; или другое в соответствии с инструкцией по эксплуатации оборудования
Ополаскивание проточной водой в течение времени, предусмотренного инструкцией к применяемому средству. Режим использования может быть включен в цикл работы оборудования
Ополаскивание дистиллированной водой с последующей сушкой горячим воздухом. Режим ополаскивания дистиллированной водой и сушки может быть включен в цикл работы оборудования
Наиболее перспективной является предстерилизационная очистка механизированным способом, среди преимуществ которой:
•сокращение тактильного контакта рук медицинского персонала с обрабатываемым инструментарием (биологическая безопасность персонала);
•сокращение времени обработки большого объема медицинских изделий (экономическая эффективность);
•предотвращение повреждения дорогостоящих изделий и инструментов, увеличение срока их службы (экономическая эффективность);
•значительное улучшение качества очистки медицинских инструментов и изделий сложной конфигурации (биологическая безопасность пациента).
•высокое пенообразование (при использовании механизированного способа предстерилизационной очистки этот фактор может быть критичным ввиду несовместимости оборудования с моющим средством);
•образование пленки на поверхности обрабатываемых изделий, что требует тщательного смывания препарата;
•достижение максимального моющего эффекта возможно лишь при определенной заданной температуре, что обуславливает необходимость поддержания температуры раствора при проведении предстерилизационной очистки.
Препараты на основе ферментов содержат бактериальные протеазы, которые способны разрушать не только клеточные стенки бактерий и белковые оболочки вирусов, но и биопленки. При этом такие моющие средства, как правило, активны при комнатной температуре и обладают низким пенообразованием. Широкое применение данных препаратов ограничивает более высокая стоимость по сравнению со средствами на основе ПАВ.

Контроль качества предстерилизационной очистки изделий медицинского назначения осуществляется посредством постановки азопирамовой (амидопириновой) и фенолфталеиновой проб. Наличие остаточных количеств крови оценивается с помощью азопирамовой или амидопириновой, моющих средств — фенолфталеиновой проб. Обратим внимание, что фенолфталеиновая проба работает только в щелочной среде и пригодна для контроля в том случае, если для предстерилизационной очистки использовалось моющее средство, pH которого более 8,5. Показатель pH, как правило, указывается в инструкции к каждому конкретному средству. Контроль качества предстерилизационной очистки изделий медицинского назначения является неотъемлемой частью системы производственного контроля, действующей в лечебно-профилактической организации. Документом, доказывающим факт проведения такого контроля, является журнал учета качества предстерилизационной обработки .
II. Организация дезинфекционных и стерилизационных мероприятий в организациях, осуществляющих медицинскую деятельность
2.14. Контроль качества предстерилизационной очистки проводят ежедневно. Контролю подлежат: в стерилизационной — 1 % от каждого наименования изделий, обработанных за смену; при децентрализованной обработке — 1 % одновременно обработанных изделий каждого наименования, но не менее трех единиц. Результаты контроля регистрируют в журнале.
Таким образом, от правильно организованной предстерилизационной обработки многоразового инструментария зависит биологическая безопасность как пациентов, так и персонала клиники. Повышению уровня безопасности способствует внедрение в практику новых средств, методов и технологий, которые существенно улучшают качество обработки изделий и сокращают контакт персонала с потенциально опасными изделиями. Контрольные мероприятия необходимо рассматривать как элемент системы менеджмента качества медицинской помощи, а не как рутинный процесс, которым можно пренебречь.
[1] Утверждены Постановлением Главного государственного санитарного врача РФ от 18.05.2010 № 58.
[2] Утверждены Постановлением Главного государственного санитарного врача РФ от 09.06.2003 № 131.
Соломай Т. В., канд. мед. наук, зам. руководителя Межрегионального управления № 1 ФМБА России

Предстерилизационная очистка (ПСО) является этапом обработки медицинского инструментария, который следует за дезинфекцией и предшествует стерилизации. ПСО может проводиться как совмещенно с дезинфекцией, так и в качестве самостоятельной процедуры. Если ПСО проводится после дезинфекции, остатки дез.средств должны тщательно смываться с инструментов под проточной водой. ПСО, совмещенная с дезинфекцией, проводится с помощью дез.средств, обладающих как дезинфицирующими, так и моющими свойствами.
Оглавление
Предстерилизационная очистка ИМН
Нормативный документ, на котором основываются мероприятия по предстерилизационной очистке — Методические указания по дезинфекции, предстерилизационной очистке и стерилизации изделий медицинского назначения. МУ-287-113 (утвержденные Департаментом Госсанэпиднадзора Минздава РФ 30.12.1998).
Профилактика ИСМП — важнейшая задача в деятельности всех медицинских организаций. Использование одноразового инструментария позволяет снизить риск внутрибольничного заражения, однако полный отказ от использования многоразовых инструментов пока невозможен. Поэтому необходимо качественная обработка медицинских изделий на всех этапах, в том числе и на этапе предстерилизационной очистки.
Определение
Предстерилизационная очистка (ПСО) — комплекс мероприятий, направленный на удаление с поверхности изделий медицинского назначения любых органических и неорганических загрязнений, в том числе остатков лекарственных веществ. ПСО должна сопровождаться снижением общей микробной контаминации для облегчения их последующей стерилизации.
Предстерилизационную очистку проводят в централизованном стерилизационном отделении (ЦСО), а при его отсутствии — в специально оборудованном помещении (например, моечная). Предстерилизационной очистке подвергаются все медицинские инструменты:
- контактирующие с кровью, открытыми ранами, слизистыми оболочками, препаратами для парентерального введения,
- а также при риске повреждения целостности кожи и слизистых при использовании.
Предстерилизационная очистка: виды
ПСО может проводиться двумя способами:
При ручном способе очистка производится непосредственно в моющем растворе, либо непосредственно в дезинфицирующем растворе (если он обладает моющими свойствами).

Алгоритм ПСО ручным способом:
- промывание инструментов под проточной водой с целью удаления остатков дез.средств
- приготовление моющего раствора согласно инструкции
- погружение в моющий раствор в разобранном виде и с наполнением всех каналов на 15-30 минут (согласно инструкции к моему средству)
- мытье и очистка в растворе с помощью ершей и ватно-марлевых тампонов в течение 30-60 сек.
- тщательное промывание под проточной водой
- ополаскивание дистиллированной водой (по 0,5 минуты на каждый инструмент, пятикратное погружение)
- высушивание до полного исчезновения влаги
При использовании дез.средств, содержащих моющие компоненты, возможно совмещение дезинфекции и ПСО в один этап.
Алгоритм дезинфекции, совмещенной с ПСО:
- приготовление дезинфицирующего раствора с моющими свойствами согласно инструкции
- погружение инструментов в раствор дез.средства с моющими компонентами, экспозиция согласно инструкции
- по окончании экспозиции проводят очистку и мытье инструментов в этом же растворе с помощью ершей и ватно-марлевых тампонов в течение 30-60 сек.
- тщательное промывание под проточной водой (0,5-5 минут, согласно инструкции к моющему средству)
- ополаскивание дистиллированной водой (по 0,5 минуты на каждый инструмент, пятикратное погружение)
- высушивание до полного исчезновения влаги
Механизированный способ обработки проводят с помощью аппаратов и специального оборудования — ультразвуковым или струйным методом.

Дезинфекция + ПСО механизированным способом:
- приготовление раствора из дез.средства с моющими компонентами, помещение его в емкости оборудования для ПСО
- погружение в раствор инструментов в разобранном виде
- тщательное промывание под проточной водой (0,5-5 минут, согласно инструкции к моющему средству)
- ополаскивание дистиллированной водой (по 0,5 минуты на каждый инструмент, пятикратное погружение)
- высушивание до полного исчезновения влаги
Предстерилизационная очистка: контроль качества
Цель ПСО — полное удаление следов крови, остатков белковых, жировых, механических загрязнений и лекарственных препаратов с поверхности МИ. От полноты и качества проведения ПСО зависит эффективность последующей стерилизации, поэтому в медицинской организации проводится обязательный ежедневный контроль качества ПСО.
После проведения всех этапов очистки инструментов обязательно проводится выборочный контроль качества. С этой целью используются:
- азопирамовая или амидопириновая проба — показывает качество очистки от крови
- фенолфталеиновая проба — показывает качество очистки от моющих и дезинфицирующих средств
Контролю подвергается 1% от общего числа обработанных инструментов, но не менее 3-5 единиц. При положительной пробе на кровь или моющее средство всю группу изделий, из которой отбирались образцы, подвергают повторной обработке до получения отрицательных результатов.
Фенолфталеиновая проба проводится, если для ПСО использовался состав с уровнем кислотно-щелочного баланса 8,5 и выше (этот показатель обычно указывается на этикетке или в инструкции к средству).
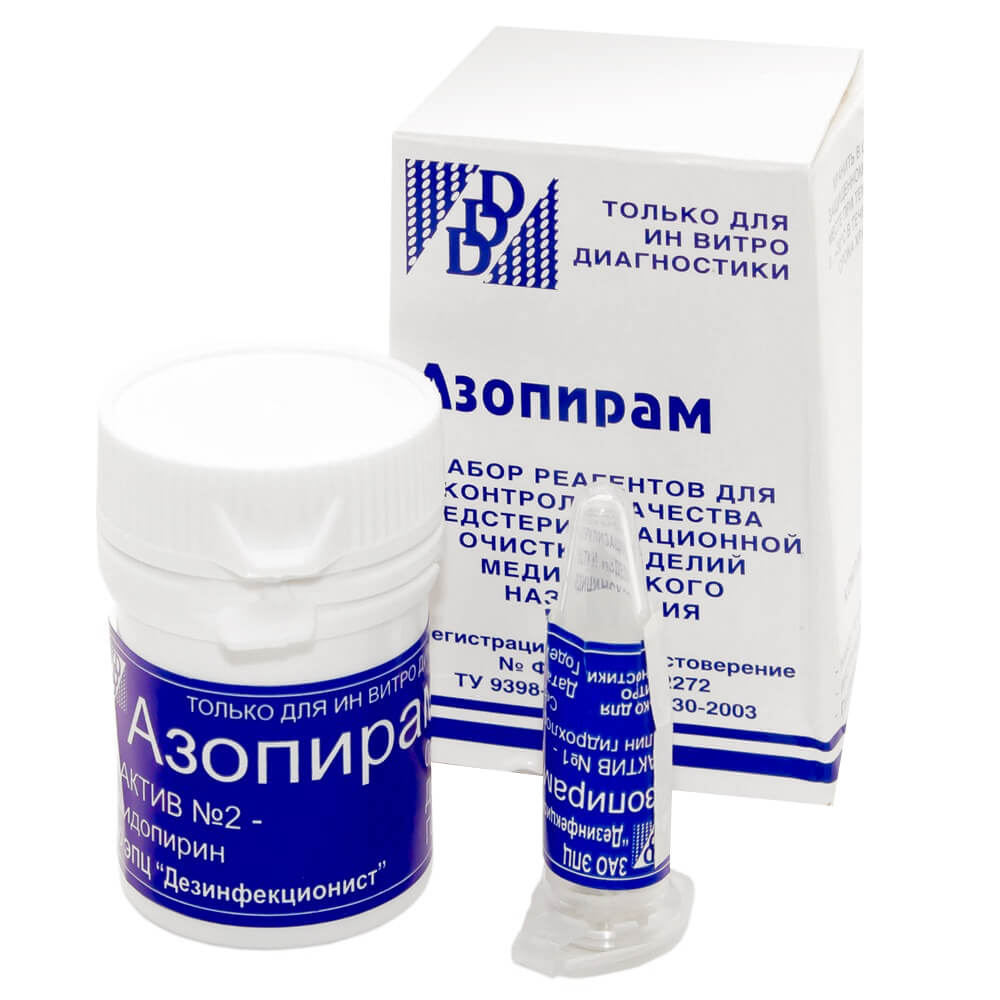
Реактивы для проведения проб готовят непосредственно перед процедурой контроля или заранее, но при условии соблюдения дальнейших условий их хранения:
- растворы амидопирина и фенолфталеина хранятся в течение 30 суток в холодильнике во флаконе с плотно закрывающейся крышкой.
- раствор азопирама хранится в холодильнике не больше 2 часов с момента приготовления, а при температуре +25°C и выше – не более 30 минут
Помимо этого, раствор азопирама перед применением необходимо проверить на предмет пригодности:
- если при окрашивании пятна крови проявляются не позже чем через 60 секунд – раствор может использоваться
- окрашивание не проявилось даже через минуту – раствор непригоден!
Инструменты и изделия во время процедуры контроля должны иметь температуру окружающей среды. Горячие инструменты проверке не подвергаются. Результаты проверок заносятся в журнал учета качества предстерилизационной очистки изделий медицинского назначения, в которым отмечается: дата проведения предстерилизационной очистки; методика обработки; состав, использующийся для проведения ПСО; результаты выборочного химического контроля обработанных ИМН; название и число проконтролированных ИМН; число положительных азопирамовых, амидопириновых или фенолфталеиновых проб.
Название раствора, использовавшегося для обработки ИМН и указанного в журнале, должно полностью совпадать с названием, указанным на этикетке емкости.

При ПСО наборов инструментов отдельно указывается каждый их них – упоминается каждое входящее в него изделие, его наименование и количество. Перечни наборов прикладываются к журналу. Если в ходе проверки надзорных ведомств обнаружится, что заполнение журнала контроля ПСО производилось с дефектами или не производилось вовсе, это может быть расценено как грубое нарушение. В этом случае на руководство лечебного учреждения может быть наложен штраф или использованы другие меры административного воздействия.
Меры безопасности при ПСО
При осуществлении ПСО существует риск парентерального заражения персонала лечебного учреждения. Это возможно: при порезах, царапинах, ссадинах кожи рук острыми инструментами, обсемененными болезнетворными микроорганизмами; при попадании капель жидкости или обсемененных аэрозолей на слизистые рта или в глаза.
При нарушении правил работы с химикатами или пренебрежении к мерам защиты в случае ЧП возможно как местное раздражение кожи, глаз, слизистых и дерматиты, так и системное отравление организма.
Меры эпидемиологической предосторожности включают в себя:
- Вакцинацию против вирусного гепатита В.
- Использование при ПСО влагонепроницаемых фартуков, щитков, масок, перчаток.
- Очистку каналов ИМН вручную под толщей моющего средства.
- Противовирусную обработку емкостей и технических очистительных приспособлений с учетом рекомендаций производителя.
- Сбор, дезинфекцию, уничтожение использованных салфеток и смывных вод в соответствии с требованиями к обращению с отходами класса Б.
- Мытье рук только в специально отведенной для этих целей раковине (мытье рук в ванне для предстерилизационной очистки инструментов строго запрещено).
- Недопущение до выполнения ПСО работников с заболеваниями кожи рук – мокнущими дерматитами, экземой, гнойничковыми поражениями и др. (в случае крайней необходимости допустить сотрудника к данной работе можно, но при условии, что все поражение кожи заклеены лейкопластырем).




Добавить комментарий
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.

1. Контроль качества предстерилизационной очистки проводят центры Государственного санитарно-эпидемиологического надзора и дезинфекционные станции не реже 1 раза в квартал.
Самоконтроль в ЛПУ проводят: в централизованных стерилизационных (ЦС) ежедневно, в отделениях - не реже 1 раза в неделю; организует и контролирует его старшая медицинская сестра (акушерка) ЦС (отделения).
2. Контролю подлежит: в ЦС - 1% от каждого наименования изделий, обработанных за смену, в отделениях - 1% одновременно обработанных изделий каждого наименования, но не менее 3 единиц.
3. Качество предстерилизационной очистки изделий оценивают путем постановки азопирамовой или амидопириновой пробы на наличие остаточных количеств крови, а также путем постановки фенолфталеиновой пробы на наличие остаточных количеств щелочных компонентов моющих средств.
4. Методика приготовления реактивов для постановки проб.
4.1. Азопирамовая проба.
4.1.1. Приготовление исходного раствора.
Для приготовления 1 л (дм3) исходного раствора азопирама отвешивают 100 г амидопирина и 1,0 - 1,5 г солянокислого анилина, смешивают их в сухой мерной посуде и доводят до объема 1 л (дм3) 95% этиловым спиртом. Смесь тщательно перемешивают до полного растворения ингредиентов.
Исходный раствор азопирама следует хранить в плотно закрытом флаконе в темноте. Допустимый срок хранения исходного раствора азопирама составляет 2 месяца при температуре 4 C (в холодильнике); при комнатной температуре (20+-2°C) - не более 1 месяца. Умеренное пожелтение исходного раствора в процессе хранения без выпадения осадка не снижает рабочих свойств раствора.
4.1.2. Приготовление реактива азопирам.
Перед постановкой пробы готовят реактив азопирам, смешивая равные объемные количества исходного раствора азопирама и 3% раствора перекиси водорода. Реактив азопирам можно хранить не более 2 часов. При более длительном стоянии может появиться розовое спонтанное окрашивание реактива. При температуре выше +25°C раствор розовеет быстрее, поэтому его необходимо использовать в течение 30 - 40 мин. Не следует подвергать проверке горячие инструменты, а также хранить реактив азопирам на ярком свету и вблизи нагревательных приборов.
В случае необходимости пригодность реактива азопирам проверяют следующим образом: 2 - 3 капли реактива наносят на пятно крови. Если не позже чем через 1 мин появляется фиолетовое окрашивание, переходящее затем в сиреневый цвет, реактив пригоден к употреблению; если окрашивание в течение 1 мин не появляется, реактивом пользоваться не следует.
4.2. Амидопириновая проба.
Готовят 5% спиртовой раствор амидопирина на 95% этиловом спирте. Данный раствор должен храниться во флаконе с притертой пробкой в холодильнике; срок годности раствора - 1 месяц.
Готовят 30% раствор уксусной кислоты и 3% раствор перекиси водорода на дистиллированной воде.
Смешивают равные количества 5% спиртового раствора амидопирина, 30% раствора уксусной кислоты и 3% раствора перекиси водорода. Реактив готовят перед применением.
4.3. Фенолфталеиновая проба.
Готовят 1% спиртовой раствор фенолфталеина на 95% этиловом спирте; раствор хранят во флаконе с притертой пробкой в холодильнике в течение месяца.
5. Методика постановки проб.
Контролируемое изделие протирают марлевой салфеткой, смоченной реактивом, или наносят 2 - 3 капли реактива на изделие с помощью пипетки.
В шприцы вносят 3 - 4 капли рабочего раствора реактива и несколько раз продвигают поршнем для того, чтобы смочить реактивом внутреннюю поверхность шприца, особенно места соединения стекла с металлом, где чаще всего остается кровь; реактив оставляют в шприце на 1 мин, а затем вытесняют на марлевую салфетку. При проверке качества очистки игл реактив набирают в чистый, не имеющий следов коррозии шприц. Последовательно меняя иглы, через них пропускают реактив, вытесняя 3 - 4 капли на марлевую салфетку.
Качество очистки катетеров и других полых изделий оценивают путем введения реактива внутрь изделия с помощью чистого шприца или пипетки. Реактив оставляют внутри изделий на 1 мин, после чего сливают на марлевую салфетку. Количество реактива, вносимого внутрь изделия, зависит от величины изделия.
6. Учет результатов постановки проб.
При положительной азопирамовой пробе в присутствии следов крови немедленно или не позднее, чем через 1 мин, появляется вначале фиолетовое, затем быстро в течение нескольких секунд переходящее в розово-сиреневое или буроватое окрашивание реактива.
Азопирам, кроме гемоглобина, выявляет наличие на изделиях остаточных количеств пероксидаз растительного происхождения (растительных остатков), окислителей (хлорамина, хлорной извести, стирального порошка с отбеливателем, хромовой смеси для обработки посуды и др.), а также ржавчины (окислов и солей железа) и кислот.
При наличии на исследуемых изделиях ржавчины и указанных окислителей наблюдается бурое окрашивание реактива, в остальных случаях происходит окрашивание в розово-сиреневый цвет.
При положительной амидопириновой пробе о наличии на изделиях остаточных количеств крови свидетельствует немедленное или не позже чем через 1 мин после контакта реактива с кровью, появление синефиолетового окрашивания различной интенсивности.
При постановке азопирамовой и амидопириновой проб окрашивание реактивов, наступившее позже чем через 1 мин после постановки пробы, не учитывается.
При положительной фенолфталеиновой пробе о наличии на изделиях остаточных количеств щелочных компонентов моющего средства свидетельствует появление розового окрашивания реактива.
В случае положительной пробы на кровь или на остаточные количества щелочных компонентов моющих средств, всю группу контролируемых изделий, от которой отбирали контроль, подвергают повторной очистке до получения отрицательных результатов.
Результаты контроля отражают в журнале по форме N 366/у (Табл.П.4.1.).
Код учреждения по ОКПО
| Министерство здравоохранения РФ Наименование учреждения | Медицинская документация Форма N 366/у Утверждена Минздравом СССР 04.10.80 Пр. N 1030 |
Журнал учета качества предстерилизационной обработки
| Дата | Способ обрабо- тки | Применя- емое средство | Результаты выборочного химического контроля обработанных изделий | Фамилия лица, проводи- вшего контроль | |||
| Наимено- вание изделий | Количес- тво (штук) | Из них загрязненных | |||||
| кровью | моющими средствами | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
Откройте актуальную версию документа прямо сейчас или получите полный доступ к системе ГАРАНТ на 3 дня бесплатно!
Если вы являетесь пользователем интернет-версии системы ГАРАНТ, вы можете открыть этот документ прямо сейчас или запросить по Горячей линии в системе.
Предстерилизационная обработка является необходимым условием для того, чтобы очистить инструменты и все изделия медицинского назначения от разного рода жировых, белковых, других механических загрязнений и остатков лекарственных средств. Такую очистку необходимо проводить, так как именно инструменты и материалы представляют собой самый приоритетный фактор при передаче инфекций гемоконтактного характера. Чтобы минимизировать риск заражения, в современной медицинской практике практикуется применение одноразовых расходных материалов и 3-ступенчатая обработка инструментов и изделий многоразового применения (дезинфекция, предстерилизационная очистка, стерилизационные мероприятия).
Почему недостаточно только дезинфекции?
Этого действительно недостаточно для дальнейшего безопасного применения инструментов и медицинских изделий, уже бывших в употреблении. Во время проведения дезинфекции могут быть допущены ошибки, которые без двух остальных этапов обработки (предстерилизационная очистка, стерилизация) не позволят получить биологически безопасный инструментарий.
Во-первых, для дезинфекции могут быть использованы средства и методики, не разрешенные к применению. Возможно, на вещества отсутствует требуемый разрешительный пакет документов, либо его использование недопустимо в учреждениях лечебно-профилактического профиля, либо оно (средство) вообще фальсифицировано и не может применяться с какой бы то ни было целью.
Во-вторых, могут быть нарушены условия, при которых эти средства для дезинфекции хранились и транспортировались (температурный режим, длительное нахождение в зоне влияния прямого солнечного света, истекший срок годности). Средство может быть неверно подобрано (не уничтожает возбудителей гепатитов группы В и С, ВИЧ), что делает дальнейшие действия, в частности, такое как предстерилизационная очистка и мероприятия по стерилизации, бесполезными.
Кроме того, неверно выбранный режим дезинфекции не обеспечит уничтожения возбудителей гемоконтактных инфекций. Да и сама дезинфекция может быть проведена некорректно (ошибки при расчете концентрации, не соблюдено время экспозиции, у рабочего раствора истек срок годности).
Факторы риска при очистке
Даже одна (не говоря уже о нескольких) ошибка практически сводит на "нет" эффективность дезинфицирующих мероприятий. В итоге предстерилизационная очистка изделий медицинского назначения может представлять опасность для медперсонала в биологическом плане.
Помимо этого, существует вероятность инфицирования в процессе проведения второго этапа очистки по причине непосредственного контактирования медработника с инструментами и изделиями. В наибольшей степени это можно отнести к ручному типу обработки (будет описан ниже), однако при механическом человек также соприкасается с инструментарием при перекладывании и сортировке.

Далее важно, чтобы медперсонал во избежание инфицирования не пренебрегал средствами индивидуальной защиты (речь идет о перчатках). Еще стоит сказать о том, что основная масса современных дезинфицирующих средств предназначена для совмещения таких процессов, как дезинфекция и предстерилизационная очистка. Однако погружение в такой раствор медицинского изделия отнюдь не означает, что проведены сразу оба эти мероприятия – и дезинфекция, и очистка. После окончания первого этапа должен быть обязательно проведен второй.
Обработка ручным способом
Этапы предстерилизационной очистки ручным способом выглядят следующим образом. После того как все изделия продезинфицированы и тщательно промыты в проточной воде, их в разобранном виде помещают в моющий состав. Все каналы и полости обрабатываемых изделий должны быть полностью погружены в жидкость и ею заполнены. Продолжительность замачивания зависит от применяемого моющего средства и может составлять от 15 минут до 1 часа. Затем каждое изделие отдельно моют ершиком или протирают ватно-марлевым тампоном не менее 1 минуты.

Далее изделия и инструменты ополаскиваются в проточной воде. Продолжительность процедуры зависит от применяемого средства. В раковине, которая используется на этом этапе, недопустимо мытье рук медперсонала.
Последний этап при ручной обработке состоит в том, что все изделия и инструменты ополаскиваются в дистиллированной воде и просушиваются в потоке горячих воздушных масс.
Совмещенная обработка
Медицинская предстерилизационная очистка может быть совмещена с мероприятиями по дезинфекции, и проводится она вручную. На начальном этапе все изделия замачивают в специальных моющих средствах, обладающих дезинфицирующими свойствами. Далее каждая обрабатываемая единица по отдельности моется ершиком или очищается ватно-марлевым тампоном на протяжении 1 минуты. Здесь важно помнить о поддержании температурного режима, если это оговорено в инструкции по применению моющего состава.
Далее каждая единица инструментария и медизделий ополаскивается в проточной воде на протяжении времени, необходимого для конкретного средства (указано в инструкции). Применение раковины, в которой производится процедура, для других целей недопустимо. На конечном этапе каждая единица ополаскивается дистиллированной водой и сушится под горячим воздухом.
Механический способ очистки изделий
В современных больших лечебных учреждениях чаще всего применяется механическая предстерилизационная очистка изделий. Все инструменты и изделия помещают в специальное оборудование, основные функции которого - проведение мероприятий по дезинфекции и предстерилизационной обработке. Для такого вида работ могут быть использованы дезинфицирующие вещества, обладающие дополнительно моющим эффектом, или предназначенные отдельно для дезинфицирования и мойки. Если дезинфекция осуществляется термическим способом, то для дальнейшей очистки возможно использование только моющих средств. Если для конкретного оборудования оговорена какая-то другая технология, значит, мероприятия по очистке проводят в соответствии с инструкцией.

Далее изделия и инструменты ополаскивают в проточной воде. Продолжительность процедуры – согласно инструкции по использованию моющего средства. Этот этап может являться частью функционального цикла задействованного оборудования.
Завершается механическая предстерилизационная очистка ополаскиванием (вода дистиллированная) всех обработанных элементов и сушкой горячими воздушными массами. Этот этап также может являться частью функционального цикла применяемого оборудования.
Преимущества механической обработки
Сегодня наиболее перспективной и предпочтительной считается предстерилизационная очистка медицинских изделий механическим способом. И тому есть несколько причин.
На самом высоком уровне обеспечивается биологическая безопасность медперсонала, так как тактильные контакты людей с медицинскими инструментами и изделиями сведены к минимуму. Далее, этот способ самый экономически эффективный, так как, во-первых, для обработки большого количества инструментов и медицинских изделий не требуется много времени, а во-вторых, сводится к минимуму возможность повредить дорогостоящий инструментарий (как результат - увеличивается срок его службы).
При таком способе очистки обеспечивается наибольшая биологическая безопасность пациентов: изделия и инструменты самой сложной конфигурации качественно очищаются.
Оборудование и выбор моющих средств

Второй вид оборудования обладает явными преимуществами перед ультразвуковыми аппаратами, т. к. в термодезинфекторе, по сути, осуществляется полный цикл обработки медизделий и инструментария – дезинфекция, очистка, ополаскивание, сушка. На долю человека остается корректно провести загрузку инструментов, а затем правильно их извлечь.
Еще один важный нюанс – это подбор моющих средств. Разрешены для использования два вида: на основе ПАВ (поверхностно-активных веществ) и ферментов. Первые обладают высокими моющими качествами и более востребованы на рынке. Однако у этих средств имеются некоторые недостатки.
Во-первых, для них характерно высокое пенообразование, а это может стать критичным фактором ввиду несовместимости моющего состава и оборудования при механической очистке.
Во-вторых, после моющих, произведенных на основе ПАВ, на обработанной поверхности медицинских изделий и инструментов остается пленка, для смывания которой потребуется особенно тщательное ополаскивание.
В-третьих, чтобы получить самый оптимальный результат, требуется поддерживать определенную температуру, при которой проводится предстерилизационная очистка.
Моющие вещества, изготовленные на основе ферментов, обладают возможностями разрушения не только стенок бактериальных клеток, белковых оболочек вирусов, но и биопленки. Помимо этого, для ферментированных моющих средств характерно низкое пенообразование, и они не теряют активности при комнатных температурах.
Контроль качества: остатки биологических жидкостей
Для определения остатков крови контроль качества предстерилизационной очистки производится с применением нескольких проб: бензидиновой, ортотолидиновой, амидопириновой и азопирамовой.
Бензидиновая проба может осуществляться двумя способами. Водный раствор бензидина хлорида 0,5-1 %-ного (вода - дистиллированная) соединяют с таким же объемом 3 %-ного раствора перекиси водорода. Второй вариант состоит в приготовлении раствора из 5 мл 50 %-ной уксусной кислоты и 0,025 г бензидина сульфата с перекисью водорода (3 %) в объеме 5 мл.
Ортотолидиновая проба может производиться в 3 модификациях. 5-10 мл основного спиртового раствора (ортотолидин - 4 %, спирт этиловый - 96 %) смешивают с такими же объемами дистиллированной воды и уксусной 50-процентной кислоты. Вторая модификация состоит в смешивании реактива, состоящего из 0,25 г ортотолидина и равных объемов (по 5 мл) 50 %-ной уксусной кислоты и 3 %-ной перекиси водорода. Третий вариант состоит в соединении равных объемов 1 %-ного водного раствора ортотолидина и 3 %-ной перекиси водорода.
Для того чтобы провести контроль предстерилизационной очистки с помощью амидопириновой пробы, готовят реактив из одинаковых (2-3 мл) объемов 5 %-ного спиртового раствора амидопирина, 30 %-ной уксусной кислоты и 3 %-ной перекиси водорода. 2 капли готового реактива наносят на негорячую поверхность. В случае если проба приобрела сине-фиолетовый оттенок, поверхность очищена недостаточно качественно.
Реактив для проведения азопирамовой пробы изготавливают на основе исходного раствора азопирама. В свою очередь, этот раствор состоит из смешанных вместе 100 г амидопирина и 1 г соляно-кислого анилина, дополненных до 1 л этиловым спиртом (95 %). Приготовленный таким образом состав можно хранить (тара – закупоренный флакон) без доступа света при комнатной температуре на протяжении 1 месяца, в холодильнике – до 2 месяцев. Когда потребуется проводить пробу, смешивают в равных долях исходный азопирам и 3 %-ную перекись водорода. Если после нанесения реактива на холодную поверхность проба становится фиолетовой, а затем быстро меняет цвет на розово-сиреневый, значит, на инструментах и изделиях присутствуют остатки крови.
При проведении азопирамовой пробы важно учесть некоторые особенности реакции. Приготовленный для проверки реактив допустимо использовать не позднее чем в течение 1-2 часов. Хранить его в это время при ярком свете и повышенной температуре недопустимо. Изменение цвета пробы, наступившее спустя минуту после нанесения, не дает оснований считать, что качество предстерилизационной очистки не соответствует требуемому по инструкции.
В процессе предстерилизационной очистки весьма нежелательно вместо перекиси водорода использовать таблетки гидропирита. Причина в том, что раствор гидропирита способствует быстрому образованию коррозии, а это приводит к порче инструментов, особенно с режущими плоскостями. Если ощущается дефицит медицинской перекиси водорода, ее допустимо в процессе обработки заменить технической перекисью марки А и Б.
На контролируемые изделия наносят капли реактивов. При наличии остатков крови состав окрашивается в сине-зеленый цвет.
Контроль качества: остатки моющих средств
Все этапы предстерилизационной очистки при любом способе обработки (ручной, совмещенный, механический) завершаются ополаскиванием медицинских изделий и инструментов. Качественно ли проведен этот этап, можно определить с помощью фенолфталеиновой пробы. 1-2 капли однопроцентного спиртового раствора фенолфталеина наносят на обработанное (т. е. вымытое) изделие. Если оно вымыто недостаточно качественно, и на его поверхности присутствуют остатки моющих средств, проба приобретет розовый оттенок.
Пробы положительные…
Если хотя бы одна из проводимых проб даст положительный результат, значит, на обработанных поверхностях присутствуют либо кровяные загрязнения, либо остатки моющих средств, с применением которых проводилась обработка. В таких случаях все изделия и инструменты подлежат повторной обработке до тех пор, пока контроль качества предстерилизационной очистки не даст отрицательных результатов (т. е. пробы не будут изменять цвет).

Контролю качества и эффективности предстерилизационной очистки должен подвергаться 1 % каждого инструмента и вида изделий, которые проходят обработку в течение суток. Специалисты дезинфекционных или санитарно-эпидемиологических станций должны контролировать качество предстерилизационной обработки в лечебных и лечебно-профилактических учреждениях не реже, чем 1 раз в течение квартала.
Читайте также:

