Классификация химических реакций в органической химии кратко презентация
Обновлено: 02.07.2024
Презентация на тему: " Типы химических реакций в органической химии МОУ Навлинская СОШ 1 учитель химии Кожемяко Г.С." — Транскрипт:
1 Типы химических реакций в органической химии МОУ Навлинская СОШ 1 учитель химии Кожемяко Г.С.
2 Цели урока: Ознакомиться с основными типами реакций в органической химии; Раскрыть способы разрыва ковалентной связи в органических соединениях; Выяснить, что такое электрофил и нуклеофил.
3 План урока: 1.Основные понятия о реакциях. 2.Особенности органических реакций. 3.Понятие о механизме реакций. 4.Классификация органических реакций. - по конечному результату; - по числу участвующих частиц; - по механизму разрыва связи. 5.Закрепление. 6.Домашнее задание. 7. Контрольные вопросы (тест).
4 Что подразумевают под химической реакцией? Процесс превращения веществ, сопровождающийся изменением их состава и (или) строения, называется химической реакцией
6 Какие характеристики можно дать химической реакции? По числу вступивших и образующихся веществ: разложения, соединения, замещения, обмена; По тепловому эффекту: экзотермические и эндотермические; По обратимости: обратимые и необратимые; По однородности среды: гомогенные и гетерогенные;
7 Характеристики химических реакций: По изменению степеней окисления: окислительно-восстановительные; без изменения степеней окисления По использованию катализатора: каталитические, некаталитические; По инициирующей энергии: электрохимические, термохимические, фотохимические и радиационные; По механизму: радикальные и ионные.
8 Классификация реакций по числу частиц, участвующих в элементарной стадии Мономолекулярные А В + … Бимолекулярные А + В С + … Тримолекулярные А + В + С D + … Тетрамолекулярные А + В + С + D Е + …
9 Отличительные особенности органических реакций: 1.В реакциях органических соединений, как правило затрагивается только часть молекулы и её основная конструкция (углеродный скелет) сохраняется. Например: CH 2 =СH 2 + Н 2 О CH 3 –СH 2 ОН Al 2 S 3 + 6H 2 O 2Al(OH) 3 +3H 2 S
10 Отличительные особенности органических реакций: 2. Большинство органических реакций протекают медленно и обычно не завершаются полностью вследствие их обратимости. Например: СH 3 –COOH + HO–C 2 H 5 СH 3 –CO–O–C 2 H 5 + H 2 O
12 Отличительные особенности органических реакций: 3. Многие органические реакции включают несколько элементарных стадий:
13 Механизм химической реакции: Реакции: простые (элементарными), сложные. Общая скорость сложной химической реакции определяется скоростью её наиболее медленной (лимитирующей) стадией.
14 Классификация органических реакций: по конечному результату реакций (на основе сопоставления строения исходных и конечных продуктов); по минимальному числу частиц, участвующих в элементарной реакции: по механизму разрыва ковалентных связей в реагирующих молекулах.
15 Сравнительная таблица типов химических реакций в Неорганической химииОрганической химии Разложения Отщепления или элиминирования СоединенияПрисоединения Замещения Обмена- АллотропииИзомеризации
16 Реакции присоединения: А + В С а) Гидрирования СН 2 = СН 2 + Н 2 СН 3 – СН 3 б) Галогенирования СН 2 = СН 2 + Вr 2 CH 2 Br – CH 2 Br
17 Реакции присоединения: в) Гидратации CH 2 = CH 2 + HOH CH 3 – CH 2 – OH г) Гидрогалогенирования CH 2 = CH 2 + HBr CH 3 – CH 2 – Br д) Полимеризации n CH 2 = CH 2 ·(·CH 2 – CH 2 ·)· n
18 Виды реакций присоединения : +Н 2 – гидрирование; +Н 2 О – гидратация; +Г 2 – галогенирование; +НГ – гидрогалогенирование; n А (А) n – полимеризация, поликонденсация.
19 Реакции отщепления: А В + С + … а) Дегидрирования СН 3 – СН 3 СН 2 = СН 2 + Н 2 б) Дегалогенирования CH 2 Br – CH 2 Br + Ca СН 2 = СН 2 + CaВr 2
20 Реакции отщепления: в) Дегидратации CH 3 – CH 2 – OH CH 2 = CH 2 + H 2 O г) Дегидрогалогенирования CH 3 – CH 2 – Br + KOH CH 2 = CH 2 + KBr + H 2 O д) Деполимеризации ·(·CH 2 – CH 2 ·)· n n CH 2 = CH 2
21 Виды реакций разложения: - Н 2 – дегидрирование; - Н 2 О – дегидратация; - Г 2 – дегалогенирование; - НГ – дегидрогалогенирование; (А) n nА – деполимеризация, деполиконденсация.
22 Реакции замещения: АВ + С АС + В CH 3 CH 2 Cl + KOH (водный) CH 3 CH 2 OH + KCl CH 3 –CH 2 –CH 2 –CH 2 –CH 3 + Br 2 CH 3 –CH 2 –CH 2 –CH 2 –CH 2 –Br + HBr
23 Реакции изомеризации или перегруппировки: А В
24 Реакции окисления и восстановления:
25 Способы образования ковалентной связи
26 Классификация реакций по механизму разрыва связей
28 Радикальные реакции: Реакции в которых происходит гомолитический разрыв связей и образуются свободнорадикальные промежуточные частицы.
29 Свободнорадикальное замещение – S R S – substitution – замещение R – radical – радикал
30 CH 4 + Cl 2 CH 3 Cl + HCl УФ-свет Промежуточные стадии : Cl 2 2Cl· (на свету) Cl· + H–CH 3 HCl + ·CH 3 ·CH 3 + Cl 2 CH 3 Cl + Cl· и так далее.
31 Свободнорадикальное присоединение – А R А – addition – присоединение R – radical – радикал
32 n CH 2 =СH 2 · ( · CH 2 –СH 2 · ) · n Промежуточные стадии : R· - инициатор R· + СН 2 =CН 2 R··СН 2 –СН 2 · рост цепи R··СН 2 –СН 2 · + СН 2 =CН 2 R··СН 2 –СН 2 ··СН 2 –СН 2 · и т.д. R·R·
33 Ионные реакции: Реакции, в которых происходит гетеролитический разрыв связей и образуются промежуточные частицы ионного типа.
34 Электрофильные реакции Электрофильной называется реакция, в которой молекула органического вещества подвергается действию электрофильного реагента.
35 Электрофилы (любящие электроны) H+,H+, CH 3 + и другие карбокатионы, NO 2 +, ZnCl 2, AlCl 3.
36 Электрофильное замещение: S Е ( substitution electrofile ) C 6 H 6 + NO 2 + C 6 H 5 NO 2 + H + (электрофил - NO 2 + ) катион NO 2 + образуется в смеси конц. кислот HNO 3 и H 2 SO 4.
37 Электрофильное присоединение: А Е ( addition electrofile ) CH 2 =CH 2 + H δ+ Cl δ- CH 3 CH 2 Cl (электрофил - H + в составе HCl) Стадии: I. (медленная) CH 2 =CH 2 + HCl CH 3 CH Cl - II. (быстрая) CH 3 CH Cl - CH 3 CH 2 Cl
38 Нуклеофильные реакции Нуклеофильной называется реакция, в которой молекула органического вещества подвергается действию нуклеофильного реагента.
39 Нуклеофилы (любящие ядро) OH -, Cl -, Br -, CN -, H 2 O, CH 3 OH, NH 3. CH 2 =CH 2, CH 2 =CH–CH=CH 2, C 6 H 6
40 Нуклеофильное замещение: S N ( substitution nucleofile )
41 Нуклеофильное присоединение: А N ( addition nucleofile )
42 Отщепления = Элеминирования CH 3 – CH 2 – CH – CH 3 + NaOH ן Br 2 – бромбутан CH 3 – CH = CH – CH 3 + NaBr + H 2 O (цис.транс.) бутен-2 спирт
43 Радикальные и ионные реакции ПрисоединениеЗамещение Свободноради- кальное АRАR SRSR ЭлектрофильноеАEАE SESE НуклеофильноеАNАN SNSN
44 Определите механизм реакций: CH 4 + Br 2 CH 3 Br + HBr УФ-свет SRSR CH 3 –CH=CH 2 + HI CH 3 –CHI–CH 3 раствор AEAE CH 3 –CH 2 –Cl + KOH CH 3 –CH 2 –OH + KCl раствор SNSN
45 Домашнее задание: § 8 1(письменно), 2-4 (устно) стр. 47 § 9 упражнение 4 стр. 54
46 Контрольные вопросы 1. В соответствии с конечным результатом данная реакция является. Ответ 1Ответ 1 : реакцией присоединения Ответ 2 : реакцией разложения Ответ 3 : реакцией замещения Ответ 4 : реакцией изомеризации Ответ 2 Ответ 3 Ответ 4
47 Контрольные вопросы 2. Какие типы реакций представлены в схеме превращений: Ответ 1Ответ 1 : I - присоединение; II - разложение Ответ 2 : I - разложение; II - замещение Ответ 3 : I - присоединение; II - замещение Ответ 4 : I - замещение; II - присоединение Ответ 2 Ответ 3 Ответ 4
48 Контрольные вопросы 3. Укажите реакции замещения в следующей схеме превращений: Ответ 1Ответ 1 : I, II Ответ 2 : I, II, VОтвет 2 Ответ 3 : II, IV Ответ 4 : III, VОтвет 3Ответ 4
49 Контрольные вопросы 4. Как изменяется степень окисления атома углерода при горении метана: CH 4 + 2O 2 CO 2 + 2H 2 O ? Ответ 1 : +4 на -4 Ответ 2 : -4 на +4 Ответ 3 : -2 на +4 Ответ 4 : -4 на +2Ответ 1 Ответ 2 Ответ 3 Ответ 4
50 Контрольные вопросы 5. По какому механизму идет реакция: CH 3 CH 2 Br + NaOH CH 3 CH 2 OH + NaBr ? Ответ 1Ответ 1 : нуклеофильное присоединение Ответ 2 : электрофильное замещение Ответ 3 : нуклеофильное замещение Ответ 4 : радикальное замещение Ответ 2 Ответ 3 Ответ 4
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.

Описание презентации по отдельным слайдам:

КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ В ОРГАНИЧЕСКОЙ ХИМИИ


ПО ТЕПЛОВОМУ ЭФФЕКТУ Экзотермические реакции (+Q) – реакции, протекающие с выделением энергии во внешнюю среду. Эндотермические реакции (-Q) – реакции, протекающие с поглощением энергии.

ПО НАПРАВЛЕНИЮ Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях. Необратимые реакции протекают в данных условиях только в одном направлении

ПО ФАЗОВОМУ СОСТОЯНИЮ Гетерогенные реакции – реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах): СаС2 (тв)+2Н2О(ж)→ С2Н2(г)+Са(ОН)2(р-р) Гомогенные реакции – реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе): СН4(г) +2 О2(г) → СО2(г) + 2Н2О(г)

ПО НАЛИЧИЮ КАТАЛИЗАТОРА: Каталитические – это реакции, протекающие в присутствии катализатора. Некаталитические – это реакции, протекающие без катализатора

ОРГАНИЧЕСКИЕ РЕАКЦИИ ПРИНЯТО КЛАССИФИЦИРОВАТЬ по механизмам протекания Под механизмом реакции понимают последовательность отдельных стадий протекания реакций с указанием промежуточных частиц, образующихся на каждой из этих стадий. по направлению и конечным продуктам реакции: Присоединения Отщепления (Элиминирования) Замещения Перегруппировки (Изомеризации) Окисления и восстановления

По механизму реакции: Гомолитические (радикальные) реакции R – это реакции, идущие с образованием радикалов (частиц с неспаренным электроном). А : В → А• + В• А•; В• - R (радикалы) Радикальные реакции протекают в газовой фазе или в неполярных растворителях в жестких условиях: высокая t, hν

Радикальные реакции имеют цепной механизм, включающий стадии: зарождения, развития и обрыв цепи (свободнорадикальные цепные реакции): Зарождение цепи (инициирование): Cl2 hν→ Cl• + Cl• 2. Рост (развитие) цепи: CH4 + Cl• → CH3• + HCl CH3• + Cl2 → CH3Cl + Cl• 3. Обрыв цепи: CH3• + Cl• → CH3Cl CH3• + CH3• → C2H6 Cl• + Cl• → Cl2

ПО МЕХАНИЗМУ РЕАКЦИИ: 2. Гетеролитические (ионные или электрофильно-нуклеофильные) реакции – это реакции, происходящие без разрыва электронных пар; оба электрона переходят на орбиталь одного из атомов с образованием аниона. А : В → А+ + :В- А+ - электрофильный реагент (электрофил) :В- - нуклеофильный реагент (нуклеофил) Ионные реакции протекают в полярных растворителях и требуют умеренной температуры, иногда катализатора.

ЭЛЕКТРОФИЛЬНЫЕ РЕАГЕНТЫ 1. Сильные: H+, Me+, HgCl+, FeCl2+, AlCl3, FeBr3, SbCl5, BF3, ZnCl2 и другие частицы, которые нейтральные по заряду, но содержат центры с повышенным сродством к электрону (например, атомы элементов, содержащие вакантные орбитали в своей валентной оболочке). В AlCl3 таким центром является атом алюминия, в FeBr3, SbCl5, BF3, ZnCl2 – атомы железа, сурьмы, бора и цинка, соответственно

2. слабые: молекулы, обладающие небольшим сродством к электрону, которое может быть повышено образованием комплексов с сильными электрофилами: СН2= СН2, СН3 – СН2 – Cl, этиленхлористый этил

ПОВЫШЕНИЕ ЭЛЕКТРОФИЛЬНЫХ СВОЙСТВ РЕАГЕНТОВ: СН2 = СН2 + Н+ → СН3 – СН2+ слабыйсильный электрофилэлектрофил СН3–СН2 – Сl + AlCl3 → CH3 – CH2+ +AlCl4- слабыйсильный сильный

НУКЛЕОФИЛЬНЫЕ РЕАГЕНТЫ: Сильные нуклеофилы: к ним относятся :ОН− , анионы с высоким сродством к протону (основания); анионы, являющиеся остатками слабых кислот :ОН− ,СН3О:− , :NH2− , С6H5O:− (фенолят ион), СN− ,СН3СОО:− и другие отрицательно заряженные остатки, :H− (гидрид-ион). Кроме того к сильным нуклеофилам относят нейтральные молекулы с неподелённой электронной парой такие, как аммиак, амины, вода, спирты Примеры нейтральных молекул с сильными нуклеофильными свойствами: NH3 , H2О: , эфиры: R NH2 , R2 NH, R3N , R–OH, ROR и др

СЛАБЫЕ НУКЛЕОФИЛЫ: Кним относятся анионы, являющиеся остатками сильных кислот: Сl− , Br−, HSO3(−), NO3(−), CNS(−), H2PO4(2−) и др.

Гетеролитические (ионные или электрофильно-нуклеофильные) реакции А) Нуклеофильные реакции N – реакции с нуклеофильными реагентами (анионами или молекулами, имеющими неподеленную электронную пару): Пример: взаимодействие бромэтана с гидроксидом натрия. С2Н5 – Вr + Na+E – OH-N → NaBr + C2H5OH Б) Электрофильные реакции Е - реакции с электрофильными реагентами (катионами или молекулами, имеющими свободную орбиталь): Пример: нитрование бензола. C6H6 + HO-N – NO2+E → C6H5NO2 + H2O

ПО НАПРАВЛЕНИЮ И КОНЕЧНОМУ ПРОДУКТУ РЕАКЦИИ: Реакции замещения S - реакции, в результате которых происходит замена атома или группы атомов на другой атом или группу атомов. А-В + С → А-С + В Например: галогенирование алканов CH4 + Cl2 hν→ CH3Cl + HCl

ПО НАПРАВЛЕНИЮ И КОНЕЧНОМУ ПРОДУКТУ РЕАКЦИИ: 2. Реакции присоединения А – реакции, в результате которых происходит введение атома или группы атомов молекулу непредельного соединения, что сопровождается разрывом π-связи. При этом двойные связи превращаются в одинарные, а тройные – в двойные: С = С + А – В → А – С – С – В а) Галогенирование (присоединение галогенов) CH2 = CH2 + Cl2 → Cl – CH2 – CH2 – Cl

б) гидрирование (присоединение водорода): CH2 = CH2 + H2 → CH3 – CH3 в) гидрогалогенирование (присоединение галогеноводородов): CH2 = CH2 + HCl → CH3 – CH2 - Cl г) гидратация (присоединение воды): CH2 = CH2 + H – OH → CH3 – CH2 - OH д) полимеризация nCH2 = CH2 → [- CH2 – CH2 - ]n

3. Реакции отщепления (элиминирования) - реакции, в результате которых происходит отщепление атомов или группы атомов от органической молекулы с образованием кратный связей: А – С – С – В → АВ + С = С а) дегидрирование CH3 – CH3 t, Ni→ CH2 = CH2 + H2 б) дегалогенирование CH2Cl – CH2Cl + Zn t→ CH2 = CH2 + ZnCl2 в) дегидрогалогенирование CH2Cl–CH3+NaOНcпирт.рр→CH2=CH2+NaCl+H2O

г) дегидратация CH2OH – CH3 t→ CH2 = CH2 + H2O д) деполимеризация - разрушение молекул полимера до исходных молекул [- CH2 – CH2 - ]n t, кат.→ nCH2 = CH2 е) крекинг - термическое разложение молекул C4H10 t→ C2H4 + C2H6

4. Реакции перегруппировки (изомеризации) - реакции, в результате которых происходит перегруппировка атома или группы атомов в молекуле (происходит перемещение атомов или группы атомов от одного фрагмента молекулы к другому без изменения их формулы). X – A – B → A – B – X CH3 – CH2 – CH2 – CH3 AlCl3, t→ CH3 – CH (CH3) – CH3

5. Реакции окисления и восстановления - реакции, в результате которых происходит изменение степени окисления атома углерода – реакционный центр. Реакции окисления Реакции восстановления

Реакции окисления - взаимодействие органического вещества с более ЭО элементом (галогеном, кислородом и др.), при этом положительная с.о. атома углерода повышается. При этом происходит введение в молекулу атома О или потеря молекулой атома Н. Реакции восстановления - при этом с.о. атома углерода понижается и образуются новые связи С – Н. При этом происходит введение в молекулу атома Н или потеря молекулой атома О. CH3 – OH CuO, t→ H – COH + H2O CH3 – COH + H2 Pt, t→ CH3 – CH2 – OH

Выводы: Органические реакции подчиняются общим законам и общим закономерностям их протекания. Они имеют общие для всех реакций признаки, но имеют и свои характерные особенности. По механизму протекания реакции делятся на свободнорадикальные и ионные. По направлению и конечному результату превращения: замещения, присоединения, отщепления, изомеризации, окисления и восстановления
Краткое описание документа:
Презентация предназначена для урока в профильных классах. В данной презентации повторяются основные законы протекания реакций и признаки классификации химических реакций: по числу и составу исходных и образующихся веществ, по тепловому эффекту, по направлению, по фазовому состоянию веществ, по наличию катализатора (здесь уместно напомнить о роли катализатора на продукты реакции на примере окисления аммиака). Более подробно рассматривается классификация реакций по механизму протекания. Рассматриваются электрофильные и нуклеофильные частицы, а также способы повышения электрофильных свойств реагентов.
Презентация по теме: "Химические реакции в органической химии" раскрывает особенности реакций в органической химии, их классификацию по структурному признаку и механизму протекания. Может использоваться при изучении химии в 10 классе на профильном уровне.
| Вложение | Размер |
|---|---|
| Химические реакции в органической химии | 1.07 МБ |
Предварительный просмотр:
Подписи к слайдам:
Особенности и классификация химических реакций в органической химии 10 класс (профильный уровень) Кокорина С.Е., учитель химии высшей кв. категории МБОУ СОШ №10 г. Североморск
Особенности реакций с участием органических веществ 1. Органические вещества имеют молекулярное строение, поэтому реакции с их участием протекают медленнее , чем реакции неорганических веществ (ионные). Во многих случаях необходимы: t, p, kat . 2. Протекают с небольшим выходом продукта реакции (не более 50%), т.к. основная реакция сопровождается несколькими побочными, многие из которых обратимы. 03.02.2015 21:20 Кокорина С.Е., МБОУ СОШ №10 г.Североморск, Мурманская область 2
Особенности реакций с участием органических веществ 3. Для записи реакций органических веществ используют схемы , где а) между формулами исходных веществ и продуктов реакции ставят стрелку ; б ) используют структурные , а не молекулярные формулы веществ ; в) указывают условия проведения химичекой реакции. 03.02.2015 21:20 Кокорина С.Е., МБОУ СОШ №10 г.Североморск , Мурманская область 3
Классификация реакций в органической химии I. Реакции замещения ( S)- в молекуле субстрата один атом или группа атомов замещается на другой( ую ) : R-X + Y → R-Y +X А ) СН 4 + С l 2 → CH 3 Cl + HCl (галогенирование алканов ) Б) CH 3 Cl + Na OH →CH 3 OH + Na Cl В) СН 4 + Н NO 3 ( НО - NO 2 ) → CH 3 NO 2 + H 2 O По структурному признаку: 03.02.2015 21:20 Кокорина С.Е., МБОУ СОШ №10 г.Североморск, Мурманская область 4
Субстрат – основное вещество ( от лат. Sybstratum - основа), вступающее в химическую реакцию. Это более сложное по строению вещество или соединение со старшей функциональной группой. Если из двух реагирующих веществ одно органическое а другое неорганическое, то субстратом считают органическое вещество; Второе (неорганическое вещество) называют реагентом . 03.02.2015 21:20 Кокорина С.Е., МБОУ СОШ №10 г.Североморск, Мурманская область 5
II . Реакции присоединения (А ) от англ. addition – присоединение В зависимости от того, какие изменения происходят с субстратом, различают реакции: 1. Гидрирование (присоединение водорода): СН 2 = СН 2 + Н 2 → СН 3 - СН 3 2. Галогенирование (присоединение галогенов С l 2 , Br 2 ) СН 2 =СН 2 + Br 2 → СН 2 – СН 2 ׀ ׀ Br Br 3. Гидрогалогенирование ( присоединение галогеноводородов НС l, HBr, HI ): СН 2 =СН 2 + HBr → СН 3 - СН 2 Br 03.02.2015 21:20 Кокорина С.Е., МБОУ СОШ №10 г.Североморск, Мурманская область 6
II . Реакции присоединения (А ) от англ. addition - присоединение 4. Гидратация (присоединение воды): СН 2 =СН 2 + H 2 O → СН 3 – СН 2 OH 5. Полимеризация (соединение большого числа молекул с двойными связями между атомами углерода с образованием высокомолекулярного соединения): n СН 2 =СН 2 → - [ СН 2 - СН 2 ]n - этилен полиэтилен 03.02.2015 21:20 Кокорина С.Е., МБОУ СОШ №10 г.Североморск , Мурманская область 7
III . Реакции элиминирования (отщепления ) – Е (от англ. eleminate- удалять) 1. Дегидрирование (отщепление водорода) на никелевом катализаторе: 2. Дегалогенирование ( отщепление галогена): СН 3 - СН – СН -СН 3 + Zn → СН 3 - СН = СН - СН 3 + Zn Br 2 ׀ ׀ Br Br 3. Дегидрогалогенирования ( отщепление галогеноводрода ): СН 3 - СН 2 Br + KOH( спиртовой р-р) → СН 2 = СН 2 + K Br + Н 2 O 4. Дегидратация ( отщепление воды): H 2 SO 4 , t> 140 СН 3 - СН 2 OH → СН 2 =СН 2 + Н 2 O СН 3 - СН 3 → СН 2 =СН 2 + Н 2 03.02.2015 21:20 Кокорина С.Е., МБОУ СОШ №10 г.Североморск, Мурманская область 8
IV . Реакции изомеризации Под влиянием катализаторов при нагревании углеводороды нормального строения подвергаются изомеризации - перестройке углеродного скелета с образованием алканов разветвленного строения. AlCl3 , t CH 3 -CH 2 -CH 2 -CH 3 → CH 3 -CH-CH 3 | CH 3 н-бутан 2-метилпропан 03.02.2015 21:20 Кокорина С.Е., МБОУ СОШ №10 г.Североморск , Мурманская область 9
VI . Ароматизация (риформинг) (англ. reforming, от reform — переделывать, улучшать ) - промышленный процесс переработки бензиновых и лигроиновых фракций нефти с целью получения высокооктановых бензинов и ароматических углеводородов: 03.02.2015 21:20 Кокорина С.Е., МБОУ СОШ №10 г.Североморск, Мурманская область 11
VII. Реакции o кисления 1. Полное окисление (реакция горения): СН 4 + 2О 2 → СО 2 + 2Н 2 О 2. Каталитическое окисление: СН 4 + 2О 2 → Н – С=О ( T=500C) \ Н Окисление неорганическими окислителями ( KMnO 4 , K 2 Cr 2 O 7 в разных средах ) : 3СН 2 =СН 2 + 2 KMnO 4 + 4Н 2 О → 3СН 2 -СН 2 + 2 MnO 2 +2КОН ОН ОН 03.02.2015 21:20 Кокорина С.Е., МБОУ СОШ №10 г.Североморск, Мурманская область 12
VIII. Наращивания углеродной цепи Реакция Вюрца: 03.02.2015 21:20 Кокорина С.Е., МБОУ СОШ №10 г.Североморск, Мурманская область 13
По механизму протекания : 1. Свободно - радикальные ® ( протекают под действием и при участии радикалов при сильном нагревании или облучении) Радикалы – активные частицы (атомы или группы атомов), имеющие неспаренные электроны- С l∙ , Br∙, СН 3 ∙ и др. Радикалы образуются в результате гомолиза (гомолитического разрыва ковалентных связей С-С и С-Н в органических веществах). 03.02.2015 21:20 Кокорина С.Е., МБОУ СОШ №10 г.Североморск, Мурманская область 14
ГОМОЛИЗ - способ разрыва ковалентной связи, в результате которого каждый из атомов, участвующих в ее образовании, сохраняет один неспаренный электрон и представляет собой радикал. А : В = А∙ + ∙ В CH 3 -CH 3 → CH 3 ∙ + ∙ CH 3 2. Нуклеофильные ( N) ( протекают под действием и при участии нуклеофилов). Нуклеофилы – анионы или молекулы, имеющие неподеленную пару электронов, способные взаимодействовать с атомами, на которых сосредоточен положительный заряд ( анионы: Br-, Cl-, OH-, RO- , нейтральные молекулы: Н 2 О , N Н 3 , спирты R-OH и др. 03.02.2015 21:20 Кокорина С.Е., МБОУ СОШ №10 г.Североморск, Мурманская область 15
3 . Электрофильные (Е)- ( протекают под действием и при участии электрофилов ). Электрофилы – катионы или молекулы, имеющие атом с незаполненной орбиталью или частичным положительным зарядом, способные взаимодействовать с амомами , обладающими избытком электронной плотности ( катионы: Н+ , ( CH 3 ) 3 C + и др.) Нуклеофильные и электрофильные частицы образуются в результате гетеролиза (гетеролитического разрыва ковалентных связей ). ГЕТЕРОЛИЗ - способ разрыва ковалентной связи, в результате которого пара электронов остается с одним из атомов, что приводит (чаще всего) к образованию двух противоположно заряженных ионов. А : В → А + + :В - ( CH 3 ) 3 C : Br → ( CH 3 ) 3 C+ + : В r - электрофил нуклеофил 03.02.2015 21:20 Кокорина С.Е., МБОУ СОШ №10 г.Североморск, Мурманская область 16
Домашнее задание: § 22 ( учебник В.В.Еремин), вопр. 1-3(устно), 4(письменно) §7 (уч. О.С. Габриелян) повторить, §8, вопр. 2, 3 03.02.2015 21:20 Кокорина С.Е., МБОУ СОШ №10 г.Североморск , Мурманская область 17

Презентация содержит материал по вопросам основных типов реакций в органической химии, материал будет полезен пр изучении темы, так и для повторения.

Типы химических реакций
в органической химии

Специфические особенности органических реакций
1. Органические реакции идут медленно , часто требуют жёстких условий (температура, давление, участие катализатора).
2. Органические реакции протекают в несколько стадий , из-за чего дают невысокий выход продукта .
3. В органических уравнениях реакций, вместо знака равенства ставится стрелка , на которой записываются условия протекания реакций .
4. В органических реакциях, которые идут в живых организмах, изменению подвергается не вся молекула, а только её часть, так называемые реакционные центры молекулы.

Химическая реакция
Исходные вещества
Продукты реакции
Реакционным центром можно считать функциональную группу или кратную связь .
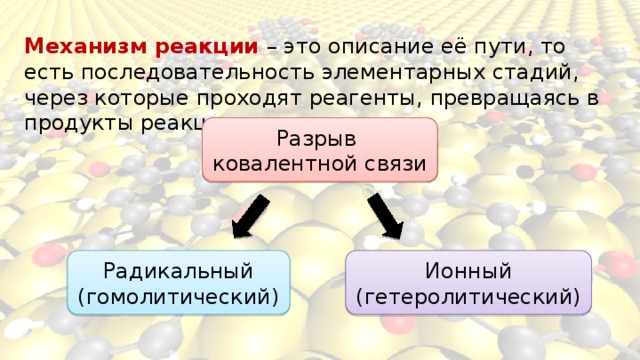
Механизм реакции – это описание её пути, то есть последовательность элементарных стадий, через которые проходят реагенты, превращаясь в продукты реакции.
Радикальному , или гомолитическому разрыву обычно подвергаются неполярные или малополярные ковалентные связи:
С – С , С – Н , Cl – Cl , N – N , Br – Br .

Радикальный (гомолитический) разрыв ковалентной связи:
Радикалы – это частицы с неспаренными электронами на внешних орбиталях, обладающие высокой реакционной способностью .
температура
К гетеролитическому разрыву склонны полярные и легко поляризуемые связи , кроме этого, такому разрыву способствуют и полярные растворители.
Читайте также:

