Химическое равновесие в гомогенных системах кратко
Обновлено: 30.06.2024
При некоторой температуре энтальпийный и энтропийный факторы уравниваются, две противоположные тенденции уравновешивают друг друга, т.е. Н = ТS. В этом случае соблюдается уравнение G = 0, которое является термодинамическим условием химического равновесия.
Химическое равновесие имеет динамический характер. Скорость реакции (число частиц, образующихся в единицу времени и в единице объема) в прямом направлении равна скорости реакции в обратном направлении. В условиях химического равновесия концентрации (или парциальные давления в случае газов) исходных веществ и продуктов реакции не изменяются во времени и называются равновесными концентрациями (или парциальными давлениями).
Используя закон действующих масс, можно рассчитать равновесие концентрации или парциальные давления реагирующих веществ.
Закон действующих масс формулируется в следующем виде: отношение произведения равновесных концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению исходных веществ в степенях, равных стехиометрическим коэффициентам при Т = const, является величиной постоянной. Используя этот закон, можно рассчитать равновесие концентрации или парциальные давления реагирующих веществ.
При внешнем воздействии на систему происходит смещение химического равновесия, т.е. изменяются равновесные концентрации исходных веществ и продуктов реакции. Характер смещения под влиянием внешних воздействий можно прогнозировать, применяя принцип Ле Шателье (который следует из закона действующих масс): если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в таком направлении, которое ослабляет внешнее воздействие.
3.6. Химическое равновесие в гетерогенных системах
Химические реакции, протекающие на границе раздела фаз, называются гетерогенными химическими реакциями. Если скорости прямой и обратной гетерогенных реакций становятся одинаковыми, то наступает химическое равновесие в гетерогенной системе, называемое гетерогенным химическим равновесием. Условием этого равновесия является равенство энергии Гиббса реакции нулю, т.е. G = 0.
Как в случае гомогенной химической реакции, константа гетерогенного химического равновесия равна отношению произведения равновесных концентраций (активностей) или парциальных давлений продуктов реакций к произведению равновесных концентраций (активностей) или парциальных давлений исходных веществ в степенях, равных стехиометрическим коэффициентам соответственно продуктов реакций и исходных веществ.
Таким образом, в уравнения констант гетерогенного химического равновесия не входят никакие члены, относящиеся к твердым веществам, участвующим в прямой и обратной реакциях. В них также не входит площадь поверхности раздела фаз.
Константа гетерогенного химического равновесия зависит от температуры. Она возрастает с увеличением температуры в случае эндотермической прямой реакции (Н 15 / 38 15 16 17 18 19 20 21 22 23 > Следующая > >>
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.

Создание учения о химическом равновесии стало одним из главных достижений физической химии XIX века. Именно исследование химического равновесия положило начало изучению зависимости хода и результата химического процесса от таких факторов, как температура, давление, концентрации реагентов, природа растворителя и прочих внешних условий. В химической промышленности определение положения химического равновесия при различных давлениях и температурах и учет скоростей реакции позволяют выбирать оптимальные условия процесса, в частности, условия, при которых наблюдается максимальный выход химических продуктов. Примеры использования обратимых реакций в технологии: производства аммиака, окисление оксида серы (+2) в производстве серной кислоты и т.д.
Цель работы: рассмотреть кинетические и термодинамические представления о химическом равновесии; изучить факторы, влияющие на смещение равновесия в системе.
В соответствии с целью работы были поставлены следующие задачи:
- рассмотреть понятие "химическое равновесие";
- изучить кинетические представления о химическом равновесии;
- изучить термодинамические представления о химическом равновесии;
- изучить факторы, влияющие на смещение равновесия в системе;
- экспериментально определить константу равновесия в системе: хлорное железо-иодид калия.
Теоретическая часть
Фазой называется часть системы, отличающаяся по своим физическим и химическим свойствам от других частей системы и отделенная от них поверхностью раздела, при переходе через которую свойства системы резко меняются.
Системы, состоящие из одной фазы, называются гомогенными, из нескольких фаз – гетерогенными. Соответственно реакции, в которых взаимодействующие вещества находятся в одной фазе, называются гомогенными, а реакции, в которых вещества соединяются в различных фазах – гетерогенными.
Химически необратимые реакции при данных условиях идут практически до конца, до полного расхода одного из реагирующих
Химически обратимые реакции протекают одновременно при данных условиях как в прямом, так и в обратном направлении. Необратимых реакций меньше, чем обратимых. Примером обратимой реакции служит взаимодействие водорода с йодом:
Через некоторое время скорость образования HI станет равной скорости его разложения:
Иными словами, наступит химическое равновесие:
Рис. 1. Изменение скорости прямой (1) и обратной (2) реакций с течением времени.
Равновесным считается состояние системы, которое остается неизменным, причем это состояние не обусловлено действием каких-либо внешних сил. Согласно химической кинетике, состояние системы реагирующих веществ, при котором скорость прямой реакции становится равной скорости обратной реакции, называется химическим равновесием. Такое равновесие называется еще подвижным или динамическим равновесием.
Признаки химического равновесия
1. Состояние системы остается неизменным во времени при сохранении внешних условий.
2. Равновесие является динамическим, то есть обусловлено протеканием прямой и обратной реакции с одинаковыми скоростями.
3. Любое внешнее воздействие вызывает изменение в равновесии системы; если внешнее воздействие снимается, то система снова возвращается в исходное состояние.
4. К состоянию равновесия можно подойти с двух сторон – как со стороны исходных веществ, так и со стороны продуктов реакции.
5. В состоянии равновесия энергия Гиббса достигает своего минимального значения.
На основании равенства скоростей прямой и обратной реакций при равновесии можно записать :
Из этого уравнения видно, что при установившемся равновесии произведение концентраций продуктов реакции, деленное на произведение концентраций исходных веществ, в степенях, равных соответствующим стехиометрическим коэффициентам, для данной реакции при данной температуре представляет собой постоянную величину, называемую константой равновесия.
В общем виде константа равновесия выглядит так :
КС- константа равновесия, индекс С показывает, что в выражение
для КС входят равновесные концентрации веществ; a, b, g, r- стехиометрические коэффициенты участвующих в реакции веществ
Поскольку для реакций с участием газов вместо молярных концентраций часто используют парциальные давления реагентов и продуктов, константу равновесия можно выразить и через равновесные парциальные давления
где pG, pR, pA, pB - равновесные парциальные давления участников реакции .
Константы равновесия КС и Кр связаны между собой выражением
где ∆п = g+ r- a- b - разность между стехиометрическими коэффициентами газообразных продуктов реакции и исходных веществ в соответствии с уравнением реакции.
Так же эти уравнения раскрывают смысл закона действующих масс, который формулируется так: В состоянии химического равновесия при постоянной температуре отношение произведений молярных концентраций продуктов реакции, взятых в степенях, равных их стехиометрическим коэффициентам, к произведению молярных концентраций оставшихся неизрасходованными исходных веществ, также взятых в степенях, равных их стехиометрическим коэффициентам, является величиной постоянной независимо от начальных концентраций веществ
Термодинамические представления о химическом равновесии
Каждая термодинамическая система характеризуется определенным набором параметров: давлением Р, объемом V, температурой Т, концентрациями веществ С, (i= A, В. G, R). Если температуру и объем системы поддерживают постоянными, то реакция протекает в изохорно-изотермических условиях. Если постоянны Р и Т, химический процесс протекает в изобарно-изотермических условиях.
В результате протекания обратимой реакции при V, Т = const или Р, Т = const в системе устанавливается состояние химического равновесия. Концентрации исходных веществ и продуктов реакции, изменявшиеся в ходе реакции, после достижения этого состояния далее уже не изменяются. Неизменность состава системы во времени при V, Т = const или Р, Т = const является необходимым, но еще не достаточным признаком установившегося химического равновесия. Реакция может протекать с очень малой (практически нерегистрируемой) скоростью.
Скорость реакции в заданных условиях (например, при низкой температуре и в отсутствие катализатора) может даже оказаться равной нулю. В последнем случае говорят, что система находится в метастабильном неустойчивом равновесии.
Кратко рассмотрим основные термодинамические функции для более полного понимания химического равновесия с точки зрения термодинамики.
Энергия Гиббса G – функция состояния термодинамической системы, равная разности между энтальпией и произведением температуры на энтропию:
Убыль энергии Гиббса в равновесном процессе, протекающем при P,T = const, равна максимальной полезной работе, произведенной системой. Величина G является критерием направленности самопроизвольного процесса в закрытой системе при P,T = const: при G 0 - в обратном, при G = 0 реализуется состояние равновесия.
Для идеального газа :
Энергия Гельмгольца F – функция состояния термодинамической системы, равная разности между внутренней энергией и произведением температуры на энтропию
Убыль энергии Гельмгольца в равновесном процессе, протекающем при V,T = const, равна максимальной полезной работе, произведенной системой. Величина F является критерием направленности самопроизвольного процесса в закрытой системе при V,T = const : при F 0 - в обратном, при F = 0 реализуется состояние равновесия.
Для идеального газа :
С точки зрения термодинамики состояние равновесия – это предел
убыли энергии Гиббса. В состоянии истинного химического равновесия: ∆G=0.
Изотерма химической реакции.
Для любого химического превращения связь между энергией Гиббса при стандартных условиях(∆G 0 ) и энергией Гиббса при любых других условиях (∆G) определяется уравнением
Где П-это отношение произведения концентрации продуктов реакции к произведению концентраций исходных веществ в неравновесных условиях, так называемая кажущаяся константа равновесия.
В состоянии равновесия ∆G=0 и кажущаяся константа равновесия становится равной истинной константе равновесия (К). Преобразованное уравнение имеет следующий вид:
∆G 0 =−RTlnK – стандартная изотерма Вант-Гоффа.
Если продифференцировать уравнение стандартной изотермы Вант- Гоффа по температуре при постоянном давлении, получим уравнение изобары Вант-Гоффа:
а если продифференцировать уравнение стандартной изотермы Вант- Гоффа по температуре при постоянном объёме, с учетом связей выражений для функций состояния получим уравнение изохоры Вант-Гоффа:
Эти уравнения применяются для расчетов Крвн при различных температурах при условии, что известны ∆H и ∆U (последнее особенно часто применяется к растворам).
Анализ уравнения изотермы показывает, что для эндотермических реакций (∆H>0) K 0 P с ростом температуры увеличивается, а для экзотермических ( ∆H
При равенстве энтальпийного и энтропийного факторов Δ Н = Т Δ S Δ G = 0 , что является термодинамическим условием химического равновесия. Химическое равновесие имеет динамический характер. Скорость реакции (число частиц образующихся в единицу времени в единице объема) в прямом направлении равна скорости реакции в обратном направлении. В этот момент концентрации исходных веществ и продуктов реакции не изменяются во времени и называются равновесными концентрациями. Они обозначаются символом вещества в квадратных скобках.
При равновесии химической реакции:
b B + d D = l L + m M
где p p , L , p pM , p p , D , p pB –равновесные парциальные давления веществ, а [ L ], [ M ],[ D ],[ B ] –равновесные концентрации веществ; l , m , d , b - показатели степени, равные стехиометрическим коэффициентам.
Отношения произведений парциальных давлений или концентраций получили названия констант химического равновесия соответственно К р или К с :
Эти уравнения являются математическими выражениями закона действующих масс, открытого норвежскими учеными К. Гульдбергом и П. Вааге в 1867 г.:
отношение произведения равновесных концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению равновесных концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам, при Т = со nst , является величиной постоянной.
Например, для реакции синтеза аммиака:
закон действующих масс имеет вид:
Подставляя выражение константы в уравнения, получаем
Δ G 0 = - RT ln K c = - 2,3 RT lgK p ,
Δ G 0 = - RT ln K p = - 2,3 RT lg K c .
Рассчитав величину Δ G 0 химической реакции, можно определить константу химического равновесия. Используя закон действующих масс, можно рассчитать равновесные концентрации реагирующих веществ.
Из вышеприведенного уравнения следует
ln К с = - Δ G 0 / RT .
Энергия Гиббса процесса имеет значение Δ G 0 = Δ H – T Δ S . Тогда
lnK c = - Δ H 0 /( RT ) + Δ S 0 / R .
Если Δ Н и Δ S не зависят от температуры, то производная константы равновесия по температуре будет равна:
d ( ln K c )/ dT = Δ H 0 /(RT 2 ) .
Это изобара равновесия. Она показывает, что константа равновесия экзотермической реакции уменьшается, а эндотермической реакции возрастает с повышением температуры. С увеличением абсолютного значения энтальпии реакции и уменьшением температуры чувствительность константы равновесия ( d ( ln K c )/ dT ) к изменению температуры повышается.
При изменении равновесных концентраций исходных веществ и продуктов реакции путем воздействия на систему происходит смещение химического равновесия. Если увеличиваются равновесные концентрации продуктов реакции, то говорят о смещении равновесия вправо. Если при внешнем воздействии увеличиваются концентрации исходных веществ, то говорят о смещении равновесия влево.
Характер смещения равновесия можно прогнозировать, применяя принцип французского ученого Ле Шателье :
если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет внешнее воздействие.
Принцип Ле Шателье следует из закона действующих масс. Если система находится при постоянной температуре, то константа равновесия при внешних воздействиях остается постоянной. Поэтому любое изменение равновесных концентраций веществ должно приводить к такому изменению равновесных концентраций других веществ, чтобы соблюдалось постоянство константы равновесия.
Рассмотрим процесс конверсии метана:
Константа равновесия этого процесса имеет вид:
1. Рассмотрим, как влияет изменение концентраций на смещение равновесия. При увеличении концентрации метана СН 4 равновесие системы нарушается, идет прямая реакция. Концентрации продуктов реакции СО 2 и Н2 увеличиваются, а концентрации Н2О уменьшается. Процесс будет протекать до тех пор, пока не установится новое равновесие. Новые равновесные концентрации компонентов будут такими, что константа равновесия не изменится. Если увеличить концентрацию СО 2 , то по принципу Ле Шателье равновесие сместится влево.
2. Если в результате реакции изменяется число молей газообразных веществ, то изменяется общее давление в системе и происходит смещение равновесия. В соответствии с принципом Ле Шателье увеличение общего давления вызывает смещение равновесия в сторону уменьшения числа молей газообразных веществ, т.е. в сторону уменьшения давления. Для рассматриваемой реакции увеличение давления должно смещать равновесие влево (слева- 3 моля, справа – 5 молей).
3. С увеличением температуры равновесие смещается в сторону эндотермических реакций, т.е. реакций протекающих с поглощением теплоты, понижение – в сторону экзотермических реакций.
Итак, принцип Ле Шателье позволяет создавать такие условия протекания реакции, которые обеспечивают максимальный выход продуктов реакции.
Химические реакции, протекающие на границе раздела фаз, называются гетерогенными химическими реакциями.
При равенстве скоростей прямой и обратной реакции наступает химическое равновесие в гетерогенной системе. Примерами гетерогенных процессов является пароводяная конверсия углерода, или восстановление оксидов металлов водородом:
Как и для любого равновесия, условием гетерогенного химического равновесия является равенство энергии Гиббса нулю, Δ G = 0 .
Как и в случае гомогенной химической реакции, константа гетерогенного равновесия равна отношению произведения равновесных концентраций (активностей) или парциальных давлений продуктов реакций к произведению равновесных концентраций (активностей) или парциальных давлений исходных веще ств в ст епенях, равных стехиометрическим коэффициентам в уравнении. Для реакции пароводяной конверсии углерода константа равновесия имеет вид:
для восстановления металла
Из приведенных выражений следует, что в уравнения констант гетерогенного химического равновесия не входят концентрации твердых веществ, участвующих в прямой и обратной реакциях. Это особенность гетерогенного химического равновесия.
Так как прямая и обратная реакции протекают на одной и той же поверхности раздела фаз, то площадь поверхности раздела фаз также не входит в уравнение константы химического равновесия.
Константа гетерогенного химического равновесия зависит от температуры. Она возрастает с увеличением температуры для эндотермической прямой реакции и уменьшается с увеличением температуры в случае экзотермической прямой реакции. Расчеты проводятся по тем же формулам, что и для гомогенных реакций.
Смещение равновесия гетерогенных реакций подчиняется принципу Ле Шателье . При повышении температуры оно смещается в сторону эндотермической реакции. При повышении давления или концентрации исходных веществ равновесие смещается в сторону образования продуктов реакции, при повышении концентрации или давления продуктов реакции равновесие смещается в сторону обратной реакции. При повышении общего давления равновесие сдвигается в направлении уменьшения числа молекул газообразных веществ.
Твердые исходные вещества и продукты реакции не влияют на смещение гетерогенного химического равновесия.
Одно и то же вещество может при изменении температуры и давления переходить в различные агрегатные состояния. Эти переходы, осуществляемые без изменения химического состава, называются фазовыми переходами. Если рассматривается гетерогенная система, в которой нет химического воздействия, а имеются лишь фазовые переходы, то при постоянстве температуры и давления существует так называемое фазовое равновесие. Примерами фазового равновесия могут быть процессы плавления, кристаллизации, испарения, конденсации воды. Это равновесие характеризуется некоторым числом фаз, компонентов и числом степеней термодинамической свободы системы или числом степеней свободы.
Фаза – это однородная часть системы одинаковая по составу и свойствам, имеющая поверхность раздела, и которая может быть выделена из системы чисто механическим путем.
Так, система лед+вода имеет две фазы.
Компонентом называется химически однородная составная часть системы, которая может быть выделена из системы и может существовать вне ее .
Так, в растворе хлорида натрия компонентами являются вода и хлорид натрия, но ионы натрия и хлора не могут считаться компонентами.
Число степеней свободы определяется как число параметров системы (температура, давление), которые могут быть произвольно изменены в некоторых пределах без изменения числа и природы фаз в системе.
У системы, состоящей лишь из газа, можно менять два параметра, третий система устанавливает произвольно сама.
Число степеней свободы определяется правилом фаз Дж .Г иббса (1876 г.):
число степеней свободы равновесной системы, на которую влияют только температура и давление, равно числу независимых компонентов системы минус число фаз плюс два:
где С – число степеней свободы; К – число компонентов; Ф – число фаз; 2 – число независимых параметров, например температура и давление.
Классификацию систем можно проводить: по числу фаз (однофазные, двухфазные и т.д.); по числу компонентов системы (однокомпонентные, двухкомпонентные и т.д.); по числу степеней свободы – инвариантные (С = 0), моновариантные (С = 1), дивариантные (С = 2) и т. д. Диаграммы, по которым можно определить условия устойчивости фаз и фазового равновесия, называются фазовыми диаграммами или диаграммами состояния. Для однокомпонентных систем правило фаз имеет вид
Примером однокомпонентной системы служит диаграмма состояния воды в координатах давление – температура . ( р ис.15) Области, находящиеся между кривыми, являются однофазными областями (С = 2). Кривые соответствуют условиям равновесия между двумя фазами (С = 1). Кривая ОС отражает равновесие процесса кипения. Кривая кипения оканчивается точкой С , которая называется критической. При температуре выше этой точки невозможно получить жидкую воду ни при каком давлении. Вода, при температурах выше критической и давлении, выше критического, переходит в особое состояние, называемое сверхкритическим (СК). Свойства веществ в этом состоянии находятся между свойствами газа и жидкости. Например, вещества в сверхкритическом состоянии имеют очень низкую вязкость, высокую диффузионную активность и способность растворять многие вещества в твердом, жидком или газообразном видах.
Кривая ОВ – это кривая плавления. При увеличении давления температура плавления немного уменьшается, что обусловлено разрывом водородных связей при повышении давления.
Кривая ОА отражает процесс сублимации, т.е. перехода из твердого состояния в газообразное , минуя жидкое. Кривая ОД описывает поведение воды в неустойчивом (метастабильном) состоянии. Явление образования метастабильного состояния получило название переохлаждения.
В точке О существует равновесие одновременно между тремя фазами. Она называется тройной точкой воды, и для нее давление равно 610 Па и температура 273,15 К.
Процесс поглощения одного вещества поверхностью или объемом другого называется сорбцией.
Вещество, частицы которого поглощаются (газ, жидкость или растворенный компонент), называют сорбатом , а поглотитель (чаще твердое тело) – сорбентом .
Сорбционные процессы играют большую роль в технике. Например, для поддержания высокого вакуума в действующем электровакуумном приборе применяют геттеры – специально изготовленные материалы, которые активно поглощают остаточные газы. В качестве геттеров используют компактные ( Zr , Ta , Nb и др.) или распыленные ( Ba , Ca , Sr ) металлы. Сорбционные процессы широко используют в металлургии при обогащении руд (флотация), в энергетике при водоподготовке (ионный обмен) и др.
При контакте сорбент поглощает сорбат поверхностью или объемом. Сорбция только поверхностью называется адсорбцией , а только объемом – абсорбцией . Процесс обратный адсорбции называется десорбцией.
Адсорбция связана с особым энергетическим состоянием частиц на поверхности адсорбента в отличие от энергетического состояния частиц в его объеме . Частицы во внутренних слоях вещества испытывают одинаковое притяжение со стороны окружающих частиц по всем направлениям.
Частицы же поверхностного слоя подвергаются неодинаковому притяжению со стороны внутренних слоев вещества и со стороны частиц граничащей с веществом посторонней фазы. Поэтому частицы поверхностного слоя адсорбента обладают свободной поверхностной энергией , которая может быть снижена за счет возникновения абсорбционных взаимодействий с молекулами, атомами и ионами адсорбата .
Для границы раздела фаз жидкость – газ (пар) обычно используют термин "удельная (на 1 м 2 ) поверхностная энергия", называемая поверхностным натяжением , которая равно работе образования единицы площади поверхности раздела фаз (Дж/м 2 ).
Поверхностная энергия – это энергия Гиббса Δ G образования поверхности. Она равна произведению удельной поверхностной энергии σ на площадь поверхности раздела фаз S :
Δ G = σ S .
Удельная поверхностная энергия зависит от природы вещества. Чем выше энергия взаимодействия между частицами вещества, тем выше удельная поверхностная энергия. С увеличением температуры удельная поверхностная энергия уменьшается.
В зависимости от природы сил взаимодействия адсорбирующего вещества с адсорбентом различают физическую и химическую (хемосорбцию) адсорбцию. В первом случае при адсорбции возникают вандерваальсовы взаимодействия, во втором – химические связи.
Физическая адсорбция характеризуется невысоким тепловым эффектом и обратимостью.
Хемосорбция протекает необратимо. Тепловой эффект ее близок к тепловому эффекту химических реакций.
Поскольку адсорбция протекает самопроизвольно, то энергия Гиббса имеет отрицательное значение
Тепловой эффект адсорбции имеет также отрицательное значение
Если адсорбция протекает из газовой, жидкой фазы на поверхность жидкой или твердой фазы, то в процессе адсорбции происходит упорядочение адсорбированных частиц и энтропия системы уменьшается, т.е.
Отсюда следует, что с увеличением температуры энергия Гиббса системы возрастает, и при некоторой температуре Т р наступает равновесие, в это время скорость адсорбции равна скорости десорбции. При этом
Δ G адс = 0 и T р Δ S адс = Δ H адс .
При увеличении температуры адсорбция уменьшается. То есть вещество можно адсорбировать при невысокой температуре и десорбировать при более высокой.
Абсорбционное равновесие подвижно и может быть смещено в ту или иную сторону в соответствии с принципом Ле Шателье .
Количественно адсорбцию можно выражать в молях адсорбата на единицу площади адсорбента, моль/м 2 . Адсорбция зависит от природы адсорбента и адсорбата , температуры и концентрации или давления адсорбата . Кривую зависимости величины адсорбции Г от равновесных концентраций С или давлений р адсорбата при постоянной температуре Т называют изотермой адсорбции :
Г = f ( C ) или Г = f ( p ) при Т = const .
Изотерма адсорбции на однородной поверхности адсорбента была выведена американским ученым Дж .Л энгмюром . При выводе уравнения было сделано предположение, что поверхность адсорбента однородна и при максимальном заполнении образуется мономолекулярный слой. В этом случае уравнение имеет вид:
где Г ∞ - адсорбция при максимальном заполнении;
с – равновесная концентрация адсорбата ;
р – равновесное давление адсорбата ;
К а – константа равновесия процесса адсорбции.
Графически изотерма адсорбции имеет вид, приведенный на рис. 16
Изотерма Лэнгмюра редко соблюдается в реальности, поэтому предложены другие уравнения.
В 1906 г. Фрейндлих предложил эмпирическое уравнение изотермы. Уравнение Фрейндлиха имеет вид:
Г = К ф р n ,
где К ф и n – постоянные.
При адсорбции изменяются свойства поверхностного слоя, т.е. поверхностное натяжение. Адсорбирующиеся вещества могут понижать поверхностное натяжение (это поверхностно - активные вещества – ПАВ), повышать поверхностное натяжение (поверхностно - инактивные вещества) и не влиять на поверхностное натяжение (поверхностно - неактивные вещества).
Широкое применение нашли лишь ПАВ. Способностью уменьшать поверхностное натяжение, т.е. поверхностной активностью обладают молекулы вещества, имеющие неполярные гидрофобные углеводородные части ("хвосты") и полярные гидрофильные группы ("головы"). К полярным принадлежат группы
К ПАВ принадлежит натриевая соль стеариновой кислоты, входящей в состав мыла
Поверхностная активность обусловлена гидрофобной частью молекул ПАВ ("хвостами"), которые выталкиваются из полярного растворителя, в то время как гидрофильные группы ("головы") удерживают молекулы ПАВ на границе раздела фаз. Таким образом, молекулы ПАВ адсорбируются на границе раздела фаз, причем гидрофобная их часть обращена в сторону газа или неполярной жидкости, гидрофильная часть – в сторону полярной жидкости или твердого гидрофильного адсорбента.
Концентрация ПАВ в поверхностном слое на несколько порядков выше, чем в объеме жидкости, поэтому даже при малом содержании ПАВ они значительно снижают поверхностное натяжение. Поверхностная активность ПАВ возрастает с увеличением длины углеводородной части молекул и их концентрации.
Изменение поверхностного натяжения под действием ПАВ влияет на смачиваемость твердых тел жидкостью. Этот эффект используется для очистки тканей (стирка, чистка) или металлов от жировых загрязнений применением ПАВ, при адсорбции которых на границе раздела фаз вода – жир, вода – твердое тело изменяется поверхностное натяжение воды на этих границах, что приводит к переходу жира в виде капель в водную среду.
Применение ПАВ позволяет разделять пустую породу и руду при флотации руд. Пустая порода смачивается водой, содержащей ПАВ, а руда поднимается вверх с пузырьками воздуха, продуваемого через раздробленную породу в воде.
Равновесным считается состояние системы, которое остается неизменным, причем это состояние не обусловлено действием каких-либо внешних сил. Состояние системы реагирующих веществ, при котором скорость прямой реакции становится равной скорости обратной реакции, называется химическим равновесием. Такое равновесие называется еще подвижным или динамическим равновесием.
- Состояние системы остается неизменным во времени при сохранении внешних условий.
- Равновесие является динамическим, то есть обусловлено протеканием прямой и обратной реакции с одинаковыми скоростями.
- Любое внешнее воздействие вызывает изменение в равновесии системы; если внешнее воздействие снимается, то система снова возвращается в исходное состояние.
- К состоянию равновесия можно подойти с двух сторон – как со стороны исходных веществ, так и со стороны продуктов реакции.
- В состоянии равновесия энергия Гиббса достигает своего минимального значения.
Влияние изменения внешних условий на положение равновесия определяется принципом Ле Шателье (принципом подвижного равновесия):
Если на систему, находящуюся в состоянии равновесия, производить какое–либо внешнее воздействие, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Принцип Ле Шателье применим не только к химическим процессам, но и к физическим, таким как кипение, кристаллизация, растворение и т. д.
Рассмотрим влияние различных факторов на химическое равновесие на примере реакции окисления NO:
При повышении температуры равновесие сдвигается в сторону эндотермической реакции, при понижении температуры – в сторону экзотермической реакции.
Степень смещения равновесия определяется абсолютной величиной теплового эффекта: чем больше по абсолютной величине энтальпия реакции ΔH, тем значительнее влияние температуры на состояние равновесия.
В рассматриваемой реакции синтеза оксида азота (IV) повышение температуры сместит равновесие в сторону исходных веществ.
Сжатие смещает равновесие в направлении процесса, который сопровождается уменьшением объема газообразных веществ, а понижение давления сдвигает равновесие в противоположную сторону.
В рассматриваемом примере в левой части уравнения находится три объема, а в правой – два. Так как увеличение давления благоприятствует процессу, протекающему с уменьшением объема, то при повышении давления равновесие сместится вправо, т.е. в сторону продукта реакции – NO2. Уменьшение давления сместит равновесие в обратную сторону. Следует обратить внимание на то, что, если в уравнении обратимой реакции число молекул газообразных веществ в правой и левой частях равны, то изменение давления не оказывает влияния на положение равновесия.
Для рассматриваемой реакции введение в равновесную систему дополнительных количеств NO или O2 вызывает смещение равновесия в том направлении, при котором концентрация этих веществ уменьшается, следовательно, происходит сдвиг равновесия в сторону образования NO2. Увеличение концентрации NO2 смещает равновесие в сторону исходных веществ.
Катализатор одинаково ускоряет как прямую, так и обратную реакции и поэтому не влияет на смещение химического равновесия.
При введении в равновесную систему (при Р = const) инертного газа концентрации реагентов (парциальные давления) уменьшаются. Поскольку рассматриваемый процесс окисления NO идет с уменьшением объема, то при добавлении инертного газа равновесие сместится в сторону исходных веществ.
Для химической реакции:
константа химической реакции Кс есть отношение:
В этом уравнении в квадратных скобках – концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, т.е. равновесные концентрации веществ.
Константа химического равновесия связана с изменением энергии Гиббса уравнением:
ΔGT о = – RTlnK (2)
Задача 1. При некоторой температуре равновесные концентрации в системе 2CO (г) + O2 (г)→2CO2 (г) составляли: [CO] = 0,2 моль/л, [O2] = 0,32 моль/л, [CO2] = 0,16 моль/л. Определите константу равновесия при этой температуре и исходные концентрации CO и O2, если исходная смесь не содержала СО2.
Решение.
Во второй строке под Спрореагир понимается концентрация прореагировавших исходных веществ и концентрация образующегося CO2, причем, Сисходн= Спрореагир + Сравн.
Задача 2. Используя справочные данные, рассчитайте константу равновесия процесса
Решение.
ΔG298 о = 2·(- 16,71) кДж = -33,42·10 3 Дж.
lnK = 33,42·10 3 /(8,314× 298) = 13,489. K = 7,21× 10 5 .
Задача 3. Определите равновесную концентрацию HI в системе
если при некоторой температуре константа равновесия равна 4, а исходные концентрации H2 , I2 и HI равны, соответственно, 1, 2 и 0 моль/л.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л H2.
| Вещество | H2 | I2 | HI |
| сисходн., моль/л | 1 | 2 | 0 |
| спрореагир., моль/л | x | x | 2x |
| cравн., моль/л | 1-x | 2-x | 2x |
Тогда, К = (2х) 2 /((1-х)(2-х))
Решая это уравнение, получаем x = 0,67.
Значит, равновесная концентрация HI равна 2× 0,67 = 1,34 моль/л.
Решение.
Если К = 1, то ΔG о T = — RTlnK = 0;
ΔН о 298 = -202 – (- 115,9) = -86,1 кДж = — 86,1× 10 3 Дж;
ΔS о 298 = 239,7 – 218,7 – 130,52 = -109,52 Дж/К;
0 = — 86100 — Т·(-109,52)
Задача 5. Для реакции SO2(Г) + Cl2(Г) →SO2Cl2(Г) при некоторой температуре константа равновесия равна 4. Определите равновесную концентрацию SO2Cl2, если исходные концентрации SO2, Cl2 и SO2Cl2 равны 2, 2 и 1 моль/л соответственно.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л SO2.
| Вещество | SO2 | Cl2 | SO2Cl2 |
| cисходн., моль/л | 2 | 2 | 1 |
| cпрореагир., моль/л | x | x | х |
| cравн., моль/л | 2-x | 2-x | x + 1 |
Решая это уравнение, находим: x1 = 3 и x2 = 1,25. Но x1 = 3 не удовлетворяет условию задачи.
Следовательно, [SO2Cl2] = 1,25 + 1 = 2,25 моль/л.
1. В какой из приведенных реакций повышение давления сместит равновесие вправо? Ответ обоснуйте.
Так как увеличение давления благоприятствует процессу, протекающему с уменьшением количества
газообразных веществ, то равновесие сместится вправо в реакции 3.
2. При некоторой температуре равновесные концентрации в системе:
составляли: [HBr] = 0,3 моль/л, [H2] = 0,6 моль/л, [Br2] = 0,6 моль/л. Определите константу равновесия и исходную концентрацию HBr.
К = 4; исходная концентрация HBr составляет 1,5 моль/л.
3. Для реакции H2(г) + S(г) →H2S(г) при некоторой температуре константа равновесия равна 2. Определите равновесные концентрации H2 и S, если исходные концентрации H2, S и H2S равны, соответственно, 2, 3 и 0 моль/л.
[H2] = 0,5 моль/л; [S] = 1,5 моль/л.
4. Используя справочные данные, вычислите температуру, при которой константа равновесия процесса
становится равной 1. Примите, что ΔН о Т≈ΔН о 298, а ΔS о T≈ΔS о 298
5. Используя справочные данные, рассчитайте константу равновесия процесса:
7. При температуре 500 К константа равновесия процесса:
равна 3,4·10 -5 . Вычислите Δ G о 500.
8. При температуре 800 К константа равновесия процесса н-С6Н14(г)+ 2С3Н6(г)+Н2(г) равна 8,71. Определите ΔG о f,800(С3Н6(г)), если ΔG о f,800(н-С6Н14(г)) = 305,77 кДж/моль.
9. Для реакции СО(г) + Cl2(г) →СO2Cl2(г) при некоторой температуре равновесная концентрация СO2Cl2(г) равна 1,2 моль/л. Определите константу равновесия данного процесса, если исходные концентрации СО(г) и Cl2(г) равны соответственно 2,0 и 1,8 моль/л.
10. При некоторой температуре равновесные концентрации в системе 2SО2(г) + О2(г) →2SO3(г) составляли: [SО2 ]=0,10 моль/л, [О2]=0,16 моль/л, [SО3]=0,08 моль/л. Вычислите константу равновесия и исходные концентрации SО2 и О2.
К=4,0; исходная концентрация SО2 составляет 0,18 моль/л;
исходная концентрация О2 составляет 0,20 моль/л.
Химическое равновесие - состояние химической системы, при котором скорость прямой реакции равна скорости обратной.
В большом количестве заданий, которые мне довелось увидеть, я ни один раз видел, как коверкают это определение. Например, в заданиях верно-неверно предлагают похожий вариант, однако говорят о "равенстве концентраций исходных веществ и продуктов" - это грубая ошибка. Химическое равновесие - равенство скоростей.
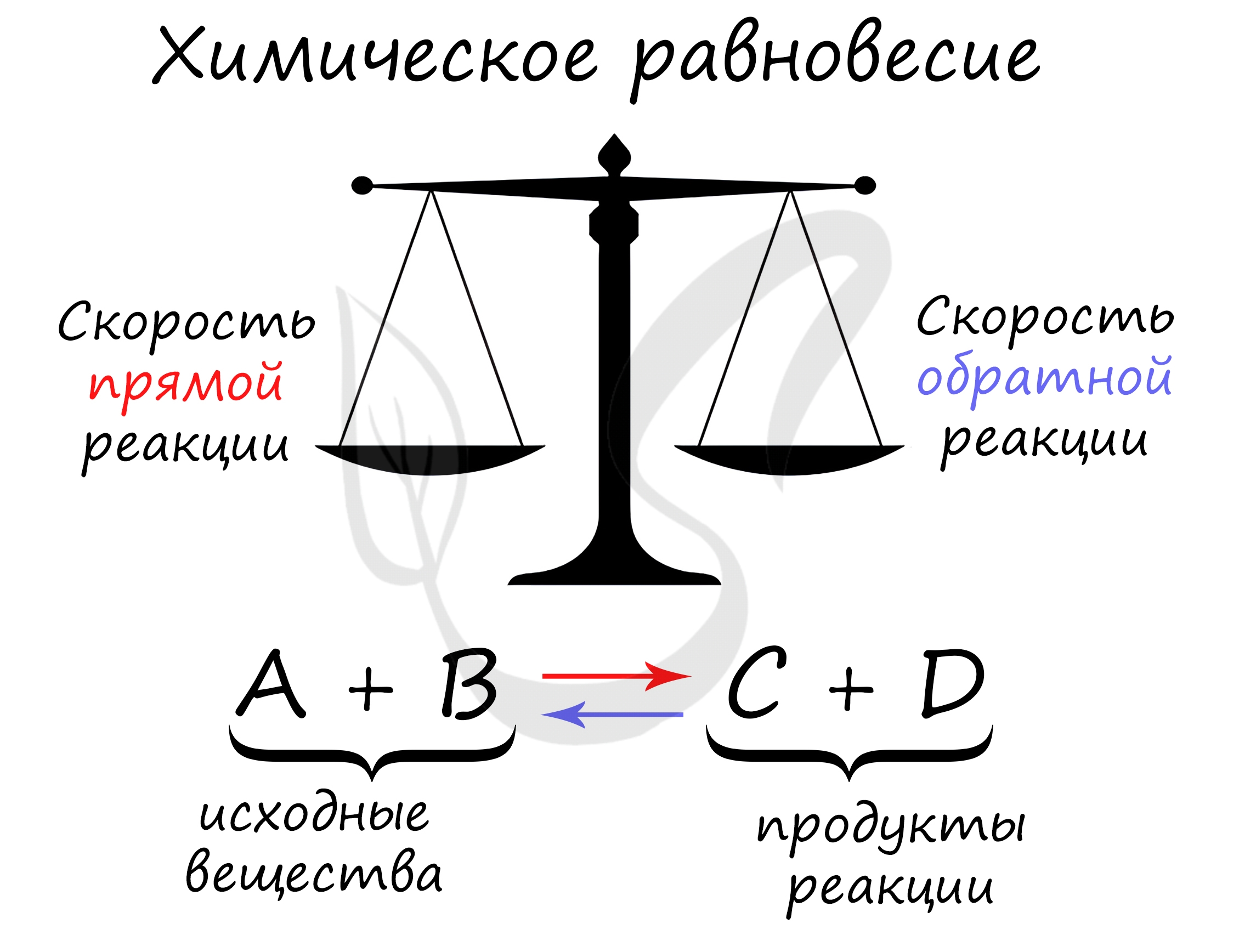
Принцип Ле Шателье
В 1884 году французским химиком Анри Ле Шателье был предложен принцип, согласно которому, если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то система будет стремиться компенсировать внешнее воздействие.

Это принцип обоснован термодинамически и доказан. Однако в такой абстрактной формулировке его сложно применить для решения конкретных задач по химическому равновесию. В этой статье я покажу конкретные примеры и обозначу алгоритм действия, чтобы вы могли успешно справляться с заданиями.
Влияние изменения концентрации на химическое равновесие
При увеличении концентрации какого-либо компонента химической реакции, система будет стремиться восстановить равновесие: равновесие будет смещаться в сторону расходования добавленного компонента.
Объясню проще: если вы увеличиваете концентрацию вещества, которое находится в левой части, равновесие сместится в правую сторону. Если добавляете вещество из левой части (продуктов реакции) - смещается в сторону исходных веществ. Посмотрите на пример ниже.
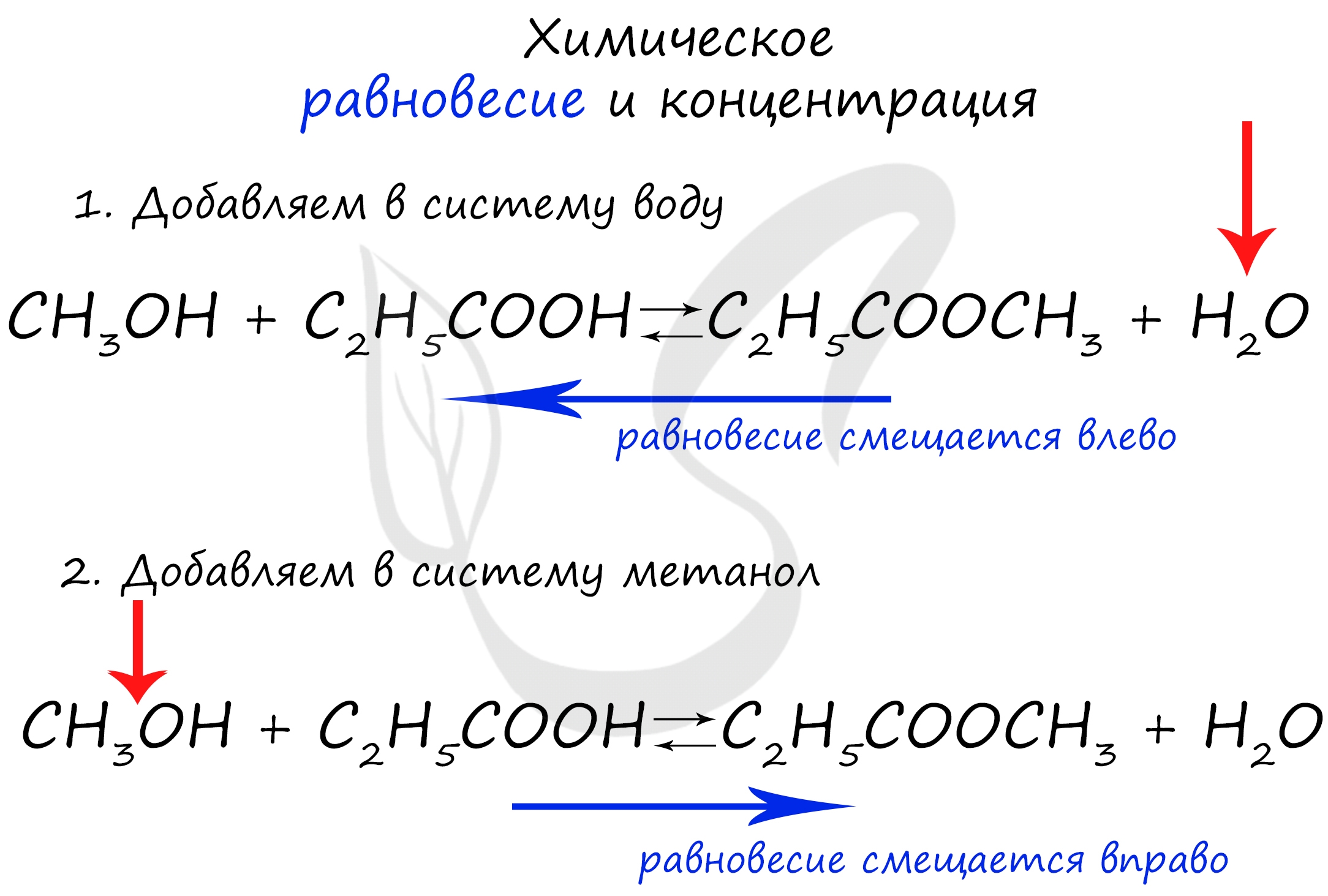
Если мы попытаемся удалить какое-либо вещество из системы (уменьшить его концентрацию), то система будет стремиться заполнить "пустое" место, которые мы создали. Наглядно демонстрирую на примере:
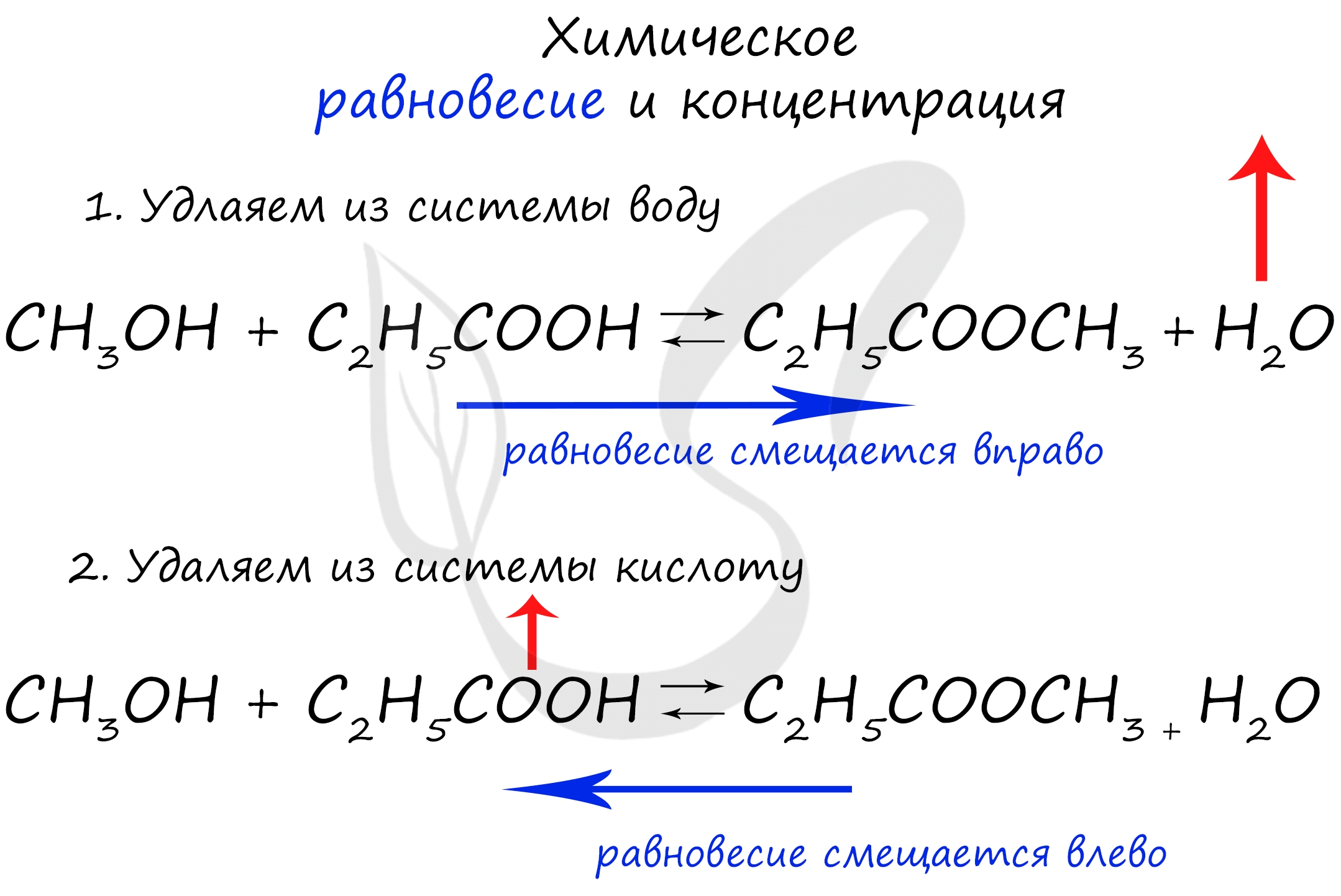
Можно подвести итог полученным знаниям таким образом: "Куда добавляем - оттуда смещается, откуда берем - туда смещается". Воспользуйтесь этой или придумайте свое правило для запоминания этой закономерности ;)
Изменения давления и химическое равновесие
Если речь в задании идет об изменении давления, то первое, что нужно сделать, это посчитать количество газов в уравнении слева и справа. Твердые вещества и жидкости считать не нужно. Например:
В приведенном уравнении количество молекул газа в левой части - 1, в правой - 2.
Запомните правило: "При увеличении давления равновесие смещается в сторону меньших газов, при уменьшении давления - в сторону больших газов". Для нашей системы правило действует таким образом:

В случае, если слева и справа количество молекул газа одинаково, например, в реакции:
Слева - 2 газа, и справа - 2. В такой реакции увеличение или уменьшение давления не повлияет на химическое равновесие.
Изменение температуры и химическое равновесие
Если в задании увеличивают или уменьшают температуру, то первое, что вы должны оценить: экзотермическая это реакция или эндотермическая.
Следуйте следующему правилу: "При увеличении температуры равновесие смещается в сторону эндотермической реакции, при уменьшении - в сторону экзотермической реакции". У любой обратимой реакции есть экзо- и эндотермические части:
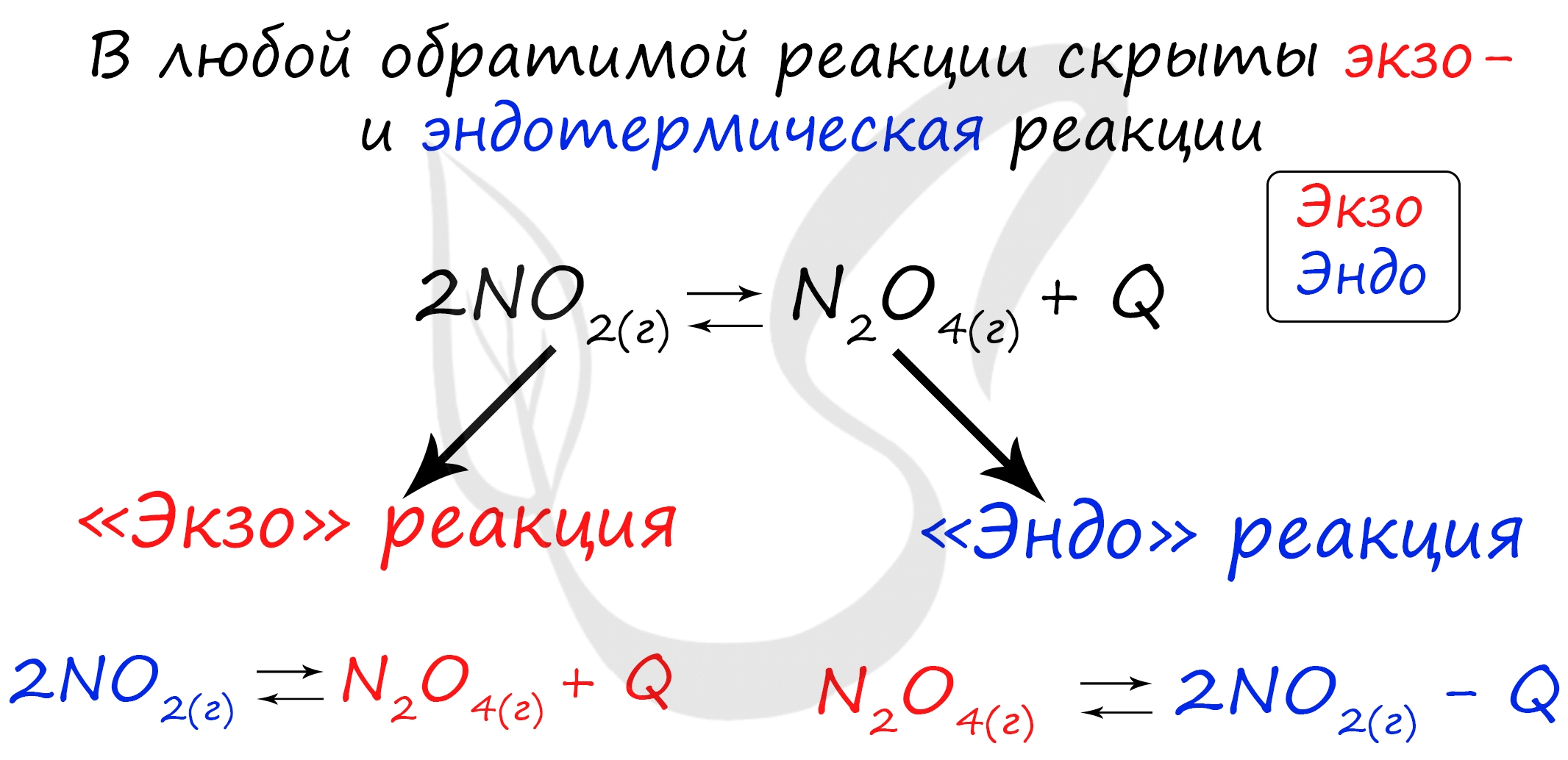
Поэтому данное правило универсально и применимо для всех реакций. Для примера разберем следующие задачи:

Чтобы не осталось белых пятен, возьмем экзотермическую реакцию и повторим с ней подобный эксперимент.

Катализатор и ингибитор
Действие катализатора и ингибитора соответственно касается только ускорения и замедления химической реакции. Они никоим образом не влияют на равновесие.
Константа равновесия
Константой равновесия называют отношения скоростей прямой и обратной реакции. Для реакции типа aA + bB = cC + dD константа равновесия будет записана следующим образом:

Решим задачу. Дана реакция: 2NO + Cl2 ⇄ 2NOCl . Вычислите константу равновесия, если равновесные концентрации веществ для данной реакции: c(NO) = 1.8 моль/л , c(Cl2) = 1.2 моль/л , c(NOCl) = 0.8 моль/л.

Константу равновесия для данной задачи можно представить в виде 1.64 * 10 -1 .
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:
- Беседа с родителями о воспитании детей в семье в детском саду
- Сонатная форма в музыке кратко
- Закон перехода количественных изменений в качественные кратко
- Роль и место полиции в системе органов внутренних дел кратко шпаргалка
- Охарактеризуйте роль гражданского общества в отношениях личности и государства кратко

