Гормоны печени и их функции кратко
Обновлено: 04.07.2024
Миома матки (ММ) относится к истинным доброкачественным опухолям гормонально зависимых органов. Ее распространенность колеблется в широких пределах. По данным литературы, каждая четвертая-пятая женщина в мире больна миомой матки
Миома матки (ММ) относится к истинным доброкачественным опухолям гормонально зависимых органов. Ее распространенность колеблется в широких пределах. По данным литературы, каждая четвертая-пятая женщина в мире больна миомой матки [40, 57]. Несмотря на низкую вероятность малигнизации (1%), до 2/3 пациенток, страдающих миомой матки, подвергаются оперативному лечению, причем 60–96% всех операций являются радикальными и приводят к потере репродуктивной и менструальной функции у женщин. Это впоследствии становится основной причиной развития нарушений в гипоталамо-гипофизарно-яичниковой системе, а также вегетососудистых и психоэмоциональных сдвигов [6, 14].
Фоном для усиленного роста миоматозных узлов в пременопаузальном периоде считаются длительные нейроэндокринные нарушения, патологический климакс, действие факторов, стимулирующих гиперпластические процессы в организме, а также различные метаболические расстройства (ожирение, нарушение липидного и углеводного обменов и т. д.) [6, 14, 17].
Миома матки часто сочетается с различными экстрагенитальными заболеваниями: ожирением (64%), заболеваниями сердечно-сосудистой системы (60%), функциональными нарушениями желудочно-кишечного тракта (40%); гипертонической болезнью (19%), неврозами и неврозоподобными состояниями (11%), эндокринопатиями (4,5%). Избыточный вес женщины в сочетании с низкой физической активностью и частыми стрессами относятся к факторам, способствующим появлению ММ. Кроме того, при оценке риска возникновения миомы матки не исключается генетическая предрасположенность ее развития [58].
В клинической практике важное значение имеет характер опухолевого роста. Опухоли матки разделяются по тканевому составу — миомы, фибромы, ангиомы и аденомиомы — в зависимости от содержания в них соединительной ткани и степени развития сосудистого компонента. Выделяют простые и пролиферирующие опухоли, последние встречаются у каждой четвертой больной с миомой матки.
ММ следует рассматривать как дисрегенераторный пролиферат поврежденного миометрия, а не опухоль [24, 38, 58].
Известно, что в миометрии вокруг тонкостенного сосуда сразу закладываются несколько зачатков роста. Миома матки имеет автономный рост (аутокринный и паракринный), обусловленный взаимодействием ростовых факторов и образованием гормонально чувствительных и ростовых рецепторов [14, 23, 38, 53].
Патогенез ММ до сих пор вызывает много споров. Существующие теории развития заболевания основаны на результатах лабораторных и экспериментальных исследований и объясняют лишь некоторые звенья патогенеза. Одно из центральных мест в патогенезе ММ отводится особенностям гормонального статуса и функционального состояния репродуктивной системы [42].
Современные исследования подтверждают традиционное мнение о ведущей роли эстрогенов в патогенезе ММ [40, 41, 56]. Содержание рецепторов эстрадиола и прогестерона в ткани миомы выше, чем в неизмененном миометрии, и подвержено циклическим изменениям. Длительное лечение агонистами гонадолиберина (гипоталамический рилизинг-фактор) уменьшает объем миоматозных узлов на фоне значительного снижения содержания рецепторов эстрогенов в миометрии и тканях миомы [14, 16, 23, 33, 40, 54].
Ведущая роль в патогенезе миомы матки отводится гиперэстрогенемии. Это было доказано в эксперименте возможностью получения псевдомиомы в результате длительного применения эстрогенных гормонов. После прекращения действия эстрогенов ММ у животных подвергается обратному развитию [19].
Эстрогены в крови женщин циркулируют как в свободном, так и в связанном состоянии в виде соединений с серной и глюкуроновой кислотами. Конъюгация эстрогенов с глюкуроновой кислотой с помощью фермента уридинфосфоглюкуронилтрансферазы происходит в основном в печени. Нарушение процессов конъюгации эстрогенов может привести к увеличению свободных фракций эстрогенов, обладающих более выраженной способностью стимулировать гиперпластические процессы в органах-мишенях — матке [19].
У женщин, страдающих ММ, все ткани (а не только ткани матки) реагируют на колебания уровня половых гормонов изменением концентрации своих рецепторов; эстрадиол индуцирует образование сначала рецепторов, а подъем уровня прогестерона в крови приводит к снижению и эстрогенных и прогестеронных рецепторов [23].
Прогестерон наряду с эстрогенами стимулирует рост миомы матки [54], но оба этих гормона, принимая участие в патогенезе миом, используют разные пути [59]. Доказано, что 4-гидроксилирование эстрадиола в ткани ММ повышено по отношению к окружающему миометрию в пять раз. Уровни активности ароматазы и продуктов транскрипции цитохрома Р450-ароматаз в 2 — 20 раз выше в культуре клеток миомы, чем в нормальной ткани. Это указывает на усиление локального биосинтеза эстрогенов, стимулирующих рост миомы [33]. Высокое содержание рецепторов эстрогенов и прогестерона в миоме реализуется в локальном повышении концентрации эстрадиола, прогестерона и стимулировании роста миомы. При этом прогестерон и эстрогены оказывают синергическое действие [59].
Таким образом, нарушения обмена половых стероидов в миоматозных узлах формируются по принципу положительной обратной связи, основанной на аутокринной стимуляции клеток. Развитие этого патофизиологического механизма обусловлено активным участием так называемых факторов роста, что приводит к росту миоматозных узлов, нарушению васкуляризации и кровотечениям [33, 40, 56, 59].
Основную роль в развитии осложнений предположительно играют фактор роста фибробластов, сосудистый эндотелиальный фактор роста, трансформирующий β-фактор роста, паратиреоидный гормоноподобный протеин и пролактин [17].
Решающим фактором, индуцирующим развитие ММ, является локальная гиперэстрадиолемия, не сбалансированная локальной гиперпрогестеронемией. ММ в условиях естественной ановуляции становится фактором риска ускоренного развития гиперпластических процессов миометрия и эндометрия [6, 23, 29, 30].
Источником синтеза основных липидов желчи, в частности желчных кислот и неизмененного холестерина желчи, является холестерин различных классов липопротеидов, причем холестерин липопротеидов высокой плотности в основном превращается в желчные кислоты, а холестерин липопротеидов низкой плотности экскретируется в желчь в неизмененном виде [17, 36, 46]. Ключевым моментом синтеза желчных кислот считается 7-альфа-гидроксилаза. Существенная роль в регуляции активности данного фермента отводится половым гормонам, кроме того, активность 7-альфа-редуктазы зависит от количества свободного неэстерифицированного холестерина [21, 35, 46].
Метаболические и катаболические реакции, происходящие в печени, уравновешивают различные секреторные процессы, в частности, здесь активируются и взаимопревращаются гормоны [22, 44]. Изменение превращений гормонов влияет на количество активных форм в крови и тканях. Усиление метаболических реакций ведет как к смещению равновесия между свободной и связанной формами гормонов в сторону увеличения концентрации свободной их фракции, так и к подавлению синтеза специфических транспортных белков и автоматическому повышению содержания свободной активной формы гормонов [19].
Катаболизм гормонов — это совокупность разнообразных процессов ферментной деградации исходной структуры секретируемого гормона [25]. Печень является главным продуцентом гормоносвязывающих белков. Более 90% холестерина, используемого при синтезе стероидных гормонов, образуется в печени. Метаболиты стероидных гормонов плохо растворяются в воде и перед экскрецией превращаются в печени в парные соединения (конъюгаты) эфира с серной, глюкуроновой и другими кислотами [21, 47].
Гормональный импринтинг метаболизма стероидов осуществляется на транскрипционном или трансляционном уровнях. Он сводится к организации определения соотношения молекулярных форм микросомального цитохрома Р-450. Нарушение стероидного обмена связано с усилением активности одних и уменьшением других ферментных систем [37, 48].
Взаимосвязь между репродуктивной и гепатобилиарной системами известна давно [2,3,4,5]. С одной стороны, у пациентов с ММ часто выявляются заболевания печени и желчевыводящих путей, способствующие развитию нарушений метаболизма эстрогенов [39, 45], с другой — избыток в крови некоторых половых стероидов неблагоприятно влияет на различные функции печени [44, 55]. M. Maneshi и A. Martorani (1974) описали печеночно-яичниковый синдром, в определенной степени определяющий эту взаимосвязь [49].
Тесные функциональные взаимосвязи печени и женских половых гормонов, часто встречающееся сочетание их поражений и связанная с ним необходимость применения гормональной терапии, влияющей на деятельность печени, объясняют повышенный интерес к изучению функционального состояния печени у больных с миомой матки.
У больных с ММ и нормальным содержанием эстрогенов в крови связей между экскрецией эстрогенов и изменением содержания белковых фракций в плазме крови не отмечено. При повышении содержания эстрогенов в крови больных с ММ наблюдалась прямая корреляционная связь между содержанием прямого билирубина и концентрацией эстрадиола [7, 9, 10, 11, 12].
У большинства больных с ММ нарушения функций печени происходят в отсутствии клинических признаков заболевания гепатобилиарной системы [20].
Таким образом, установлено, что развитие ММ сочетается с функциональными поражениями печени, и не исключается, что рост миомы происходит на их фоне.
Нельзя исключить, что обнаруженные функциональные изменения печени у больных с ММ связаны с нарушением обмена стероидных гормонов. Установлено, что концентрация плазменных липидов увеличивается параллельно повышению уровня эндогенных половых гормонов, в частности эстрогенов, и это в определенной степени доказывает гормональную обусловленность гиперлипидемии при ММ [34, 44, 50]. Под влиянием эстрогенов происходят торможение синтеза холестерина в печени и уменьшение содержания холестерина в надпочечниках, увеличение содержания фосфолипидов [1, 13, 51, 52].
Известно, что транспорт липидов в печень плазмы крови осуществляется рецепторами мембран гепатоцитов и синусоидальных клеток печени. Эстрогены активируют рецепторы гепатоцитов для ХС ЛПНП, в результате чего увеличивается их захват [8, 10, 26, 31, 46]. Следствием этого процесса является увеличение содержания холестерина в печени и пузырной желчи, но не за счет усиления его синтеза, а за счет повышения уровня эстрогенов, приводящего к снижению синтеза желчных кислот в печени в результате ингибирующего влияния эстрогенов на активность 7-альфа-гидроксилазы холестерина [37, 43].
Повышенное содержание половых гормонов (эстрогенов) обусловливает изменение соотношения холестерина и желчных кислот в желчи. Это приводит к увеличению содержания свободного холестерина, выделяемого с желчью, и образованию насыщенной и перенасыщенной холестерином желчи. Наиболее выраженные нарушения липидного обмена отмечались у больных со значительными размерами опухоли при ее быстром росте. У них имелась отчетливая тенденция к нарастанию концентрации в крови общих липидов, липопротеидов, свободного холестерина, отмечено значительное снижение фосфолипидов и эфиров холестерина [2, 3, 4, 18].
При длительном существовании ММ и ее медленном росте показатели содержания общих липидов, липопротеидов и холестерина в сыворотке крови незначительно отличаются от нормальных значений, тогда как качественные нарушения липидного обмена сохранили описанные выше закономерности и укладываются в рамки дислипопротеидемии [2, 4]. Кроме того, значительный дефицит фосфолипидов, особенно при длительно существующих опухолях, является доказанным фактом [2, 3, 18].
Таким образом, имеющиеся в литературе данные о функциональном состоянии печени у больных с ММ противоречивы, так как были получены при анализе небольшого и неоднородного количества клинических наблюдений, кроме того, часто ограничены характеристикой одной из функций печени. Практически не освещен вопрос комплексной диагностики нарушений функционального состояния печени (особенно на ранних стадиях ее поражения) с применением современных радиоизотопных методов исследования, включая исследования ее ретикулоэндотелиальной системы. Тактика лечения больных с ММ не учитывает нарушения функций печени.
Нельзя упускать из вида следующее обстоятельство: основная задача при лечении ММ, особенно гормональном, направлена на избавление пациенток от миомы. В то же время любой из используемых сегодня препаратов оказывает в той или иной степени негативное влияние, а хирургическое лечение не оказывает положительного воздействия на нарушенные функции печени.
Современные методы диагностики позволяют по-новому взглянуть на проблему лечения миомы матки с учетом патогенеза морфологических и функциональных изменений печени у больных с ММ, что, безусловно, положительно скажется на ее результатах.
Независимо от вида терапии (консервативное или хирургическое) нарушения функции печени при ММ следует рассматривать с позиций липидного дистресс-синдрома Савельева [28]. В этой связи наиболее перспективным направлением лечения метаболических нарушений функции печени можно считать длительную липидокоррегирующую терапию вазелин-пектиновой эмульсией ФИШант С (Россия, ПентаМед) с обязательным применением комбинированных растительных гепатотропных препаратов (гепабене, ратиофарм) и восстановлением микробиоценоза толстой кишки пробиотиками (хилак форте, ратиофарм) [28].
По вопросам литературы обращайтесь в редакцию
З. Р. Кантемирова, кандидат медицинских наук
А. М. Торчинов, доктор медицинских наук, профессор
Т. А. Жигулина
В. В. Кадохова
Е. А. Алексеева, кандидат медицинских наук
Е. А. Девятых
В. А. Петухов, доктор медицинских наук, профессор
МГМСУ, РГМУ, 1-я Градская больница, Москва
Печень, hepar, представляет собой объемистый железистый орган (масса около 1500 г). Функции печени многообразны. Она является прежде всего крупной пищеварительной железой, вырабатывающей желчь, которая по выводному протоку поступает в двенадцатиперстную кишку. (Такая связь железы с кишкой объясняется развитием ее из эпителия передней кишки, из которой развивается часть duodenum.)
Печени приписывают также гормональные функции. В эмбриональном периоде ей свойственна функция кроветворения, так как она вырабатывает эритроциты. Таким образом, печень является одновременно органом пищеварения, кровообращения и обмена веществ всех видов, включая гормональный.
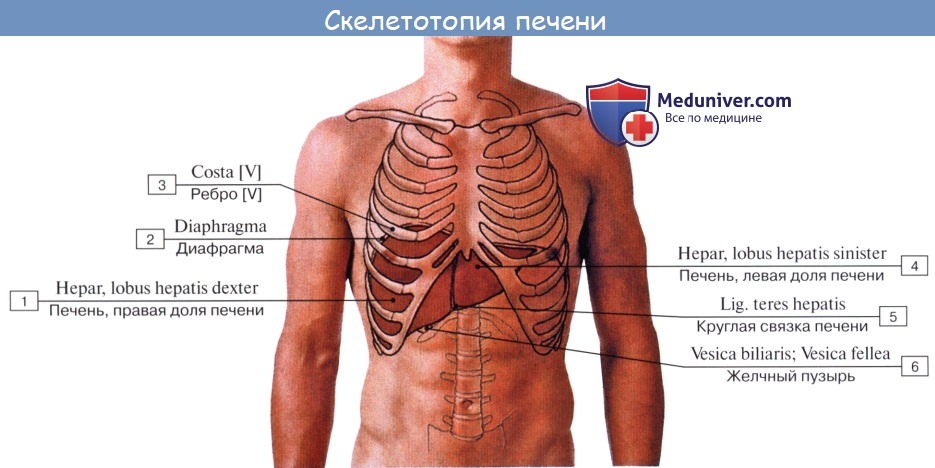
Расположена печень непосредственно под диафрагмой, в верхней части брюшной полости справа, так что лишь сравнительно небольшая часть органа заходит у взрослого влево от средней линии; у новорожденного она занимает большую часть брюшной полости, равняясь 1/20 массы всего тела, тогда как у взрослого то же отношение понижается приблизительно до 750- На печени различают две поверхности и два края.
Верхняя, или, точнее, передневерхняя, поверхность, facies diaphragmatica, выпукла соответственно вогнутости диафрагмы, к которой она прилежит; нижняя поверхность, facies visceralis, обращена вниз и назад и несет на себе ряд вдавлений от брюшных внутренностей, к которым она прилежит. Верхняя и нижняя поверхности отделяются друг от друга острым нижним краем, margo inferior. Другой край печени, верхнезадний, напротив, настолько тупой, что его можно рассматривать как заднюю поверхность печени.
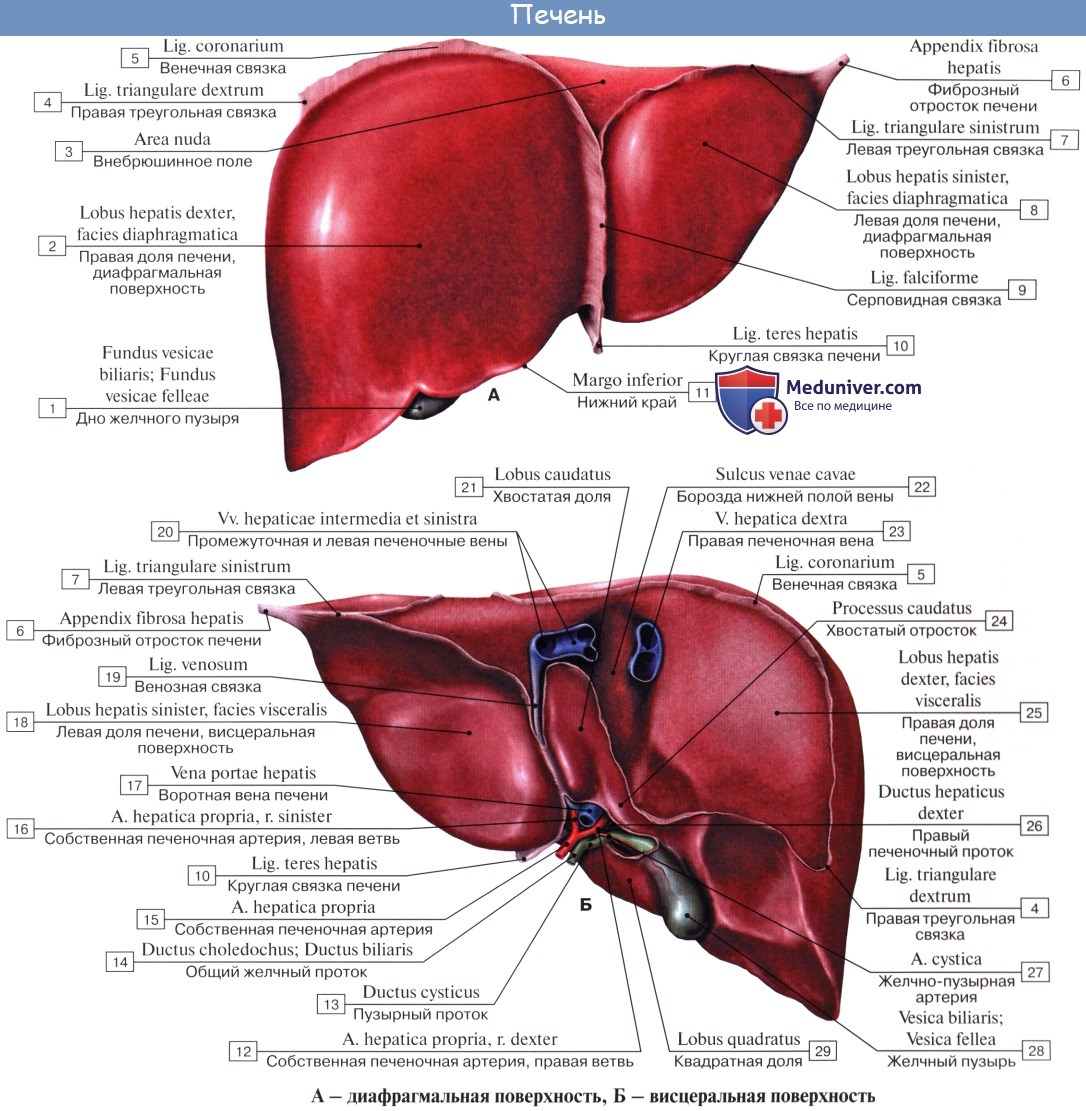
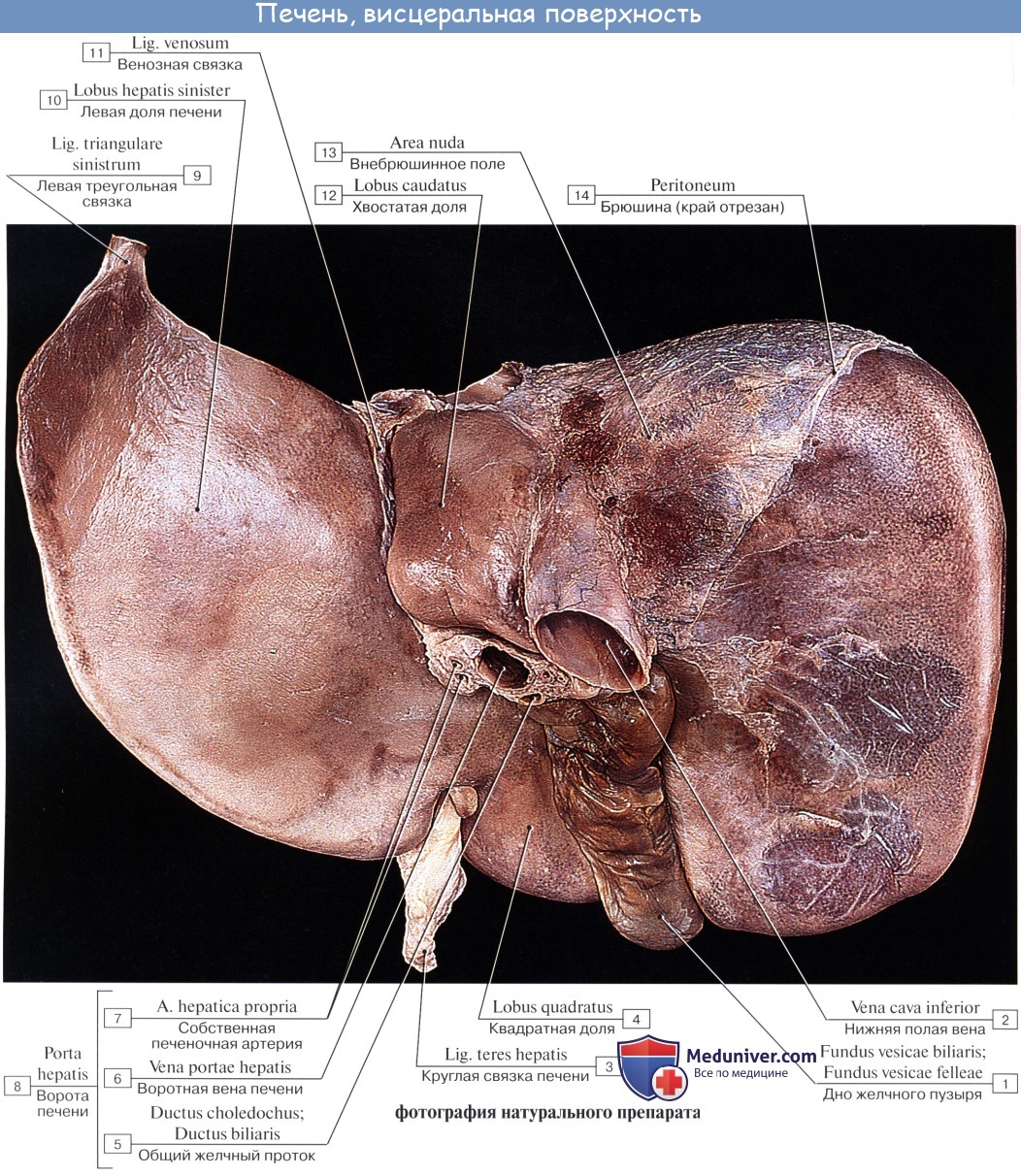
В печени различают две доли: правую, lobus hepatis dexter, и меньшую левую, lobus hepatis sinister, которые на диафрагмальной поверхности отделены друг от друга серповидной связкой печени, lig. falcifdrme hepatis. В свободном крае этой связки заложен плотный фиброзный тяж — круглая связка печени, lig. teres hepatis, которая тянется от пупка, umbilicus, и представляет собой заросшую пупочную вену, v. umbilicalis.
Круглая связка перегибается через нижний край печени, образуя вырезку, incisura ligamenti teretis, и ложится на висцеральной поверхности печени в левую продольную борозду, которая на этой поверхности является границей между правой и левой долями печени. Круглая связка занимает передний отдел этой борозды — fissura ligamenti teretis; задний отдел борозды содержит продолжение круглой связки в виде тонкого фиброзного тяжа — заросшего венозного протока, ductus venosus, функционировавшего в зародышевом периоде жизни; этот отдел борозды называется fissura ligamenti venosi (рис. 141).
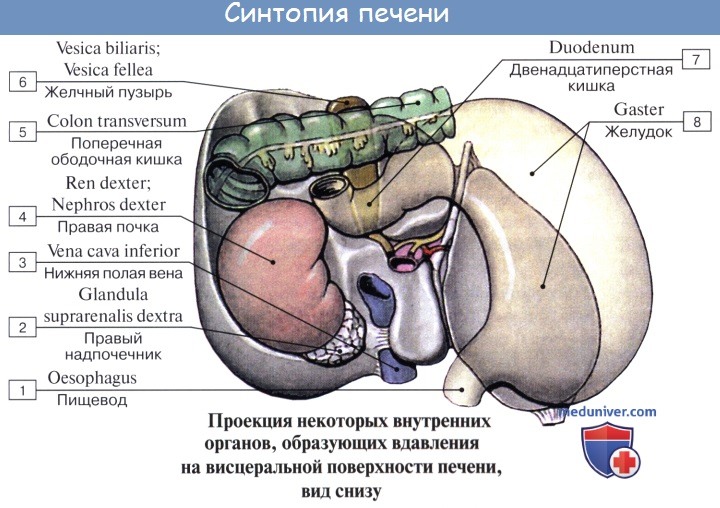
Правая доля печени на висцеральной поверхности подразделяется на вторичные доли двумя бороздами, или углублениями.
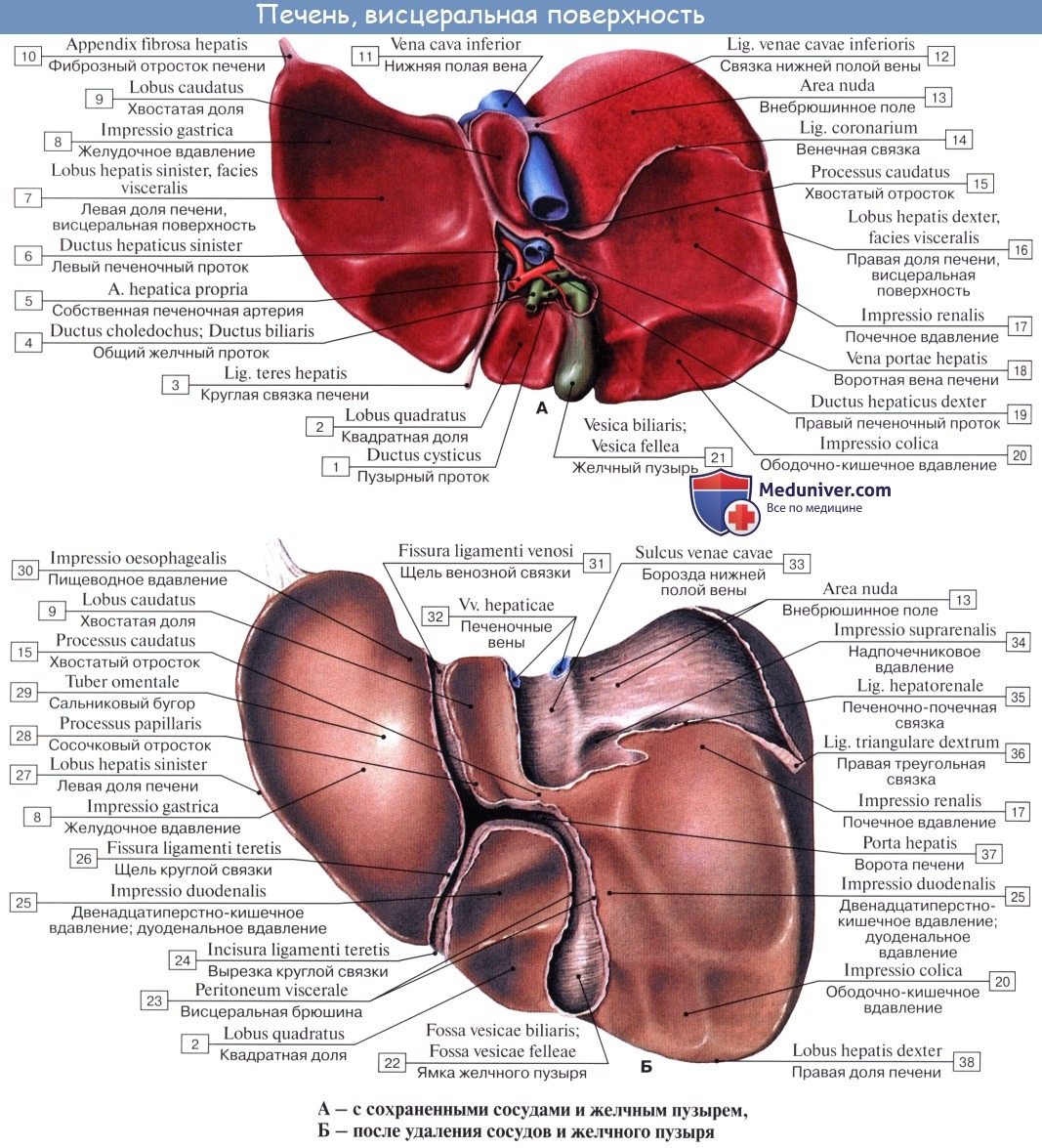
Одна из них идет параллельно левой продольной борозде и в переднем отделе, где располагается желчный пузырь, vesica fellea, носит название fossa vesicae felleae; задний отдел борозды, более глубокий, содержит в себе нижнюю полую вену, v. cava inferior, и носит название sulcus venae cavae. Fossa vesicae felleae и sulcus venae cavae отделены друг от друга сравнительно узким перешейком из печеночной ткани, носящим название хвостатого отростка, processus caudatus.
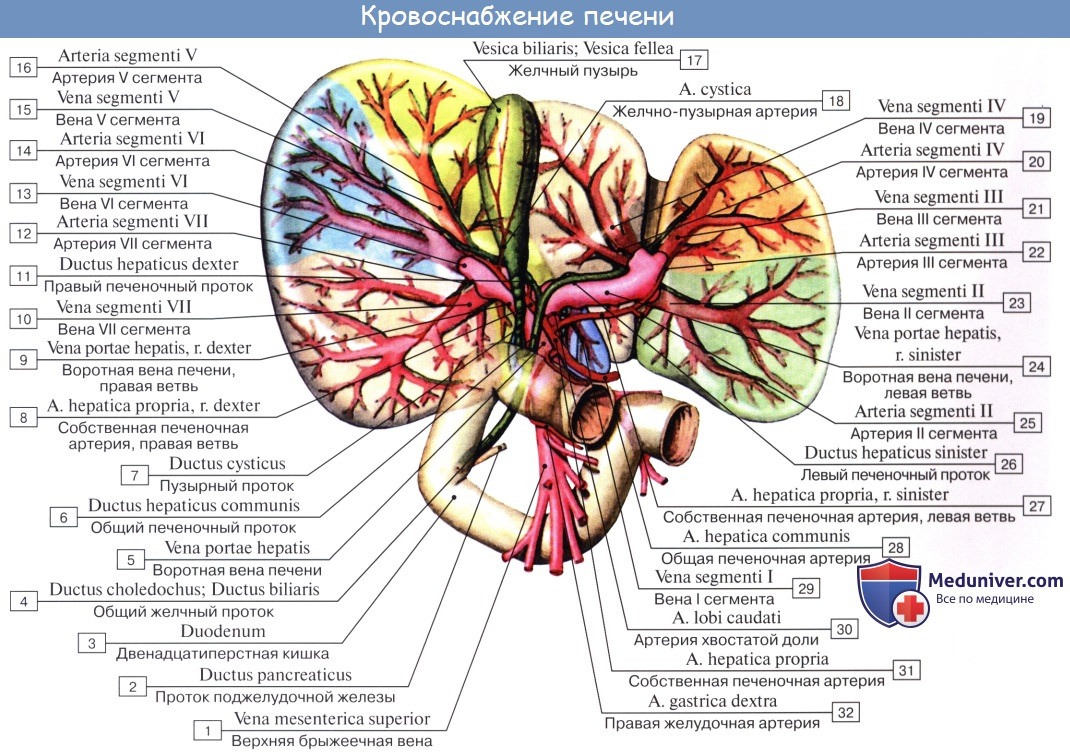
Глубокая поперечная борозда, соединяющая задние концы fissurae ligamenti teretis и fossae vesicae felleae, носит название ворот печени, porta hepatis. Через них входят a. hepatica и v. portae с сопровождающими их нервами и выходят лимфатические сосуды и ductus hepaticus communis, выносящий из печени желчь. Часть правой доли печени, ограниченная сзади воротами печени, с боков — ямкой желчного пузыря справа и щелью круглой связки слева, носит название квадратной доли, lobus quadratus. Участок кзади от ворот печени между fissura ligamenti venosi слева и sulcus venae cavae справа составляет хвостатую долю, lobus caudatus.
Соприкасающиеся с поверхностями печени органы образуют на ней вдавления, impressiones, носящие название соприкасающегося органа. Печень на большей части своего протяжения покрыта брюшиной, за исключением части ее задней поверхности, где печень непосредственно прилежит к диафрагме.
Учебное видео по анатомии печени
Редактор: Искандер Милевски. Дата последнего обновления публикации: 31.8.2020
Итак, что мы знаем о печени ?
Печень - один из самых крупных органов человека. Ее масса в среднем составляет около 1,5 кг (1300-1800 граммов). У человека печень находится преимущественно в правом подреберье под куполом диафрагмы, захватывая эпигастральную область. В норме нижний край печени определяется или по краю реберной дуги или чуть ниже (~ на 1 см), При значительном увеличении печени ее нижний край может определяться на уровне пупка. Анатомически традиционно в печени выделяют две основных доли – левую и правую. В правой доле дополнительно выделяют еще две небольшие доли - квадратную долю и хвостатую долю. Доли печени дополнительно делятся на сегменты (c I по VIII). Сразу под печенью находится желчный пузырь.
Ткань печени мягко-эластической консистенции, с поверхности покрытая соединительнотканной капсулой. В ней очень мало болевых рецепторов, вот почему даже при значительном увеличении печени больной не ощущает боли, а лишь некоторое чувство тяжести. Это же определяет и бессимптомность подавляющего большинства хронических заболеваний печени. Печень удерживается в своем положении за счет связок брюшины и внутрибрюшного давления, которое создается напряжением мышц брюшной стенки.
Печень имеет и свои уникальные особенности кровоснабжения, которые обусловлены выполнением ею важной биологической функции – детоксикации: кровь от кишечника, содержащая токсичные вещества, образованные в результате переваривания пищи, или поступившие извне (лекарственные препараты, токсины и прочее), поступает по воротной вене для обезвреживания и метаболизма, а печеночная артерия доставляет кровь для обеспечения ее жизнедеятельности. Так, в 1 минуту через печень проходит 1,5 литра крови, а за сутки этот объем достигает 2000 литров. Нормальное функционирование обеих систем кровоснабжения позволяет печени полноценно защищать организм от любых токсических веществ.
Функции печени.
Печень является основным органом человека, который обеспечивает гомеостаз - динамическое постоянство состава и свойств внутренней среды для сохранения физиологических функций организма человека. То есть, с печенью напрямую связана наша способность жить и существовать. Печень выполняет около 500 различных функций, нарушение которых сказывается на функционировании практически каждого органа в нашем организме.
К основным функциям печени относятся:
- метаболическая – печень регулирует обмен белков, аминокислот, липидов, углеводов, биологически активных веществ (гормонов, витаминов А, В, С, D, E, К, РР и фолиевой кислоты, лекарственных препаратов), микроэлементов;
- синтетическая – печень участвует в синтезе многих белков плазмы крови (альбумина, альфа- и бета-глобулинов, транспортных белков для различных гормонов и витаминов, белков свертывающей и противосвертывающей систем крови), синтезирует холестерин и другие липопротеиды, участвует в синтезе гормонов (например, инсулиноподобных факторов роста);
- детоксикационная - печень нейтрализует ядовитые продукты протеинового обмена, поступающие с кровью, обеззараживает различные чужеродные вещества, превращая их в безвредные, менее токсичные и легко выводимые из организма;
- депонирующая - в печени происходит накопление углеводов (она получила название депо гликогена), белков, жиров, гормонов, витаминов (особенно велики в печени запасы жирорастворимых витаминов А, D, водорастворимого витамина B12), минеральных веществ (катионов железа, меди и кобальта); печень служит депо для довольно значительного объёма крови (10% от общего количества крови в организме), который может быть выброшен в общее сосудистое русло при кровопотере или шоке;
- секреторная – печень вырабатывает желчь, которая по желчным протокам поступает в двенадцатиперстную кишку; желчные кислоты, содержащиеся в желчи участвуют в эмульгировании жиров и способствуют их всасыванию в кишечнике;
- выделительная – через печень происходит удаление из организма избытков гормонов, медиаторов, витаминов, а также токсичных промежуточных и конечных продуктов обмена веществ - аммиака, фенола, этанола, ацетона, индола и других.
Автор: врач-инфекционист, гепатолог, врач высшей категории, к.м.н. Наталья Васильевна Воронкова
Медицинский редактор: руководитель Университетской клиники, к.м.н., врач-инфекционист Коннов Данила Сергеевич.
Эндокринная система человека состоит из органов, называемых железами внутренней секреции, которые регулируют работу всего организма посредством выделения в кровеносную систему биологически активных веществ – гормонов. Эти вещества выполняют архиважные функции в организме: способствуют поддержанию гомеостаза, контролируют рост и развитие, участвуют в обменных процессах, отвечают за реакцию на изменения условий среды, регулируют репродуктивную систему.
К железам внутренней секреции относятся:

Щитовидная железа. Вырабатывает гормоны - тироксин (Т4), трийодтиронин (Т3), кальцитонин. Эти гормоны участвуют в обмене веществ, повышая его интенсивность, регулируют процессы роста в организме, повышают уровень потребления жизненно важного кислорода органами и тканями.
Паращитовидные железы. Вырабатывают паратиреоидный гормон, регулирующий уровень кальция в организме, который необходим для нормального функционирования двигательного аппарата и нервной системы.
Надпочечники. Вырабатывают так называемый гормон стресса - адреналин, участвующий в ответной реакции организма на внешние стрессовые ситуации. При выбросе большого количества адреналина в кровь учащается дыхание, увеличивается сердечный ритм, сужаются сосуды, расширяются зрачки.
Поджелудочная железа. Является главным источником ферментов для переваривания жиров, белков и углеводов. Вырабатывает гормоны инсулин, понижающий уровень глюкозы в крови, и глюкагон – наоборот, повышающий.
Половые железы. У женщин – яичники, у мужчин - семенники. Гормоны, вырабатываемые этими железами, отвечают за репродуктивную функцию.
Гипофиз и гипоталамус. Образовывают гипоталамо-гипофизарную систему. Гипофиз вырабатывает гормоны, контролирующие работу почти всей эндокринной системы. Среди них особо важен гормон роста – соматотропин, оказывающиЙ влияние на рост костей, хрящей и мышц.
Эпифиз (шишковидное тело, или пинеальная железа). Орган выполняет важные функции: замедляет гормоны роста, тормозит развитие опухолей, оказывает влияние на половое развитие. Продуцирует антидиуретический гормон (АДГ), контролирующий водный баланс организма, окситоцин, отвечающий за сокращение мышц, и мелатонин – гормон, контролирующий очередность фаз сна.
Исходя из всего вышесказанного, можно следить вывод, что значимость эндокринной системы невозможно переоценить - ее деятельность распространяется на все органы организма и все процессы, происходящие в нем. Поэтому, все отклонения от нормы в работе этой системы нуждаются в немедленном медицинском вмешательстве.
Симптомы гормонального сбоя
Симптомов неправильной работы эндокринных желез великое множество, среди них можно выделить:
- Нерегулярная менструация у женщин или ее отсутствие;
- Невынашивание беременности или бесплодие;
- Потеря сексуального влечения;
- Увеличение массы тела;
- Высыпания на теле, угревая сыпь;
- Ухудшение состояния волос и ногтей;
- Нарушения сна, вялость, повышенная утомляемость;
- Эмоциональная нестабильность: плаксивость, вспыльчивость, нервозность;
- Развитие остеопороза - болезнь, приводящая к хрупкости костей.
Стоит отметить, что ни один из вышеперечисленных симптомов не является прямым подтверждением наличия сбоя гормонального фона, а только возможным следствием. Для постановки точного диагноза необходимо пройти полное обследования у врача – эндокринолога, которое включает в себя метод функциональной диагностики (УЗИ, МРТ), а также лабораторные исследования крови, речь о которых пойдет ниже.
Как сдают кровь на гормоны?

Исследование крови на гормоны является наиболее показательным и информативным методом обнаружения каких- либо патологий в работе эндокринных желез. Однако важно учесть, что на гормональный фон влияют многие факторы: время суток, менструальный цикл у женщин, прием лекарств. По этой причине к подготовке сдачи анализов на гормональное исследование нужно относиться со всей серьезностью. Если этим пренебречь, то результат анализа может быть неверным и, в лучшем случае, его придется пересдать, а в худшем – на его основании может быть поставлен неправильный диагноз и назначено неправильное лечение, что может привести к непоправимым последствиям.
Для подготовки сдачи крови на гормоны необходимо соблюсти следующие общие правила:
- Накануне сдачи следует отказаться от физических нагрузок, постараться избегать стрессовых ситуаций, прекратить любые физиотерапевтические процедуры, исключить прием оральных контрацептивов, употребление алкоголя, жирной пищи и продуктов, содержащих йод. Также рекомендуется перенести ЭКГ, УЗИ, ренгенографичекое исследование на время после сдачи анализа.
- Важным моментом является прием лекарственных препаратов – необходимо уведомить врача, назначившего гормональное исследование крови, о факте приема медикаментов. Он примет решение об отмене или дальнейшем приеме лекарств на время сдачи анализа.
- Анализ на гормональное исследование сдается строго натощак. Поэтому рекомендуется отказаться от приема пищи за 12 часов до забора крови.
- Утром, перед проведением анализа запрещается жевать жвачку, пить чай и курить.
- Непосредственно перед сдачей крови следует отдохнуть 15-10 минут.
- Женщинам необходимо учесть свой менструальный цикл, т.к. исследовать кровь на некоторые гормоны возможно лишь в отдельные периоды этого цикла.
- Для прослеживания динамики показателей уровня тех или иных гормонов требуется провести повторный анализ. Он сдается приблизительно в тоже время, что и предыдущий, с соблюдением всех вышеперечисленных правил.
Забор крови для проведения анализа проводится в первой половине дня в утренние часы. Биоматериал берется из локтевой вены.
Расшифровка анализов
Гормоны щитовидной железы
Трийодтиронин, или Т3 – дает общую оценку работе щитовидной железы. Данный гормон определяют как в свободной форме (норма: от 2,6 до 5,7 пмоль/л.), так и в сывороточном состоянии, (обшей форме; норма: от 1,3 до 2,7 нмоль/л). Повышение показателя свидетельствует о приеме наркотических веществ: метадона, героина, амфетамина, ВИЧ-инфекции, почечной недостаточности, гипертиреозе. Понижение установлено при применении андрогенов, даназола, дексаметазона, пропранолола.
Тироксин, или Т4 – регулирует энергетический обмен в организме. Норма: 10,8 - 22,0 пмоль/л. Низкий уровень наблюдается при гипертиреозе, гемолизе. Повышенный уровень – при приеме оральных контрацептивов, методона, героина, экстрогенов.
Читайте также:

