Газовые законы в химии кратко
Обновлено: 02.07.2024
I. Состояние идеального газа определённой массы характеризуется тремя параметрами:
P, V, T. Между этими величинами были экспериментально установлены следующие соотношения:
1. при постоянной температуре: P 1 V 1 = P 2 V 2 (з. Бойля-Мариотта)
2. при постоянном давлении: V 1 /T 1 = V 2 /T 2 (з. Гей-Люссака)
3. при постоянном объёме: P 1 /T 1 = P 2 /T 2 (з. Шарля)
Эти три закона можно объединить в один универсальный газовый закон ( уравнение состояния идеального газа ):
, или PV/T = const (Клайперон, 1834 г)
Значение постоянной (const) в уравнении зависит только от количества вещества газа.
Для одного моль газа постоянная называется универсальной газовой постоянной (R):
PV = RT
, здесь R = 8,314 Дж/(моль∙К) = 0,0821 л∙атм./(моль∙К) = 62400 мм. рт. ст. ∙ мл/(моль∙К).
Для произвольного количества газа ν уравнение имеет вид:
PV = νRT, или PV = (m/M)RT (уравнение Клайперона-Менделеева)
II. Нормальными условиями (н.у.) для газов считаются:
P 0 = 1 атм. = 101325 Па = 760 мм. рт. ст.
T 0 = 273,15 К = 0°С
Найдём объём 1 моль газа (н.у.):
V m = RT 0 /P 0 = (8,314 ∙ 273,15) / 101,325 = 22,4 13 л/моль (молярный объём газа)
Задачи для самостоятельного решения:
№1. Определите объём, занимаемый 8 г кислорода при 28 °С и давлении 744 мм. рт. ст.
№2. При температуре 39 °С и давлении 741 мм. рт. ст. 1,73 г газа занимают объём, равный 640 мл. Определите молярную массу газа?
№3. При какой температуре давление азота в закрытом сосуде утроится по сравнению с нормальными условиями?
№4. При сгорании 2,3 г органического вещества образовалось 4,4 г углекислого газа и
2,7 г воды. 2,3 г паров сгоревшего вещества при температуре 40 °С и давлении 1,5 атм. занимают объём 0,855 л. Определите молекулярную формулу вещества.
№5. При температуре 35°С объём газа равен 200 мл. Вычислите, до какой температуры (°С) надо нагреть газ при постоянном давлении, чтобы объём его увеличился до 250 мл.
№6. Некоторое количество газа при давлении 2,5 атм. занимает объём 14 л. Вычислите, какому давлению надо подвергнуть этот газ при постоянной температуре, чтобы его объём уменьшился до 10 л.
№7. В закрытом сосуде при 0°С находится газ объёмом 50 л. На сколько градусов надо нагреть газ, чтобы давление его увеличилось в 3 раза?
№8. Вычислите, какой объём займёт при температуре 22 °С и давлении 735 мм. рт. ст. кислород, полученный при разложении 1,7 кг пероксида водорода.
№9. Вычислите объём кислорода (н.у.), который необходим для сжигания 53 л водорода, измеренного при 25°С и давлении 2 атм.
Атомно–молекулярная теория. Создал атомно-молекулярное учение и открыл закон сохранения массы веществ М.В. Ломоносов. Он четко различал две ступени в строении вещества: элементы (в нашем понимании – атомы) и корпускулы (молекулы). Согласно Ломоносову, молекулы простых веществ состоят из одинаковых атомов, а молекулы сложных веществ – из разных атомов. Всеобщее признание атомно-молекулярная теория получила в начале XIX в. после утверждения в химии атомистики Дальтона. С тех пор главным объектом исследования химии стали молекулы. Химией молекул продолжает оставаться современная органическая химия, а большинство неорганических веществ не имеют молекулярной структуры. В последнем случае макротела состоят либо из атомов одного и того же химического элемента, либо из атомов разных элементов.
Закон сохранения массы и энергии. В 1760 г. Ломоносов сформулировал единый закон сохранения массы и энергии:
Закон сохранения массы. Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Закон сохранения энергии. Энергия не исчезает и не возникает из ничего, а только превращается из одного вида в другой в строго эквивалентных соотношениях.
До начала ХХ в. эти законы обычно рассматривались независимо друг от друга. Химия в основном имела дело с законом сохранения массы вещества, а физика – с законом сохранения энергии. В 1905 г. основоположник современной физики А.Эйнштейн показал, что между массой и энергией существует взаимосвязь, выражаемая уравнением
Е = mc 2 , где Е – энергия ; m – масса; с – скорость света в вакууме.
Газовые законы химии.
При определении атомной массы элемента Дальтон исходил из понятия атомной массы и результатов химического анализа. Однако для установления правильных атомных масс элементов оказались недостаточными указанные исходные позиции Дальтона. Необходимо было атомистику Дальтона дополнить ясными представлениями о молекулах. На этом пути важную роль сыграли газовые законы и особенно закон объемных отношений Гей-Люссака и закон Авогадро. Экспериментальные исследования по изучению химических реакций между газообразными веществами привели Гей-Люссака к открытию
Закона объемных отношений (1808): Объемы реагирующих газов относятся друг к другу и к объемам образующихся газов как небольшие целые числа.
Так, при образовании хлорида водорода из простых веществ объемы реагирующих и получающихся газов относятся друг к другу как 1:1:2. А при синтезе воды из простых веществ это отношение равно 2:1:2. Эти пропорции небольших и целых чисел нельзя объяснить, исходя из атомистики Дальтона.
Закон Авогадро (1811 г).В равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
Впоследствии это число было названо числом (константой) Авогадро, Na = 6,022·10 23 моль -1 .
Следствия из закона Авогадро:
1 моль любого вещества содержит 6,0221·10 23 число молекул.
1 моль любого газа при одинаковых условиях занимает один и постоянный объем. Это объем при нормальных условиях (н. у.), т.е. Т=273 К и р=101,3 кПа равен 22,4 л/моль (дм 3 /моль). Данный объем называется молярным.
где m – масса газа; М – молекулярная масса ; R – молярная газовая постоянная; Р – давление ; Т – абсолютная температура; V – объем газа, а m/M = n – число молей.
Молярный объем – это отношение объема вещества к количеству моль этого вещества.= 22,4 дм 3 /моль
Объединенный закон газового состояния (уравнение Клапейрона-Менделеева)выражается уравнением состояния идеального газа:PV=(m/M)RT
где R – универсальная газовая постоянная, зависит от единиц, в которых измеряется давление и объем. R = 62400 мм.рт.ст.·см 3 /К·моль = 0,082 атм.·л/К·моль = 8,314 Дж/К·моль.
Закон парциальных давлений –общее давление смеси газов, не вступающих друг с другом в химическое взаимодействие, равно сумме парциальных давлений ее составных частей.
Парциальное давление газа в газовой смеси – это давление, которое производил бы газ, занимая объем всей газовой смеси.
Например,в газовой смеси содержится 20% О2 и 80% N2, общее давление равно 1,013·10 5 Па, парциальное давление кислорода и азота равны

1,013·10 5 ·0,2 = 2,026·10 4 Па и 1,013·10 5 ·0,8 = 8,104·10 4 Па соответственно.
Фундаментальные законы химии.
Атомно–молекулярная теория. Создал атомно-молекулярное учение и открыл закон сохранения массы веществ М.В. Ломоносов. Он четко различал две ступени в строении вещества: элементы (в нашем понимании – атомы) и корпускулы (молекулы). Согласно Ломоносову, молекулы простых веществ состоят из одинаковых атомов, а молекулы сложных веществ – из разных атомов. Всеобщее признание атомно-молекулярная теория получила в начале XIX в. после утверждения в химии атомистики Дальтона. С тех пор главным объектом исследования химии стали молекулы. Химией молекул продолжает оставаться современная органическая химия, а большинство неорганических веществ не имеют молекулярной структуры. В последнем случае макротела состоят либо из атомов одного и того же химического элемента, либо из атомов разных элементов.
Закон сохранения массы и энергии. В 1760 г. Ломоносов сформулировал единый закон сохранения массы и энергии:
Закон сохранения массы. Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Закон сохранения энергии. Энергия не исчезает и не возникает из ничего, а только превращается из одного вида в другой в строго эквивалентных соотношениях.
До начала ХХ в. эти законы обычно рассматривались независимо друг от друга. Химия в основном имела дело с законом сохранения массы вещества, а физика – с законом сохранения энергии. В 1905 г. основоположник современной физики А.Эйнштейн показал, что между массой и энергией существует взаимосвязь, выражаемая уравнением
Е = mc 2 , где Е – энергия ; m – масса; с – скорость света в вакууме.
Газовые законы химии.
При определении атомной массы элемента Дальтон исходил из понятия атомной массы и результатов химического анализа. Однако для установления правильных атомных масс элементов оказались недостаточными указанные исходные позиции Дальтона. Необходимо было атомистику Дальтона дополнить ясными представлениями о молекулах. На этом пути важную роль сыграли газовые законы и особенно закон объемных отношений Гей-Люссака и закон Авогадро. Экспериментальные исследования по изучению химических реакций между газообразными веществами привели Гей-Люссака к открытию
Закона объемных отношений (1808): Объемы реагирующих газов относятся друг к другу и к объемам образующихся газов как небольшие целые числа.
Так, при образовании хлорида водорода из простых веществ объемы реагирующих и получающихся газов относятся друг к другу как 1:1:2. А при синтезе воды из простых веществ это отношение равно 2:1:2. Эти пропорции небольших и целых чисел нельзя объяснить, исходя из атомистики Дальтона.
Закон Авогадро (1811 г).В равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
Впоследствии это число было названо числом (константой) Авогадро, Na = 6,022·10 23 моль -1 .
Следствия из закона Авогадро:
1 моль любого вещества содержит 6,0221·10 23 число молекул.
1 моль любого газа при одинаковых условиях занимает один и постоянный объем. Это объем при нормальных условиях (н. у.), т.е. Т=273 К и р=101,3 кПа равен 22,4 л/моль (дм 3 /моль). Данный объем называется молярным.
где m – масса газа; М – молекулярная масса ; R – молярная газовая постоянная; Р – давление ; Т – абсолютная температура; V – объем газа, а m/M = n – число молей.
Молярный объем – это отношение объема вещества к количеству моль этого вещества.= 22,4 дм 3 /моль
Объединенный закон газового состояния (уравнение Клапейрона-Менделеева)выражается уравнением состояния идеального газа:PV=(m/M)RT
где R – универсальная газовая постоянная, зависит от единиц, в которых измеряется давление и объем. R = 62400 мм.рт.ст.·см 3 /К·моль = 0,082 атм.·л/К·моль = 8,314 Дж/К·моль.
Закон парциальных давлений –общее давление смеси газов, не вступающих друг с другом в химическое взаимодействие, равно сумме парциальных давлений ее составных частей.
Парциальное давление газа в газовой смеси – это давление, которое производил бы газ, занимая объем всей газовой смеси.
Например,в газовой смеси содержится 20% О2 и 80% N2, общее давление равно 1,013·10 5 Па, парциальное давление кислорода и азота равны
1,013·10 5 ·0,2 = 2,026·10 4 Па и 1,013·10 5 ·0,8 = 8,104·10 4 Па соответственно.
(М.В.Ломоносов, 1748г): масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Pb + O2 = PbO (в реторте)
- Закон постоянства состава
(Пруст, 1808г): всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
- С помощью значения относительной плотности были определены относительные молекулярные массы и уточнены составы молекул многих газообразных веществ. Молекулярная масса может быть вычислена также по
уравнению состояния идеального газа
, или
P - давление газа в замкнутой системе
V - объем системы (м 3 )
m - масса газа (кг)
М - молярная масса
Т - абсолютная температура t° в Кельвинах
R - универсальная газовая постоянная
P = 101,325 кПа
Используемые величины:
R = pV/T = 1.01•105•22.4•10-3/273[Па•м3/моль]/K =8.31(44) Дж/(моль•K)
при постоянной температуре t°, давление, производимое данной массой газа, обратно пропорционально объему газа:
.jpg)
, при t° = const.
при постоянном давлении объем газа изменяется прямо пропорционально абсолютной температуре:
.jpg)
, при P = const.
при постоянном объеме давление газа изменяется прямо пропорционально абсолютной температуре.
.jpg)
, при V = const.
- Объединенный закон Бойля - Мариотта, Гей - Люссака и Шарля:
.jpg)
, при V = const.
Закон кратных отношений
(открыт в 1803 Дж.Дальтоном).
Если два элемента образуют друг с другом несколько соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся как небольшие целые числа:
.jpg)
Разделив числа нижней строки на 0,57, видим, что они относятся как 1:2:3:4:5.
2) Хлористый кальций образует с водой 4 кристаллогидрата, состав которых выражается формулами: CaCl2•H22O, CaCl2•2H2O, CaCl2•4H2O, CaCl2•6H2O, т. е. во всех этих соединениях массы воды, приходящиеся на одну молекулу CaCl2, относятся как 1: 2: 4: 6.
(открыт в конце XVIII в.) - вещества взаимодействуют между собой в количествах, пропорциональных их химическим эквивалентам.
.jpg)
, при t° = const.
- это масса элемента (выраженная в углеродных единицах), которая присоединяет или замещает одну атомную массу водорода или половину атомной массы кислорода.
Химический эквивалент кислоты равен её молярной массе, деленной на основность (число ионов водорода) кислоты.
Химический эквивалент основания равен его молярной массе, деленной на кислотность (число гидроксильных групп) основания.
Химический эквивалент соли равен её молярной массе, деленной на сумму зарядов образующих её катионов или анионов.
(Гей-Люссак, 1808) - объемы вступающих в реакцию газов при одинаковых условиях относятся друг к другу, а также к объемам образующихся газообразных продуктов как небольшие целые числа.
(Авогадро, 1811г.) – в равных объемах различных газов при одинаковых условиях (t˚ и давлении) содержится одинаковое число молекул. Из закона вытекают 2 следствия:
1. 1 моль любого газа при одинаковых условиях занимает один и тот же объем – равный 22,4 л. (при температуре˚-0˚C и давление 1,01325•105 Па). В этом же объеме находится 6,023•1023 молекул газообразного вещества.
2. Массы равных объемов двух газов, взятых при одинаковом давлении и температуре, относятся друг к другу как их молярные массы:
, также плотности газов относятся как их относительные молекулярные массы: ,
Д – относительная плотность.
Для правильного написания химических формул надо знать валентность элементов или степень окисления. Валентностью называется способность атомов данного элемента присоединять или замещать определенное число других атомов. max вал. = 8.
Законов в химии большое множество. В этой статье собраны и объяснены наиболее важные, для того, чтобы вы понимали основы химии и могли успешно решать задачи.
Вы увидите множество примеров по ходу данной статьи, обратите внимание на то, что все реакции уравнены. Это необходимое условие для решения задач.
Закон сохранения массы веществ
Гласит о том, что масса веществ, вступающих в реакцию, равна массе веществ, образующихся в результате реакции. Бесспорно, данный закон служит фундаментом решения любой химической задачи.

Массы исходных веществ и продуктов всегда будут одинаковы. Если в результате реакции образуется газ, вы можете найти количества вещества газа и посчитать его массу. Этот закон не имеет исключений.
Объем газа легко перевести в массу, например, найдем массу 32 литров кислорода:
ν (O2) = V(O2) : VM = 32 литра : 22.4 литра/моль = 1.43 моль
m (O2) = ν(O2) × M(O2) = 1.43 моль × 32 грамм/моль = 45.76 грамм
Очевидно, что выделение газа не нарушает закон сохранения масс, напротив - является его подтверждением. Моль в химии - замечательный посредник, который помогает переводить литры в граммы, или наоборот.
Иногда, только вспомнив про закон сохранения масс, вы можете найти массу нужного вещества для решения задачи. Представим такое задание:
Неизвестное вещество массой 124 грамма полностью прореагировало с водой, при этом образовалась соль массой 140 грамм и спирт массой 30 грамм. . здесь много-много текста. Найдите неизвестное вещество.
Это сильно сокращенный пример задания :) Решение это задачи основано на законе сохранения масс. Нам известно все необходимое, чтобы посчитать массу воды.
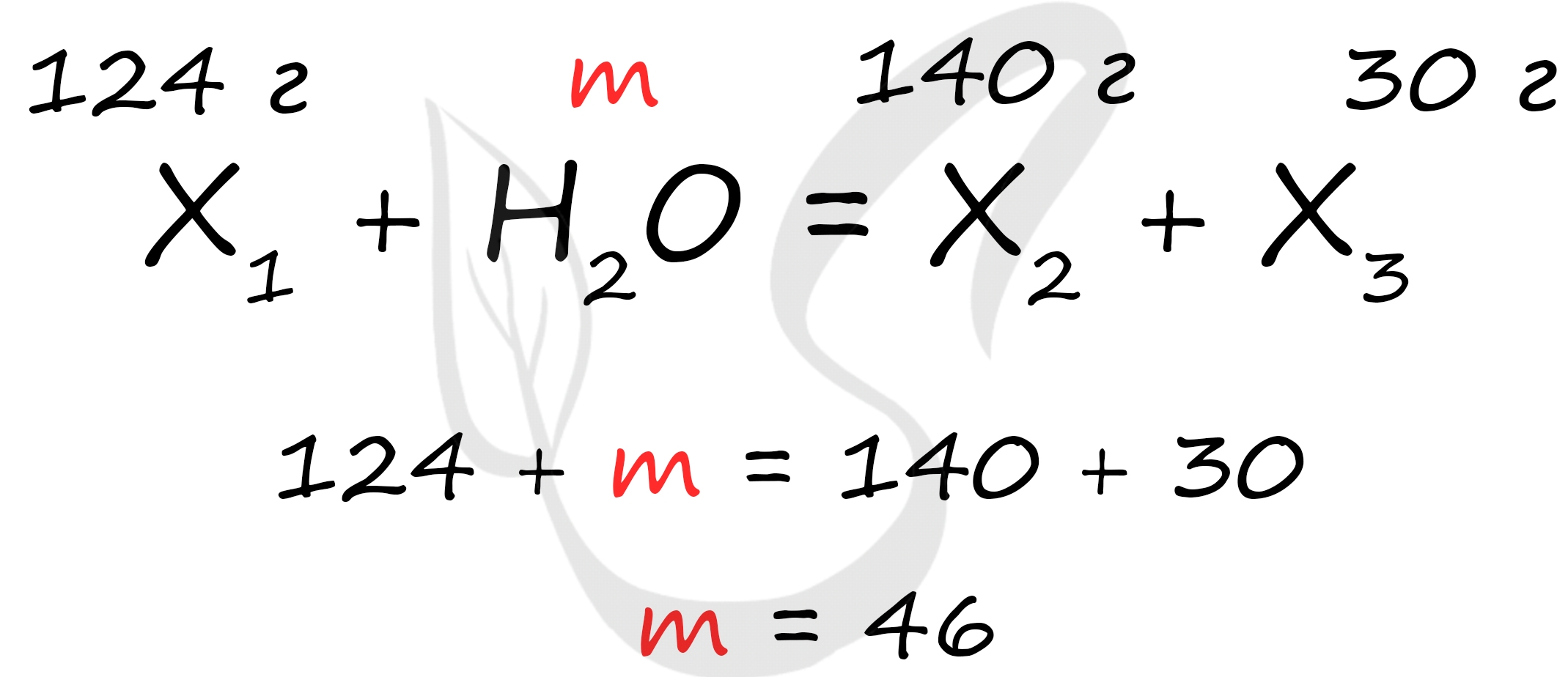
Посчитав массу воды, в дальнейшем мы найдем количество вещества воды и сможем перейти к остальным веществам в задачке (не пытайтесь ее решить до конца, она составлена мной для примера экспромтом :)
Мне доводилось видеть, как в сложных задачках ученики забывали об этом законе, ведь он кажется таким очевидным и простым. Не забывайте про него, будьте уверены - он вам пригодится ;-)
Закон объемных отношений газов
Установлен Ж. Л. Гей-Люссаком в 1808 году. Закон гласит о том, что при постоянном давлении и температуре объемы газов, вступающих в химическую реакцию, находятся в простых отношениях друг к другу и к объемам газообразных продуктов реакции, то есть отношение объемов, в которых газы участвуют в реакции, соответствует отношению небольших целых чисел.
Попытаемся быть чуть проще в трактовке закона, его суть в том, что объемы вступающих в реакцию газов относятся друг к другу как стехиометрические коэффициенты (простые числа).
Наглядно посмотрим на примеры, которые демонстрируют данный закон:

Объемы газов могут быть не равны между собой, как в реакции выше: 3 газа слева и 2 газа справа. Не существует "закона равности объемов газов", существует только закон сохранения массы, который не противоречит разности объемов газов, наоборот только подтверждает ее, так как данный закон выполняется.
Самостоятельно посчитайте, какое количество аммиака может образоваться при участии 15 литров азота в реакции: N2 + 3H2 = 2NH3. Решение найдете ниже.
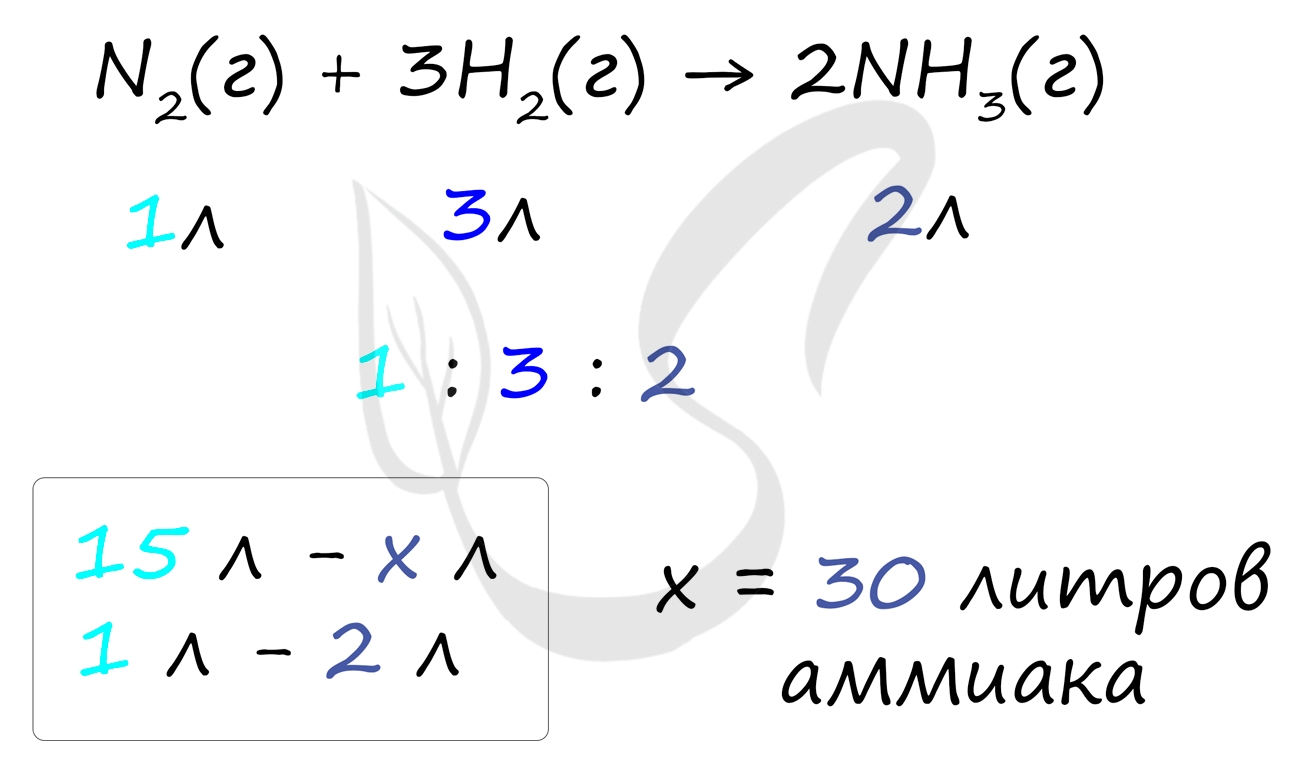
Иногда газов в реакции бывает избыточно, и не все они реагирую полностью. Представим следующую задачу: в синтезе аммиака участвовало 10 литров водорода и 20 литров азота. Найдите объем образующегося аммиака и избыток газа, который не вступит в реакцию.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Основные законы химии
1. В реакции A + B = C + D, известна масса A (22 грамма) и B (42 грамма). Известна масса вещества C (18 грамм). Вычислите, чему равна масса D.
В соответствии с законом сохранения масс, сумма C + D равна сумме A + B = 64 г. Теперь нужно из 64 вычесть массу известного C, после чего получить массу D: 64 - 18 = 46 грамм.
Читайте также:
- Нормы первичных средств пожаротушения в соответствии с требованиями ппб 01 03 для школы
- Технология интерактивного обучения в начальной школе в соответствии с фгос
- Нормативное финансирование образования кратко
- Предупреждение развития перегревов кратко
- Срок действия программы производственного контроля в школе

