Этапы выделения чистой культуры микроорганизмов кратко
Обновлено: 30.06.2024
Чистые культуры – ключевая догма микробиологии XX века. Для понимания сути данного понятия стоит вспомнить, что бактерии очень малы и морфологически трудноразличимы. Но они отличаются по биохимическим процессам, и именно это является их главной видовой особенностью. Но в обычной среде мы имеем дело не с одним видом бактерий, а с целым биомом – сообществом, которое влияет друг на друга, и выделить роль одного микроорганизма невозможно. И вот тут нам и нужна чистая культура или штамм конкретного вида.
Вам будет интересно: География родного края: в какой части России находится Ярославль
Гениальная идея выделения чистых культур микробов принадлежит медицинскому микробиологу Генриху Герману Роберту Коху (1843-1910). Тому самому, который открыл возбудителя сибирской язвы, холеры и туберкулеза и заслуженно считается основоположником бактериологии и эпидемиологии.
Именно он изобрел метод чистых культур, когда на питательную среду на основе полисахарида агар-агара наносится разбавленная культура микробов и из одной клетки вырастает колония совершенно идентичных организмов. Она хорошо видна невооруженным глазом и специфична для каждого вида.
Его изобретение дало толчок к развитию микробиологии и таксономии микроорганизмов. Ведь так можно было любой микроб культивировать в чистом виде и исследовать сто миллионов клеток как одну.
Вам будет интересно: Нужна ли программисту математика: перечень предметов для поступления, советы и отзывы

Не умаляя достижений Коха
Стоит отметить, что в данное изобретение внесли вклад соратники и ученики Коха. Так, идея с использованием агар-агара принадлежит Фанни Анжелине Гессе, жене ассистента Коха - В. Гессе.
Еще один помощник Коха бактериолог Юлиус Рихард Петри (1852-1921) предложил выращивать колонии бактерий в плоских стеклянных чашках. Сегодня о чашках Петри знают даже школьники.
Догма микробиологии
Чистая (аскеничная) культура – совокупность (популяция или штамм) микроорганизмов, которые имеют идентичные морфологические и биохимические свойства и являются потомками одной клетки.
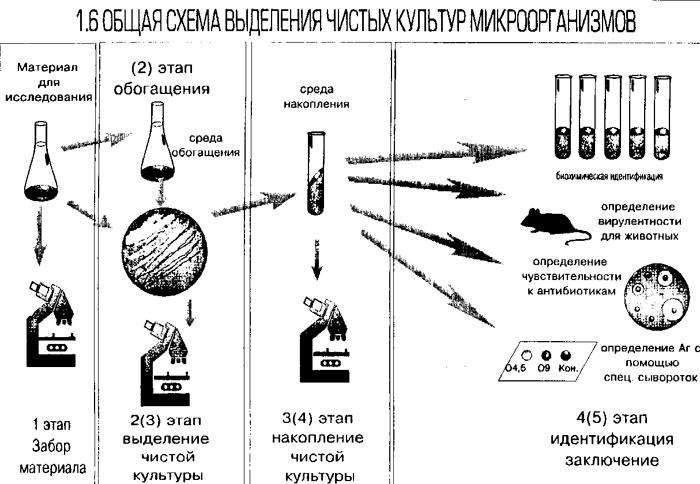
Выделение чистой культуры предполагает осуществление трех этапов:
Методы выделения чистых культур
В микробиологии используются следующие методы для получения аксеничной культуры организмов:
- Механические методы (посев на чашки Петри при помощи шпателя или петли, посев при помощи разведения материала в агаре – пластинчатые разводки, метод разделения на основании подвижности микроорганизмов).
- Биологический – метод, при котором заражают чувствительных к патогену лабораторных животных. Так выделяют чистые культуры бактерий из организма мышей (например, пневмококков и палочки туляремии).
- Методы, которые основаны на избирательной резистентности микроорганизмов к определенным факторам. При нагревании, например, погибнут все спорообразующие бактерии, а неспорообразующие останутся в чистой культуре. При воздействии кислотами гибнут чувствительные к ним бактерии, а кислотоустойчивые (например, палочки туберкулеза) выживают. Воздействие антибиотиков оставляет на среде чистую культуру микроорганизмов, не чувствительных к нему. Создание кислородной и бескислородной среды отделит аэробов от анаэробов.
Для чего это необходимо
Чистые культуры применяются:
- В научной таксономии при классификации (определении филогенетического места в системе) микроорганизмов.
- В изучении наследственности и изменчивости организмов.
- При инфекционной диагностике и выявлении возбудителей заболеваний.
- При выделении чистой культуры бактерий, которые приводят к порче продуктов питания.
- При производстве витаминов, ферментов, антибиотиков, сывороток и вакцин.
- В пищевой промышленности (производство хлеба, вина, кваса и пива (уксусные бактерии и одноклеточные грибы дрожжи), молочнокислая продукция (лактобактерии и молочнокислые бактерии)).
- В биотехнологии и при изучении вирусов.
В природе все совсем не так
В 90-е годы прошлого столетия в отношении чистых культур все вдруг изменилось. Выяснилось, что при соединении микроорганизмов двух чистых штаммов в одной пробирке они ведут себя совсем не так, как поодиночке. Биохимические процессы их жизнедеятельности влияют (подавляют или стимулируют) друг на друга. Именно так и происходит в природных биомах.
Вывод прост: свойства чистой культуры в лаборатории не могут быть экстраполированы на природные биомы.
Геномная революция
Еще один удар был нанесен геномной идентификацией микроорганизмов. Изначально для геномного анализа микроорганизмов молекулярными генетиками был выбран общий для всех бактерий участок рибосомальной РНК. В соответствии с различиями в последовательности нуклеотидов в этой нуклеиновой кислоте все бактерии были распределены по признаку филогенетического родства.
Вот тут-то и оказалось, что культурные штаммы и те бактерии, которых мы изучили, составляют порядка 5% всех бактерий, населяющих нашу планету. И, в отличие от культурных штаммов, об их свойствах и особенностях биохимии мы ничего не знаем.
Найдя соответствующую последовательность в геноме природного штамма, мы можем только разместить его на филогенетическом древе и предположить, что в природе он имеет те же свойства, что и ближайший родственный штамм чистой линии.

И что же дальше?
Похожая ситуация сложилась и с бактериями, живущими в глубине золотобывающих шахт. Оказалось, что это чистая линия микроорганизмов – потомки одной бактерии.
При этом эти организмы не растут на питательных средах, и вырастить колонию чистого штамма пока никому не удалось.
В развитии этой отрасли прикладного знания перед человечеством стоит множество вопросов. И не только биологических, но и этических. Насколько человек может изменить окружающий мир и не навредить ему? Вопрос остается открытым.
А искусственный биосинтез уже сегодня поставляет нам биогаз и биотопливо в виде высокомолекулярных углеводов природного происхождения (продукты жизнедеятельности бактерий, простейших грибов, которые перерабатывают биомассу наших отходов в топливо, энергию, химикаты).
Пахотные земли и пресная вода – сегодня это самый важный компонент из ограниченных природных ресурсов. Новые биотехнологии (биоремедиация) предлагает возможности использования микроорганизмов для восстановления их потенциальных возможностей и удаления загрязняющих факторов.
Цель занятия. Изучить методы посева бактерий на плотные и жидкие питательные среды, а также способы выделения чистых культур.
Задание: записать этапы и зарисовать схему посева культур микроорганизмов из пробирки в пробирку с помощью бактериологической петли, а также пересева культур микроорганизмов, выращенных на жидких питательных средах, в стерильные питательные среды. Выписать выделенные термины, ответить на вопросы, сделать вывод.
В лабораторных условиях микроорганизмы выращивают на твердых и жидких средах в пробирках, колбах или в чашках Петри. Перед выделением чистой культуры из различных объектов окружающей среды (пищевого продукта, с поверхности плодов и овощей, из почвы, воды и др.), в которых находится множество микроорганизмов, вначале получают накопительные культуры, проводя культивирование в элективных условиях - условиях, способствующих развитию одной культуры и ограничивающих развитие сопутствующих микроорганизмов.
Для выделения чистых и накопительных культур из различных объектов в лабораториях используют методы посева и пересева.
Посевом в микробиологии называют внесение клеток микроорганизмов (посевного материала — инокулята) в стерильные среды.
Пересев - это перенос выращенной культуры микроорганизмов на питательной среде на другую свежую питательную среду. Посев (и пересев) микроорганизмов проводят при соблюдении определенных правил стерильности, которые необходимо выполнять, чтобы предохранить исследуемую культуру от загрязнения посторонними организмами и не загрязнять окружающую среду исследуемыми культурами микроорганизмов.
Накопительные культуры состоят преимущественно из клеток микроорганизмов одного вида. Для получения накопительных культур используют жидкие накопительные питательные среды, различные методы обработки материала, содержащего смесь микробов, а также учитывают другие особенности выделяемых из объекта микроорганизмов.
Получают накопительные культуры микроорганизмов, используя различные методы. К таким методам относятся методы обогащения, метод нагревания исследуемого материала для выделения спорообразующих бактерий, метод выделения подвижных форм бактерий (метод Шукевича) и др.
Чистой культурой называют культуру, состоящую из микроорганизмов одного вида. Чистая культура микроорганизмов, которая является потомством одной единственной клетки, называется клоном.Существует несколько методов получения чистых культур. Все они основаны на выделении из популяции одной клетки.
МЕТОДЫ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
Их часто применяют для выделения чистых культур микроорганизмов (например, бактерий группы кишечной палочки (БГКП), сальмонелл и др.) из материалов, в которых мало выделяемых микроорганизмов, но содержится большое количество сопутствующей микрофлоры. Для увеличения численности выделяемого вида микроорганизмов вначале делают посев исследуемого материала в накопительные питательные среды, которые содержат вещества, стимулирующие его рост и угнетающие или задерживающие размножение сопутствующей микрофлоры. Например, для выделения сальмонелл проводят посев в среды обогащения Кауфмана, Мюллера и др., для выделения БГКП – на среду Кесслера. При выделении культур молочнокислых бактерий из почвы, сырого молока или растений посевы делают на стерильное обезжиренное молоко, содержащее 5 % этилового спирта для подавления роста гнилостных бактерий.
Применяют для выделения чистых культур споровых форм бактерий (бацилл, клостридий). В этом случае перед посевом исследуемый материал прогревают на водяной бане при температуре 75…85 0 С в течение 20…30 мин. Вегетативные формы погибают во время прогревания, а споры микробов остаются живыми и при последующих высевах на плотную среду прорастают, формируя колонии.
Метод выделения подвижных форм бактерий (метод Шукевича)
Заключается в посеве исследуемого материала в конденсационную воду скошенного мясопептонного агара. При размножении подвижные формы микроорганизмов из конденсационной воды распространяются на агаре, как бы вползая на его поверхность.
Методы выделения анаэробных микроорганизмов
Основаны на выращивании микроорганизмов в средах с низкой концентрацией кислорода или в безкислородной среде, что достигается:
посевом исследуемого материала в среды, содержащие редуцирующие и легко окисляемые вещества (антиоксиданты). В качестве таких веществ чаще всего используют тиогликолят натрия, солянокислый цистеин, кусочки животных и растительных тканей;
посевом исследуемого материала в глубину плотных питательных сред. Посев делается уколом препаровальной иглой в пробирку со столбиком плотной среды или в расплавленную плотную или полужидкую питательную среду с последующим перемешиванием;
механическим удалением воздуха из сосудов при выращивании анаэробных микроорганизмов (создают вакуум);
культивированием анаэробных микроорганизмов в жидких средах под слоем масла;
культивированием анаэробных микроорганизмов в атмосфере инертного газа, диоксида углерода, азота.
ТЕХНИКА ПРОВЕДЕНИЯ ПОСЕВОВ
Посев на плотные среды в чашки проводят несколькими способами.
Для переноса пробы из жидкой среды, например воды, молока или бульона, в пробирку с питательной средой используют проволочную петлю. Петлю погружают в среду и мягко взбалтывают ее, не забывая каждый раз прокаливать горлышко флакона.
Готовят в чашках Петри твердые пластинки из питательной среды. Стерильную твердую питательную среду расплавляют на водяной бане в пробирке или колбе и охлаждают до температуры 50 °С.
Вынимают чашки Петри из бумаги, в которой они стерилизовались, и ставят их на ровную горизонтальную поверхность.
Берут пробирку или колбу с охлажденной до 50 °С питательной средой, вынимают ватную пробку, обжигают на пламени горелки края пробирки и держат ее в наклонном положении. Приоткрывают крышку чашки Петри левой рукой, а правой рукой наливают среду на дно чашки Петри, заполняя всю ее поверхность.
Оставляют чашку Петри на столе до полного застывания среды, затем ставят в термостат на 15-20 мин для подсушивания.
На твердую среду посевной материал наносят петлей или пипеткой. Затем каплю посевного материала равномерно распределяют по поверхности, пользуясь стерильным шпателем (изогнутой стеклянной палочкой). Для этого, шпатель вынимают из бумаги и берут в правую руку.
Приоткрывают крышку чашки Петри левой рукой и вносят в нее шпатель.
Размазывают каплю посевного материала шпателем вращательными движениями по поверхности агаровой пластинки (надавливать шпателем на твердую среду не следует, так как можно ее повредить).
Переносят шпатель в сосуд с дезинфицирующим раствором.
Посев заливкой - метод, альтернативный методу посева на поверхность агара, используется для инокуляции клеток из жидкой культуры, а также для подсчета жизнеспособных клеток. Поскольку клетки распределены по всей среде, а не только по поверхности агара, можно подсчитать гораздо большее их количество - до 1000 колоний на чашку. Однако размеры выросших колоний значительно меньше.
Для этого, определенный объем (до 0,5 см 3 ) клеточной суспензии вносят в простерилизованный флакон, подходящего объема (около 15- 20 см 3 ) с расплавленным в нем питательным агаром, который предварительно был охлажден до 45—50 °С в водяной бане. Снимают крышку и перед добавлением клеточной суспензии прожигают горлышко флакона. Суспензию клеток тщательно перемешивают с питательным агаром, поворачивая (не встряхивая) назад и вперед зажатый в ладонях флакон. Затем выливают смесь в стерильную чашку Петри. Подписывают донышко чашки и инкубируют ее.
Используется и другой вариант посева в жидкую среду, т.н. глубинный способ посева:
Приоткрывают стерильную чашку Петри и помещают петлей или пипеткой каплю посевного материала на дно чашки.
Расплавляют агаризованную питательную среду в пробирке или колбе и охлаждают ее до 45-48 °С.
Обжигают края пробирки или колбы в пламени горелки и выливают среду в чашку Петри с внесенным посевным материалом, соблюдая правила стерильной работы.
Распределяют равномерно посевной материал в питательной среде, для чего осторожно круговыми движениями перемещают чашку Петри по поверхности стола.
Оставляют чашку Петри на столе до полного застывания среды.
Делают на чашке Петри надпись (число, название микроорганизма).
Посев уколом используют для культивирования анаэробных организмов или организмов, растущих при низкой концентрации кислорода (микроаэрофилов). Обычно используют пробирку с питательной агаризованной средой. Благодаря небольшой поверхности и достаточно большой глубине агара в пробирке по сравнению с чашкой доступ кислорода внутрь агара ограничивается. Посев производят прямой проволочкой (без петли), или бактериологической иглой. Небольшое количество культуры (твердой или жидкой) берут кончиком иглы и затем вертикально прокалывают ею агар. Культура растет в агаре во все стороны от линии прокола.
Все посевы, выполненные описанными способами, помещают в термостат для выращивания микроорганизмов при температуре, благоприятной для их роста.
Далее производят пересев культуры.
Пересев микроорганизмов, выращенных на твердой среде в пробирках, в другие пробирки со средой выполняется в определенной последовательности:
На пробирке со свежей питательной средой разборчиво подписывают название микроорганизма, ставят дату посева. Надписи делают чернилами по стеклу или стеклографом.
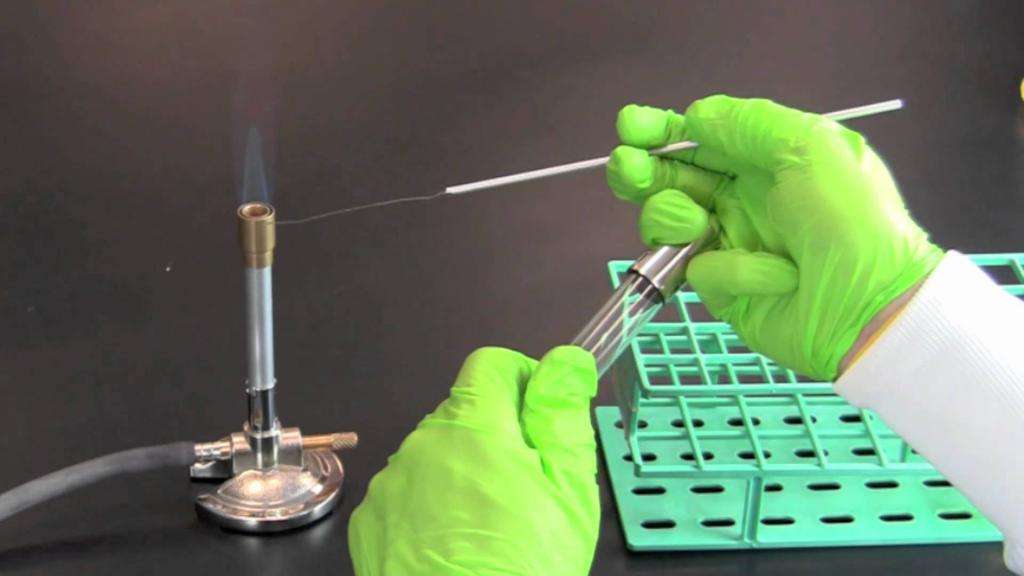
Зажигают горелку. Посевы проводят над пламенем горелки, чтобы теплый воздух препятствовал осаждению микроорганизмов из окружающего воздуха и отчасти их уничтожал.
Берут и правую руку бактериологическую петлю, с помощью которой осуществляют посев (петлю держат как карандаш).
Стерилизуют бактериологическую петлю в пламени горелки, прокаливая проволоку докрасна, и одновременно обжигают примыкающую к петле часть держателя, который будет вводиться в пробирку с культурой микроорганизмов. При прокаливании петлю держат в пламени почти вертикально, чтобы вся проволока была раскалена.
Берут в левую руку две пробирки: одну со стерильной средой (дальше от себя), другую — с культурой микроорганизмов (ближе к себе).
Не выпуская бактериологической петли в правой руке, мизинцем и безымянным пальцем правой руки прижимают наружные концы ватных пробок к ладони и вынимают пробки из пробирок. Класть пробки па стол нельзя.
Слегка обжигают в пламени горелки края открытых пробирок.
Вводят в пробирку с культурой микроорганизмов петлю. Чтобы не повредить клетки микроорганизмов, петлю вначале охлаждают, прикасаясь к внутренней поверхности пробирки или к питательной среде, свободной от клеток микроорганизмов, и только после этого отбирают небольшое количество микробной массы.
Вынимают петлю и вводят ее в пробирку со стерильной питательной средой, избегая прикосновения со стенками пробирки.
Проводят петлей от дна вверх зигзагообразную или прямую черту-штрих, слегка касаясь поверхности агара.
Обжигают ватные пробки и края пробирок одновременно в пламени и закрывают обе пробирки.
Обжигают петлю в пламени.
Пересев культур микроорганизмов, выращенных в жидкой среде, выполняется с учетом особенностей характеристик среды:
Из стерильной бумаги вынимают градуированную стерильную пипетку за верхний конец. Берут пипетку средним и большим пальцами правой руки, не касаясь поверхности той части пипетки, которая будет вводиться в сосуд с жидкой средой.
Берут в левую руку пробирку (или колбу) с культурой микроорганизмов, выращенной в жидкой среде, и держат ее в вертикальном положении, чтобы не замочить пробку.
Открывают пробку, соблюдая все правила стерильности, описанные выше, и вводят пипетку в пробирку.
Набирают в пипетку суспензию микроорганизмов, закрывают пробкой пробирку (или колбу), вносят определенное количество суспензии в свежую стерильную питательную среду, соблюдая описанные правила предосторожности.
Пипетку помещают в сосуд с дезинфицирующим раствором (0,5-3%-м водным раствором хлорамина или 3-5%-м водным раствором фенола), не касаясь ею окружающих предметов.
При использовании этих методов иногда получаются не чистые, а смешанные культуры. Это является результатом того, что колонии могут образоваться не из одной, а из двух или нескольких клеток, попавших в одну точку. Поэтому метод выделения чистых культур требует двух- или трехкратного повторения выделения культур из одной колонии. Для выделения чистых колоний бактерий из смеси бактерий применяют посев на твердую среду штрихом, или посев разведением. Для выделения чистых культур многих бактерий используют МПА, для дрожжей — сусло-агар.
Метод разбавления Пастера (метод предельных разведений)
Заключается в том, что из исследуемого материала делают ряд последовательных разведений в жидкой питательной среде. Для этого каплю посевного материала вносят в пробирку со стерильной жидкой средой, из нее каплю переносят в следующую пробирку и так засевают до 8…10 пробирок. С каждым разведением количество микробных клеток, попадающих в среду, будет уменьшаться и можно получить такое разведение, в котором во всей пробирке со средой будет находиться только одна микробная клетка, из которой разовьется чистая культура микроорганизма. Так как в жидких средах микробы растут диффузно, т.е. легко распределяются во всей среде, то изолировать одну микробную клетку от другой трудно. Таким образом, метод Пастера не всегда обеспечивает получение чистой культуры. Поэтому в настоящее время этот метод используется, главным образом, для предварительного уменьшения концентрации микроорганизмов в материале перед посевом его в плотную среду для получения изолированных колоний.
Капельный метод выделения чистой культуры из одной клетки
Предварительно подготавливается разведение культуры микроорганизма в питательной среде с таким расчетом, чтобы в небольшой капле этой среды могли быть единичные клетки. Затем на поверхность стерильного стекла с помощью стерилизованной иглы и стеклянной палочки наносят ряды мелких капель среды, содержащей микроорганизмы.
Стекло переворачивают и помещают над лункой предметного стекла. Края лунки предварительно обмазывают вазелином. Затем все капли просматривают под микроскопом и отмечают те из них, в которых находится только одна клетка.
Стекло помещают в чашку Петри, на дне которой находится увлажненная фильтровальная бумага, и ставят в термостат; клетка размножается, образуя микроскопическую колонию.
Полученную колонию снимают стерильной фильтровальной бумагой, которую держат стерилизованным на пламени пинцетом, и переносят в пробирку с питательной средой. Выделение чистой культуры капельным методом используется при работе с крупными микроорганизмами (дрожжами, плесенью).
Метод выделения чистой культуры с помощью твердых сред (метод Коха и метод Дригальского)
Наиболее распространенный в микробиологической практике метод основан на том, что при нанесении микроорганизмов из посевного материала на твердую среду отдельные клетки будут закрепляться (иммобилизоваться) в определенной точке твердой среды и, размножаясь, давать потомство (клон), представляющее чистую культуру микроорганизма.
Для получения изолированных колоний на твердой среде на поверхность твердой питательной среды исследуемый материал высевают, каплю его наносят петлей или пипеткой.
Рассев проводят либо методом истощающего мазка, либо методом истощающего штриха.
В первом случае шпателем равномерно распределяют нанесенную каплю по поверхности твердой среды. Тем же шпателем делают посев на поверхности второй пластинки и затем третьей, т. е. переносят последовательно на твердую среду клетки микроорганизмов, которые остались на шпателе.
Таким образом, количество микроорганизмов, вносимых последовательно на пластинки, будет уменьшаться: на вторую пластинку - меньше, чем на первую; на третью - еще меньше, чем на вторую, и т. д.
При использовании метода истощающего штриха исследуемый материал наносят петлей в верхнюю часть твердой среды в чашке Петри и аккуратно, зигзагообразно петлей по поверхности чашки. Затем посев проводят аналогично на второй и третьей чашках.
После посева чашки необходимо перевернуть вверх дном и поставить в термостат при температуре, благоприятной для данного микроорганизма. Инкубируют посевы обычно в термостате в течение 2-3 дней. В результате на поверхности среды вырастают колонии микроорганизмов. Выросшие колонии сначала рассматривают невооруженным глазом, а затем при помощи лупы или при малом увеличении микроскопа.
а б
Рисунок 1. а -метод посева зигзагообразной петлей; б – метод посева истощающего штриха
Может наноситься серия штрихов (рис. 2). При этом, проводя на поверхности среды штрихи, после каждой серии чашку немного поворачивают, так чтобы в каждой новой серии распределялись бактерии из предыдущей серии штрихов, истощая, таким образом штрихи до отдельных бактерий.
С помощью этого метода можно выделять бактерии из естественных мест обитания, например из почвы, молока, воды. Образцы твердых субстанций, таких как почва, лучше суспендировать в небольшом количестве воды, либо предварительно проинкубировать в жидкой среде. Безопасным источником для рутинной работы является пастеризованное молоко. Перед тем как проводить эксперименты с бактериями или грибами, следует ознакомиться с инструкциями и правилами безопасности, чтобы снизить до минимума риск культивирования вредных организмов.
Из отобранных колоний готовят препараты, микроскопируют их (рассматривают под микроскопом) для проверки морфологической однородности клеток. Рассматривают препараты с объективом х 90 при максимальном освещении. При приготовлении препаратов необходимо соблюдать все правила стерильности (не открывать широко крышку чашки, хорошо стерилизовать петлю).
1. Выделение чистой культуры является основой бактериологической работы, т.к. в практической деятельности приходится иметь дело с материалом, содержащим смесь микробов (гной, испражнения и т.д.), идентификация же вида возможна только тогда, когда бактерии получены в чистом, изолированном виде.
2. Для получения чистой культуры необходимо отделить бактериальные клетки разных видов друг от друга. По способу их отделения различают две основные группы методов выделения чистых культур: а) методы, основанные на механическом разделении; б) методы основанные на различиях в биологических свойствах микроорганизмов.
3. Чаще всего используются механические способы разъединения бактериальных клеток – специальные методы посева:
а) рассев шпателем по Дригальскому: берут три чашки Петри с питательным агаром; на первую чашку наносят петлей или пипеткой каплю исследуемого материала и растирают шпателем по всей поверхности агара; затем шпатель переносят во вторую чашку и втирают оставшуюся на шпателе культуру в поверхность питательной среды; аналогичным образом производят посев шпателем и в третьей чашке. На первой чашке вырастает максимальное количество колоний; на третьей – минимальное, где вырастают отдельные колонии, пригодные для выделения чистой культуры;
б) рассев петлей ("штрихами" или "сеткой"): берут одну чашку Петри с питательным агаром; петлей на небольшом участке питательного агара делают сплошной посев исследуемого материала, а затем, отступив от засеянной площадки, делают посев прерывистыми штрихами; в том месте, где на агар попало большое количество микробных клеток, рост будет в виде сплошного штриха, а на штрихах с небольшим количеством клеток вырастут отдельные колонии;
в) фильтрация: исследуемый материал пропускают через специальные фильтры с определенным диаметром пор и таким образом разделяют микроорганизмы по величине (в основном применяется для очистки вирусов от бактерий).
Т.о., при помощи специальных методов посева добиваются роста микроорганизмов на плотных питательных средах в виде изолированных колоний различных видов бактерий, содержащихся в исходном материале в виде смеси, т.е. получают чистую культуру из одной клетки, а далее осуществляют ее пересев.
4. Биологические способы выделения основаны на различиях в биологических свойствах микроорганизмов:
а) метод Шукевича – исследуемый материал засевают в конденсационную воду скошенного агара, подвижные формы микробов при размножении как бы "вползают" на поверхность агара из конденсационной воды (Proteus vulgaris), отсевая верхние края культуры в воду свежескошенного агара, и, повторяя это несколько раз, можно получить чистую культуру;
б) метод прогревания – прогревают материал при 80° С на водяной бане 10-15 минут, при этом вегетативные формы погибают, а споры остаются и при посеве на соответствующую питательную среду прорастают (этот метод позволяет отделить споровые формы от неспоровых);
в) бактериостатический метод – при посеве в исходный материал добавляют некоторые химические вещества или антибиотики, которые угнетают рост одних микроорганизмов, не влияя на другие (например, пенициллин задерживает рост грамположительных микроорганизмов, не влияя на грамотрицательные; 5 % р-р H2SO4 убивает большинство микроорганизмов, а туберкулезная палочка выживает);
г) метод обогащения – посев на элективные питательные среды;
д) метод заражения лабораторных животных или растений – заражают исследуемым материалом восприимчивые к возбудителю виды животных или растений; после появления признаков заболевания производят посев органов и тканей на питательные среды (применяют для выделения патогенных видов микроорганизмов и отделения их от сапрофитов).
5. Для выделения чистых культур большинства бактерий обычно затрачивается не более 2-3 суток (для выращивания микобактерий туберкулеза – 4-6 недель). Процесс выделения чистой культуры можно разделить на три этапа: а) отделение чистой культуры; б) накопление чистой культуры; в) идентификация – заключение о видовой принадлежности.
6. Первый этап (1-ый день):
а) из исследуемого материала готовят мазок, окрашивают по Граму (или другим методом) и микроскопируют;
б) производят посев исследуемого материала (смеси бактерий) на чашку Петри с МПА штриховым методом или по методу Дригальского и ставят в термостат при 37° С на 24-48 часов (на этом этапе можно использовать и какой-либо биологический способ).
Второй этап (2-ой день):
а) наблюдают результаты посева и проводят описание колоний разных видов по следующим признакам: размер, форма, цвет, поверхность, форма края, структура, консистенция;
б) из колоний готовят мазки и окрашивают по Граму для изучения морфологических и тинкториальных свойств; убеждаются в том, что колония содержит один вид бактерий;
в) осуществляют пересев одной или нескольких различных изолированных колоний в отдельные пробирки со скошенным МПА для накопления чистой культуры; выращивают в термостате при 37° С 24 часа.
Третий этап (3-ий день):
а) отмечают характер роста выделенной чистой культуры на МПА (визуально она характеризуется однородным ростом);
б) готовят мазок, окрашивают по Граму (или другим методом) и микроскопируют; при наличии чистой культуры обнаруживаются морфологически и тинкториально однородные клетки (исключение – полиморфные организмы);
в) производят посев на жидкие и полужидкие среды Гисса и МПБ для изучения биохимических (сахаролитических и протеолитических) свойств чистой культуры; оставляют в термостате при 37° С на 24 часа;
г) проводят идентификацию выделенной чистой культуры по морфологическим, тинкториальным, культуральным, биохимическим и др. свойствам; делают окончательный вывод о видовой принадлежности выделенной чистой культуры.
Морфологические признаки – форма, расположение и размеры бактериальных клеток.
Тинкториальные признаки – отношение к различным красителям. Эти признаки изучают при микроскопическом исследовании мазков, окрашенных разными методами (например, по Граму) и нативных препаратов.
Культуральные признаки – морфологические особенности колоний и характер роста микроорганизмов на жидких и плотных питательных средах.
Биохимические признаки – способность ферментировать белки, углеводы и другие соединения с образованием различных продуктов (определяются набором ферментов).
В бактериологической практике иногда ограничиваются изучением сахаролитических и протеолитических признаков исследуемых бактерий, если это является достаточным для их идентификации.
В необходимых случаях проводят изучение других признаков, например, восстановление нитратов, декарбоксилирование аминокислот, образование оксидазы, плазмокоагулазы, фибринолизина и других ферментов, а также определение антигенной структуры, чувствительности к фагам, вирулентности и т.д. Для этого проводят дополнительные исследования по определению соответствующего маркера (фермента, антигена, чувствительности к фагам).
1. Выделение чистой культуры является основой бактериологической работы, т.к. в практической деятельности приходится иметь дело с материалом, содержащим смесь микробов (гной, испражнения и т.д.), идентификация же вида возможна только тогда, когда бактерии получены в чистом, изолированном виде.
2. Для получения чистой культуры необходимо отделить бактериальные клетки разных видов друг от друга. По способу их отделения различают две основные группы методов выделения чистых культур: а) методы, основанные на механическом разделении; б) методы основанные на различиях в биологических свойствах микроорганизмов.
3. Чаще всего используются механические способы разъединения бактериальных клеток – специальные методы посева:
а) рассев шпателем по Дригальскому: берут три чашки Петри с питательным агаром; на первую чашку наносят петлей или пипеткой каплю исследуемого материала и растирают шпателем по всей поверхности агара; затем шпатель переносят во вторую чашку и втирают оставшуюся на шпателе культуру в поверхность питательной среды; аналогичным образом производят посев шпателем и в третьей чашке. На первой чашке вырастает максимальное количество колоний; на третьей – минимальное, где вырастают отдельные колонии, пригодные для выделения чистой культуры;
б) рассев петлей ("штрихами" или "сеткой"): берут одну чашку Петри с питательным агаром; петлей на небольшом участке питательного агара делают сплошной посев исследуемого материала, а затем, отступив от засеянной площадки, делают посев прерывистыми штрихами; в том месте, где на агар попало большое количество микробных клеток, рост будет в виде сплошного штриха, а на штрихах с небольшим количеством клеток вырастут отдельные колонии;
в) фильтрация: исследуемый материал пропускают через специальные фильтры с определенным диаметром пор и таким образом разделяют микроорганизмы по величине (в основном применяется для очистки вирусов от бактерий).
Т.о., при помощи специальных методов посева добиваются роста микроорганизмов на плотных питательных средах в виде изолированных колоний различных видов бактерий, содержащихся в исходном материале в виде смеси, т.е. получают чистую культуру из одной клетки, а далее осуществляют ее пересев.
4. Биологические способы выделения основаны на различиях в биологических свойствах микроорганизмов:
а) метод Шукевича – исследуемый материал засевают в конденсационную воду скошенного агара, подвижные формы микробов при размножении как бы "вползают" на поверхность агара из конденсационной воды (Proteus vulgaris), отсевая верхние края культуры в воду свежескошенного агара, и, повторяя это несколько раз, можно получить чистую культуру;
б) метод прогревания – прогревают материал при 80° С на водяной бане 10-15 минут, при этом вегетативные формы погибают, а споры остаются и при посеве на соответствующую питательную среду прорастают (этот метод позволяет отделить споровые формы от неспоровых);
в) бактериостатический метод – при посеве в исходный материал добавляют некоторые химические вещества или антибиотики, которые угнетают рост одних микроорганизмов, не влияя на другие (например, пенициллин задерживает рост грамположительных микроорганизмов, не влияя на грамотрицательные; 5 % р-р H2SO4 убивает большинство микроорганизмов, а туберкулезная палочка выживает);
г) метод обогащения – посев на элективные питательные среды;
д) метод заражения лабораторных животных или растений – заражают исследуемым материалом восприимчивые к возбудителю виды животных или растений; после появления признаков заболевания производят посев органов и тканей на питательные среды (применяют для выделения патогенных видов микроорганизмов и отделения их от сапрофитов).
5. Для выделения чистых культур большинства бактерий обычно затрачивается не более 2-3 суток (для выращивания микобактерий туберкулеза – 4-6 недель). Процесс выделения чистой культуры можно разделить на три этапа: а) отделение чистой культуры; б) накопление чистой культуры; в) идентификация – заключение о видовой принадлежности.
6. Первый этап (1-ый день):
а) из исследуемого материала готовят мазок, окрашивают по Граму (или другим методом) и микроскопируют;
б) производят посев исследуемого материала (смеси бактерий) на чашку Петри с МПА штриховым методом или по методу Дригальского и ставят в термостат при 37° С на 24-48 часов (на этом этапе можно использовать и какой-либо биологический способ).
Второй этап (2-ой день):
а) наблюдают результаты посева и проводят описание колоний разных видов по следующим признакам: размер, форма, цвет, поверхность, форма края, структура, консистенция;
б) из колоний готовят мазки и окрашивают по Граму для изучения морфологических и тинкториальных свойств; убеждаются в том, что колония содержит один вид бактерий;
в) осуществляют пересев одной или нескольких различных изолированных колоний в отдельные пробирки со скошенным МПА для накопления чистой культуры; выращивают в термостате при 37° С 24 часа.
Третий этап (3-ий день):
а) отмечают характер роста выделенной чистой культуры на МПА (визуально она характеризуется однородным ростом);
б) готовят мазок, окрашивают по Граму (или другим методом) и микроскопируют; при наличии чистой культуры обнаруживаются морфологически и тинкториально однородные клетки (исключение – полиморфные организмы);
в) производят посев на жидкие и полужидкие среды Гисса и МПБ для изучения биохимических (сахаролитических и протеолитических) свойств чистой культуры; оставляют в термостате при 37° С на 24 часа;
г) проводят идентификацию выделенной чистой культуры по морфологическим, тинкториальным, культуральным, биохимическим и др. свойствам; делают окончательный вывод о видовой принадлежности выделенной чистой культуры.
Морфологические признаки – форма, расположение и размеры бактериальных клеток.
Тинкториальные признаки – отношение к различным красителям. Эти признаки изучают при микроскопическом исследовании мазков, окрашенных разными методами (например, по Граму) и нативных препаратов.
Культуральные признаки – морфологические особенности колоний и характер роста микроорганизмов на жидких и плотных питательных средах.
Биохимические признаки – способность ферментировать белки, углеводы и другие соединения с образованием различных продуктов (определяются набором ферментов).
В бактериологической практике иногда ограничиваются изучением сахаролитических и протеолитических признаков исследуемых бактерий, если это является достаточным для их идентификации.
В необходимых случаях проводят изучение других признаков, например, восстановление нитратов, декарбоксилирование аминокислот, образование оксидазы, плазмокоагулазы, фибринолизина и других ферментов, а также определение антигенной структуры, чувствительности к фагам, вирулентности и т.д. Для этого проводят дополнительные исследования по определению соответствующего маркера (фермента, антигена, чувствительности к фагам).
Читайте также:

