Сера в природе доклад
Обновлено: 16.05.2024
Сера является элементом периодической таблицы Менделеева, в которой она обозначена символом S и имеет атомный номер 16. Этот неметалл обладает полиморфизмом, не имеет запаха, встречается во многих сульфидных и сульфатных минералах и даже в чистом виде в вулканических регионах. Сера присутствует во всех живых организмах и необходима для образования некоторых аминокислот, участвующих в синтезе различных белков.
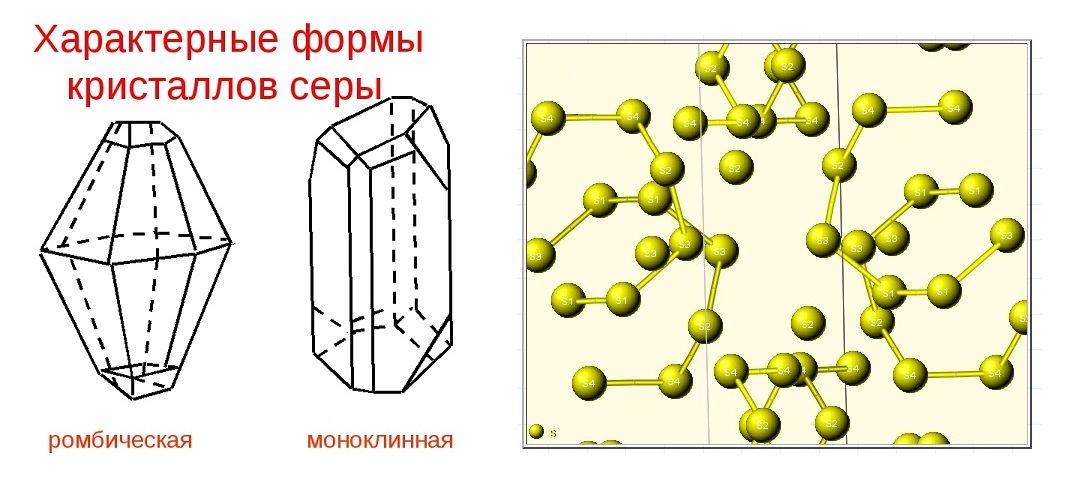
Этот неметалл имеет бледно-желтый цвет, на ощупь мягкий и легкий, с отчетливым запахом в сочетании с водородом. При горении сера образует диоксид, который имеет специфический удушающий запах. В воде она нерастворима, но растворима в сероуглероде. Во всех состояниях, твердых, жидких и газообразных, сера имеет аллотропные формы. Ее можно получить в двух кристаллических модификациях, в ромбических октаэдрах или в моноклинных призмах, первая из которых является более стабильной при обычных температурах.
Сера используется во многих промышленных процессах, таких, например, как производство серной кислоты для аккумуляторов, создание пороха и проведение вулканизации каучука. Серу применяют как фунгицид и при производстве удобрений. Она используется для отбеливания бумаги и сухофруктов, находит применение в спичках и фейерверках. Тиосульфат натрия используется в качестве фотографического фиксирующего агента, а сульфат магния применяют в качестве слабительного, добавки для ванн, в питании растений.
Аминокислоты цистеин, метионин, гомоцистеин, таурин и некоторые ферменты содержат серу, что делает ее необходимым компонентом всех живых клеток. Дисульфидные связи между полипептидами очень важны для сборки и структуры белка. Некоторые формы бактерий используют сероводород вместо воды в качестве донора электронов в процессе примитивного фотосинтеза. Сера поглощается растениями из почвы в виде сульфат-ионов.
В большинстве лесных экосистем сульфаты накапливаются в основном из атмосферы. Выветривание рудных минералов также приводит к появлению некоторого количества серы. Сера с характерным изотопным составом была использована для выявления источников загрязнения, а обогащенная сера нашла применение в качестве индикатора в гидрологических исследованиях.
С сероуглеродом, сероводородом и диоксидом серы следует обращаться осторожно. Помимо того, что диоксид серы является довольно токсичным веществом, он реагирует с атмосферной водой, образуя кислотные дожди. При высокой концентрации в атмосфере диоксид серы, попадая в легкие, образует там серную кислоту, что вызывает немедленное кровотечение, легкие наполняются кровью и наступает удушье.

Популярные сегодня темы
Физика – это наука, которая изучает материальные явления вокруг нас. Одно из них - действие тела на опору или подвес, которое называется весом.
Сергей Есенин появился на свет 3 октября в 1895 году в селе Константиново Рязанской губернии. Свое школьное обучение начал в земском училище, после – в церковно-приходской школе.
В связи с тем, что большинство городов находиться на берегу моря, соответственно и происходит загрязнение вод мирового океана. Так как канализация, все сточные воды и отходы заводов сливают
Земля – является третьей, единственной обитаемой планетой, в порядке удаления от центральной планеты Солнечной системы - Солнца. Имеет круглую, слегка приплюснутую по полюсам форму
В природе все происходит циклично: за весной следует лето, а за летом идет осень. Кстати, осень – прекрасная пора, чтобы собирать и заготавливать на год лекарственные растения.
Сейчас в это сложно поверить, однако первая версия Microsoft Word была создана в далеком 1983-м году. Естественно, она существенно отличалась от того варианта текстового редактора, который
Химический элемент сера и ее нахождение в природе в свободном (самородном) состоянии, ее основные физические и химические свойства, биологическая роль. Получение серы, выплавка ее из горных пород, экстракция сероуглеродом или флотационными методами.
| Рубрика | Химия |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 03.11.2009 |
| Размер файла | 22,1 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Сера и её роль в жизни
2.Нахождение в природе.
4.Физические и химические свойства.
В свободном виде сера представляет собой желтые хрупкие кристаллы или желтый порошок.
Практическое значение серы резко возросло после того, как изобрели черный порох (в состав которого обязательно входит сера). Византийцы в 673 г., защищая Константинополь, сожгли флот неприятеля с помощью так называемого греческого огня -- смеси селитры, серы, смолы и других веществ -- пламя которого не гасилось водой. В средние века в Европе применялся черный порох, по составу близкий к смеси греческого огня. С тех пор началось широкое использование серы для военных целей.
Издавна было известно и важнейшее соединение серы -- серная кислота. Один из создателей ятрохимии, монах Василий Валентин, в 15 веке подробно описал получение серной кислоты путем прокаливания железного купороса (старинное название серной кислоты -- купоросное масло).
2.Нахождение в природе
Сера довольно широко распространена в природе. В земной коре ее содержание оценивается в 0,05% по массе. В природе часто встречаются значительные залежи самородной серы (обычно вблизи вулканов); в Европе они расположены на юге Италии, в Сицилии. Еще большие залежи самородной серы имеются в США (в штатах Луизиана и Техас), а также в Средней Азии, в Японии, в Мексике. В природе сера встречается как россыпями, так и в виде кристаллических пластов, иногда образуя изумительные по красоте группы полупрозрачных желтых кристаллов (так называемые друзы).
В вулканических местностях часто наблюдается выделение из-под земли газа сероводорода H2S; в этих же регионах сероводород встречается в растворенном виде в серных водах. Вулканические газы часто содержат также сернистый газ SO2.
На поверхности нашей планеты широко распространены месторождения различных сульфидных соединений. Наиболее часто среди них встречаются: железный колчедан (пирит) FeS2, медный колчедан (халькопирит) CuFeS2, свинцовый блеск PbS, киноварь HgS, сфалерит ZnS и его кристалическая модификация вюртцит, антимонит Sb2S3 и другие. Известны также многочисленные месторождения различных сульфатов, например, сульфата кальция (гипс CaSO4·2H2O и ангидрит CaSO4), сульфата магния MgSO4 (горькая соль), сульфата бария BaSO4 (барит), сульфата стронция SrSO4 (целестин), сульфата натрия Na2SO4·10H2O (мирабилит) и др.
Каменные угли содержат в среднем 1,0-1,5% серы. Сера может входить и в состав нефти. Целый ряд месторождений природного горючего газа (например, Астраханское) содержат как примесь сероводород.
Серу получают, в основном, выплавляя ее из горных пород, содержащих самородную (элементарную) серу. Так называемый геотехнологический способ позволяет получать серу без подъема руды на поверхность. Этот способ был предложен в конце 19 века американским химиком Г.Фрашем, перед которым встала задача извлечения на поверхность земли серы из месторождений юга США, где песчаный грунт резко усложнял ее добычу традиционным шахтным методом.
Фраш предложил использовать для подъема серы на поверхность перегретый водяной пар. Перегретый пар по трубе подают в подземный слой, содержащий серу. Сера плавится (ее температура плавления немного ниже 120°С) и по трубе, расположенной внутри той, по которой под землю закачивают водяной пар, поднимается наверх. Для того, чтобы обеспечить подъем жидкой серы, через самую тонкую внутреннюю трубу нагнетают сжатый воздух.
По другому (термическому) методу, получившему особое распространение в начале 20 века на Сицилии, серу выплавляют, или возгоняют, из дробленной горной породы в специальных глиняных печах.
Существуют и другие методы выделения самородной серы из породы, например, экстракцией сероуглеродом или флотационными методами.
В связи с тем, что потребность промышленности в сере очень велика, разработаны методы ее получения из сероводорода H2S и сульфатов.
Метод окисления сероводорода до элементарной серы был впервые разработан в Великобритании, где значительные количества серы научились получать из остающегося после получении соды Na2CO3 по методу французского химика Н.Леблана сульфида кальция CaS. Метод Леблана основан на восстановлении сульфата натрия углем в присутствии известняка CaCO3.
Na2SO4 + 2C = Na2S + 2CO2;
Na2S + CaCO3 = Na2CO3 + CaS
Соду затем выщелачивают водой, а водную суспензию плохо растворимого сульфида кальция обрабатывают диоксидом углерода:
CaS + CO2 + H2O = CaCO3 + H2S
Образующийся сероводород H2S в смеси с воздухом пропускают в печи над слоем катализатора. При этом за счет неполного окисления сероводорода образуется сера:
2H2S + O2 = 2H2O +2S
Аналогичный метод используют для получения элементарной серы и из сероводорода, сопутствующего природным газам.
Так как современная техника нуждается в сере высокой чистоты, разработаны эффективные методы рафинирования серы. При этом используют, в частности, различия в химическом поведении серы и примесей. Так, мышьяк и селен удаляют, обработав серу смесью азотной и серной кислот.
Использованием методов, основанных на дистилляции и ректификации, удается получить высокочистую серу с содержанием примесей 10-5-10-6% по массе.
4.Физические и химические свойства
Атомы серы обладают уникальной способностью образовывать устойчивые гомоцепи, т. е. цепи, состоящие только из атомов S (энергия связи S-S составляет около 260 кДж/моль). Гомоцепи серы имеют зигзагообразную форму, так как в их образовании принимают участие электроны, расположенные в соседних атомах на взаимно перпендикулярных рорбиталях. Эти цепи могут достигать большой длины, или, наоборот, образовывать замкнутые кольца S20, S8, S6, S4.
Поэтому сера образует несколько десятков как кристаллических, так и аморфных модификаций, отличающихся как составом молекул и полимерных цепей, так и способом их упаковки в твердом состоянии.
При нормальном давлении и температурах до 98,38°C стабильна ?-модификация серы (иначе эту модификацию называют ромбической), образующая лимонно-желтые кристаллы. Ее кристаллическая решетка орторомбическая, параметры элементарной ячейки a = 1,04646, b = 1,28660, c = 2,4486 нм. Плотность 2,07 кг/дм3. Выше 95,39°C стабильна ? -модификация серы (так называемая моноклинная сера). При комнатной температуре параметры элементарной ячейки моноклинной ?-S a = 1.090, b = 1.096, c = 1,102 нм, t = 83,27°. Плотность ?-S 1,96 кг/дм3.
В структурах как ?-, так и ?-модификаций серы имеются неплоские восьмичленные циклические молекулы S8. Такие молекулы немного похожи на короны.
Две эти модификации серы отличаются взаимной ориентацией молекул S8 в кристаллической решетке.
Еще одну модификацию серы -- так называемую ромбоэдрическую серу -- можно получить выливанием раствора тиосульфата натрия Na2S2O3 в концентрированную соляную кислоту при 0°C с последующей экстракцией серы толуолом. После испарения растворителя возникают ромбоэдрические кристаллы, содержащие молекулы S6 в форме кресла.
Аморфную серу (плотность 1,92 г/см3) и резиноподобную пластическую серу получают при резком охлаждении расплавленной серы (выливая расплав в холодную воду). Эти модификации состоят из нерегулярных зигзагообразных цепей Sn. При длительном выдерживании при температурах 20-95°C все модификации серы превращаются в ?-серу.
Температура плавления ромбической ? -серы 112,8°С, а моноклинной ?-серы 119,3°С. И в том, и в другом случае образуется легкоподвижная желтая жидкость, которая при температуре около 160°С темнеет; ее вязкость повышается, и при температуре выше 200°С расплавленная сера становится темно-коричневой и вязкой, как смола. Это объясняется тем, что сначала в расплаве разрушаются кольцевые молекулы S8. Возникающие фрагменты объединяются друг с другом с образованием длинных цепей S из нескольких сотен тысяч атомов. Дальнейшее нагревание расплавленной серы (выше температуры 250°C) ведет к частичному разрыву цепей, и жидкость снова становится более подвижной. На рис. показана температурная зависимость вязкости жидкой серы. Около 190°C ее вязкость примерно в 9000 раз больше, чем при 160°C.
При температуре 444,6°C расплавленная сера закипает. В зависимости от температуры в ее парах можно обнаружить молекулы S8, S6, S4 и S2. Изменение состава молекул вызывает изменение окраски паров серы от оранжево-желтого до соломенно-желтого цвета. При температуре выше 1500°C молекулы S2 диссоциируют на атомы.
Молекулы S2 парамагнитны и построены аналогично молекуле O2. Во всех других состояниях сера диамагнитна.
В воде сера практически нерастворима. Некоторые ее модификации растворяются в органических жидкостях (толуоле, бензоле) и особенно хорошо -- в сероуглероде CS2 и жидком аммиаке NH3.
Сера -- достаточно активный неметалл. Даже при умеренном нагревании она окисляет многие простые вещества, но и сама довольно легко окисляется кислородом и галогенами.
S + O2 = SO2, S + 3F2 = SF6,
2S + Cl2 = S2Cl2 (c примесью SCl2)
С водородом при нагревании сера образует сероводород H2S и в небольшом количестве сульфаны (соединения состава H2Sn):
Примеры реакций серы с металлами:
2Na + S = Na2S, Ca + S = CaS, Fe + S = FeS
Образующиеся в этих реакциях сульфиды характеризуются не постоянным, а, как правило, переменным составом. Так, состав сульфида кальция может непрерывно изменяться в границах от CaS до CaS5. Полисульфиды типа СаSn или Na2Sn при взаимодействии, например, с соляной кислотой образуют сульфаны H2S n, причем значение n может составлять от 1 до приблизительно 10.
Концентрированная серная кислота при нагревании окисляет серу до SO2:
S + 2H2SO4 = 2H2O + 3SO2
Царская водка (смесь азотной и соляной кислот) окисляет серу до серной кислоты.
Разбавленная азотная кислота, соляная кислота без окислителей и серная кислота на холоде с серой во взаимодействие не вступают. При нагревании в кипящей воде или растворах щелочей сера диспропорционирует:
3S + 6NaOH <> 2Na2S + Na2SO3 + 3H2O;
Сера может присоединяться к сульфидам
Na2S + (n-1)S = Na2Sn
Na2SO3 + S = Na2S2O3
В результате протекания данной реакции из сульфита натрия Na2SO3 образуется тиосульфат натрия Na2S2O3.
При нагревании сера реагирует почти со всеми элементами, кроме инертных газов, иода, азота, платины и золота.
Известно несколько оксидов серы. Кроме устойчивых диоксида серы SO2 [другие названия: сернистый газ, сернистый ангидрид, оксид серы (IV)] и триоксида серы SO3 [другие названия: серный газ, серный ангидрид, оксид серы (VI)], получены неустойчивые оксиды S2O (при пропускании тока SO2 через тлеющий разряд) и S8O (при взаимодействии H2S c SOCl2). Пероксиды SO4 и S2O7 образуются при пропускании SO2 в смеси с кислородом через тлеющий разряд или за счет окисления SO2 озоном.
Кислотному диоксиду серы SO2 соответствует неустойчивая кислота средней силы H2SO3 (сернистая кислота):
Н2О + SO2 <> H2SO3,
а кислотному триоксиду серы SO3-- сильная двухосновная серная кислота H2SO4:
SO3 + H2O = H2SO4
И сернистой кислоте H2SO3, и серной H2SO4 соответствуют по два ряда солей: кислые [соответственно гидросульфиты NaHSO3, Ca(HSO3)2 и др. и гидросульфаты КНSO4, NaНSO4 и другие] и средние [сульфиты Na2SO3, K2SO3 и сульфаты CaSO4, Fe2(SO4)3].
Сера входит в состав многих органических соединений (см. статьи Тиофен, Тиолы и другие).
Около половины производимой серы используется на производство серной кислоты, около 25% расходуется для получения сульфитов, 10-15% -- для борьбы с вредителями сельскохозяйственных культур (главным образом винограда и хлопчатника) (наибольшее значение здесь имеет раствор медного купороса CuSO4·5H2O), около 10% используется резиновой промышленностью для вулканизации резины. Серу применяют при производстве красителей и пигментов, взрывчатых веществ (она до сих пор входит в состав пороха), искусственных волокон, люминофоров. Серу используют при производстве спичек, так как она входит в состав, из которого изготовляют головки спичек. Серу до сих пор содержат некоторые мази, которыми лечат заболевания кожи. Для придания сталям особых свойств в них вводят небольшие добавки серы (хотя, как правило, примесь серы в сталях нежелательна).
Сера постоянно присутствует во всех живых организмах, являясь важным биогенным элементом. Ее содержание в растениях составляет 0,3-1,2 %, в животных 0,5-2 % (морские организмы содержат больше серы, чем наземные). Биологическое значение серы определяется прежде всего тем, что она входит в состав аминокислот метионина и цистеина и, следовательно, в состав пептидов и белков. Дисульфидные связи -S-S- в полипетидных цепях участвуют в формировании пространственной структуры белков, а сульфгидрильные группы (-SH) играют важную роль в активных центрах ферментов. Кроме того, сера входит в молекулы гормонов, важных веществ. Много серы содержится в кератине волос, костях, нервной ткани. Неорганические соединения серы необходимы для минерального питания растений. Они служат субстратами окислительных реакций, осуществляемых распространенными в природе серобактериями.
В организме среднего человека (масса тела 70 кг) содержится около 1402 г серы. Суточная потребность взрослого человека в сере -- около 4.
Однако по своему отрицательному воздействию на окружающую среду и человека сера (точнее, ее соединения) стоит на одном из первых мест. Основной источник загрязнения серой -- сжигание каменного угля и других видов топлива, содержащих серу. При этом около 96% серы, содержащейся в топливе, попадает в атмосферу в виде сернистого газа SO2.
В атмосфере сернистый газ постепенно окисляется до оксида серы (VI). Оба оксида -- и оксид серы (IV), и оксид серы (VI) -- взаимодействуют с парами воды с образованием кислотного раствора. Затем эти растворы выпадают в виде кислотных дождей. Оказавшись в почве, кислотные воды угнетают развитие почвенной фауны и растений. В результате создаются неблагоприятные условия для развития растительности, особенно в северных регионах, где к суровому климату добавляется химическое загрязнение. В результате гибнут леса, нарушается травяной покров, ухудшается состояние водоемов. Кислотные дожди разрушают изготовленные из мрамора и других материалов памятники, более того, они вызывают разрушение даже каменных зданий и изделий из металлов.
Поэтому приходится принимать разнообразные меры по предотвращению попадания соединений серы из топлива в атмосферу. Для этого подвергают очистке от соединений серы нефть и нефтепродукты, очищают образующиеся при сжигании топлива газы.
Сама по себе сера в виде пыли раздражает слизистые оболочки, органы дыхания и может вызывать серьезные заболевания. ПДК серы в воздухе 0,07 мг/м3.
Многие соединения серы токсичны. Особенно следует отметить сероводород, вдыхание которого быстро вызывает притупление реакции на его неприятный запах и может привести к тяжелым отравлениям даже с летальным исходом. ПДК сероводорода в воздухе рабочих помещений 10 мг/м3, в атмосферном воздухе 0,008 мг/м3.
Сера является весьма важным элементом тканей и органов организма животного. Основные её количества находятся в составе серосодержащих аминокислот (метионин, цистеин, цистин), которых сравнительно много в покровных тканях (в белках эпителия, шерсти, волос, пера, рога).
Сера является обязательным компонентом витаминов B1 и B3, сульфолипидов, таурина, гепарина, хондроитинсерной кислоты, ряда ферментов. Сера входит и в состав серной кислоты, которая в печени осуществляет функцию обезвреживания ядовитых продуктов распада аминокислот, таких как индол, скатол, крезол, фенол, переводя их в малотоксичные парные соединения.
Подобные документы
История распространения серы в природе, физические характеристики и химические свойства. Добыча и получение производных продуктов. Особенности различия сортов и сферы применения данного химического элемента в процессе жизнедеятельности человечества.
презентация [1,3 M], добавлен 20.04.2011
Физические свойства, происхождение и нахождение серы в природе. Использование в аналитической химии сульфатов бария и кальция. Получение и применение сульфида серебра, сульфата хрома, медного купороса и сероуглерода в сельском хозяйстве и промышленности.
презентация [601,7 K], добавлен 17.11.2012
Химические и физические свойства серы. История открытия вещества. Основные месторождения самородной серы, способы получения и применение, пожароопасные свойства. Взаимодействие серы с кислородом, аллотропные модификации. Особенности плавления серы.
презентация [1,7 M], добавлен 12.01.2012
Строение атома оксида серы, его молекулярная формула, валентность, тип кристаллической решетки. Нахождение в природе сернистого газа SO2. Его физические и химические свойства. Получение сернистого газа в промышленности и в лабораторных условиях.
презентация [330,6 K], добавлен 13.05.2015
Характеристика брома как химического элемента. История открытия, нахождение в природе. Физические и химические свойства этого вещества, его взаимодействие с металлами. Получение брома и его применение в медицине. Биологическая роль его в организме.
презентация [2,0 M], добавлен 16.02.2014
Медь - химический элемент I группы периодической системы Менделеева. Общая характеристика меди. Физические и химические свойства. Нахождение в природе. Получение, применение, биологическая роль. Использование соединений меди.
реферат [13,4 K], добавлен 24.03.2007
Особенности серы как химического элемента таблицы Менделеева, ее распространенность в природе. История открытия этого элемента, характеристика его основных свойств. Специфика промышленного получения и способов добычи серы. Важнейшие соединения серы.
В сельском хозяйстве молотую серу применяют в борьбе с вредителями растений: ею опыливают листья хлопчатника и виноградной лозы.
Посредством нагревания каучука с серой получают резину, из которой изготовляют покрышки, калоши, резиновые трубки и шланги.
Как горючее вещество сера (или сульфиды) входит в состав спичечных головок, в чем легко убедиться по запаху сернистого газа, появляющемуся в момент воспламенения спички.
Свободная сера входит в состав черного, или охотничьего, пороха. Больше всего сера расходуется на получение серной кислоты.
Подобно кислороду, сера встречается в природе и в виде простого вещества и в виде соединений. В Европе залежи свободной серы имеются в Западной Украине, Поволжье и Средней Азии.
Гораздо богаче недра Земли соединениями серы. К ним относятся соединения серы с разными металлами: железный колчедан, или пирит, FeS2, цинковая обманка ZnS и др. Сера встречается в природе также в виде солей серной кислоты, главным образом гипса CaSO4, 2H2O и Na2SO4 – сульфата натрия. В виде включений пирита сера обычно содержится в каменных углях. Сера принадлежит к числу элементов, без которых невозможна жизнь, так как Она входит в состав белков. Потребность растений в соединениях серы обычно обеспечивается запасом этих соединений в почве.
Сырьевая промышленность. Сера относится к числу довольно широко распространенных на земном шаре элементов. В нашей стране и за рубежом открыты богатые месторождения самородной серы, железного колчедана FeS2 и сульфата кальция CaSO4. Все эти виды ископаемого сырья используются для производства серной кислоты. Но этими видами сырья промышленность не ограничивается.
Во многих производствах образуются отходы, которые могут быть использованы для переработки в серную кислоту. Так, при получении меди из сульфидных руд их предварительно обогащают – разделяют на концентрат с относительно высоким содержанием меди и отход, содержащий железный колчедан. Экономически целесообразно использовать этот отход для получения серной кислоты взамен колчедана, специально добываемого из недр.
Сырьем для производства серной кислоты служит также и другой отход заводов цветной металлургии – сернистый газ, получающийся при обжиге сульфидных руд (первая стадия производства многих цветных металлов).
Во всех видах ископаемого топлива содержатся соединения серы. При коксовании каменных углей получается наряду с коксом коксовый газ, содержащий сероводород. Он содержится также в некоторых природных газах. Все эти газы используются как топливо и как химическое сырье, причем предварительно очищаются от сероводорода, а из сероводорода получают серную кислоту.
В России имеются все рассмотренные виды сырья для производства серной кислоты. Цеха серной кислоты расположены в различных районах страны и используют тот или иной вид сырья в соответствии с местными условиями.
Можно, однако, заметить общую тенденцию в развитии сернокислотного производства, а именно все более приобретают значение отходящие газы металлургических заводов и сероводород. Комплексное использование природных ресурсов – задача, которая стоит перед химической промышленностью и которую она успешно решает.
В периодической таблице Менделеева сера находится в VIA группе (шестая группа, подгруппа А), в третьем периоде. Она относится к немногочисленной группе неметаллов: Периодическая система насчитывает их всего 22, в том числе инертные газы. Как неметалл сера проявляет такие физические свойства: хрупкость, плохая тепло- и электропроводность, в отличие от металлов не обладает ковкостью и тягучестью. В естественных условиях она находится в твердом состоянии.
Аллотропия
Говоря о физическом состоянии серы, надо упомянуть о ее аллотропии, то есть о существовании нескольких форм в одном физическом состоянии. У серы есть 5 таких форм или аллотропов. Это связано со способностью серы создавать устойчивые ряды из ее атомов. Такие молекулы S8 имеют форму короны и образуют аллотропы: ромбическую и моноклинную серу - кристаллическую хрупкую желтую. Молекулы S6 и S4 – пластическую серу - вязкую, коричневую, получаемую при нагревании кристаллической серы до температуры выше 120 градусов.
Химические свойства
Сера обладает окислительными свойствами. С щелочными металлами она вступает в реакцию при обычной температуре. С остальными, кроме золота и платины, при повышении температуры. С неметаллами, такими как водород, углерод, фосфор, у серы также получаются бинарные соединения (это соединения, образующиеся в результате связывания двух элементов). Эти бинарные соединения называются сульфидами. Сероводород - H2S – является слабой сероводородной кислотой. Сульфиды металлов являются ее солями.
Когда сера встречает более сильный окислитель, чем она сама, то проявляет восстановительные свойства, например, с кислородом, хлором (и другими галогенами, кроме йода), сильными кислотами.
Сера выступает в качестве окислителя и восстановителя одновременно в реакции диспропорционирования. При этой реакции образуются соединения, содержащие разные степени окисления одного и того же элемента.
История применения серы человеком
Сегодня половина добываемой серы идет на производство серной кислоты, крайне необходимой в химической промышленности. Сера и соединения серы применяются в производстве резины, бумаги, лекарств, тканей, пластмасс, краски, удобрений, ядохимикатов и многих других вещей.
Где содержится сера в природе
В чистом виде сера добывается в местах с вулканической активностью, но не только. На планете есть также месторождения сульфидов: железный и медный колчедан, киноварь, и сульфатных соединений: гипс, ангидрит, сульфат магния, сульфат натрия и другие. Соединения серы могут содержаться в нефти и природном газе. Сера встроена в состав белка.
4, 9 класс по химии

Конный спорт был основан еще в средневековье во время проведения Олимпийских игр, которые могли грозить жизни человека. Суть данного соревнования заключалась в гонке на колеснице на которой стоял римлянин, кто приедет первым – тот победит.
Корова относится к травоядным животным. В холодное время года, корову можно прокормить благодаря зерновым культурам, а также кукурузе. А вот летом, взрослое животное может съесть не меньше 45 кг травы. Если корова относится к молочной породе,
Лама - одомашненное животное, которое относится к семейству верблюдовых. Первые, кто приручил лам были индейцы. Долгое время до того, как завезли в Южную Америку лошадей, их использовали для транспортировки груза.

Чистая желтая сера
Сера — минерал из класса самородных элементов. Сера представляет собой пример хорошо выраженного энантиоморфного полиморфизма. В природе образует 2 полиморфные модификации: a-сера ромбическая и b-сера моноклинная. При атмосферном давлении и температуре 95,6°С a-сера переходит в b-серу. Сера жизненно необходима для роста растений и животных, она входит в состав живых организмов и продуктов их разложения, ее много, например, в яйцах, капусте, хрене, чесноке, горчице, луке, волосах, шерсти и т.д. Она присутствует также в углях и нефти.
Смотрите так же:
СТРУКТУРА
Кристаллическая структура и две сингонии серы
СВОЙСТВА

Самородная сера жёлтого цвета, при наличии примесей – жёлто-коричневая, оранжевая, бурая до чёрной; содержит включения битумов, карбонатов, сульфатов, глины. Кристаллы чистой серы прозрачны или полупрозрачны, сплошные массы просвечивают в краях. Блеск смолистый до жирного. Твердость 1-2, спайности нет, излом раковистый. Плотность 2,05 -2,08 г/см 3 , хрупкая. Легко растворима в канадском бальзаме, в скипидаре и керосине. В HCl и H2SO4 нерастворима. HNO3 и царская водка окисляют серу, превращая её в H2SO4. Сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов.
Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую). Формулу серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами.
Плавление серы сопровождается заметным увеличением объёма (примерно 15 %). Расплавленная сера представляет собой жёлтую легкоподвижную жидкость, которая выше 160 °C превращается в очень вязкую тёмно-коричневую массу. Наибольшую вязкость расплав серы приобретает при температуре 190 °C; дальнейшее повышение температуры сопровождается уменьшением вязкости и выше 300 °C расплавленная сера снова становится подвижной. Это связано с тем, что при нагревании серы она постепенно полимеризуется, увеличивая длину цепочки с повышением температуры. При нагревании серы свыше 190 °C полимерные звенья начинают рушиться.
Сера может служить простейшим примером электрета. При трении сера приобретает сильный отрицательный заряд.
МОРФОЛОГИЯ

Образует усечённо-дипирамидальные, реже дипирамидальные, пинакоидальные или толстопризматические кристаллы, а также плотные скрытокристаллические, сливные, зернистые, реже тонковолокнистые агрегаты. Главные формы на кристаллах: дипирамиды (111) и (113), призмы (011) и (101), пинакоид (001). Также сростки и друзы кристаллов, скелетные кристаллы, псевдосталактиты, порошковатые и землистые массы, налёты и примазки. Для кристаллов характерны множественные параллельные срастания.
ПРОИСХОЖДЕНИЕ

Сера образуется при вулканических извержениях, при выветривании сульфидов, при разложении гипсоносных осадочных толщ, а также в связи с деятельностью бактерий. Главные типы месторождений самородной серы – вулканогенные и экзогенные (хемогенно-осадочные). Экзогенные месторождения преобладают; они связаны с гипсо-ангидритами, которые под воздействием выделений углеводородов и сероводорода восстанавливаются и замещаются серно-кальцитовыми рудами. Такой инфильтрационно-метасоматический генезис имеют все крупнейшие месторождения. Самородная сера часто образуется (кроме крупных cкоплений) в результате окисления H2S. Геохимические процессы её образования существенно активизируются микроорганизмами (сульфатредуцирующими и тионовыми бактериями). Сопутствующие минералы – кальцит, арагонит, гипс, ангидрит, целестин, иногда битумы. Среди вулканогенных месторождений самородной серы главное значение имеют гидротермально-метасоматические (например, в Японии), образованные сероносными кварцитами и опалитами, и вулканогенно-осадочные сероносные илы кратерных озёр. Образуется также при фумарольной деятельности. Образуясь в условиях земной поверхности, самородная сера является всё же не очень устойчивой и, постепенно окисляясь, даёт начало сульфатам, гл. образом гипсу.
Используется в производстве серной кислоты (около 50% добываемого количества). В 1890 г. Герман Фраш предложил плавить серу под землёй и извлекать на поверхность через скважины, и в настоящее время месторождения серы разрабатывают главным образом путём выплавки самородной серы из пластов под землёй непосредственно в местах её залегания. Сера также в больших количествах содержится в природном газе (в виде сероводорода и сернистого ангидрида), при добыче газа она откладывается на стенках труб, выводя их из строя, поэтому её улавливают из газа как можно быстрее после добычи.
ПРИМЕНЕНИЕ

Сера входит в состав спичечной головки
Примерно половина производимой серы используется в производстве серной кислоты. Серу применяют для вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона. Сера находит применение для производства пиротехнических составов, ранее использовалась в производстве пороха, применяется для производства спичек.
Читайте также:

