Производство серной кислоты презентация и доклад
Обновлено: 17.05.2024
Загрузить презентацию (387 кБ)
В современном мире неуклонно возрастает антропогенное и техногенное воздействие на биосферу. Поэтому перед человеческим обществом стоит задача рационального и продуманного формирования техносферы, которая обеспечивала бы приемлемые для человека и природных экосистем условия существования. Это очень трудная задача, решение которой могут найти только грамотные, думающие люди. Воспитание таких людей и есть основная задача школы в условиях введения ФГОС. Необходимо научить подрастающее поколение мыслить экологично, экономично и научно, а так же применять полученные знания в жизни.
Изучение химических производств на уроках химии даёт возможность показать связь между теорией и практическим применением знаний по предмету.
Так при изучении производства серной кислоты учащиеся знакомятся с общенаучными принципами организации производства:
а) увеличение поверхности реагирующих веществ,
б) теплообмен,
в) противоток,
г) циркуляция реагирующих веществ,
д) изменение скорости и направления химических реакций (использование катализатора, оптимальных температур, давления и концентрации).
Все перечисленные общие принципы современных химических производств основываются на закономерностях химических процессов, изучаемых в курсе химии средней школы. Поэтому учитель на примерах отдельных химических производств должен знакомить учащихся, как с научными принципами производств, так и с лежащими в их основе теориями и химическими закономерностями.
В части описания химического производства серной кислоты материал учебника недостаточен и поэтому большую роль играет использование презентации по теме.
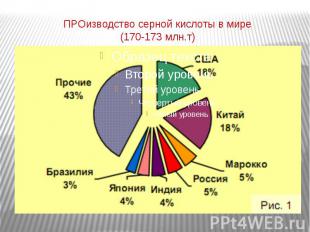
В самом начале презентации показано значение производства серной кислоты и доля расхода серной кислоты в различных отраслях химической промышленности (СЛАЙД 2).
Далее предлагается план изучения производства (СЛАЙД 3). Этот слайд призван акцентировать внимание учащихся на наиболее важные моменты при изучении химического производства.
В данной презентации не дается полная характеристика сырья для производства серной кислоты, а лишь приводятся иллюстрации различных видов сырья и их химические формулы (СЛАЙД 4).
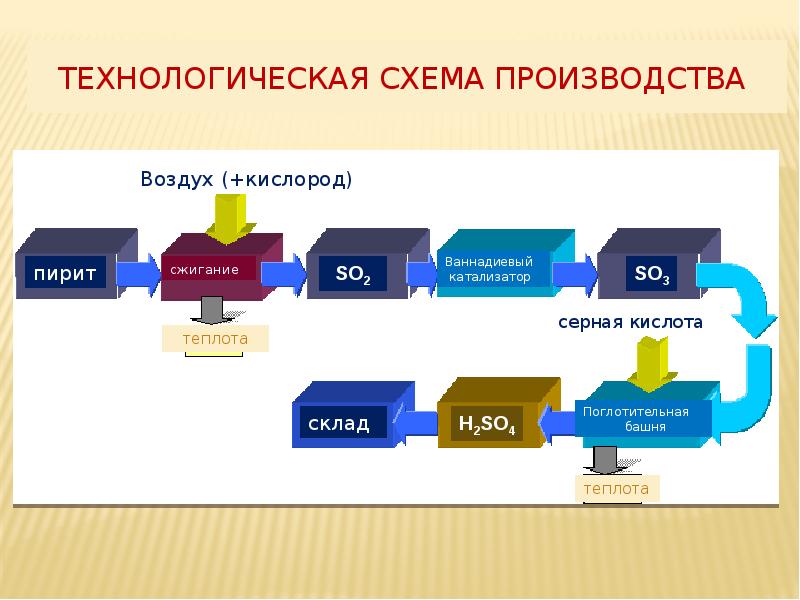
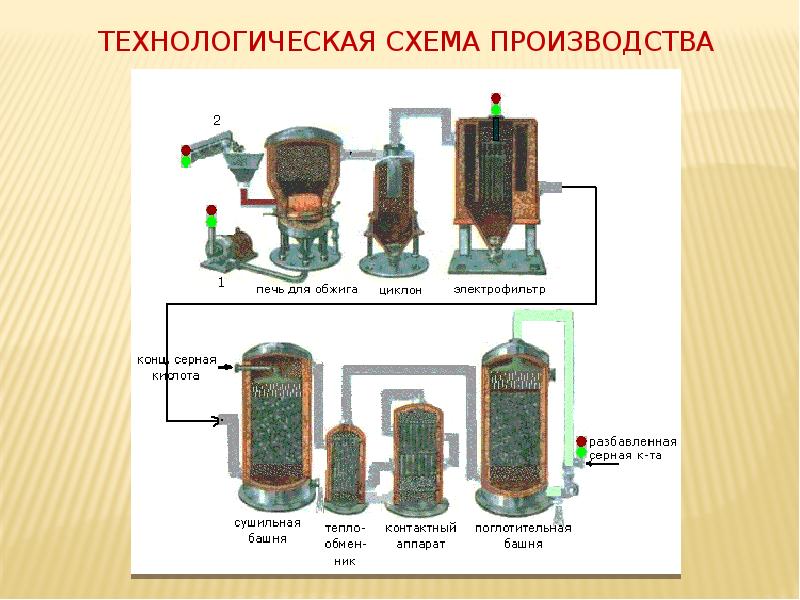
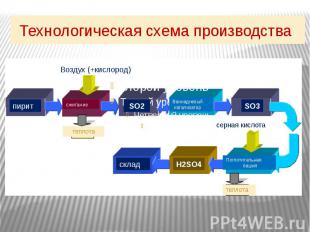
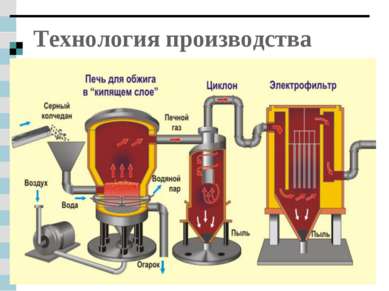
На следующем слайде приводится общая схема производства серной кислоты (СЛАЙД 5). Данная схема поможет учащимся проследить последовательность превращений от сырья до конечного продукта.
Далее в презентации следует краткая характеристика основных и промежуточных стадий производства (СЛАЙДЫ 6-10). На слайдах приводятся иллюстрации аппаратов, которые в учебнике, к сожалению, отсутствуют.
Так как транспортировка олеума вопрос непростой из-за высокой активности вещества, то при рассмотрении производства следует и на это обратить внимание (СЛАЙД 11). Здесь логично будет активизировать знания учащихся о взаимодействии концентрированной серной кислоты с различными металлами.
В завершении изучения производства серной кислоты обязательно стоит обратить внимание на экологические проблемы, возникающие при данном производстве (СЛАЙД 12). На уроке можно лишь перечислить эти проблемы, а более подробное их описание дать учащимся для самостоятельного изучения дома.
Данная презентация поможет учителю в изложении непростого вопроса химического производства серной кислоты и поможет расставить акценты на самые важные моменты при изучении любого производства в дальнейшем.
Как показывает практика, использование презентации на уроке всегда способствует повышению интереса учащихся к изучаемому вопросу. И даже дети с невысокой учебной мотивацией способны усвоить сложный материал, изложенный в доступной, иллюстративной форме.
Вы можете изучить и скачать доклад-презентацию на тему Производство серной кислоты. Презентация на заданную тему содержит 23 слайдов. Для просмотра воспользуйтесь проигрывателем, если материал оказался полезным для Вас - поделитесь им с друзьями с помощью социальных кнопок и добавьте наш сайт презентаций в закладки!















Исходное сырье Сырьё – исходный материал для производства промышленных продуктов. В мире 75% получают из серы. В России 60% получают из серы. В Японии 60% из отходящих газов.
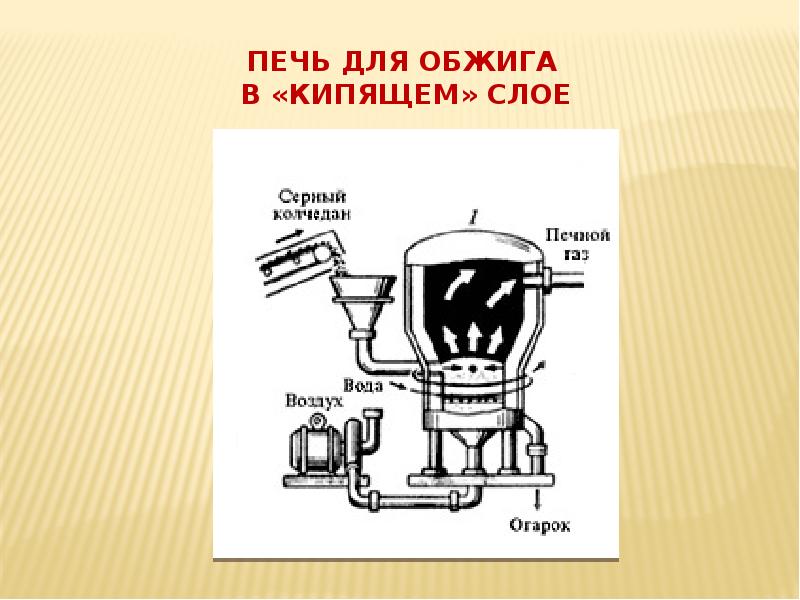
Технология – наука о наиболее экологичных способах и процессах получения сырья, полупродуктов и продуктов. I стадия Обжиг сырья (пирита) и получение оксида серы SO2. 4FeS2+11O2=2Fe2O3+8SO2 + Q (минерал пирит.) Характеристика реакции: экзотермическая, необратимая, окислительно-восстановительная.
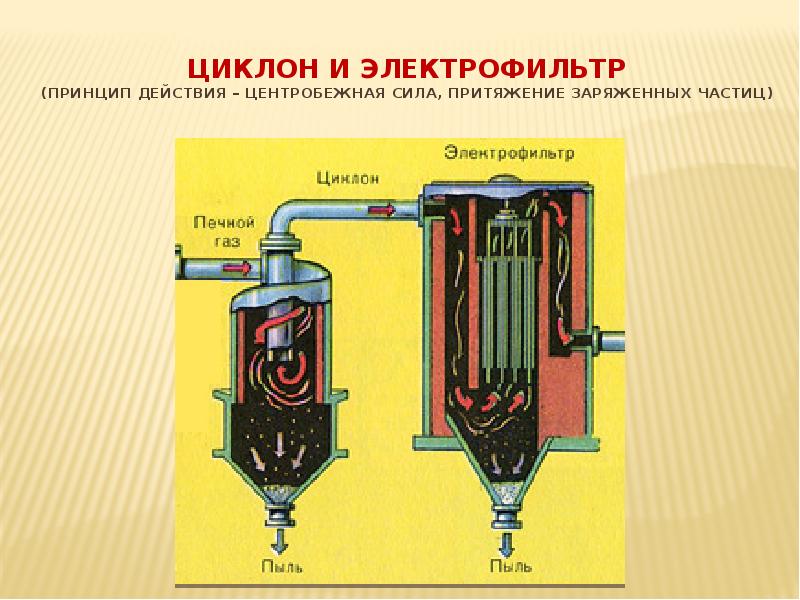
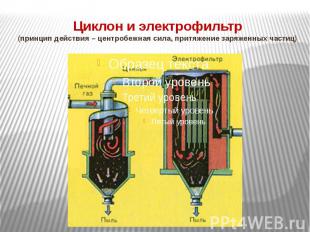
Подготовка сырья для II стадии (циклон, электрофильтр, сушильная башня) Прежде чем приступить ко II стадии SO2 очищают от пыли: 1. “Циклон” – от крупных частиц пыли. 2. Электрофильтр – от мелких частиц пыли Осушить в сушильной башне Нагреть до t=4000 в теплообменнике

№ слайда 1

№ слайда 2

№ слайда 3

№ слайда 4
Исходное сырье Сырьё – исходный материал для производства промышленных продуктов. В мире 75% получают из серы. В России 60% получают из серы. В Японии 60% из отходящих газов.
№ слайда 5
Технологическая схема производства

№ слайда 6
Технология – наука о наиболее экологичных способах и процессах получения сырья, полупродуктов и продуктов. I стадия Обжиг сырья (пирита) и получение оксида серы SO2. 4FeS2+11O2=2Fe2O3+8SO2 + Q (минерал пирит.) Характеристика реакции: экзотермическая, необратимая, окислительно-восстановительная.

№ слайда 8

№ слайда 10
Подготовка сырья для II стадии (циклон, электрофильтр, сушильная башня) Прежде чем приступить ко II стадии SO2 очищают от пыли: 1. “Циклон” – от крупных частиц пыли. 2. Электрофильтр – от мелких частиц пыли Осушить в сушильной башне Нагреть до t=4000 в теплообменнике
№ слайда 11
Циклон и электрофильтр (принцип действия – центробежная сила, притяжение заряженных частиц)

№ слайда 12
Сушильная башня (принцип действия – поглощение воды концентрированной серной кислотой)

№ слайда 13
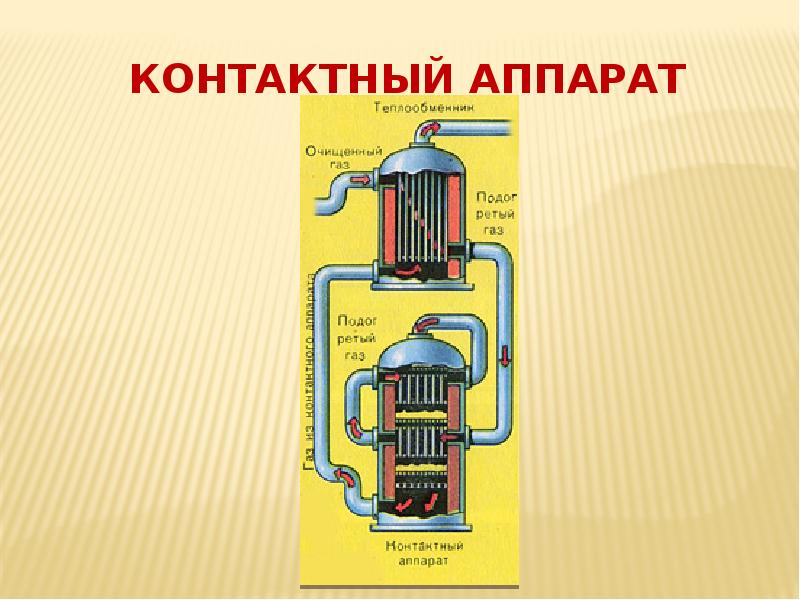
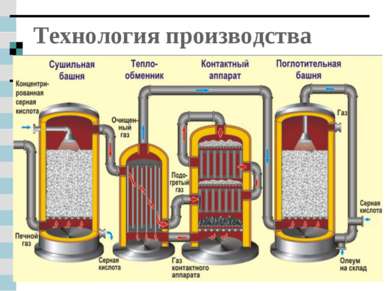
Принципы II стадии (контактный аппарат) 2 SO2 + O2 ↔ 2 SO3 + Q (обратимая, каталитическая, экзотермическая) 1. Понижают температуру от 6000С до 4000С. 2. Катализатор V2O5 на керамике. 3. Противоточное движение. 4. Теплообмен. Выход продукта 99,2%

№ слайда 14

№ слайда 15
III Стадия (поглотительная башня) SO3+H2O=H2SO4+Q (до 3000C) Увеличивают площадь соприкосновения (керамические кольца Рашига) Отводят продукты реакции Орошают 98% серной кислотой, образуется олеум(раствор SO3 в H2SO4)

№ слайда 16

№ слайда 17
Технологическая схема производства

№ слайда 18
Транспортировка и хранение серной кислоты Транспортируют в железнодорожных и автоцистернах из кислотостойкой стали Хранят в герметически закрытых емкостях из полимера или нержавеющей стали, покрытой кислотоупорной плёнкой
№ слайда 19
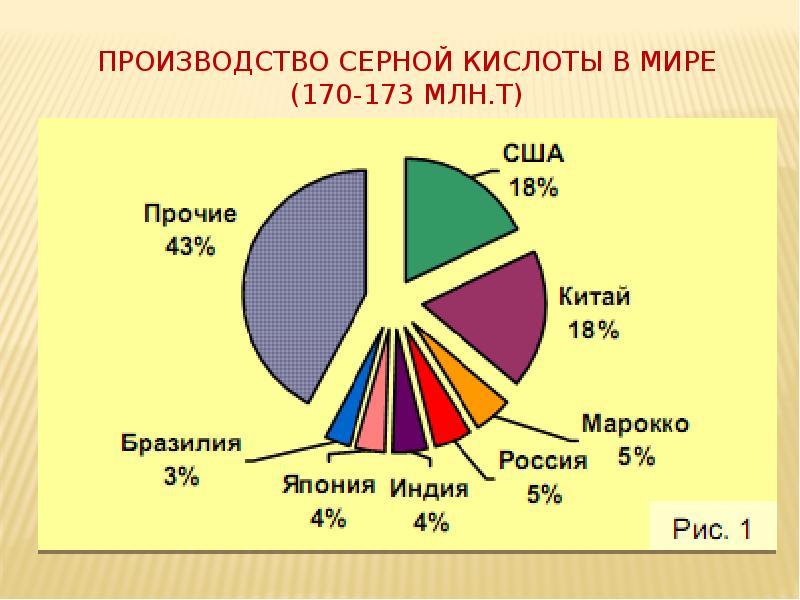
ПРОизводство серной кислоты в мире (170-173 млн.т)
№ слайда 20
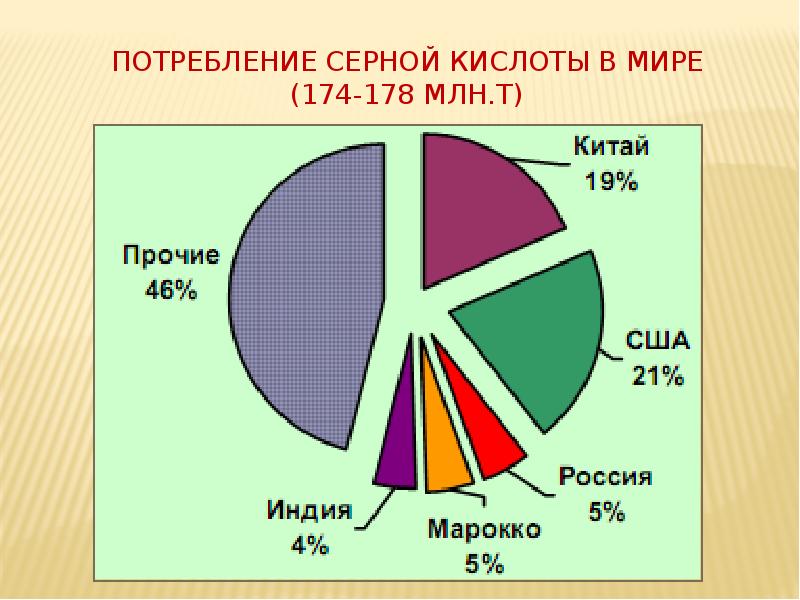
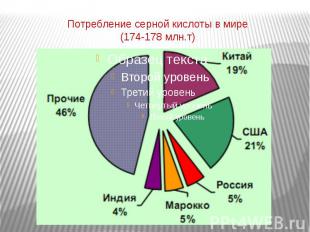
Потребление серной кислоты в мире (174-178 млн.т)

№ слайда 21
потребление серной кислоты 1. Производство минеральных удобрений. 2. Производство сульфатов (солей серной кислоты). 3. Производство синтетических волокон. 4. Черная и цветная металлургия. 5. Производство органических красителей. 6. Спирты, кислоты, эфиры(орг. вещества). 7. Пищевая промышленность(патока, глюкоза), эмульгатор (загуститель) Е513. 8. Нефтехимия(минеральные масла). 9. Производство взрывчатых веществ.

№ слайда 22
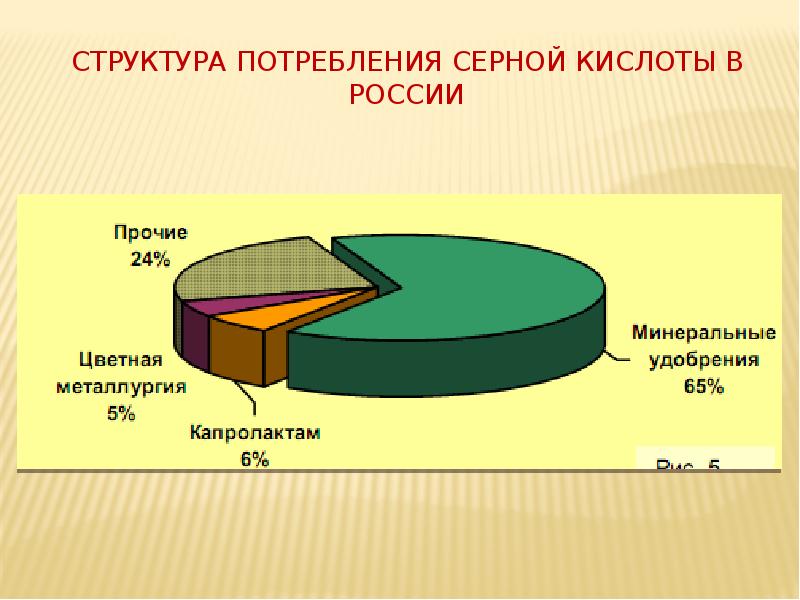
Структура потребления серной кислоты в России

№ слайда 23

Производство серной кислоты H2SO4 МОУ Навлинская СОШ №1 Учитель химии Кожемяко Г.С.

Сырьё FeS2 - пирит, серный колчедан, железный колчедан S8 самородная ромбическая сера H2S – сероводород Сu2S; ZnS; PbS – сульфиды цветных металлов CaSO4*2H2O – гипс
Технология производства
Технология производства
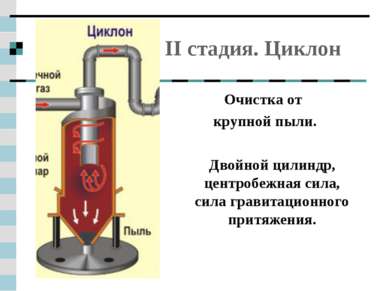
II стадия. Циклон Очистка от крупной пыли. Двойной цилиндр, центробежная сила, сила гравитационного притяжения.
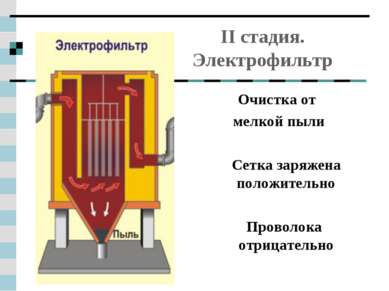
II стадия. Электрофильтр Очистка от мелкой пыли Сетка заряжена положительно Проволока отрицательно
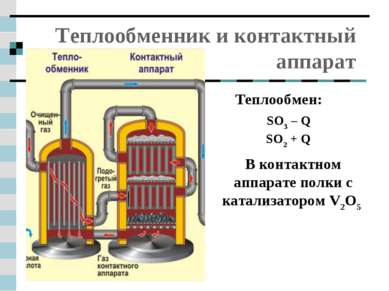
Теплообменник и контактный аппарат Теплообмен: SO3 – Q SO2 + Q В контактном аппарате полки с катализатором V2O5

III стадия. Окисление оксида серы (IV) в оксид серы (VI) 2 SO2(г) + O2(г) 2 SO3(г) + Q Соединения Экзотермическая Гомогенная Каталитическая Обратимая Окислительно-восстановительная V2O5
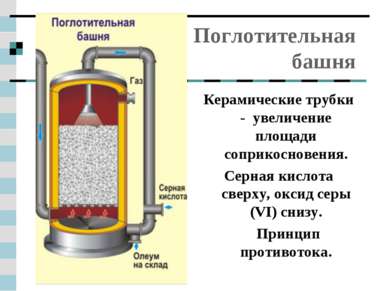
Поглотительная башня Керамические трубки - увеличение площади соприкосновения. Серная кислота сверху, оксид серы (VI) снизу. Принцип противотока.
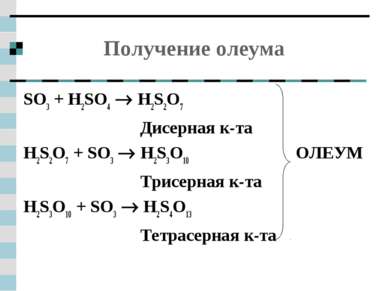
Получение олеума SO3 + H2SO4 H2S2O7 Дисерная к-та H2S2O7 + SO3 H2S3O10 ОЛЕУМ Трисерная к-та H2S3O10 + SO3 H2S4O13 Тетрасерная к-та

IV стадия. Поглощение оксида серы (VI) водой SO3(г) + Н2О(ж) Н2SO4(ж) + Q Соединения Экзотермическая Гетерогенная Некаталитическая Необратимая Без изменения степеней окисления
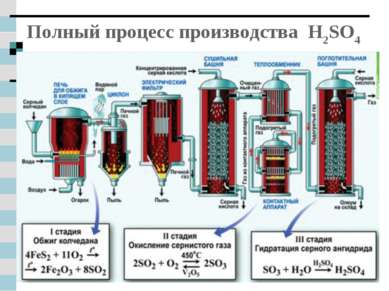
Полный процесс производства H2SO4
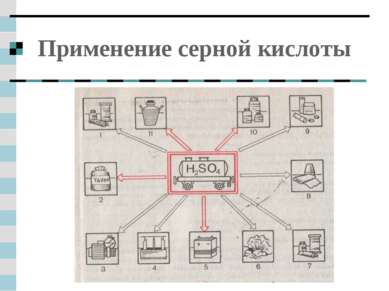
Применение серной кислоты

Профессии работников сернокислотного производства Инженер – технолог. Аппаратчик. Лаборант – аналитик.
Читайте также:

