Математика в онкологии доклад
Обновлено: 05.07.2024
Ученые НИУ ВШЭ разработали новую математическую модель, описывающую развитие рака молочной железы, которая способна предсказать время появления метастазов.
Алексей Незнанов , старший научный сотрудник Международной научно-учебной лаборатории интеллектуальных систем и структурного анализа НИУ ВШЭ.
Элла Тюрюмина , стажер-исследователь Международной научно-учебной лаборатории интеллектуальных систем и структурного анализа НИУ ВШЭ.
Двойной удар по опухоли
Персонализированная медицина — это модель организации врачебной помощи, когда лечение выбирается с учетом генетических, физиологических, биохимических и прочих особенностей конкретного пациента. А онкология — одна из отраслей медицины, где персонализированный подход наиболее востребован и применяется чаще всего.
Рассчитать невидимое
Незнанов и Тюрюмина поставили перед собой цель — оптимизировать прогнозирование развития опухолевого процесса с использованием оригинальной математической модели роста РМЖ. При этом ученые хотели:
Математики НИУ ВШЭ предложили новую Объединённая модель, основанную на экспоненциальной модели роста, и состоящую из системы детерминированных линейных и нелинейных уравнений. Базой для ее построения стала информация по математическому моделированию РМЖ, представленная в мировой литературе с 1930 по 2014 год.
Для применения Объединенной модели на практике было создано оригинальное программное средство. Оно разработано на языке С++ в качестве фундамента для дальнейших исследований в области моделей развития РМЖ. Так, для последующего уточнения прогнозирования жизни больных РМЖ предусмотрено простое добавление новых параметров модели. Программное средство интегрировано с базой данных, накапливающей исходные данные и результаты прогнозирования. Минимальными исходными данными являются всего два измерения первичной опухоли.
Таким образом, сама модель и реализующее ее программное средство позволяют повысить точность прогноза развития РМЖ, что, в свою очередь, поможет оптимизировать проведение диагностики вторичных метастазов.
Выявить взаимосвязь между математикой и проблемой рака.
Задачи исследования:
- Выяснить, были ли в истории попытки связать математику с медициной.
- Исследовать зарождение математики как способ борьбы с раком.
- Узнать были ли случаи победы над раком с помощью математики.
Гипотезы:
- С помощью математики можно узнать причины образования опухолей.
- Использование математических моделей позволяет лучше проанализировать огромные объемы накопленных данных.
- Раковые заболевания можно вылечить с помощью математических моделей.
Этапы исследования:
- Изучить научную литературу.
- Выполнить опрос.
- Найти ответы на интересующие вопросы.
- Подвести итог.
Введение:
Такой болезнью, как рак – не хвастаются. Всем известно об этой страшной патологии. Но еще страшней тот факт, что она стала намного масштабней. За последние пят лет можно проследить определенные тенденции патологии к увеличению. За несколько последних лет число онкологических патологий значительно возросло в бедных африканских странах, в Восточной Азии и России. В рамках нашей страны наибольший процент онкологии фиксируется в регионах с сильно развитой промышленностью, что обуславливается недостаточной экологией.
Зачем нужна математика?

Математика — наука о количественных отношениях и пространственных формах, абстрагируемых от конкретного содержания, разработала и применила на деле конкретные методы отвлечения формы от содержания и сформулировала правила рассмотрения формы как самостоятельного объекта в виде чисел, величин, множеств и математических структур. Именно это позволяет глубже выявлять скрытные логические связи между объектами, от которых абстрагирована форма, вычленять исходные положения, давать точные формулировки и строгие суждения. Математика дает образец дедуктивного мышления и построения теории.
Подробнее о математическом исследовании рака и о математических моделях мы рассмотрим в
Математическое изучение рака: опухоли в компьютере:
Математическое изучение раковых заболеваний проводится с использованием математических моделей и компьютерного моделирования. Математика при этом, во-первых, помогает выдвигать новые гипотезы о причинах образования опухолей, а во-вторых, использование математических моделей позволяет лучше проанализировать огромные объемы накопленных экспериментальных и клинических данных.
Математика и новые пути исследования:
В 2005 году исследователь Антонио Бру из мадридского университета Комплутенсе предположил, что на поздних стадиях раковые заболевания можно излечивать, вызывая сильное и продолжительное воспаление тканей вокруг опухоли. Эта гипотеза стала результатом математических исследований роста раковых клеток. В ходе исследований было отмечено, что рост всех клеток подчиняется одной схеме, которую Бру назвал схемой универсальной динамики роста опухолей. В этой модели клетки на границе опухоли играют определяющую роль в методе лечения, предложенном Бру. Первоначальное скептическое отношение к гипотезе отчасти было вызвано тем, что использованная математическая модель отличалась от классических моделей раковых заболеваний. Во-первых, в ней предполагалось, что рост клеток подчиняется не экспоненциальному, а линейному закону, а во-вторых, считалось, что рост опухоли зависит не от количества питательных веществ, а от свободного пространства. Это прекрасный пример того, как математика подсказывает исследователям новые пути лечения рака
Так же следует отметить ученого Сехё Цой. Он в месте со своими коллегами разработал математическую модель развития раковой опухоли. Учеными были детально проанализированы изображения раковых опухолей и питающих их сосудов. Получившиеся в ходе исследования результаты были подставлены в математические уравнения, описывающие достаточно сложное взаимодействие между раковыми и здоровыми клетками и окружающими их кровеносными сосудами. В конечном итоге появилась математическая модель, которая способна предсказать вероятностные границы роста раковой опухоли на основе распространения кровеносных сосудов вокруг нее. Несмотря на то, что исследования проводились на мышах, полученные результаты оказались очень точными.

Функция Гомпертца:
В 1964 году исследователь по фамилии Лэйрд заметил, что размножение раковых клеток в опухолях определенного типа описывается функцией Гомпертца. Функцию Гомпертца первыми применили страховые компании. Основная ее идея заключается в том, что с увеличением возраста уровень смертности возрастает в геометрической прогрессии. Если мы используем функцию в ином контексте, в частности применительно к раковым заболеваниям Эта функция весьма схожа с сигмоидой (логистической функцией): рост опухоли замедлен в начале и конце процесса. Замедление в конце процесса кажется очевидным, если учесть, что по мере роста опухоли клетки, расположенные внутри нее, получают меньше кислорода, отмирают и вызывают некроз ядра опухоли. В результате ее размер стабилизируется: рост внешней части уравновешивается отмиранием клеток во внутренней части.

Опрос:
Я провела опрос, чтобы узнать, знают ли люди, что математика очень важна в медицине, не только как способ дозирования лекарства, но и как помощь в исследовании серьезных заболеваний.
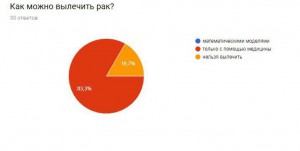
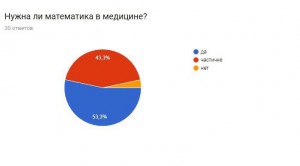
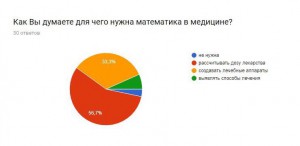
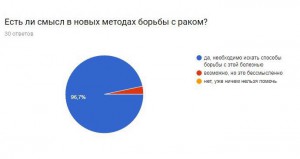
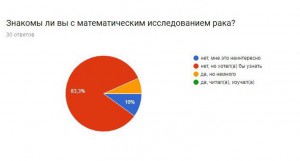
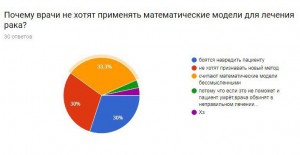
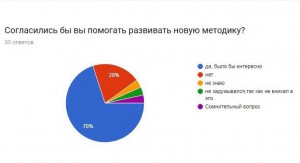
Итоги:
В результате получаем, что большинство опрошенных не знают о новых методиках, но им эта тема интересна. Они согласны с тем, что нужно искать новые методы борьбы с раком и необходимо проводить опыты и развивать математику, как лекарство.
Математическое моделирование:
Историческая хронология:
Кто был основателем? Кто проводил математическое исследование рака? Когда зародилась биоматематика? Давайте заглянем в историю развития методики, где найдем ответы на все вопросы.
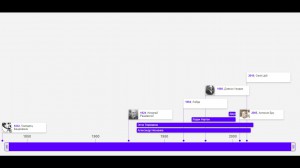
Опыты и исследования:
По словам экспертов, в ходе осуществления дополнительных наблюдений врачи смогли рассчитать, какой из способов современной терапии является более эффективным для той или иной категории пациентов.В процессе реализации проектов научные работники улучшили результативность оказания медицинской помощи больным, страдающим острым лимфобластным лейкозом. Следует заметить, что анализируя персональные данные и сведения о состоянии здоровья детей, специалисты рассчитали, какой из методов лечения будет самым правильным и эффективным. Во время осуществления исследований авторы проектов установили, почему отдельные препараты или отдельные типы терапий действуют лучше, чем другие. В процессе проведения испытаний у медиков возник вопрос, как результат экспериментов зависит от физиологических свойств пациента.В качестве базы в опытах были задействованы 1773 добровольца. Возраст всех испытуемых составил до 18 лет. Научные работники анализировали влияние пола и диагноза на ход лекарственной терапии. Математическое моделирование позволило найти связь между комбинациями определенных признаков и эффективностью предложенного способа терапии.

Победа над раком:

- Утверждается, что принявший участие в эксперименте больной страдал от рака печени в терминальной стадии. Исследовав конкретную опухоль, ученые вывели уравнение, решение которого предполагало повышение активности нейтрофилов — разновидности полиморфоядерных лейкоцитов, участвующих в работе иммунной системы человека. Предпринятая в отношении пациента терапия дала немедленныйположительный результат без каких бы то ни было побочных эффектов, в результате чего было отмечено полное выздоровление больного и восстановление трудоспособности.
Вывод:
Мы узнали, что не раз была установлена взаимосвязь математики с медициной. Многие ученые обращались за помощью к математики. Испытания комплексной математической модели в реальных клинических условиях показали высокие результаты. Однако, это только первый шаг в создании комплексной модели. Исследователи планируют провести массовые испытания для получения достаточного количества статистических данных, которые позволят значительно повысить точность моделирования, а также расширить область применения модели на все виды онкологических заболеваний. Необходимо развивать новую методику. ведь возможно именно она станет основным лекарством от рака.
Исследование Интергруппы INT 9741, опубликованное в настоящем номере Journal of Clinical Oncology Цитроном и соавт.[1], было начато в 1999 г. с целью испытать две новые концепции, основанные на математических моделях кинетики роста опухолевых клеток. Эти модели были сформулиро- ваны Нортоном [2] 15 лет тому назад. В соответствии с первой концепцией, увеличение плотности дозы при химиотерапии, т.е. проведение химиотерапии при сокращении сроков между курсами, повышает шансы уничтожения опухоли. Вторая концепция относится к проблеме гетерогенной чувствительности к лекарственным препаратам за счет использования последовательных плотнодозных, не дающих перекрестной резистентности индивидуальных препаратов или схем. Интересно видеть, как эта элегантная математическая модель материализуется, по крайней мере, отчасти, в форме положительных результатов рандомизированного клинического испытания.
Первый вопрос, который возникает при этом, заключается в том, почему для того, чтобы привнести эту интересную концепцию в клинику, потребовалось 15 лет. Конечно, одной из проблем был вопрос о безопасности плотнодозной химиотерапии, и это потребовало проведения ряда маломасштабных исследований, успех которых был в огромной степени основан на применении в клинике гранулоцитных колониестимулирующих факторов. При использовании таких ростовых факторов оказалось возможным проводить химиотерапию в соответствии с графиком в условиях низкого процента фебрильной нейтропении 11. В то же самое время значительная часть энергии онкологического сообщества на протяжении последних двух десятилетий была направлены на вопросы, связанные с конкретными лекарственными препаратами, тогда как большинство других ключевых переменных химиотерапии, которые могли иметь исключительную важность, например, вопрос о времени проведения химиотерапии по отношению к резекции опухоли и началу эндокринного лечения, продолжительность химиотерапии и, наконец, график применения лекарственных препаратов, игнорировались.
КАКОВЫ СИЛЬНЫЕ СТОРОНЫ ИСПЫТАНИЯ INT 9741, ПОМИМО ЕГО МАТЕМАТИЧЕСКОЙ ОСНОВЫ
Схема испытания почти не оставляет места для критики. Было уделено тщательное внимание вопросу о контроле над всеми четырьмя группами испытания в отношении применявшихся агентов (доксорубицин, циклофосфамид и паклитаксел), а также общей использованной дозы, в результате для анализа остаются лишь те переменные, которые представляют интерес для исследователей. Возможные взаимодействия между химиотерапией, с одной стороны, и лучевой терапией или адъювантным применением тамоксифена, с другой, были устранены за счет того, что эти другие формы лечения были отложены на период времени после завершения программы химиотерапии. В испытании использовалась факторная схема 2х2, позволившая ответить одновременно на два вопроса при условии, что между группами лечения отсутствует взаимодействие. Исследование было спланировано так, чтобы обеспечить надлежащую разрешающую способность, которая позволила бы выявить 33%-ное различие риска по поводу каждого из двух основных эффектов, а именно времени бессимптомного выживания и времени общего выживания.
Проведение испытания было вполне удовлетворительным. Лечение по протоколу не получало менее 2% рандомизированных больных; они были исключены из анализа, что обычно не делается при использовании принципа учета всего числа включенных больных. Маловероятно, однако, что включение нелеченых больных привело бы к иному результату. Наконец, согласно детальному анализу токсичности, проведенному для контингента, принимавшего участие в испытании, лишь у небольшого процента больных потребовалось снизить дозу или отсрочить применение одного или нескольких назначенных препаратов.
ИМЕЮТСЯ ЛИ СЛАБЫЕ СТОРОНЫ В ОПУБЛИКОВАННОМ ОТЧЕТЕ ОБ ИСПЫТАНИИ INT 9741
На данный вопрос следует дать положительный ответ. Опубликованные данные следует по-прежнему считать неокончательными, как в плане эффективности, так и в плане безопасности. Хотя результаты в отношении первых двух лет после рандомизации носят стабильный характер, отношения риска (ОР) как отношении рецидивов (ОР=0,74; p=0,010), так и в отношении летального исхода (ОР=0,69; p=0,013), вероятно, изменятся после того, как будет накоплена информация по значительно большему количеству событий в ходе последующего длительного наблюдения.
Исследование, очевидно, не обладает достаточной разрешающей способностью для индивидуального сравнения четырех групп лечения, и таких сравнений не следует проводить или следует рассматривать их результаты с чрезвычайной осторожностью. Однако вызывает определенную озабоченность, что последовательная схема один раз в три недели дает худшие результаты по сравнению со стандартной американской схемой применения доксорубицина (А) в сочетании с циклофосфамидом (С) с последующим применением паклитаксела (Т) один раз в три недели (АС® Т). Это указывает на возможность, что терапевтические преимущества, достигающиеся за счет перехода от существующей стандартной схемы на любую из плотнодозных схем, могут быть меньшими по сравнению с теми, на которые указывает анализ основных эффектов исследования 2х2.
Данные по токсичности до настоящего момента носили довольно спокойный характер. Нет указаний на повышение частоты кардиотоксических эффектов или вторичных лейкозов при использовании плотнодозных схем. Однако окончательная оценка процента лейкозов может потребовать дополнительных лет наблюдения, и для четкой оценки кардиологического риска также могут потребоваться длительные сроки наблюдения, превышающие 5 лет.
Можно высказать сожаление об отсутствии проведения оценки качества жизни среди больных, включенных в испытание INT 9741. Такие данные могли бы придать дополнительную ценность традиционному способу описания побочных эффектов лечения, усилить представление о том, что женщины при плотнодозном лечении чувствуют себя лучше. Возможно, что это также могло подчеркнуть тонкие различия между группой, в которой индивидуальные препараты применялись последовательно в плотнодозном режиме, и группой, где в плотнодозном режиме использовались комбинации.
Поскольку испытание INT 9741 дало положительный ответ на первый из поставленных вопросов, а именно на вопрос о превосходстве ускоренной химиотерапии по сравнению с химиотерапией, проводимой в обычном масштабе времени, анализ соотношения между затратами и эффективностью также дал бы ценную информацию для медицинского сообщества. Хотя имеются очевидные опасения, связанные с добавочными затратами на факторы роста, детальный анализ соотношения между затратами и преимуществами мог бы смягчить эти опасения за счет сопоставления более высоких затрат на лекарственные препараты со снижением затрат на лечение токсических проявлений и потерю продуктивности.
Возможно, наиболее справедливая критика испытания INT 9741 относится к отсутствию проспективной стратификации в отношении статуса по эстрогеновому рецептору (ER). Клинические исследования последних лет привлекли наше внимание к тому обстоятельству, что эффект адъювантной химиотерапии может значительно отличаться в подгруппах больных с ER-положительными и ER-отрицательными опухолями и может дополнительно осложняться за счет косвенных эндокринных эффектов. Двумя разительными примерами является отсутствие значительного преимущества применения схемы АС® Т в ER-положительной подгруппе в испытании CALGB 9344 [12, 13] и очень плохие результаты использования для адъювантной терапии схемы циклофосфамид/метотрексат в сочетании с фтороурацилом (CMF) у очень молодых женщин с ER-положительным заболеванием, у которых не проводится абляции яичников при данной форме лечения в отличие от предменопаузальных женщин более старшего возраста [13]. Описанное отсутствие взаимодействия между ER-статусом и результатом лечения в испытании INT 9741 не исключает наличия потенциально осложняющих переменных в подгруппе ER-положительных женщин, например более эффективной и более быстрой индукции менопаузы у молодых женщин, получающих ускоренную химиотерапию. Половина женщин в испытании INT 9741 имела возраст менее 50 лет, и у двух третей из них заболевание характеризовалось положительным ER-статусом. Было бы интересно увидеть данные по проценту бессимптомной и общей выживаемости в связи с менопаузой при более длительных сроках наблюдения в данном испытании.
ЗАНИМАЕТ ЛИ ИСПЫТАНИЕ INT 9741 ОСОБОЕ МЕСТО СРЕДИ ТУМАННОГО ЛАНДШАФТА ПЛОТНОДОЗНОЙ ХИМИОТЕРАПИИ ?
В эпоху до появления таксанов большинство исследований по повышению плотности дозы химиотерапии при лечении рака молочной железы давало отрицательные результаты, но такие испытания страдали от серьезных ограничений схемы. Эти ограничения включали недостаточную разрешающую способность, асимметрию между группами в отношении типов применяемых препаратов, использование субоптимальных доз препаратов или изменение плотности применения препаратов и кумулятивных доз одновременно, что затрудняло интерпретацию результатов [16, 17]. Испытания схем с повышенной плотностью дозы при распространенном раке молочной железы были обескураживающе маломасштабными и давали отрицательный результат в отношении сроков выживания без признаков прогрессии заболевания и общего выживания, хотя эпизодически сообщалось о тенденции к улучшению ответа на лечение.
При местнораспространенном раке молочной железы относительно маломасштабные испытания, проведенные Европейской организацией по исследованию и лечению рака (EORTC) совместно с Национальным институтом рака Канады и Швейцарской группой клинических и эпидемиологических исследований в области онкологии, не смогли продемонстрировать улучшение, по сравнению с шестимесячной канадской схемой применения циклофосфамида, эпирубицина и фтороурацила для 3-месячной дозоинтенсивной и плотнодозной комбинации эпирубицин+циклофосфамид (ЕС), которая применялась в условиях поддержки Филграстимом. Оптимистический взгляд на это испытание подчеркивает близкую эффективность короткого курса лечения по сравнению с продолжительным курсом, причем при 5-летнем сроке последующего наблюдения при использовании плотнодозной стратегии не было отмечено повышенного процента кардиотоксичности или роста числа острых миелоидных лейкозов [18].
При ранних стадиях рака молочной железы маломасштабное (N=183) и явно обладающее недостаточной разрешающей способностью испытание, ориентированное на подгруппу женщин высокого риска с количеством положительных лимфатических узлов ? 10 или экстракапсулярной инвазией, выявило аналогичные результаты для плотнодозовой схемы применения ЕС и схемы ЕС® CMF, вводимой по обычному расписанию [19]. В то же самое время несколько более крупномасштабное исследование ECOG (N=646) обнаружило тенденцию к увеличению продолжительности бессимптомного выживания при использовании плотнодозовой и частой (метрономной) схемы с использованием постоянно вводимого перорально циклофосфамида и один раз в две недели схемы: доксорубицин, винкристин и фтороурацил попеременно с вводимым раз в две недели фтороурацилом, по сравнению со стандартной американской схемой: циклофосфамид, доксорубицин и фтороурацил [20].
Еще одно исследование немецкой группы обнаружило, что плотнодозовая последовательная схема применения эпирубицина и паклитаксела превосходит использование комбинации этих агентов, которые применяются в соответствии со стандартной схемой один раз в три недели. К сожалению, однако, в этом испытании использовалась комбинации интенсивности дозы и плотности дозы и не выполнялся контроль в отношении общих совокупных доз, которые были более высокими в группе, получавшей плотнодозовую схему [29].
Последним среди испытаний таксанов является достаточно большое испытание (N=913), проведенное Якишем и соавт. [30] и недавно представленное на конференции по раку молочной железы в Сан-Антонио; это испытание говорит, что не все плотнодозовые режимы улучшат получаемые у больных результаты и что экстраполяция результатов испытания INT 9741 на другие лекарственные препараты или их комбинации является потенциально рискованной. В исследовании Якиша и соавт. плотнодозовая схема доксорубицин-доцетаксел, используемая в виде четырех курсов, давала худшие результаты по сравнению с более обычной схемой последовательного применения АС->докситаксел для предоперационной химиотерапии с точки зрения полных и подтвержденных данными патолога полных ремиссий, а также с точки зрения процента случаев, когда удавалось сохранить молочную железу.
Одно из интересных исследований, в которое в настоящее время проводится набор больных, может пролить свет на по-прежнему противоречивый вопрос относительно дозовой интенсивности при применении антрациклинов. В исследовании национального онкологического института Канады МА21 проводится сравнение шести циклов применения канадской схемы циклофосфамид-эпирубицин-фтороурацил со схемами АС->Т (как она применялась в исследовании CALGB 9344) и последовательностью плотнодозовой схемы ЕС (как она применялась в ранее описанном испытании, проводимом при местнораспространенной форме рака молочной железы, которое координировалось EORTC) с последующим применением паклитаксела по схеме один раз в три недели. Различия между плотнодозовой схемой ЕС и применением таксана в обычном режиме сможет дать ответ на вопрос, существуют ли какие-либо достоинства в ускоренном применении комбинации антрациклин/циклофосфамид у более благоприятного контингента больных с операбельной формой рака молочной железы по сравнению с тем контингентом, который был предметом исследования в испытании EORTC [31].
В данный момент непонятно, обладает ли какой-либо ценностью повышение плотности дозы применения доцетаксела, однако было показано, что плотнодозовый последовательный режим применения доксорубицина/доцетаксела в полной дозе приводил к повышенному проценту тяжелых токсических эффектов в отношении кожи [32].
В совокупности имеющиеся на сегодняшний день данные показывают, что преимущество последовательной плотнодозовой схемы лечения может быть специфическим для паклитаксела; данные в отношении доцетаксела являются слишком ограниченными и субоптимальными по своему характеру, а данные по антрациклинам не являются убедительными.
ПОСЛЕДОВАТЕЛЬНОЕ ПРИМЕНЕНИЕ ИНДИВИДУАЛЬНЫХ АГЕНТОВ ИЛИ КОМБИНИРОВАННАЯ ТЕРАПИЯ?
Второй вопрос, который был поставлен перед испытанием INT 9741, а именно вопрос о потенциальном превосходстве последовательного применения индивидуальных препаратов по сравнению с их комбинированным применением, до сегодняшнего дня получал отрицательный ответ. Это не означает, что неправильна концепция: по современным стандартам INT 9741 является относительно маломасштабным испытанием, и в нем могло быть не замечено небольшое, но все же достоверное клиническое преимущество. Весьма вероятно, что проводящиеся в настоящее время или недавно завершенные адъювантные испытания эпохи таксанов смогут дать определенный ответ на данный вопрос после проведения метаанализа. Действительно, в такие испытания было включено около 10 000 женщин, что подчеркивает выраженный интеерс онкологов к данному вопросу [33]. Далее, то обстоятельство, что последовательные схемы, вероятно, дают такую же эффективность, но лучший профиль токсичности, является важной информацией, полученной в исследовании INT 9741. Следует, однако, отметить, что в эпоху до таксанов испытание SWOG 0137 не смогло продемонстрировать ожидавшееся 30%-ное увеличение времени бессимптомного выживания при использовании последовательных повышенных доз доксорубицина/циклофосфамида по сравнению с их комбинированным применением, а последовательная схема лечения обладала большей токсичностью [34]. Во время эпохи таксанов и при распространенном заболевании исследование ECOG продемонстрировало сходные цифры по выживаемости для схемы последовательного применения паклитаксел/доксорубицин (или обратной последовательности) при сравнении с комбинированным использованием этих препаратов [35].
КАКИЕ ВЫВОДЫ ИЗ ИССЛЕДОВАНИЯ INT 9741 ВАЖНЫ ДЛЯ ОНКОЛОГИЧЕСКОГО СООБЩЕСТВА?
Для онкологов, занимающихся клиническими исследованиями, вывод заключается в том, что выбор химиотерапевтического препарата не является единственным путем вперед. График применения препаратов представляет собой важную переменную, помимо вопроса о времени и продолжительности химиотерапии, что также может играть определенную роль, однако до настоящего времени этот вопрос исследован недостаточно. В настоящее время наша задача заключается в том, чтобы подтвердить имеющиеся данные независимо, в рамках гораздо более крупномасштабных испытаний, которые позволят выявить подгруппы, в которых могут обнаружиться значительные преимущества за счет подхода, основанного на увеличении плотности дозы.
На основании индивидуального испытания на 2000 женщин клиницистам не было бы разумным на практике принять схему ускоренной химиотерапии для всех больных с раком молочной железы, в группе высокого риска. Тем не менее, ожидая дополнительных данных, индивидуализированное применение таких плотнодозовых режимов, которые использовались в испытании INT 9741 для женщин из групп высокого риска, особенно для тех, которые не могут рассчитывать на положительные эффекты адъювантной эндокринной терапии, не является чем-то неразумным, при условии, что женщин информируют в отношении тех неопределенностей, которые связаны с соотношением между риском и положительными результатами для плотнодозовой терапии. Последним, но безусловно не менее важным выводом является то, что экстраполяция результатов испытания INT 9741 на другие препараты или комбинации препаратов может быть опасной и вредной.
В общем и целом, Цитрона и его коллег можно поздравить с тем, что они провели в известном смысле эпохальное испытание адъювантной терапии при раке молочной железы. Это испытание символизирует прочный союз математики и химиотерапии рака молочной железы после пятнадцати лет существовавшего между ними романа. Будущее покажет, заключен ли этот союз на всю оставшуюся жизнь.

Рак остается одним из заболеваний, которые вопреки развитию медицины и появлению новых препаратов во многих случаях остаются неизлечимыми. Обнаружение онкологического заболевания на поздней стадии и вовсе равняется смертному приговору. Не гарантирует выздоровления и раннее обнаружение раковой опухоли: предлагаемые стратегии лечения могут оказаться малоэффективными, а развитие злокачественного образования предсказать невозможно. Более того, в средней раковой опухоли число клеток превышает число людей, живущих на Земле. При этом клетки из различных областей одной опухоли имеют различный генетический код, что также усложняет попытки предсказать ее распространение.
С этой проблемой попытались разобраться британские ученые, опубликовавшие итоги своей работы в журнале Nature Genetics. Исследователи утверждают, что все виды рака в течение времени развиваются согласно тем же законам природы, которые отвечают за течение рек и изменение яркости небесных тел. Результаты работы ученых помогут сделать лечение каждого из онкологических больных персонифицированным: врачи смогут пользоваться математическими формулами для того, чтобы понять, как развивается опухоль и каким образом с ней лучше бороться.
Модель ученых основана на предположении, что скорость роста числа мутировавших клеток прямо пропорциональна их количеству в данный момент времени, и учитывает, что не все размножившиеся клетки впоследствии окажутся жизнеспособными. Полученная учеными модель является предельным случаем теории биофизиков, нобелевских лауреатов 1969 года по физиологии и медицине Макса Дельбрюка (Max Delbrück) и Сальвадора Лурия (Salvatore Luria;), описывающей экспоненциальный характер накопления мутаций в бактериях.

Математика позволит найти индивидуальный подход для каждого пациента
Фото: Justin Sullivan / Getty Images
С другой стороны, согласно закону, предложенному британским математиком Годфри Харди (Godfrey Hardy) и немецким врачом Вильгельмом Вайнбергом (Wilhelm Weinberg), для мутации, произошедшей в некоторый момент времени, частота аллеля должна быть обратно пропорциональна числу аллелей в популяции. В применении к раковой модели это означает, что число мутаций оказывается обратно пропорциональным частоте аллеля. Таким образом ученые получили степенную зависимость, известную, в частности, в физике как модель фликкерного (или розового) шума (от английского flicker — мерцание, дрожание).
Спектральная модель 1/f-шума описывает многие явления — от биологии (как в данном случае) до астрофизики (изменение светимости звезд) и экономики (модели финансовых рынков). Фликкерный шум возникает в системах, состоящих из огромного числа взаимодействующих частиц. Проще всего его понять на примере токового шума в электрическом проводнике, находящемся под напряжением. Наличие 1/f-шума означает невозможность получить точное значение силы тока — в том смысле, что его средняя величина меняется непредсказуемым образом.
Последнее связано не столько с характером усреднения, сколько с природой явления — наличию флуктуаций, предусмотреть которые одновременно невозможно из-за различия в характерных масштабах времен, на которых они определены. В приложении к экономике это можно объяснить следующим образом: имея неограниченные возможности бесконтрольного поступления и расходования денежных средств, человек не сможет озвучить средние суммы своих денежных трат в среднем по времени.

Математические модели оказались эффективным оружием в онкологии
Фото: David Gray / Reuters
Предложенная учеными модель оказалась практически непригодна в случаях опухоли мозга и поджелудочной железы. Исследователи уверены, что такие заболевания являются более комплексными и во многом зависят от факторов, связанных с естественным отбором. Скорее всего, для понимания присущих им закономерностей необходимо использовать более сложные математические модели.
Читайте также:

