Конъюгация доклад по микробиологии
Обновлено: 02.07.2024
Конъюгация — истинная копуляция двух бактерий различного пола с переносом части или всей хромосомы клетки-донора в клетку-реципиент и последующей рекомбинацией хромосомы последнего с вновь внесенным генетическим материалом донора. Иногда при конъюгации в реципиентную клетку может быть передана только плазмидная ДНК донора. Конъюгация—наиболее совершенный из всех известных способов передачи генов у бактерий, поскольку при ней может происходить передача больших количеств генетического материала, что обусловливает широкие возможности его обмена, а следовательно, и широкие возможности изменчивости.
Процесс конъюгации был описан впервые в 1946 г. у Е. coli К-12 Ледербергом и Тейтумом (Lederberg J., Tatum Е. L.). Обнаружение этого явления — пример значимости случайности и удачи в научном открытии. С одной стороны, эксперимент был тщательно продуман его авторами методически, с другой — им крупно повезло: случайно была взята культура К-12 Е. coli, у которой конъюгация осуществляется с наиболее высокой частотой, и два штамма разного пола. В первых же экспериментах было показано, что для возникновения рекомбинантов (гибридного потомства) необходим, в отличие от трансформации, контакт клеток двух родительских штаммов. Было обнаружено также, что в потомстве наблюдается как перекомбинация некоторых признаков родителей (их расщепление), так и совместное наследование (сцепление) других признаков. Очень скоро при изучении различных вариантов скрещиваний было обнаружено, что картина расщепления признаков в полученном после конъюгации потомстве бактерий резко отличается от той, которую привыкли видеть при скрещиваниях у эукариотов. Определенные маркеры (помеченные мутациями гены) одного из родителей всегда отсутствовали у рекомбинантов (гибридного потомства) — создавалось впечатление, что возникшие при копуляции бактерий зиготы (слившиеся клетки) были неполными, т.е. содержали неполные два генома. Они были названы мерозиготами.
Истинные механизмы передачи генетического материала бактерий и его рекомбинации при конъюгации были вскрыты после многолетних экспериментов многих научных коллективов ученых разных стран. Было показано, что способность к конъюгации обусловлена наличием в клетках донорного штамма плазмиды, несущей гены, которые контролируют ее свойства, необходимые для стабильного контакта клеток. Эта плазмида первоначально была названа F-фактором (от fertility — плодовитость), поскольку плазмиды у бактерий в то время были еще неизвестны, а потом — F-плазмидой, т.е. половой плазмидой, или конъюгативной плазмидой. F-плазмида имеет протяженность 100 гпо (это крупная плазмида) и несет более двадцати генов (около 20 тпо), определяющих способность бактериальной клетки к конъюгации. У Е. coli К-12 все эти гены собраны в один кластер — tra-область (от transfer—перенос), у других бактерий они могут быть расположены несколькими группами. В tra-область входят гены, контролирующие образование на поверхности донорных клеток специальных структур — половых волосков (фимбрий, или пилей), состоящих из белка нилина и служащих для первичного контакта донорных и реципиентных клеток (их заякоривания).
После возникновения первичного контакта пили сокращаются и клетки подтягиваются друг к другу вплотную, в их оболочках образуются поры — возникает возможность перехода клеточных органел из одной клетки в другую. Сейчас показано, что при конъюгации у бактерий возникают целые комплексы контактирующих клеток, которые обеспечивают эффективную передачу генетического материала. Один из генов tra-области плазмиды кодирует эндонуклеазу, специфичную к последовательности ori Т (ориджин трансферного переноса), расположенной в начале этой области. Данный фермент делает однонитевой надрез ДНК в ori Т-последовательности, после чего начинается контролируемая генами tra-области репликация плазмиды по способу катящегося кольца. С кольцевой молекулы ДНК плазмиды как бы сползает одна нить, которая через пору передается в клетку-реципиент, а двунитевая структура ДНК плазмиды в клетке донора восстанавливается за счет комплементарного синтеза ДНК по матрице оставшейся в донорной клетке нити. В клетке реципиента тоже идет синтез ДНК по матрице переданной туда нити, и образуется нормальная двунитевая молекула—плазмида. В описанном процессе, кроме упомянутых выше, участвуют и другие ферменты и их комплексы, необходимые для синтеза ДНК. Кроме того, конъюгативные плазмиды кодируют специальные антирестрикционные белки, защищающие от разрушения передаваемую при конъюгации ДНК; контролирующие их гены тоже лежат в tra-области. Передача конъюгативных плазмид от донора реципиенту происходит очень быстро—за несколько минут и может осуществляться в самых различных условиях среды.
Электронная микрофотография конъюгирующих клеток Е. coli. Модель конъюгационного переноса половой плазмиды F из клетки-донора в клетку-реципиент:
А — донор; Б — реципиент; 1 — цепь ДНК, остающаяся в доноре; 2 — вновь синтезирующаяся комплементарная цепь;
3 — клеточная стенка; 4 — ДНК-полимераза III; 5 — РНК-затравка; 6 — ДНК-геликаза;
7 — цепь ДНК F-плазмиды, переданная реципиенту; 8 — вновь синтезирующаяся в реципиенте комплементарная цепь;
9 — белок, защищающий ДНК; 10 — конъюгационная пора, в которой находятся эндонуклеаза и белок.
Хромосома со встроенной в нее F-плазмидой при конъюгации передается от донора в клетку реципиента за счет tra-области плазмиды. Процесс начинается с ori Т-плазмиды й протекает так же, как описано выше для конъюгативной плазмиды. При этом сначала передается фрагмент плазмидной ДНК от последовательности ori Т до точки рекомбинации ее с хромосомой, потом—хромосомная ДНК. Процесс этот длится дольше, чем передача одной плазмиды и занимает около 90 мин. После хромосомы передается оставшийся фрагмент плазмиды. Размер плазмидных фрагментов, передающихся перед хромосомой и после нее зависит от взаимного расположения участка плазмиды, по которому произошла рекомбинация при ее включении в хромосому, и ori Т-плазмиды.
Целиком хромосома донора крайне редко передается в клетку реципиента: обычно в процессе передачи происходят ее спонтанные разрывы, и разные реципиентные клетки получают фрагменты хромосомы донора разных размеров. В связи с этим маркеры донора, лежащие в проксимальном отделе хромосомы реципиента (с точки зрения последовательности ее переноса), переносятся с большей частотой, чем дистальные,—от 10 -3 до 10 -8 на клетку, т.е. наблюдается градиент переноса маркеров донора в клетку реципиента. Доноры, включившие F-плазмиду в хромосому и способные передавать ее маркеры с высокими частотами, называются Hfr-донорами (от high frequency recombination). Доноры, содержащие конъюгативную плазмиду в автономном состоянии, называются донорами F + . Они тоже способны передавать при конъюгации не только плазмидные, но и хромосомные гены, но с меньшей и одинаковой для всех генов частотой. Способность F + -доноров к передаче хромосомных маркеров обусловлена тем, что в каждой бактериальной популяции с частотой около 10 -5 происходит включение плазмиды в хромосому и, следовательно, возникают Hfr-донорные клетки. Поскольку плазмида может включаться в разные точки хромосомы, в каждой популяции возникают разные Hfr-доноры, передающие свои хромосомы с разных точек и иногда даже в разных направлениях. При передаче разных маркеров таким F + -донором частоты передачи каждого маркера усредняются и составляют обычно 10 -7 на клетку-донора.
В ходе исследования процесса конъюгации у Е. coli К-12 было выделено большое количество Hfr-доноров, переносящих хромосому этого штамма при конъюгации с разных точек и в разных направлениях. При изучении порядка переноса ими генетических маркеров в клетки реципиентов было показано до появления электронно-микроскопических материалов Кернса (Cairns J.), что хромосома Е. coli имеет кольцевое строение.
На основании изложенных выше данных сделано заключение, что возможность попадания генетического маркера в зиготу при конъюгации определяется вероятностью предзиготного исключения, т.е. разрыва хромосомы проксимальнее этого маркера. Анализ закономерностей рекомбинации в большом числе различных конъю-гационных скрещиваний показал, что для разных хромосомных маркеров, уже попавших в зиготу, вероятность включения в хромосому реципиента одинакова и составляет 0,5, т.е. 50%. Было также установлено, что для его включения необходимо четное число перекрестов. Другими словами, фрагмент хромосомы донора, встраиваясь в хромосому реципиента, замещает ее гомологичный участок. Генотип рекомбинантов, полученных в конъюгационных скрещиваниях, представляет собой в основном генотип реципиента с включением групп генов донора. Поэтому для получения жизнеспособного потомства после таких скрещиваний важна жизнеспособность клеток реципиента; донорные клетки могут погибнуть после окончания процесса конъюгации, и это не отразится на жизнеспособности рекомбинантов.
В процессе конъюгации хромосомные гены могут быть перенесены от донора реципиенту не только при передаче хромосомы, но и при переносе только F-плазмиды. У донорных штаммов Hfr с определенной частотой происходит выщепление плазмиды из хромосомы — возникают клоны F + . Иногда это выщепление осуществляется неправильно с захватом прилежащего к плазмиде участка хромосомы, как у умеренных фагов. Такие конъюгативные плазмиды получили название F' (F-прим). Обычно они несут небольшие фрагменты хромосомы, не превышающие длину ДНК самой плазмиды, но иногда встречаются плазмиды, включившие 10-25% хромосомы. Процесс передачи хромосомных генов бактерии половой плазмидой называется сексдукцией.
Схематическое изображение процесса превращения донора F в донора Hfr. Порядок генов при конъюгационном переносе хромосомы Е. coli различными Hfr-донорами. Сверху представлена хромосома Е. coli с точками начала и направлением переноса генов шестью Hfr-донорами, приведенными ниже. Снизу — частоты переноса проксимальных и дистальных генов.
Конъюгация — наиболее универсальный процесс переноса генов у бактерий, при котором может происходить передача больших количеств генетического материала вплоть до целой хромосомы. Это открывает широкие возможности для различных приемов генетического анализа у бактерий.
Кроме того, при изучении процесса конъюгации были сделаны два открытия общебиологической значимости: открыто кольцевое строение бактериальной хромосомы и обнаружены плазмиды у бактерий (первой выявленной бактериальной плазмидой была F-плазмида).
Все сказанное выше относится к Е. coli.
В настоящее время конъюгация, обусловленная различными половыми в подавляющем большинстве случаев крупными плазмидами, обнаружена у очень большого числа бактерий. Хотя другие системы конъюгации изучены намного хуже, чем конъюгация у Е. coli, тем не менее ясно, что в ряде случаев в них имеются некоторые различия. В качестве примера опишем процессы конъюгации у актиномицетов и стрептококков.
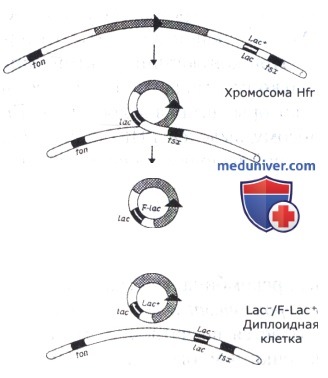
Схематическое изображение процесса образования F' плазмиды, несущей ген lac из бактериальной хромосомы.
Конъюгация у актиномицетов. Актиномицеты — мицелиальные бактерии, в клетках которых содержится несколько гомологичных нуклеоидов. Это, несомненно, затрудняет их генетическое изучение. Однако практическая значимость этих объектов стимулировала исследования переноса генов у них и конъюгации в том числе. Было обнаружено, что у актиномицетов есть процесс конъюгации, в общих чертах аналогичный конъюгации грамотрицательных бактерий, хотя и отличающийся по ряду параметров (к тому же надо учитывать, что механизмы этого процесса у актиномицетов изучены недостаточно). Прежде всего половые плазмиды актиномицетов существенно отличаются от таковых у других бактерий. Многие штаммы актиномицетов имеют, как уже говорилось, линейные плазмиды. Ряд этих плазмид трансмиссивен, т. е. способен передаваться от содержащего их штамма реципиенту, другими словами, обладает свойствами половых плазмид. Такие плазмиды довольно разнообразны (различаются у разных штаммов) и некоторые из них имеют небольшие размеры, в отличие от половых плазмид других бактерий (как было сказано выше, только tra-область F-плазмиды Е. coli имеет протяженность более 20 тпо). На ряде половых плазмид актиномицетов показано, что их tra-область, необходимая для конъюгации, имеет протяженность всего 2 тпо. Ясно, что процесс конъюгации у актиномицетов должен быть более сложным, чем у других бактерий, по причине их мицелиального строения и не может обеспечиваться такой небольшой последовательностью ДНК. Возможно, что часть конъюгационных tra-генов находится в хромосоме или в составе конъюгативных транспозонов.
При конъюгации у актиномицетов передаются с высокой эффективностью не только плазмиды, но и хромосомные гены: частоты передачи всех генов генома у некоторых штаммов достигают 10 -3 . Половые плазмиды могут встраиваться в хромосому, выделены Hfr-доноры. Однако последние отличаются от Hfr-доноров кишечной палочки: чаще всего у таких доноров не обнаруживается направленного переноса генов при конъюгации он либо двунаправлен, либо вовсе не направлен. Часто рекомбинанты, полученные после конъюгационных скрещиваний актиномицетов, имеют в основном гены донора, а не реципиента, как у кишечной палочки. Кроме того, у актиномицетов после скрещивания возникают, кроме стабильных рекомбинантов (как у кишечной палочки), еще и нестабильные, называемые гетероклонами и долгое время выщепляющие как бы вторичные рекомбинанты. Создается впечатление, что состояние мерозиготы, очень короткое у кишечной палочки и многих других бактерий, у актиномицетов может сохраняться долгое время. Возможно, ряд перечисленных особенностей конъюгационного процесса у актиномицетов связан с линейным строением их хромосом и плазмид.
Конъюгация у стрептококков. У грамположительных бактерий, таких как стрептококки, конъюгация обнаружена у большого числа групп как внутри них, так и между ними. При этом у стрептококков описаны различные системы конъюгации. Наиболее хорошо изучена феромониндуцибельная система, при которой крупные конъюгативные плазмиды с молекулярной массой более 40 MD (около 60 тпо) передаются под контролем выделяемых реципиентом половых феромонов — пептидов с молекулярной массой 100 D. Реципиент выделяет феромон, строго специфичный к определенной конъюгативной плазмиде. Один реципиент может выделять несколько (до шести) различных феромонов, а один донор — нести до трех различных конъюгативных плазмид, чувствительных к разным феромонам. Под влиянием феромонов реципиента на поверхности клеток донора индуцируется образование фимбриеподобных структур, которые способствуют возникновению агрегатов разнополых клеток. (Показано, что у Streptococcus faecalis рецепторами у реципиента служит тейхоевая кислота.) Предполагается, что феромоны регулируют работу занимающих около 20 тпо и составляющих несколько групп tra-генов конъюгативных плазмид. Плазмиды в этой системе конъюгации передаются с высокой частотой, как F-плазмида Е. coli.
Обнаружены у стрептококков и конъюгативные системы, работающие без участия феромонов. У S. lactis описана такая система, обусловленная крупной плазмидой (около 50 тпо). Эта плазмида передается с высокой частотой. У некоторых культур выявлены обусловленные плазмидами протяженностью 25-50 тпо системы конъюгации, в которых передача плазмид осуществляется без образования половых пилей, только на плотных подложках (мембранных фильтрах) с низкой частотой. К сожалению, оба названных выше процесса плохо изучены.
Вероятно, конкретные механизмы образования контактов и перехода генетического материала от донора к реципиенту у бактерий довольно разнообразны и могут отличаться у различных систематических групп.
Перенос бактериальной ДНК. Конъюгация бактерий. F-фактор бактерии.
Длительное время считали, что бактерии — изолированные генетические системы, и каждая особь имеет одного (и только одного) родителя, то есть их изменчивость вызвана лишь мутациями. Никто не мог себе представить, что, подобно гаметам высших организмов, бактерии способны обмениваться генетическим материалом и, по аналогии с половым размножением, давать начало потомству с новыми свойствами. Однако Лёдерберг и Тёйтем (1946), высевая на минеральную среду, предварительно смешав два типа мутантов Escherichia coli (один нуждался в биотине и метионине, другой — в треонине и лейцине), показали, что у бактерий генетические рекомбинанты со способностью к синтезу всех четырёх факторов роста возникают с частотой 10"6, хотя теоретическая вероятность реверсии по двум генам составляет 10-14-10-16 на генерацию. Это противоречие было снято установлением факта прямой передачи генетического материала от донорной клетки к реципиентной (конъюгация). Помимо конъюгации, передача генетического материала у бактерий может осуществляться также с помощью трансформации и трансдукции (рис. 4-16).
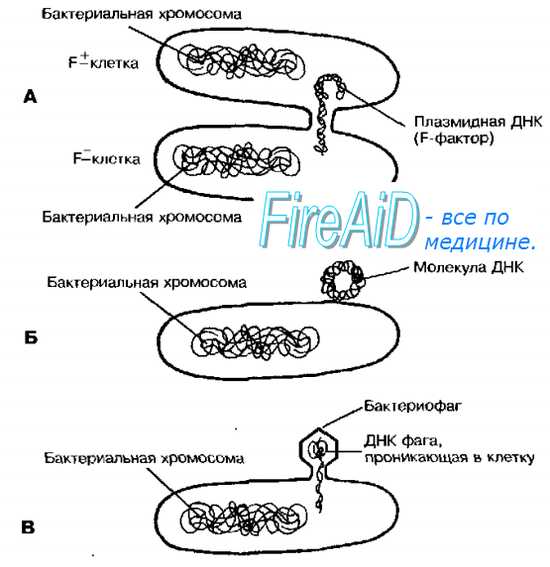
Рис. 4-16. Механизмы перенос бактериальной ДНК. Конъюгация (А), трансформация с использованием отдельной молекулы ДНК (Б) трансдукция с помощью фагов (В).
Конъюгация бактерий. F-фактор бактерии.
Конъюгация — прямой перенос фрагмента ДНК от донорских бактериальных клеток к реципиентным при непосредственном контакте этих клеток. Биологическая значимость этого процесса стала проясняться после внедрения в медицинскую практику антибиотиков. Устойчивость к антибиотикам можно получить в результате мутации, что происходит один раз на каждые 106 клеточных делений. Однако, однажды изменившись, генетическая информация может быстро распространяться среди сходных бактерий благодаря конъюгации, поскольку каждая третья из близкородственных бактерий способна именно к этому типу генетического переноса. Для реализации процесса необходим F-фактор — плазмида, кодирующая информацию, необходимую для конъюгации.
Конъюгация требует наличия двух типов клеток: доноров (F + ), обладающих F-фактором, и реципиентов (F - ), не обладающих им. При скрещивании клеток F - и F + фактор фертильности передаётся с частотой, близкой к 100%.
Фактор переноса содержит гены специальных и необходимых при конъюгации структур — F-пилей и ряд других генов, вовлечённых в процесс взаимодействия с F - -клетками.
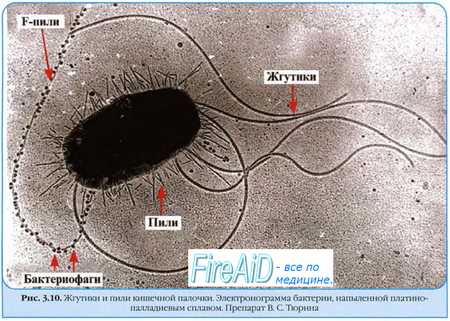
Первый этап конъюгации — прикрепление клетки-донора к реципиенту с помощью F-пилей. Затем между клетками формируется конъюгационный мостик, через который передаётся F-фактор, а также и другие плазмиды, автономно пребывающие в цитоплазме донора. При попадании F-фактора в реципиентную клетку она становится F+ и приобретает способность передавать фактор фертильности другим F - -клеткам. Подобный механизм обеспечивает приобретение популяционно. устойчивости к антибактериальным агентам.
В популяции клеток, содержащих F-плазмиду, только те, в которых она интегрирована в бактериальную хромосому (Hft + -клетки), способны быть донорами хромосомной ДНК. При перенос генетического материала бактериальная ДНК реплицируется, начиная от места включения F-фактора, одна цепь ДНК переносится в реципиентную F'-клетку двигаясь 5'-концом вперёд тогда как другая остаётся в Hfr + -клетке, то есть донор сохраняет своё генетическое постоянство. После начала конъюгации хромосомный материал переносится, начиная от генов, близких к начальной точке транспорта (рис. 4-17).
В бактерии-реципиенты обычно попадают первые из переносимых генов, размер которых зависит от времени, в течение которого проходила конъюгация, и очень редко — все гены. Позже всех переносится участок плазмиды, содержащий ген переноса кодирующий F-пили. Поскольку полная трансмиссия — явление редкое, реципиентная клетка при Hfr-конъюгации обычно остаётся F-. Вслед за процессом переноса в клетке-реципиенте происходит гомологичная рекомбинация между донорской ДНК и собственной ДНК реципиента.
Процесс конъюгации может происходить только при соблюдении ряда условий.
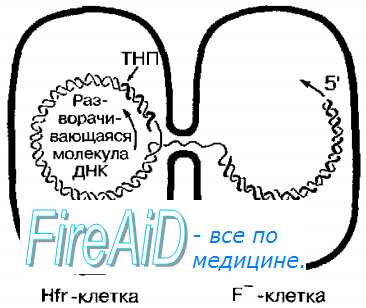
Рис. 4-17. Hfr-конъюгация. Hfr-бактерии функционируют при конъюгации как доноры. Перенос ДНК осуществляется линейно и начинается с удвоения места включения F-фактора (то есть с удвоения точки начала переноса — ТНП).
• На поверхности реципиентных бактерий должны быть рецепторы пилей, имеющие существенное сродство ( к F-пилям, что позволяет образовать стабильную связь между пилями и рецепторами.
• Для эффективной конъюгации у F-фактора должна быть точка начала репликации, распознаваемая репликативными системами хозяина.
• Эффективность Hfr-конъюгации зависит от величины гомологии ДНК. Перенос негомологичного хромосомного материала донора не приведёт к его интеграции с ДНК реципиента.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Перенос генетического материала путем прямого контакта между дву мя клетками называется конъюгацией. Уже давно на основании морфо логических данных предполагали, что и у бактерий может происходить своего рода спаривание; однако только эксперименты с множественны ми мутантами бесспорно доказали, что и у бактерий возможна передача генетического материала при прямом межклеточном контакте. В 1946 г. Ледерберг и Татум провели решающий опыт с двумя мутантами Е. coli К12, каждый из которых был ауксотрофным по двум различным ами нокислотам (рис. 15.14). Один двойной мутант нуждался в аминокисло тах А и В, но был способен синтезировать С и D (А ~ В ~ С * D + ); другой мутант был ему комплементарен (А т В т С~ D"). Эти мутанты не росли на минимальной питательной среде и не обра зовывали колоний. Однако если на ту же минимальную среду высевали смесь суспензий обоих мутантов, то колонии появлялись. Клетки этих колоний обладали наследственной способностью синтезировать все аминокислоты, т.е. принадлежали к типу A + B + C + D + (были прото-трофными). Такие клетки возникали с частотой 1 :10 б ; это были генетические рекомбинанты - они объединяли в себе генетическую информацию двух реципрокно дефектных (взаимодополняющих) родительских кле ток. Использование в качестве исходных штаммов множественных му тантов исключало возможность появления ревертантов, так как вероят ность одновременной реверсии по двум генам составляет величину по рядка 10~ 14 -10~ 16 на генерацию. Необходимой предпосылкой реком бинации служил прямой контакт родительских клеток.
Фактор F и состояние Hfr. При исследовании процесса скрещивания бактерий выяснилось, что способность клетки быть донором связана с наличием особого фактора, который при конъюгации передается из одной клетки в другую - полового фактора F (от fertility - плодовитость). Клетки, не содержащие фактора F (клетки F~), могут функционировать только как реципиенты. При конъюгации, т.е. при прямом контакте между клетками, частота передачи фактора F близка к 100%. Таким образом, клетки-реципиенты в результате конъюгации превращаются в потенциальных доноров; при этом хромосомные признаки еще не передаются.
В популяции F + лишь немногие клетки способны быть донорами хромосомной ДНК. Оказалось, что это те клетки, в которых фактор F интегрировался в бактериальную хромосому (рис. 15.16). Если клоны таких клеток-доноров использовать в экспериментах со скрещиванием, то рекомбинанты образуются примерно в тысячу раз чаще, чем при ис-
пользовании обычных клеток F + . Клетки-доноры, обеспечивающие вы сокую частоту рекомбинаций, получили название клеток Hfr (от англ. high frequency of recombinants). Фактор F включается в бактериальную хромосому лишь в определенных участках, число которых ограниченно; этот процесс сравним с интеграцией фага X (лямбда) в хромосому клет ки-хозяина (см. рис. 4.14, 15.12 и 15.16).
Генетическая карта. В результате применения описанного выше ме тода прерванной конъюгации, позволяющего выяснить временную по следовательность переноса генов из клетки-донора, можно составить карту расположения генов в бактериальной хромосоме (рис. 15.17). Ско рость их переноса в течение всего процесса остается постоянной. Мо менты перехода внутрь клетки-реципиента позволяют судить о расстояниях между ними в хромосоме. При использовании этого метода не удается учитывать различия менее одной минуты. Для более тонкого картирования может служить анализ сцепления при трансдукции (переносе генов фагом).
Для Escherichia coli K12 известно расположение более чем тысячи ге нов, главным образом структурных, кодирующих ферменты. Последо вательность расположения генов на бактериальной хромосоме была определена для Salmonella typhimurium, Streptomyces coelicolor, Bacillus subtilis и некоторых других бактерий.
хромосомной ДНК, называют фактором F'. Возникновение фактора F' аналогично образованию фага, осуществляющего специфическую транс-дукцию (разд. 15.3.3).
Клетку, содержащую фактор F', называют первичной клеткой F'. Включившаяся в F-фактор ДНК теперь может передаваться клетками-донорами F' штаммам F~ с такой же высокой частотой (100%), что и при обычной передаче фактора F штаммами F + реципиентам F ~. Тот же самый фрагмент ДНК мог бы передаваться штаммом Я/г штамму F ~ с максимальной частотой 1%. Если фактор F' будет перене сен из первичной родительской клетки F' (где он впервые возник) в нор мальную клетку F ~, то образуется вторичная клетка F', в которой не большой участок бактериальной хромосомы окажется удвоенным (будет в диплоидном состоянии).
Распространенность конъюгации среди других групп бактерий. Переда ча генов путем конъюгации, открытая у Escherichia coli, очень широко распространена у энтеробактерий.
Посредством переноса факторов F из Е. coli K12 в клетки Salmonella и Shigella удалось создать новые генетические системы. Сходные си стемы были найдены в группе псевдомонад. Конъюгация у энтеробактерий представляет собой высокоразвитый процесс; чтобы она осуществи лась, достаточно суспендировать смесь клеток-партнеров в жидкой среде и оставить на некоторое время в покое. У многих других бакте рий конъюгацию удается вызвать лишь в том случае, если колонии обо их партнеров будут хорошо перемешаны и размазаны на твердой среде, где они должны затем расти несколько дней. Если теперь распределить клетки по одной на селективной среде, то окажется, что у многих кле ток возникла новая комбинация признаков и, по всей вероятности, про изошел обмен крупными участками бактериальных хромосом. Про цессы конъюгации широко изучались на Streptomyces coelicolor, видах Nocardia, Rhizobium и других бактериях. Обмен генами путем конъюга ции и мобилизация генов с помощью плазмид, вероятно, очень распространены в мире прокариот.
Фактор переноса устойчивости (RTF) включает все гены, ответ ственные за перенос фактора R из клетки в клетку, который осущест вляется обычно путем конъюгации. Таким образом, фактор R, так же как и фактор F, в широком смысле инфекционен. Область RTF по своей молекулярной структуре гомологична соответствующей области F-фак-тора Е. coli. Для некоторых К-факторов характерен широкий круг хо зяев; возможен их перенос между несколькими разными родами бакте рий, что способствует их дальнейшему распространению. В некоторых случаях наблюдали, что вместе с фактором R передаются и хромо сомные гены, которые, по-видимому, были мобилизованы им.
Механизм устойчивости к антибиотикам, определяемой К-факторами, может быть не таким, как в случае ее хромосомного наследования. На глядным примером этого служит резистентность к стрептомицину. Если она зависит от хромосомного гена, то она связана с изменением субъ единицы 30S рибосомы, так что бактерия не имеет мишени для воздей ствия стрептомицина (разд. 2.2.2). В отличие от этого устойчивость, обусловленная К-фактором, основана на инактивации антибиотика в ре зультате его аденилирования под влиянием фермента. Ферментативная химическая модификация антибиотиков часто бывает причиной устой чивости к ним, обусловленной плазмидами; например, хлорамфеникол ацетилируется, канамицин и неомицин подвергаются фосфорилирова-
нию и ацетилированию, а пенициллин инактивируется пенициллиназой. Поскольку и при наличии К-факторов возможна генетическая рекомби нация, может возникнуть новое сочетание генов, придающее дополнительные свойства устойчивости. К-факторы имеют большое значение для химиотерапии; их существование-лишний довод против бескон трольного применения антибиотиков, так как они могут распростра няться в популяциях бактерий подобно инфекционным агентам.
Бактериоцины. Многие бактерии синтезируют белки, убивающие родственные виды или штаммы или тормозящие их рост. Эти белки с весьма специфическим действием, бактериоцины, кодируются особыми плазмидами, бактериоциногенными факторами. Бактериоцины были вы делены из Escherichia coli (колицины), Pseudomonas aeruginosa (пиоцины), Bacillus megaterium (мегацины) и других бактерий.
Другие признаки, определяемые плазмидами. Плазмиды могут содер жать также гены, обусловливающие ряд специфических биологических свойств, которые в определенных условиях создают селективное пре имущество. Гены ферментов, необходимых для расщепления камфоры, салициловой кислоты, нафталина, октана, 2,4-дихлорфеноксиуксусной кислоты и многих других необычных субстратов, могут находиться в плазмидах. Мы уже упоминали о плазмиде бактерии Agrobacterium tumefaciens,вызывающей опухоли у растений, и ее биохимической актив ности (разд. 4.3). Перечень свойств, наследуемых с плазмидами, стал сейчас очень длинным и включает, в частности, азотфиксацию, образование клубеньков, синтез индолилуксусной кислоты, диацетила, гидроге-назы, поглощение Сахаров. Некоторые из этих свойств могут опреде ляться генами бактериальной хромосомы; это свидетельствует о том, что более или менее часто происходит обмен генами или группами ге нов между хромосомой и плазмидой. Плазмиды, вероятно, играли очень важную роль в эволюции прокариот.
Несовместимость. Многие бактерии содержат плазмиды различной величины. Сосуществование разных плазмид в одной бактериальной клетке говорит о том, что такие плазмиды совместимы между собой. Однако две родственные плазмиды не могут сосуществовать в одной клетке-они несовместимы. Все плазмиды подразделяются на группы несовместимости: плазмиды, относящиеся к одной и той же группе, несовместимы друг с другом.
Конъюга́ция (от лат. conjugatio — соединение), парасексуальный процесс — однонаправленный перенос части генетического материала (плазмид, бактериальной хромосомы) при непосредственном контакте двух бактериальных клеток. Открыт в 1946 году Дж. Ледербергом и Э. Тайтемом [1] . Имеет большое значение в природе, поскольку способствует обмену полезными признаками при отсутствии истинного полового процесса. Из всех процессов горизонтального переноса генов конъюгация позволяет передавать наибольшее количество генетической информации.
Содержание
Механизм
Для успешного установления контакта двух клеток в клетке-доноре должна присутствовать конъюгативная (половая, трансмиссивная) плазмида. Первой из них была открыта F-плазмида: эписома (способная встраиваться в бактериальную хромосому), длиной около 100 тыс. пар оснований. Плазмида несёт гены, кодирующие ряд функций. Одна из них — образование половых пилей, отвечающих за приклепление к клетке-реципиенту.
Конъюгативные плазмиды также кодируют белки, противодействующие прикреплению пилей других бактерий к клеточной стенке данной. Поэтому клетки, уже содержащие трансмиссивные плазмиды, на несколько порядков реже выступают в роли реципиентов при конъюгации.
Плазмидой кодируется эндонуклеаза, разрезающая одну из нитей её ДНК в определённой точке (oriT). Затем разрезанная цепь раскручивается и 5'-концом переносится в клетку-реципиент. Выдвигалось предположение, что ДНК передаётся по каналам в половых пилях, но к настоящему времени показано, что перенос идёт через поры в клеточной стенке. В первом сегменте поступающей в клетку реципиента нити ДНК расположены антирестрикционные гены. Эти гены должны транскрибироваться в реципиенте сразу же после своего поступления туда, чтобы обеспечить накопление белков, блокирующих процесс разрушения ДНК рестриктазами. Наконец, переданная цепь замыкается в кольцо и на её основе восстанавливается двунитевая структура ДНК плазмиды. Весь процесс длится несколько минут.
Конъюгативная плазмида может встраиваться в хромосому путём гомологичной рекомбинации с участием IS-элементов. Конъюгация при этом идёт по тому же механизу, однако реципиенту передаётся не только плазмида, но и хромосомный материала донора. В этом случае процесс затягивается на часы, часто происходит разрыв передаваемой нити ДНК. Путём искусственного прекращения передачи ДНК в разное время и наблюдения за тем, какие гены были при этом переданы, была получена карта хромосомы кишечной палочки (E. coli) и показано её кольцевое строение.
При выщеплении из хромосомы плазмида может захватывать её фрагмент и переносить его с собой в другую клетку (аналогия с трансдукцией). Данный процесс носит название сексдукции.
Конъюгация между видами с различным классификационным положением
Для успешной конъюгации бактериальные клетки не обязательно должны принадлежать к одному виду. Показана даже возможность передачи посредством конъюгации генов от бактерий эукариотам: растениям и грибам. Например, бактерии рода Agrobacterium (семейство Rhizobia) содержит Ti и Ri плазмиды, которые переносятся в клетки растений, внедряются в ядро и изменяют их метаболизм, в результате чего клетки начинают вырабатывать опины, которые Agrobacterium использует как источник углерода и энергии. В Ti и Ri плазмидах существуют две системы генов, кодирующих свой перенос. Это vir гены для переноса в растения и tra гены для переноса в другие бактерии.
Конъюгативный перенос у основного лабораторного штамма бацилл – Bacillus subtilis 168
В лаборатории генетики микроорганизмов Института общей генетики РАН по руководством профессора А. А. Прозорова впервые было показано существование конъюгативного переноса плазмид и хромосомных генов у основного лабораторного штамма бацилл – Bacillus subtilis 168 [2] .
Читайте также:

