Химические вещества доклад по химии
Обновлено: 18.05.2024
Смотрите и качайте готовые доклады на тему "химия" бесплатно без регистрации. Воспользуйтесь поиском, чтобы найти доклады по вашей теме. Банк готовых работ будет полезен студентам, которым нужны примеры написания работы
Не отобразилась форма расчета стоимости? Переходи по ссылке
Не отобразилась форма расчета стоимости? Переходи по ссылке
Доклад на тему «Опыт экспресс-определения плотности мазутов на автоматическ.
Одним из основных показателей качества тяжелых нефтепродуктов при их отгрузке и приемке является зна.
Доклад на тему «Влияние первичного вскрытия на производительность скважин п.
В настоящее время в разработку широко вовлекаются трудноизвлекаемые запасы углеводородов, приуроченн.
Доклад на тему «Заводнение нефтяного пласта горизонтальной нагнетательной с.
Вопросу использования горизонтальных добывающих скважин в нефтедобывающих регионах мира посвящено до.
Доклад на тему «Предупреждение отложений и эмульсеобразования в нефтегазодо.
В статье рассмотрены вопросы ресурсосбережения при разработке и эксплуатации нефтяных и газовых мест.
Добавки применяют для улучшения свойств бетонов и растворов, а также по технико-экономическим сообра.
Цезий (лат. Caesium), Cs, химический элемент I группы периодической системы Менделеева, атомный номе.
С 1931 года кроме бутадиенового каучука, синтетических полимеров еще не было, а для изготовления .
Для деталей машин используют сплавы меди с цинком , оловом, алюминием, кремнием и др. (а не чистую м.
Эмульсиями называются дисперсные системы, в которых дисперсионная среда и дисперсная фаза находятся .
Серебро (лат. Argentum), Ag, химический элемент I группы периодической системы Менделеева, атомный н.
Каковы же основные формы связи аминокислот в сложной молекуле белка? Ещё в 1891 г. А. Я. Данилевский.
Рубидий (лат. Rubidium), Rb, химический элемент I группы периодической системы Менделеева, атомный н.
26 сентября 1754 г. – 5 июля 1826 г. Французский химик Жозеф Луи Пруст родился в небольшом городке А.
ПОЛИНГ, ЛАЙНУС КАРЛ (Pauling, Linus Carl) (1901–1994), американский химик и физик, удостоенный в 195.
Бунзен (Bunsen) Роберт Вильгельм (31 марта 1811, Геттинген — 16 августа 1899, Гейдельберг), немецкий.
Калий по распространенности в земной коре занимает 7-е место. Главные минералы: сильвин (минерал под.
Кекуле (Kekule) Фридрих Август (1829-96) — Немецкий химик-органик, иностранный член-корреспонд.
Полинг (Pauling) Лайнус Карл (28 февраля 1901, Портленд, штат Орегон, США — 19 августа 1994, Биг Сур.
Зелинский Николай Дмитриевич [6 февраля (25 января) 1861, Тирасполь Херсонской губернии, ныне Молдав.
Зинин Николай Николаевич [13 (25) августа 1812, г. Шуша Елизаветпольской губернии, ныне в Нагорном К.
Марковников Владимир Васильевич [(13) 25 декабря 1837, г. Княгинин Нижегородской губернии — (29 янва.
Александр Бутлеров родился в 1828 году в Бутлеровке – небольшой деревушке неподалеку от Казани, где .
Неплохо провести эксперименты также в конце изучения курса химии, т.е. в конце 11 класса, когда учащ.
Газы нефтяные попутные – это природные газы, сопровождающие нефть и выделяющиеся при ее добыче. Хара.
Представим себе, что можно найти “центры тяжести” отрицательных и положительных частей молекулы. Тог.
Доклад на тему «История получения цинка, его химические св-ва и применение .
Элемент цинк (Zn) в таблице Менделеева имеет порядковый номер 30. Он находится в четвертом периоде в.
В наши дни нефть является важнейшим химическим сырьем и энергетическим источником. В 1962 году ее ми.
Мембранное равновесие, связанное с различием концентрации солей внутри и вне клеток, известно давно.
Крахмал состоит из 2 полисахаридов — амилозы и амилопектина, образованных остатками глюкозы. Э.
Доклад на тему «Сравнительный анализ моделей обратимого электрорастворения .
Метрологические характеристики метода инверсионной вольтамперометрии существенным образом зависят от.
Каждое вещество в зависимости от внешних условий — температуры и давления — может находи.
Внешняя электронная конфигурация атома Cl 3s2Зр5. В соответствии с этим Хлор в соединениях проявляет.
Оксид кальция (негашеная известь). Основные объёмы используются в строительстве в качестве известков.
Разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов называ.
Закон открыт и сформулирован Д.И.Менделеевым: «Свойства простых тел, а также формы и свойства соедин.
1925. Наблюдения за изменением главнейших химических веществ, входящих в состав виноградного сока пр.
Силикатная промышленность — это производство керамики, стекла, цемента из природных соединений кремн.
Доклад на тему «Причины образования, последствия, эффективные меры предотвр.
Причины парникового эффекта. Суть парникового эффекта состоит в следующем: Земля получает энергию от.
Вещество́ — форма материи, в отличие от поля, обладающая массой покоя. Вещество состоит из частиц, среди которых чаще всего встречаются электроны, протоны и нейтроны. Последние два образуют атомные ядра, а все вместе — атомы, молекулы, кристаллы и т. д.
В биологии Вещество́ — форма материи, образующая ткани организмов, входящая в состав органелл клеток.
Содержание
Различие между веществом и полем
Поле, в отличие от веществ, характеризуется непрерывностью, известны электромагнитное и гравитационное поля, поле ядерных сил, волновые поля различных элементарных частиц.
Современное естествознание нивелирует различие между веществом и полем, считая, что и вещества, и поля состоят из различных частиц, обладающих корпускулярно-волновой (двойственной) природой. Выявление тесной взаимосвязи между полем и веществом привело к углублению представлений о единстве всех форм и структуры материального мира.
Однородное вещество характеризуется плотностью — отношением массы вещества к его объёму:

где ρ — плотность вещества, m — масса вещества, V — объём вещества.
Физические поля такой плотностью не обладают.
Свойства вещества
Каждому веществу присущ набор специфических свойств — объективных характеристик, которые определяют индивидуальность конкретного вещества и тем самым позволяют отличить его от всех других веществ. К наиболее характерным физико-химическим свойствам относятся константы — плотность, температура плавления, температура кипения, термодинамические характеристики, параметры кристаллической структуры. К основным характеристикам вещества принадлежат его химические свойства.
Разнообразие веществ
Число веществ в принципе неограниченно велико; к известному числу веществ всё время добавляются новые вещества, как открываемые в природе, так и синтезируемые искусственно.
Индивидуальные вещества и смеси
В химии принято разделять все объекты изучения на индивидуальные вещества (иначе — соединения) и их смеси. Под индивидуальным веществом понимают абстрактное понятие, обозначающее набор атомов, связанных друг с другом по определённому закону. Граница между индивидуальным веществом и смесью веществ довольно расплывчата, так как существуют вещества непостоянного состава, для которых, вообще говоря, нельзя предложить точной формулы. Кроме того, индивидуальное вещество остаётся абстракцией в силу того, что практически достижима лишь конечная чистота вещества. Это значит, что любой конкретный, реально существующий образец представляет собой смесь веществ, пусть и с подавляющим преобладанием одного из них. Несмотря на кажущуюся надуманность этого ограничения, зачастую чистота вещества играет ключевую роль в его свойствах. Так, знаменитая прочность титана проявляется только после того, как он очищен от кислорода до определённого предела (менее сотых долей процента).
Агрегатные состояния
Все вещества в принципе могут существовать в трёх агрегатных состояниях — твёрдом, жидком и газообразном. Так, лёд, жидкая вода и водяной пар — это твёрдое, жидкое и газообразное состояния одного и того же вещества — воды H2O. Твёрдая, жидкая и газообразная формы не являются индивидуальными характеристиками веществ, а соответствуют лишь различным, зависящим от внешних физических условий состояниям существования веществ. Поэтому нельзя приписывать воде только признак жидкости, кислороду — признак газа, а хлориду натрия — признак твёрдого состояния. Каждое из этих (и всех других веществ) при изменении условий может перейти в любое другое из трёх агрегатных состояний.
В физике рассматривается четвёртое агрегатное состояние вещества — плазма, частично или полностью ионизированное состояние, в котором плотность положительных и отрицательных зарядов одинакова (плазма электронейтральна).
Кристаллы
Кристаллы — это твёрдые вещества, имеющие естественную внешнюю форму правильных симметричных многогранников, основанную на их внутренней структуре, то есть на одном из нескольких определённых регулярных расположений составляющих вещество частиц (атомов, молекул, ионов). Кристаллическая структура, будучи индивидуальной для каждого вещества, относится к основным физико-химическим свойствам. Составляющие данное твёрдое вещество частицы образуют кристаллическую решётку. Если кристаллические решётки стереометрически (пространственно) одинаковы или сходны (имеют одинаковую симметрию), то геометрическое различие между ними заключается, в частности, в разных расстояниях между частицами, занимающими узлы решётки. Сами расстояния между частицами называются параметрами решётки. Параметры решётки, а также углы геометрических многогранников определяются физическими методами структурного анализа, например методами рентгеновского структурного анализа.
Часто твёрдые вещества образуют (в зависимости от условий) более чем одну форму кристаллической решётки; такие формы называются полиморфными модификациями. Например, среди простых веществ известны ромбическая и моноклинная сера, графит и алмаз, которые являются гексагональной и кубической модификациями углерода, среди сложных веществ — кварц, тридимит и кристобалит представляют собой различные модификации диоксида кремния.
За последние 200 лет человечество изучило свойства веществ лучше, чем за всю историю развития химии. Естественно, количество веществ так же стремительно растет, это связано, прежде всего, с освоением различных методов получения веществ.
В повседневной жизни мы сталкиваемся с множеством веществ. Среди них – вода, железо, алюминий, пластмасса, сода, соль и множество других. Вещества, существующие в природе, например, кислород и азот, содержащиеся в воздухе, вещества, растворенные в воде, и имеющие природное происхождение, называются природными веществами. Алюминия, цинка, ацетона, извести, мыла, аспирина, полиэтилена и многих других веществ в природе не существует.
Их получают в лаборатории, и производит промышленность. Искусственные вещества не встречаются в природе, их создают из природных веществ. Некоторые вещества, существующие в природе, можно получить и в химической лаборатории.
Так, при нагревании марганцовки выделяется кислород, а при нагревании мела – углекислый газ. Ученые научились превращать графит в алмаз, выращивают кристаллы рубина, сапфира и малахита. Итак, наряду с веществами природного происхождения существует огромное множество и искусственно созданных веществ, не встречающихся в природе.
Вещества, не встречающиеся в природе, производятся на различных предприятиях: фабриках, заводах, комбинатах и т.п.
В условиях исчерпания природных ресурсов нашей планеты, сейчас перед химиками стоит важная задача: разработать и внедрить методы, при помощи которых можно искусственно, в условиях лаборатории, или промышленного производства, получать вещества, являющиеся аналогами природных веществ. Например, запасы топливных ископаемых в природе на исходе.
Может настать тот момент, когда нефть и природный газ закончатся. Уже сейчас ведутся разработки новых видов топлива, которые были бы такими же эффективными, но не загрязняли окружающую среду. На сегодняшний день человечество научилось искусственно получать различные драгоценные камни, например, алмазы, изумруды, бериллы.
Агрегатное состояние вещества
Таким образом, можно сделать важный вывод. Вещество при переходе из одного агрегатного состояния в другое не превращается в другие вещества. Сам процесс некоего изменения, превращения, называется явлением.
Физические явления. Физические свойства веществ.
Явления, при которых вещества изменяют агрегатное состояние, но при этом не превращаются в другие вещества, называют физическими. Каждое индивидуальное вещество обладает определенными свойствами. Свойства веществ могут быть различными или сходными друг с другом. Каждое вещество описывают при помощи набора физических и химических свойств. Рассмотрим в качестве примера воду. Вода замерзает и превращается в лед при температуре 0°С, а закипает и превращается в пар при температуре +100°С. Данные явления относятся к физическим, так как вода не превратилась в другие вещества, происходит только изменение агрегатного состояния. Данные температуры замерзания и кипения – это физические свойства, характерные именно для воды.
Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
Испарение спирта, как и испарение воды – физические явления, вещества при этом изменяют агрегатное состояние. После проведения опыта можно убедиться, что спирт испаряется быстрее, чем вода – это физические свойства этих веществ.
К основным физическим свойствам веществ можно отнести следующие: агрегатное состояние, цвет, запах, растворимость в воде, плотность, температура кипения, температура плавления, теплопроводность, электропроводность. Такие физические свойства как цвет, запах, вкус, форма кристаллов, можно определить визуально, с помощью органов чувств, а плотность, электропроводность, температуру плавления и кипения определяют измерением. Сведения о физических свойствах многих веществ собраны в специальной литературе, например, в справочниках. Физические свойства вещества зависят от его агрегатного состояния. Например, плотность льда, воды и водяного пара различна.
- цвет – бесцветная (в небольшом объеме)
- запах – без запаха
- агрегатное состояние – при обычных условиях жидкость
- плотность – 1 г/мл,
- температура кипения – +100°С
- температура плавления – 0°С
- теплопроводность – низкая
- электропроводность – чистая вода электричество не проводит
Кристаллические и аморфные вещества
При описании физических свойств твердых веществ принято описывать структуру вещества. Если рассмотреть образец поваренной соли под увеличительным стеклом, можно заметить, что соль состоит из множества мельчайших кристаллов. В соляных месторождениях можно встретить и весьма крупные кристаллы. Кристаллы – твердые тела, имеющие форму правильных многогранников Кристаллы могут иметь различную форму и размер. Кристаллы некоторых веществ, таких как поваренная соль – хрупкие, их легко разрушить. Существуют кристаллы довольно твердые. Например, одним из самых твердых минералов считается алмаз. Если рассматривать кристаллы поваренной соли под микроскопом, можно заметить, что все они имеют похожее строение. Если же рассмотреть, например, частицы стекла, то все они будут иметь различное строение – такие вещества называют аморфными. К аморфным веществам относят стекло, крахмал, янтарь, пчелиный воск. Аморфные вещества – вещества, не имеющие кристаллического строения
Химические явления. Химическая реакция.
Если при физических явлениях вещества, как правило, лишь изменяют агрегатное состояние, то при химических явлениях происходит превращение одних веществ в другие вещества. Приведем несколько простых примеров: горение спички сопровождается обугливанием древесины и выделением газообразных веществ, то есть, происходит необратимое превращение древесины в другие вещества. Другой пример: со временем бронзовые скульптуры покрываются налетом зеленого цвета. Дело в том, что в состав бронзы входит медь. Этот металл медленно взаимодействует с кислородом, углекислым газом и влагой воздуха, в результате на поверхности скульптуры образуются новые вещества зеленого цвета Химические явления – явления превращений одних веществ в другие Процесс взаимодействия веществ с образованием новых веществ называют химической реакцией. Химические реакции происходят повсеместно вокруг нас. Химические реакции происходят и в нас самих. В нашем организме непрерывно происходят превращения множества веществ, вещества реагируют друг с другом, образуя продукты реакции. Таким образом, в химической реакции всегда есть реагирующие вещества, и вещества, образовавшиеся в результате реакции.
- Химическая реакция – процесс взаимодействия веществ, в результате которого образуются новые вещества с новыми свойствами
- Реагенты – вещества, вступающие в химическую реакцию
- Продукты – вещества, образовавшиеся в результате химической реакции
Химическая реакция изображается в общем виде схемой реакции РЕАГЕНТЫ -> ПРОДУКТЫ
- реагенты – исходные вещества, взятые для проведения реакции;
- продукты – новые вещества, образовавшиеся в результате протекания реакции.
Любые химические явления (реакции) сопровождаются определенными признаками, при помощи которых химические явления можно отличить от физических. К таким признакам можно отнести изменение окраски веществ, выделение газа, образование осадка, выделение тепла, излучение света.
Многие химические реакции сопровождаются выделением энергии в виде тепла и света. Как правило, такими явлениями сопровождаются реакции горения. В реакциях горения на воздухе вещества реагируют с кислородом, содержащимся в воздухе. Так, например, металл магний вспыхивает и горит на воздухе ярким слепящим пламенем. Именно поэтому вспышку магния использовали при создании фотографий в первой половине ХХ века. В некоторых случаях возможно выделение энергии в виде света, но без выделения тепла. Один из видов тихоокеанского планктона способен испускать ярко-голубой свет, хорошо заметный в темноте. Выделение энергии в виде света – результат химической реакции, которая протекает в организмах данного вида планктона.
Лекарства, косметика, бытовая химия, многие пищевые добавки, вещи первой необходимости – все это получено с помощью химических веществ и их реакций. Роль этой науки большей частью положительна. И лишь бесконтрольное ее использование в отраслях потребительского рынка может нанести вред.
Роль химии в жизни человека
Химия – не только научно-теоретическая дисциплина. Это одна из самых применимых на практике наук. Ее открытиями пользуются промышленность, сфера услуг и просто любая семья.
Химия в быту

Каждая современная семья использует огромное количество средств бытовой химии – на кухне, в ванной, гостиной, спальне. Они помогают экономить время, сохранять здоровье, поддерживать чистоту, создавать красивый интерьер, выращивать растения, ухаживать за автомобилями.
Вот только некоторые из этих средств:
стиральные порошки, мыло;
клеи, краски, лаки;
пятновыводители, очистители, крема для обуви;
удобрения, вещества для защиты домашних растений от насекомых, болезней.
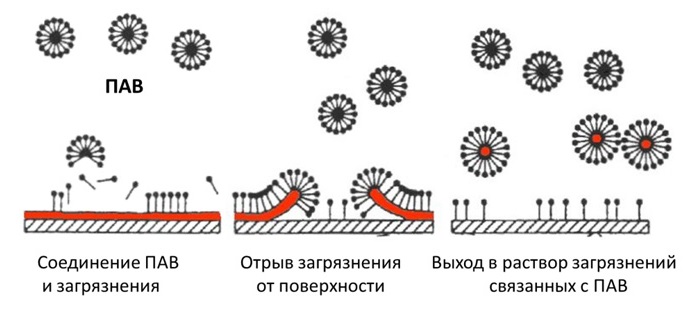
Так, при стирке активные вещества вступают в реакцию с грязью, в результате чего она как бы отталкивается от ткани. В хозяйственном мыле – это обычная щелочь природного происхождения, в порошках – синтетические ПАВ. Для создания красок тоже используют химию: едкий натр в гуаши, олифа – в масляных разновидностях.
Однако химия оставила свой след и в привычных операциях. Когда готовят пирог, то смешивают соду и лимонный сок. Происходит процесс растворения соды и выделения углекислого газа СО2. Он пробивает себе выходы, и тесто поднимается.
Очистка металлической посуды от накипи с помощью лимонной кислоты производится в результате растворения твердых карбонатных пленок (накипи) в кислой среде.
Химия и человеческий организм
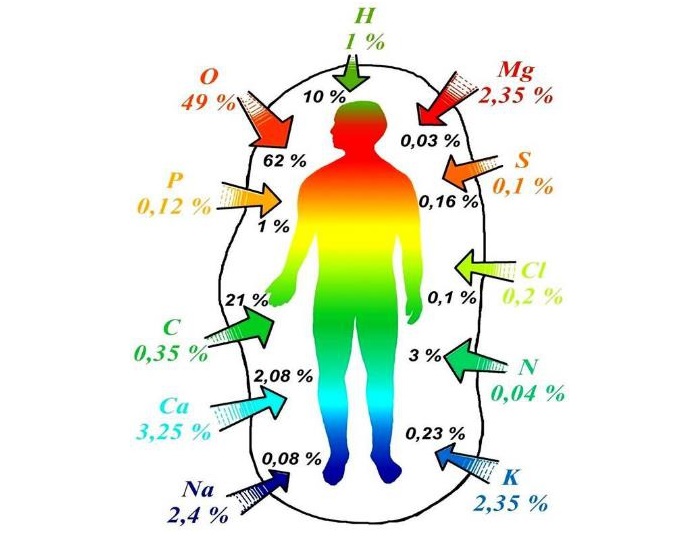
Человек – это сложная система, состоящая из различных элементов и органических веществ. Но требуется постоянное их пополнение. Кальций, калий, кислород, фосфор, аминокислоты – все это должно поступать в организм с едой.
Влияние внешних веществ по-разному воздействует на человека. Так, принятие аспирина с помощью химических реакции разжижает кровь. Для одного человека, с густой кровью и склонностью к тромбам, - это спасение. Для другого, с нарушением свертываемости крови, применение этого лекарства может довести до летального исхода.
Поэтому химические вещества или продукты с ними сопровождаются инструкциями, как обезопасить себя.
Пример: уксусную кислоту нельзя употреблять, не разбавив большим количеством воды. При работе с чистящими гелями, пастами, надо надевать перчатки. Нельзя употреблять слишком много соли из-за накопления натрия, ведущего к отекам.
Химия в промышленности
На химических реакциях основано большинство промышленных производств мира.
Читайте также:

