Доклад про кислород 6 класс география
Обновлено: 28.04.2024
Один из основных составляющих газового состава атмосферы (20,95%), по количеству занимает второе место после азота.
Словарь по географии . 2015 .
Смотреть что такое "кислород" в других словарях:
КИСЛОРОД — ( Охуgenum ). Бесцветный газ без запаха и вкуса. Мало растворим в воде (приблизительно 1:43). Ингаляциями кислорода широко пользуются при различных заболеваниях, сопровождающихся гипоксией: при заболеваниях органов дыхания (пневмония, отек легких … Словарь медицинских препаратов
КИСЛОРОД — (Oxygenium), О, химический элемент VI группы периодической системы, атомный номер 8, атомная масса 15,9994; газ, tкип 182,962шC. Кислород наиболее распространенный элемент, в атмосфере 23,10% по массе свободного кислорода, в гидросфере и… … Современная энциклопедия
КИСЛОРОД — (лат. Oxygenium) О, химический элемент VI группы периодической системы, атомный номер 8, атомная масса 15,9994. В свободном виде встречается в виде двух модификаций О2 ( обычный кислород) и О3 (озон). О2 газ без цвета и запаха, плотность 1,42897… … Большой Энциклопедический словарь
КИСЛОРОД — КИСЛОРОД, самый легкий элемент VI группы периодической системы Менделеева, симв. О, порядковый номер 8. К. газ без цвета, запаха и вкуса. Изотопов не имеет. Ат. в. 16,000, мол. в. 32,000. Уд. в. К. по отношению к воздуху 1,10535; при 0° и 760 … Большая медицинская энциклопедия
Кислород — самый распространенный элемент земной коры. Содер. его составляет 49,13 по весу и 91,8% по объему. В литосфере содер. 47% К. по весу, в гидросфере 85,89% и в атмосфере 23,01%. Подавляющая часть атомов К. (около 99,99%) имеет высокую хим.… … Геологическая энциклопедия
КИСЛОРОД — (символ О), обычно газообразный химический элемент, необходимый для ДЫХАНИЯ растений и животных и для горения. Был открыт в 1774 г. Джозефом ПРИСТЛИ и независимо от него Карлом ШЕЕЛЕ (около 1772 г.). Газ без вкуса и запаха, являющийся самым… … Научно-технический энциклопедический словарь
КИСЛОРОД — (Oxygenium), O, хим. элемент VI группы периодич. системы элементов, ат. номер 8, ат. масса 15,9994 а. е. м. Природный К. состоит из трёх стабильных изотопов: 16 О(99,762%),17 О (0,038%) и 18O (0,200%). Ядра атомов 16 О содержат 8 протонов и 8… … Физическая энциклопедия
кислород — халькоген, органоген, озон, оксиген Словарь русских синонимов. кислород сущ., кол во синонимов: 8 • газ (55) • неметалл … Словарь синонимов
КИСЛОРОД — КИСЛОРОД, кислорода, мн. нет, муж. Газ, химический элемент, входящий в состав воздуха и необходимый для дыхания. В тесной комнате чувствуется недостаток кислорода. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
КИСЛОРОД — КИСЛОРОД, а ( у), муж. Химический элемент, бесцветный газ, входящий в состав воздуха, необходимый для дыхания и горения. | прил. кислородный, ая, ое. Кислородное голодание, кислородная недостаточность (пониженное содержание кислорода в организме; … Толковый словарь Ожегова
КИСЛОРОД — самый распространенный в природе элемент, представляющий собой газ без цвета, запаха и вкуса. Встречается в соединении с водородом (вода), с разными металлами и металлоидами, в минералах и горных породах и в свободном состоянии в воздухе. Для… … Технический железнодорожный словарь
Кислород, или Oxygenium - это 8 элемент в 6 группе периодической системы химических элементов Менделеева с атомной массой 15,9994. Кислород представляет собой бесцветный и безвкусный газ, не имеющий запаха. Играет самую главную роль среди газов на Земле. Кислород – самый распространенный газ нашей планеты, его масса составляет примерно 6/7 массы гидросферы Земли.
Кислород впервые был открыт 1 августа 1774 года химиком Джозефом Пристли, который был англичанином. Получил Джозеф этот элемент путем разложения оксида ртути в закрытом, герметичном сосуде с помощью лучей 2HgO(t) = 2Hg+O2. Открытию кислорода также поспособствовали исследования француза Петра Байена. Его исследования заключались в изучении процесса окисления ртути и разложения ее оксида.
На три года раньше, в 1771 году кислород выделил Карл Шееле, путем прокаливания смеси серной кислоты и селитры, а получившийся оксид азота разложил на атомы. А гораздо позже, в 1777 году он выяснил, что кислород – часть воздуха, кислот и содержится в еще огромном количестве веществ. Эта работа была революционной для своего времени.
Ни для кого не секрет, что кислород уже очень давно применяют в промышленном производстве многих вещей. Его применение началось примерно с середины 20 века, после того, как изобрели различные устройства для разделения и сжижения воздуха.
Кислород часто используется в производстве различных металлов, к примеру, при конвертерном производстве стальной продукции. Также его используют при сварке металлов, используя баллоны с кислородом. В жидком виде вместе со сжиженным озоном возможно применение кислорода как окислителя ракетного топлива. Кислород входит в состав множества различных химических веществ, таких, как азотная кислота, пероксид водорода и др. Используется он и в медицинских целях. Причем его используют не только при проблемах с дыханием. Изотопы кислорода используются даже для такой сложной процедуры, как вычисление скорости движения крови в организме. Из него делаются кислородные коктейли, при некоторых заболеваниях даже вводят подкожно. Кислород используется даже в пищевой промышленности, как упаковочный газ и пищевая добавка Е948.

Популярные сегодня темы
Теме исследования космоса уделено огромное внимание ученых и любителей данной отрасли. Открытий множество, как и интересных фактов о нашей Солнечной системе
Египетские пирамиды, расположенный на обширном плато Гиза – пожалуй, самое известное из семи чудо света и единственное, которое современные люди могут увидеть собственными глазами.
Одним из самых известных ученых, сделавших невероятные открытия является Павлов Иван Петрович. Знаменитый физиолог создал учение о высшей нервной системе животных и людей.
Выдающийся художник Кирилл Викентьевич Лемох появился на свет 19 июня 1841 года в Москве, он был третьим ребенком в семье выдающегося педагога Викентия Лемоха. Родственники живописца были род
Медики различными методами пытаются предостеречь нерадивых горожан об опасности чрезмерного потребления алкоголя. В настоящее время, когда алкоголь занимает очень крепкую позицию в жизни люде

Научные доклады
Когда и кто открыл кислород?
Химические и физические свойства кислорода
В химии элемент образовывает 2 простых вещества — кислород О2 и О3. Газ О2 не имеет ни запаха, ни цвета. Его молекула притягивается магнитом, так как содержит 2 неспаренных электрона. Атмосферный кислород состоит из двухатомных молекул. В каждой молекуле имеются 2 неспаренных электрона. Молекула инертна и устойчива к высокой энергии активации.
Существуют модификации кислорода: жидкий голубой кислород, твердый кислород. Высокая химическая прочность связи между атомами приводит к тому, что газообразный кислород при комнатной температуре становится малоактивным. В природе он является важным участником процессов превращения и гниения. Интересно, что данный элемент при комнатной температуре реагирует с кровяным гемоглобином. Это обеспечивает транспортабельность кислорода ко всем органам организма.
Со многими веществами может вступать в связь без предварительного нагревания (с щелочноземельными и щелочными металлами, белым фосфором и альдегидами). При этом на поверхности изделий образуется ржавчина. При малейшем нагревании кислород повышает свою химическую активность. С водородом, горючими газами, метаном, простыми и сложными веществами кислород реагирует взрывом.
Изотопный состав элемента изменяется в зависимости от природных условий – он либо обогащается тяжелыми металлами, либо обедняется ими. Очень часто кислород выступает в роли окислителя. В процессе реакции выделяется свет и тепло. Из кислорода в естественных условиях на высоте 10—30 км, при грозовых разрядах, образуется озон (03). Он защищает планету от ультрафиолетового излучения и используется для очищения питьевой воды.
Как мы уже упоминали, кислород – это окислитель. Если окисляемый металл характеризуется высокой летучестью, то процесс происходит как горение с образованием оксида. Эффективность реакции зависит от восстановительной активности. При этом оксиды, выделяемые в процессе, могут быть кислотными, амфотерными и основными. Иногда при горении образуются пероксиды и надпероксиды.
Где применяется кислород?
Кислород используется в черной и цветной металлургии. Он интенсифицирует пирометаллургические и гидрометаллургические процессы. Благодаря элементу научились извлекать из руд золото. Это трудоемкая операция, но благодаря кислороду она протекает значительно быстрее. Также он применяется в химической промышленности, на нужды которой расходуется 30% производящего кислорода. Элемент берет участие в термоокислительном крекинге, когда получается ацетилен – вещество для сварки и резки металлов, для синтезов органических веществ.
Кислород применяется в космосе. Он выступает окислителем в двигателях космических кораблей второй ступени и в ракетах высотных исследований. В составе взрывчатых веществ находится жидкий кислород. Также он применяется в авиации и медицине. Когда затруднительное дыхание, при сердечных и легочных заболеваниях, то больным из кислородных подушек подают кислород.
Атмосфера это объем газа, которая состоит из разных смесей, на земле они считаются воздухом. Сам воздух состоит из молекул кислорода и с наибольшим участием азота. Незначительный процент разделяют другие газы - это пар, озон, инертные и углекислые газы, вместе все взятые которые существенно поддерживают жизнь на земле.
Как только появились на свете растения, они стали выделять и размножать кислород, соответственно жизнедеятельность всей земли, поддерживая живой природой, которая сама уже нуждается в заботе.
Выделение углекислого газа происходит извержением вулканов и при дыхании живых организмов, после фотосинтеза появляются органические вещества.
Когда увеличивается газ, что происходит регулярно, то образуется парниковый эффект и вода испаряется, повышается влажность воздуха, при которой человеку становиться комфортно. Однако усиленное парниковое состояние может быть угрозой таянию полярных льдов.
Атмосфера имеет свойственность собирать резервуар веществ и впоследствии выдавать внезапные ветра, влияющие на изменения давления и температуры воздуха.
Также состояние газов в атмосфере защищает земную оболочку от пере нагревания солнцем и переохлаждения луной, таким образом, регулируя тепловой режим.
В атмосфере еще есть тонкий слой, который защищает нас от воздействия солнца, называемый озоном. Озоновый экран появляется путём действия разрядов и лучей солнца, имеет запах свежести, особенно после грозы на высоте около 30 метров.
В атмосфере могут быть еще и вредные вещества, выделяемые промышленными предприятиями, автомобильными выхлопами, также микроорганизмы и пыль.
Атмосфера есть не только на нашей планете, но существуют планеты, которые состоят исключительно из газа. Уникальная атмосфера Земли также защищает от падения на нее мелких метеоритов и вредной радиации, и состоит она из пяти слоёв, длиною в десять тысяч километров.
В тропосфере существует человек и наблюдает за погодными изменениями, как образуются облака, дожди и град.
В стратосфере образуется тот самый защитный слой, где температура понижается и воздух становится плотным. А вот в Марсе этого слоя не существует, поэтому поверхность этой планеты достаточно выстуженная.
В мезосфере не могут летать ни самолеты, ни спутники, которые находятся в термосфере.
В термосфере нет воздуха, есть там только ионы, поэтому все летит там с огромной скоростью света.
После заключительной слои - экзосферой начинается космос.
Благодаря ультрафиолетовым лучам, проходящим малыми дозами через слой атмосферы, нам удаётся красиво загореть. А излучение нас заряжает энергией, обогащает кожу серотонином и витамином Д. Применяется ультрафиолетовое излучение, чтобы добиться бактерицидного эффекта, установления электронных структур частиц, а также борьбе с бактериями в медицинских учреждениях.
Кроме этого, ультрафиолетовые лучи используют в театрах для создания неповторимых световых эффектов.
Доклад №2
Планета Земля состоит из 6 основных оболочек сфер:
- Атмосфера (верхний слой)
- Гидросфера (поверхность)
- Литосфера (каменный слой Земли)
- Биосфера (слой для жизни)
- Пиросфера (огненная оболочка)
- Центросфера (ядро Земли)
Все оболочки настолько важны для жизнедеятельности на планете, что отсутствие или нарушение одной из них, будет гибель.
Атмосфера представляет собой газовый слой планеты Земля, который располагается на внешней стороне. Границы атмосферы пролагаются по двум сферам лито и гидросфера. Газовые вещества этой сферы подразделяются еще на 3 сферы:
- Тропосфера (двигающаяся оболочка)
- Стратосфера (находится выше тропосферы)
- Ионосфера (верхняя оболочка)
Определение тропосфер
Высота: 10 000м, масса: 75% всей атмосферы, перемещение воздушных масс: горизонтально и вертикально, образуют турбулентность, водяные пары, облака, циклоны, создают погодные явления, скапливается пыль, пар. Тропосфера прозрачная, холодная в ней есть озон. Подразделяется на:
Метеориты, попадая в эту сферу, начинают светиться и в итоге сгорают. С точки рассуждения, летательные аппараты не заходят в эту сферу. Для самолетов эта сфера называется мертвая зона.
Определение стратосферы
Высота над тропосферой: 80км, перемещение: только горизонтально, образуют слои из озона. В стратосфере удерживаются ультрафиолетовое излучения и трансформируется энергия кратковременных волн. Под этим влиянием лучей меняется магнитное поле, происходит распад молекул, образуются новые газовые вещества и другие химические соединения. Такой процесс можно видеть в виде северных сияний
Определение ионосферы
Четких границ не имеет. Подразделяется на 3 типа слоя
- Слой D (слабая ионизация воздуха, особенно в ночное время суток) распространена на высоте 60-90км
- Слой Е (средняя ионизация) высота 100-130км
- Слой F (сильно ионизированный) высота достигает до 1000км над уровнем моря
Благодаря открытию ионосферы, сейчас есть возможность передачи радио магнитных передач коротковолнового диапазона.
Атмосфера важна тем, что содержит огромное количество кислорода, который используется живыми организмами для дыхания. Еще атмосфера является защитником планеты от различных камнепадов с галактики, а также ультрафиолета.
Интересный факт
Атмосфера есть у всех известных нам 9 планет, кроме Меркурия
6 класс, по географии
Атмосфера

Жуки — это насекомые, которых относят к типу членистоногих и царству животных. Слово жук посвилось в следствии совмещения двух латинских слов – ножны и крылья. На Руси слово появилось благодаря подражанию звука, во время полета жук.
Медуз можно назвать одними из самых загадочных существ морей и океанов. Их относят к классу многоклеточных беспозвоночных. Они отлично охотятся и даже захватывают своих жертв, благодаря своим щупальцам. Медузы могут нормально существовать только
Арктикой называют северную часть планеты, находящуюся за полярным кругом. Арктическая граница проходит примерно на 66°33/ с.ш. Но встречают и места, заходящие в южные районы. Температура здесь опускается ниже 60 градусов, часто бывают метели и бураны.

Распространённость и свойства
Прежде всего, элемент необходим для дыхания активных организмов. Он также принимает участие в разложении мёртвых животных и растений. Содержание кислорода в земной коре составляет почти 50%, содержится в различных минералах в виде оксидов и солей. В связанном виде кислород входит в химический состав воды — его процентное соотношение составляет около 89%, а также в клетки всех живых существ — растений и животных.

Компонент характеризуется высочайшей химической насыщенностью и образует гибридные субстанции, состоящие из связанных атомов двух и более компонентов вместе с почти всей периодической таблицей, за исключением только лишь инертных газов (криптон, аргон, неон, гелий и ксенон). В период изменения акцентируется огромное количество тепла, такая реакция является экзотермичной. Он весьма тяжело приготовить в воде.
С повышением температуры водорастворимость убавляется. При снижении температуры вплоть до — 218*с он становится твёрдым.
При соприкосновении сжатого кислородного газа с распылёнными жирными веществами, полученными из веществ растительного, животного или минерального происхождения, происходит их самовозгорание. Это частый источник пожаров. Во избежание несчастных случаев кислородное оборудование должно быть тщательно обезжирено.
Бесцветное вещество обладает способностью образовывать взрывоопасные смеси и легковоспламеняющиеся газы, где поблизости находится источник открытого огня.
Извлечение вещества

Элемент из атмосферы можно приобрести с помощью специализированных установок. В них воздушное пространство фильтруется, избавляется от водорода и азота, малейших сухих элементов, углекислого газа, а также высушивается от влаги. Рециркулированный воздух сокращается компрессионной машиной, а газ перед нажимом переходит в конденсатор для сжижения. Для перевоплощения жидкого воздуха в газ применяются криоцилиндры либо приспособления для откачки с теплообменником. Этот химический компонент можно приобрести как в лаборатории, так и на промышленном предприятии.
Существует несколько способов получения кислорода в лабораторных условиях:
- С помощью реакции разложения хлората калия.
- За счёт разложения пероксида водорода при его нагревании в присутствии оксида марганца, который действует как катализатор.
- Через разложение перманганата калия.
Производство кислорода в промышленности осуществляется различными способами. Современное оборудование обеспечивает приготовление вещества любой степени чистоты.
Применение элемента
Химический элемент используется для жизнеобеспечения людей, страдающих затруднённым дыханием, а также для лечения некоторых недугов. Примечательно, что при нормальном давлении чистый кислород долго не, может быть, вдыхаем. Это небезопасно для здоровья в любой области. Бывает использование компонента в авиации.
Этот химический элемент используется в стекловаренных печах в качестве компонента, улучшающего горение в них. Кроме того, благодаря веществу промышленность сокращает выбросы оксидов азота до уровня, безопасного для жизни. Теплоэлектростанции, работающие на нефти, природном газе или угле, используют кислород для сжигания топлива. Без него все промышленные предприятия просто не работали бы.
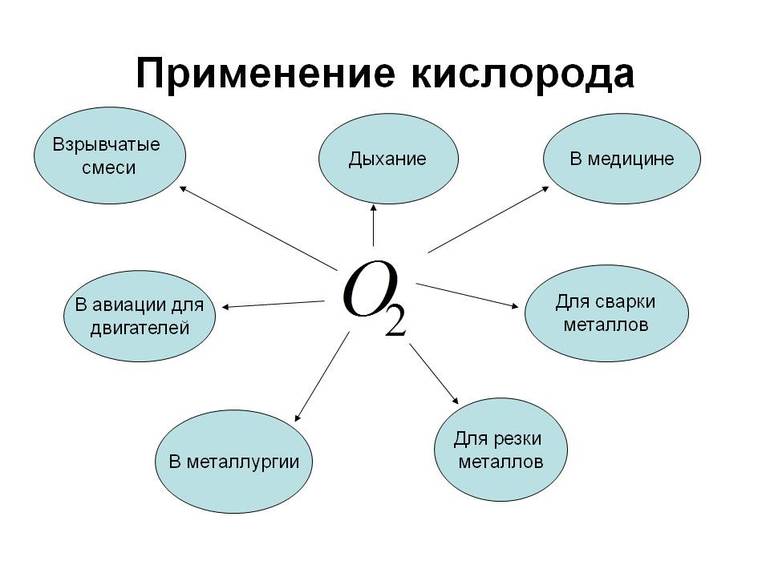
Этот химический элемент используется в спиртовании, делигнификации и других процессах, таких как:
- Отбеливание бумаги.
- Очистка сточных вод, что имеет большое значение.
- Подготовка питьевой воды в быту.
- Интенсификация сжигания отходов мусоросжигательных заводов и др.
В природе существует круговорот кислорода: в процессе фотосинтеза растения на свету превращают углекислый газ и воду в органические соединения. Этот процесс можно назвать выделением. Подобно людям и животным, растения ночью потребляют кислород из атмосферы, а потом растения вырабатывают его днём и расходуют ночью. Применение кислорода по химии 9 класса кратко рассматривают, пишут реферат с рисунками и схемами по теме.
Читайте также:

