Доклад по химии на тему окислительно восстановительные реакции
Обновлено: 19.05.2024
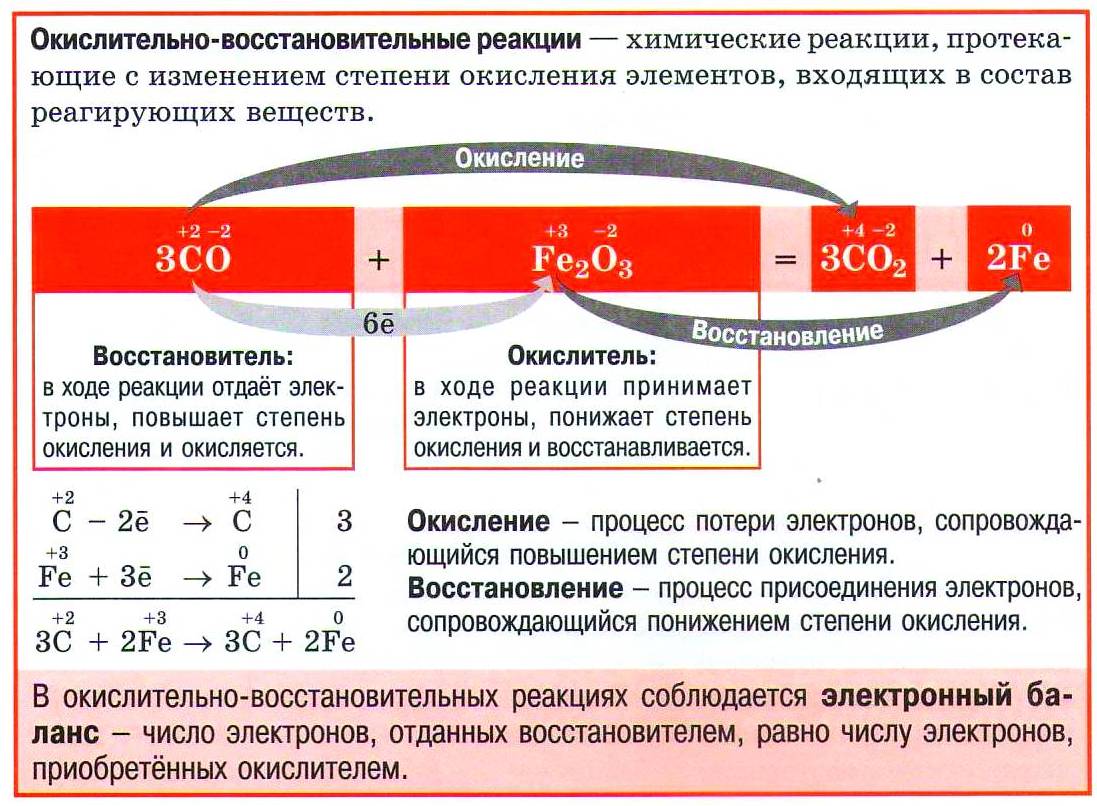
Окисли́тельно-восстанови́тельные реа́кции (ОВР) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление — процесс отдачи электронов, с увеличением степени окисления.
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества, называются донорами электронов, а атомы окислителя —акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель + e− ↔ сопряжённый восстановитель.
Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
восстановитель — e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
Виды окислительно-восстановительных реакций
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S + Cl2 → S + 2HCl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых атомы с промежуточной степенью окисления превращаются в эквимолярную смесь атомов с более высокой и более низкой степенями окисления, например:
Cl2 + H2O → HClO + HCl
Репропорционирование (компропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:
NH4NO3 → N2O + 2H2O
Окислительно-восстановительная реакция между водородом и фтором
Разделяется на две полуреакции:
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны — восстановителями.
Для запоминания процессов окисления-восстановления, а также свойств окислителей и восстановителей существует несколько мнемонических правил:
Отдать — Окислиться, Взять — Восстановиться (слова начинаются с одинаковых букв; при отдавании кем-либо чего-либо полезного — кислое, опущенное выражение лица, при получении — воспрявшее, восстановленное).
Окислитель — грабитель (в процессе окислительно-восстановительной реакции окислитель присоединяет электроны).

1.1 Правила расчёта степени окисления (СО)……………..……….
Глава 2. КЛАССИФИКАЦИЯ ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ……………………….….……
2.1 Межмолекулярные окислительно –восстановительные реакции ……………….………………………..…………………..…
2.2 Внутримолекулярные окислительно –восстановительные реакции ……………….………………………..…………………..…
Глава 3. МЕТОД ЭЛЕКТРОННОГО БАЛАНСА………………..……
5.2 Этапы развития представлений об окислительно – восстановительных реакциях………………………………………..
Химия – фундаментальная наука, тесно связанная с материальным миром знакомство с химией как с наукой начинается со школьного урока. Именно на уроке впервые зарождается интерес к науке химии, именно на уроке ребята учатся писать первые химические формулы и уравнения реакций, именно на уроке начинают понимать химическую картину мира.
Окружающий мир постоянно изменяется. С каждым годом во все области человеческой деятельности поступает огромное количество различных веществ, роль химических знаний становится очевидной, и ценность их постоянно возрастает. Именно знания о химических процессах в значительной степени могут обеспечить экологически грамотное отношение к природе и умелое обращение с веществами. Глубокое изучение основ химии очень важно специалистам большинства отраслей народного хозяйства: будущим врачам, химикам-технологам, инженерам – биотехнологам, военным специалистам, агрономам, ветеринарам и т. д.
Окислительно-восстановительные процессы принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. Окисление-восстановление - один из важнейших процессов природы. С этими реакциями связана жизнь любого живого существа: процессы обмена веществ в организме, фотосинтез, гниение и брожение. Окислительно-восстановительные реакции можно наблюдать при сгорании топлива, коррозии металлов, электролизе и выплавке металлов. С их помощью получают щелочи, кислоты и многие другие ценные химические вещества. Эти же реакции лежат в основе преобразования химической энергии в электрическую в гальванических и топливных элементах. Таким образом, окружающий нас мир можно рассматривать как гигантскую химическую лабораторию, в которой ежесекундно протекают химические реакции в основном окислительно-восстановительные.
Развитие представлений об окислительно-восстановительных реакциях началось с работ русского ученого и педагога С.В. Дайна, преподавателя Томского технологического института, который не только сформулировал и обобщил принципиальные особенности этого типа реакций, но и разработал методический подход к трактовке и изучению ОВР, как ряда последовательных стадий. Он теоретически обосновал и развил практические методы подбора стехиометрических коэффициентов в реакциях данного типа, фактически не претерпевшие изменений до настоящего времени.
При изучении школьного курса химии основной из задач учителя является формирование ключевых понятий (информационных, интеллектуальных, организационных, социальных, жизненных, предметных: обобщенно-теоретических и прикладных) у учащихся.
Если понятия не сформированы, то не могут быть усвоены ни законы, ни теории, поэтому данная проблема находится в центре внимания методистов и учителей. Согласно данным психолого-дидактических исследований можно выделить ключевые шаги формирования понятий:
применение понятий при усвоении новых знаний;
уточнение и закрепление содержания понятий.
Особенностью программы по химии является её концентричность, т.е. повторяемость из года в год одних и тех же тем с добавлением новых сведений, что способствует усвоению курса химии за весь период обучения. Такой подход делает процесс формирования понятий преемственным и непрерывным.
Изучение окислительно-восстановительных реакций вызывает у учащихся определенные трудности. Особенно сложно воспринимаются такие реакции в курсе органической химии, а между тем данная тема включена в задания части А, Б, С при сдаче экзамена в форме ЕГЭ. Все это требует поисков новых, нестандартных решений, оптимизации способов подачи материала.
- Глава 1. ПРИЗНАКИ ОИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ. СТЕПЕНЬ ОКИСЛЕНИЯ
- Глава 2. КЛАССИФИКАЦИЯ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
- Глава 4. НАПРАВЛЕННОСТЬ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ В РАСТВОРАХ
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
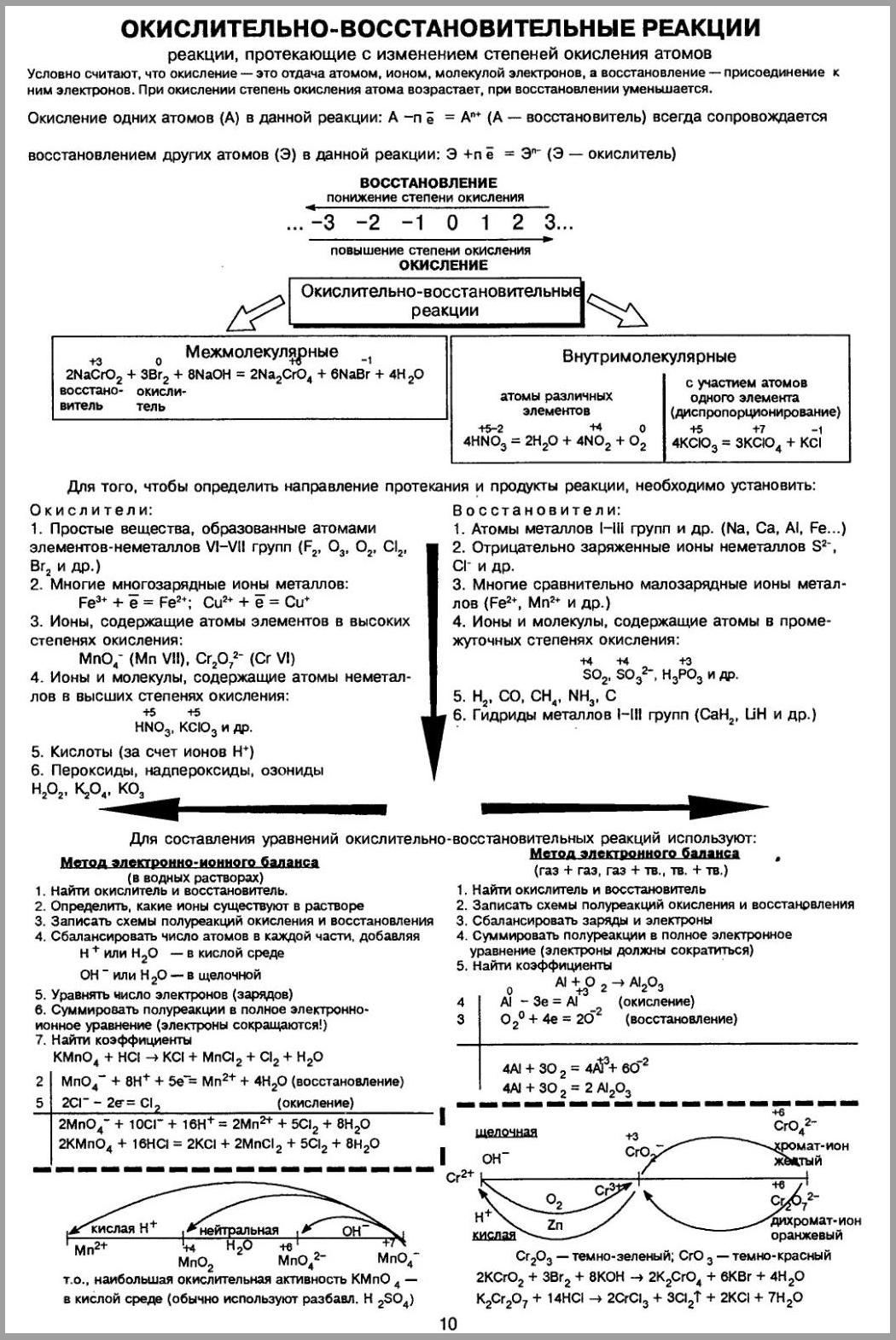
Окислительно-восстановительные реакции (ОВР) – это такие химические реакции, в которых происходит передача электронов от одних частиц (атомов, молекул, ионов) к другим, в результате чего степень окисления атомов, входящих в состав этих частиц, изменяется.
Наличие атомов, у которых в ходе реакции изменяется степень окисления - характерный признак ОВР.
Степень окисления (СО) – формальный заряд, который можно приписать атому, входящему в состав какой-либо частицы (молекулы, иона), исходя из предположения о чисто ионном характере связи в данной частице (частица состоит из ионизированных атомов).
1.1 Правила расчета степени окисления (СО)
Сумма СО всех атомов в частице равна заряду этой частицы (в простых веществах СО всех атомов равна 0).
В соединениях с ионным и ковалентно-полярным характером связи более электроотрицательным атомам соответствует более низкая СО. В бинарных ионных соединениях, атомы неметалла, как правило, проявляют минимальные СО.
Постоянную степень окисления имеют атомы: щелочных металлов (+1), щелочноземельных металлов (+2), водорода (+1) (кроме гидридов NaH, CaH2 и др., где степень окисления водорода -1), кислорода (-2) (кроме F2 -1 O +2 и пероксидов, содержащих группу –O–O–, в которой степень окисления кислорода -1). Например, в CaO2: СО(Сa)= +2, СО(О)= -1.
Степени окисления атомов в простых веществах равны нулю (Na 0 ; H2 0 ).
Максимальная СО равна номеру группы (для короткопериодного варианта периодической таблицы элементов Д.И. Менделеева), за исключением ряда элементов, входящих в VIIIБ и IБ-подгруппы, и некоторых f-элементов. Минимальная СО неметаллов = Nгр -8 . Например P +5 и P -3 , S +6 и S -2 .
Окислитель (Ox) – частица, которая в ходе ОВР приобретает электроны.
Восстановитель (Red) – частица, которая в ходе ОВР отдаёт электроны.
Восстановление – процесс, в ходе которого окислитель приобретает электроны и переходит в сопряжённую восстановленную форму. При восстановлении степень окисления понижается:
Mn +4 + 2ē → Mn +2 ; S 0 + 2ē → S -2 ; Cr +6 +3ē → Cr +3 ;
Cl2 0 +2ē → 2Cl - ; O2 0 + 4ē → 2O -2 .
Окисление – процесс, в ходе которого восстановитель отдаёт электроны и переходит в сопряжённую окисленную форму.
При окислении степень окисления повышается:
H2 0 - 2ē → 2H + ; S -2 - 2ē → S 0 ; Al 0 - 3ē → Al +3 ;
Fe +2 - ē → Fe +3 ; 2Br - - 2ē → Br2 0 .
Условная форма записи ОВР:
Cu 2+ + Zn 0 = Zn 2+ + Cu 0
Межмолекулярные окислительно-восстановительные реакции
Окислитель и восстановитель находятся в разных веществах; обмен электронами в этих реакциях происходит между различными атомами или молекулами:
S - восстановитель; O2 - окислитель
Внутримолекулярные окислительно - восстановительные реакции
Во внутримолекулярных реакциях окислитель и восстановитель находятся в одной и той же молекуле. Внутримолекулярные реакции протекают, как правило, при термическом разложении веществ, содержащих окислитель и восстановитель.
2KCl +5 O -2 → 2KCl -1 + 3O 0
Cl +5 - окислитель; О -2 – восстановитель
Диспропорционирование
Диспропорционирование - окислительно-восстановительная реакция, в которой один элемент одновременно повышает и понижает степень окисления.
Cl 2 0 + 2KOH → KCl +1 O + KCl -1 + H2O
Глава 3. МЕТОД ЭЛЕКТРОННОГО БАЛАНСА
Уравнивание ОВР основано на записи полуреакций окисления и восстановления.
Алгоритм метода:
Найти атомы, у которых изменяется СО, и составить схему полуреакций окисления и восстановления с участием этих атомов.
Уравнять каждую полуреакцию, добиваясь:
материального баланса (равенства числа атомов каждого элемента в правой и левой частях уравнения)
баланса по зарядам (равенства суммарных зарядов в правой и левой частях уравнения реакции). Для этого к левой части полуреакции добавляют или вычитают из неё необходимое количество электронов.
Умножить каждую полуреакцию на коэффициенты:
учитывающие стехиометрию реагирующих (образующихся) молекул (численное отношение между атомами в полуреакциях должно соответствовать стехиометрии молекул)
для достижения электронного баланса: сумма отданных электронов должна быть равна сумме принятых электронов.
Сложить полуреакции (при этом Σe = 0).
Проверить материальный баланс.

Одна из ключевых задач химии – предсказание направления и глубины протекания химической реакции. В случае ОВР имеется удобная возможность экспериментального

определения как максимальной полезной электрохимической работы

при постоянных давлении (р) и температуре (Т): . Знак “-“ перед Аэл.хим соответствует термодинамической системе знаков. Он означает, что система совершает работу Аэл.хим над окружающей средой. Неравенству соответствует протекание неравновесного и необратимого процесса, равенство выполняется для обратимых равновесных окислительно-восстановительных процессов, в которых отсутствуют другие виды работ (кроме работы расширения р∆V): Действительно, характерная особенность ОВР, отличающая этот вид химических реакций от других, состоит в том, что процессы окисления и восстановления можно пространственно разделить, если проводить реакцию в электрохимической цепи. При этом удаётся осуществить перенос электронов через металлический проводник и измерить величину, непосредственно
связанную с Аэл.хим, а именно электродвижущую силу (ЭДС).
Рассмотрим устройство и работу электрохимической цепи на примере элемента Даниэля (рис.1). Он состоит из цинкового электрода, погруженного в раствор сульфата цинка, и медного электрода, погруженного в раствор сульфата меди. Электроды соединены металлическим проводником, а растворы – солевым мостиком. Солевой мостик – это трубка, заполненная концентрированным раствором электролита с равными или близкими подвижностями анионов и катионов (например, КCl). Один конец трубки погружён в раствор ZnSO4, другой – CuSO4. При погружении металлического проводника в раствор, содержащий катионы того же самого металла, устанавливается динамическое равновесие между катионами М n+ , находящимися в растворе, и атомами М на поверхности электрода: М n+ + ne=М.
Часть атомов М в виде катионов М n+ переходит в раствор, в тоже время катионы М n+ могут восстанавливаться на поверхности электрода. Если преобладает прямая реакция, то пластина заряжается положительно, а раствор вблизи электрода отрицательно. Если преимущественно идёт обратная реакция, то пластина заряжается отрицательно, а раствор вблизи электрода – положительно. В любом случае в результате пространственного разделения зарядов противоположного знака на границе электрод – раствор образуется разность потенциалов - двойной электрический слой. Величина электрического потенциала электрода называется
электродным потенциалом (обозначение или ). Она зависит от температуры, природы металла, состава раствора и концентрации катионов M n+ . Чем активнее металл, тем ниже его электродный потенциал, в частности . Для того, чтобы в электрохимической цепи протекала окислительно-восстановительная реакция, необходимо, чтобы электроды были соединены проводником, а растворы - солевым мостиком. В этом случае электроны перемещаются от электрода с меньшим потенциалом (Zn) к электроду с большим потенциалом (Cu).
Элемент Даниэля.

Э лектрод, на котором протекает процесс окисления, называется анодом Zn 0 –2e = Zn 2+ . Электрод, на котором протекает процесс восстановления, называется катодом Сu 2+ + 2e = Cu 0 .
Если ОВР в электрохимической цепи протекает самопроизвольно, то такая цепь называется гальваническим элементом. Гальванические элементы находят применение в качестве химических источников тока. Если ОВР идёт под внешним воздействием в направлении, противоположном самопроизвольному, то такая электрохимическая цепь называется электролитической ячейкой. В ней протекает электролиз. Действительно, если к элементу Даниэля подключить внешний источник тока и подать на Сu- и Zn-электроды достаточно большие положительный и отрицательный потенциалы, соответственно, то на электродах будут протекать процессы, противоположные самопроизвольным:
Составление уравнений окислительно-восстановительные реакции методом полуреакций. Значение степени окисления элемента в веществе, проявление окислительно-восстановительной двойственности. Схема перемещения электронов от восстановителя к окислителю.
| Рубрика | Химия |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 31.08.2017 |
| Размер файла | 24,4 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Окислительно-восстановительные реакции (ОВР)
Большинство реакций являются окислительно-восстановительными реакциями (ОВ-реакциями). Они широко встречаются в природе, технике, быту, имеют большое биологическое значение. Фотосинтез, дыхание, гниение - все это ОВ-реакции. Много ОВ-реакций протекает в живых организмах.
В основе современных представлений об ОВ-реакциях лежат электронные представления, которые были предложены русским ученым Писаржевским в 1913г.
ОВ-реакции - это такие реакции, которые протекают с переходом электронов от одних частиц (восстановителя) к другим (окислителю), например, при вытеснении цинком меди из раствора сульфата меди (II).
При этом два электрона от атома цинка переходят к ионам меди, поэтому данная реакция будет ОВ-реакцией.
Можно дать и другое определение: ОВ-реакция - это реакция, протекающая с изменением степени окисления атомов реагирующих веществ.
Например, . В этой реакции изменяют степени окисления атомы цинка и меди, поэтому она будет ОВ-реакцией.
При протекании ОВ-реакции происходит процесс окисления и процесс восстановления.
Окисление - это процесс отдачи электронов частицей (молекулой, атомом, ионом). Частица, отдавая электроны, окисляется, а сама является восстановителем по отношению к другой частице.
Zn 2e Zn 2+ - процесс окисления, а цинк будет восстановителем.
При окислении степень окисления атома повышается (цинк повышает степень окисления от нуля до +2, то есть переходит из менее окисленного состояния Zn o в более окисленное состояние Zn 2+ ).
Восстановление - это процесс присоединения электронов частицей. Частица, присоединяя электроны, восстанавливается, а сама является окислителем по отношению к другой частице.
Cu 2+ + 2e Cu - процесс восстановления, а ион Cu 2+ будет окислителем. При восстановлении степень окисления атома уменьшается (медь понижает степень окисления с +2 до нуля).
Окисление и восстановление - это два неразрывно связанных процесса, то есть единый процесс в ОВ- реакции. Один без другого протекать не могут, то есть в ОВ - реакции одновременно с процессом окисления происходит и процесс восстановления. При этом сколько электронов отдает восстановитель при окислении, столько же электронов принимает окислитель при восстановлении и, таким образом, во всей ОВ-реакции не может быть ни лишних, ни недостающих электронов. Так в реакции одновременно с процессом окисления Zn, отдающего электроны, происходит процесс восстановления ионов Cu 2+ , принимающего два электрона. Таким образом, окисление и восстановление - это два сопряженных процесса в ОВ-реакции, а окислитель и восстановитель (Cu 2+ и Zn о ) составляют сопряженную пару в вышеприведенной ОВ-реакции.
Окислительно-восстановительные свойства элементов зависят от строения атома данного элемента и определяются положением элемента в ПСЭ. В периоде слева направо () восстановительные свойства элементов уменьшаются, а окислительные свойства увеличиваются. В главных подгруппах сверху вниз восстановительные свойства элементов увеличиваются. Поэтому чем правее и выше находится элемент в ПСЭ, тем будет проявлять более сильные окислительные свойства. Самыми сильными окислителями поэтому являются галогены (кроме иода) и кислород. И наоборот, чем левее и ниже находится элемент в ПСЭ, тем сильнее проявляет восстановительные свойства. Поэтому самыми сильными восстановителями являются щелочные (Na, K, Cs и др.) и щелочноземельные (Ca, Sr, Ba) металлы. окислительный восстановительный реакция электрон
Окислительно-восстановительные свойства зависят также от степени окисления элемента в веществе:
Если элемент (например, Mn и Cr) находится в высшей степени окисления (например, KMnO4, K2Cr2O7 и др.), то он может только понижать степень окисления, то есть только принимать электроны, являясь только окислителем.
Если элемент (например, йод и сера) находится в низшей степени окисления (KI, Na2S и др.), то может только повышать степень окисления, являясь только восстановителем.
Если элемент может проявлять в соединениях различную степень окисления и при этом в данном соединении имеет промежуточную степень окисления (Na2SO3, NaNO2, MnO2), то данный элемент может и повышать степень окисления, и понижать, то есть может и окисляться, и восстанавливаться, проявляя окислительно-восстановительную двойственность (то есть может быть и окислителем, и восстановителем). Например, в КNO2 азот имеет промежуточную степень окисления, равную +3 и может повышать ее до +5 (окисляясь до КNO3), и понижать до +2 (NO), то есть КNO2 может быть и окислителем, и восстановителем.
Вначале подбирают исходные реагирующие вещества, среди которых должен быть окислитель и восстановитель (А + В). Затем записывают продукты реакции (Д + Е), в которые превращаются исходные вещества. В результате получили схему ОВ-реакции: А + В Д + Е.
Затем расставляются коэффициенты в уравнении ОВ-реакции. Для составления уравнений ОВ-реакций используются два метода:
Метод электронного баланса;
Ионно-электронный метод или метод полуреакций.
Разберем оба метода в отдельности.
Дана молекулярная схема реакции:
Необходимо расставить коэффициенты.
Определяем степень окисления всех элементов во всех исходных и образующихся веществах и отмечаем (то есть пишем) степени окисления только тех элементов, у которых степень окисления изменилась (то есть у серебра и марганца):
Определяем окислитель и восстановитель. Марганец повышает степень окисления от нуля до +2, то есть отдал два электрона, поэтому окисляется, являясь восстановителем. Серебро понижает степень окисления от +1 до нуля, поэтому восстанавливается, принимая один электрон, являясь окислителем.
Составляем схему перемещения электронов от восстановителя к окислителю, то есть составляем уравнения процессов окисления и восстановления:
Так как должен быть электронный баланс во всей ОВ-реакции (то есть сколько электронов отдает восстановитель, то столько же электронов должен принять окислитель), то на один атом марганца Mn o требуется два иона серебра Ag + , то есть получаем:
Mn o + 2Ag + - 2e + 2e Mn +2 + 2Ag o
В самом деле, один атом марганца отдает два электрона, а два иона Ag + присоединят эти два электрона. Таким образом, будет электронный баланс во всей ОВ-реакции и не будет ни лишних электронов, ни недостающих электронов.
В итоге получаем уравнение ОВ-реакции (вместе с коэффициентами):
Метод полуреакций
Рассмотрим ОВ-реакцию, протекающую в кислой среде (среду создает H2SO4):
это молекулярная схема реакции
Определяем степени окисления элементов, которые изменяют степени окисления (то есть марганца и азота), а затем определяем окислитель и восстановитель.
Далее записываем ионную схему реакции: сильные и хорошо растворимые электролиты записываем в виде ионов; слабые электролиты, неэлектролиты, газы и осадки записываем в виде молекул:
Затем составляем полуреакции окисления и восстановления, то есть процессы окисления и восстановления.
Окислительно-восстановительные реакции
Учитель. В III в. до н.э. на острове Родос был построен памятник в виде огромной статуи Гелиоса (у греков – бог Солнца). Грандиозный замысел и совершенство исполнения Колосса Родосского – одного из чудес света – поражали всех, кто его видел.
Мы не знаем точно, как выглядела статуя, но известно, что она была сделана из бронзы и достигала в высоту около 33 м. Статуя была создана скульптором Харетом, на ее строительство ушло 12 лет.
Бронзовая оболочка крепилась к железному каркасу. Полую статую начали строить снизу и, по мере того как она росла, заполняли камнями, чтобы сделать ее устойчивее. Примерно через 50 лет после завершения строительства Колосс рухнул. Во время землетрясения он переломился на уровне колен.
Ученые считают, что истинной причиной недолговечности этого чуда стала коррозия металла. А в основе процесса коррозии лежат окислительно-восстановительные реакции.
Изучение нового материала
Учитель. Запишите молекулярные уравнения следующих реакций: взаимодействие сульфата меди (II) со щелочью и взаимодействие этой же соли с железом.
В каждом уравнении расставьте степени окисления элементов в формулах исходных веществ и продуктов реакции.

Учитель. Изменились ли степени окисления элементов в этих реакциях?
Ученик. В первом уравнении степени окисления элементов не изменились, а во втором изменились – у меди и железа.
Учитель. Вторая реакция относится к окислительно-восстановительным. Попробуйте дать определение окислительно-восстановительных реакций.
Ученик. Реакции, в результате которых изменяются степени окисления элементов, входящих в состав реагирующих веществ и продуктов реакции, называют окислительно-восстановительными реакциями.
Учащиеся записывают в тетради под диктовку учителя определение окислительно-восстановительных реакций.
Учитель. Что же произошло в результате окислительно-восстановительной реакции? До реакции у железа была степень окисления 0, после реакции стала +2. Как видим, степень окисления повысилась, следовательно, железо отдает 2 электрона.
У меди до реакции степень окисления +2, после реакции – 0. Как видим, степень окисления понизилась. Следовательно, медь принимает 2 электрона.
Железо отдает электроны, оно является восстановителем, а процесс передачи электронов называется окислением.
Медь принимает электроны, она – окислитель, а процесс присоединения электронов называется восстановлением.
Запишем схемы этих процессов:

Ученик. Атомы, молекулы или ионы, которые отдают электроны, называют восстановителями.
Атомы, молекулы или ионы, которые присоединяют электроны, называют окислителями.
Учитель. Какое определение можно дать процессам восстановления и окисления?
Ученик. Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом.
Окислением называют процесс передачи электронов атомом, молекулой или ионом.
Учащиеся записывают под диктовку определения в тетрадь и выполняют рисунок.

Отдать электроны – окислиться.
Взять электроны – восстановиться.
Учитель. Окисление всегда сопровождается восстановлением, и наоборот, восстановление всегда связано с окислением. Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем.
Для подбора коэффициентов в уравнениях окислительно-восстановительных реакций используют два метода – электронного баланса и электронно-ионного баланса (метод полуреакций).
Мы рассмотрим только метод электронного баланса. Для этого используем алгоритм расстановки коэффициентов методом электронного баланса.

П р и м е р. Расставьте коэффициенты в данной схеме реакции методом электронного баланса, определите окислитель и восстановитель, укажите процессы окисления и восстановления:
Fe2O3 + CO → Fe + CO2.
Воспользуемся алгоритмом расстановки коэффициентов методом электронного баланса.



Окислительно-восстановительные реакции очень распространены. С ними связаны не только процессы коррозии, но и брожение, гниение, фотосинтез, процессы обмена веществ, протекающие в живом организме. Их можно наблюдать при сгорании топлива. Окислительно-восстановительные процессы сопровождают круговороты веществ в природе.
Ключевые слова конспекта по химии для 11 класса: Окислительно-восстановительные реакции. Степень окисления. Окисление и восстановление. Окислитель и восстановитель. Метод электронного баланса.
Химия даёт множество примеров, иллюстрирующих один из основных философских законов — единства и борьбы противоположностей.
Единую структуру атома отражают его положительное ядро и отрицательно заряженные электроны оболочки. Природа амфотерных соединений заключается в единстве их кислотных и основных свойств. Обратимый гидролиз солей — это результат противоположных процессов: взаимодействия кислот и оснований с образованием соли и воды и разложение продуктов этого взаимодействия водой. Это утверждение справедливо для всех обратимых реакций: единство прямого и обратного химических процессов. Окислительно-восстановительные реакции — ещё один пример действия этого философского закона.
В пробирку налейте 4—5 мл раствора сульфата меди(II) и опустите в неё стальную канцелярскую скрепку. Оставьте пробирку в штативе на 1—2 мин. При наблюдении легко заметить, что в результате реакции стальная скрепка покрылась красноватым налётом свободной меди:
CuSO4 + Fe = FeSO4 + Сu
Для того чтобы выполнить задание, сформулированное в условии эксперимента, вам необходимо записать степени окисления элементов, образующих реагенты и продукты данной реакции.
Для дальнейшего рассмотрения окислительно-восстановительных реакций необходимо уметь быстро и безошибочно определять степени окисления атомов . Приведём основные правила, которые необходимо знать.
Рассмотрим пример расстановки степеней окисления атомов в перманганате калия КМnO4:

Следовательно,

Вернёмся к выполнению задания, указанного в лабораторном опыте:
Как видите, степени окисления в данной реакции изменили атомы железа и меди. Следовательно, эта реакция является окислительно-восстановительной.

Атомы железа в степени окисления 0 отдали два электрона, превратившись при этом в ион с зарядом +2: — процесс окисления.

Ионы меди в исходном веществе имели степень окисления +2, а в продукте реакции — степень окисления 0, т. е. каждый из них принял по два электрона: — процесс восстановления.


Итак, на схеме показано, что железо в этой реакции окисляется, являясь восстановителем; сульфат меди(II), а точнее, ионы , входящие в его состав, принимают 2 электрона, выступая в роли окислителя, т. е. восстанавливаются.

Окислительно–восстановительные реакции играют важную роль и в органической химии. Рассмотрим, например, реакцию горения метана и повторим, как рассчитываются коэффициенты и составляются уравнения окислительно–восстановительных реакций с использованием метода электронного баланса, т. е. равенства числа отданных и принятых электронов.

Убедиться, что атомы углерода в этой реакции теряют именно 8 электронов, поможет схема, где на числовом луче показаны степени окисления атомов, а также изменение этой величины в процессах окисления и восстановления.
Одно вещество в реакциях может выступать и в роли окислителя, и в роли восстановителя.
Во-первых, в состав вещества могут входить атомы элементов, один из которых проявляет свойства окислителя, а другой — восстановителя. Например, хлороводород (и его водный раствор — соляная кислота) проявляет окислительные свойства при взаимодействии с металлами за счёт катиона водорода и восстановительные благодаря наличию галогена в минимальной степени окисления :


Во-вторых, вещество может содержать атомы элемента в промежуточной степени окисления и выступать в качестве окислителя, принимая чужие электроны, или в качестве восстановителя, отдавая электроны другим атомам. Так, оксид серы(IV) в реакции с кислородом выступает в роли восстановителя, а в реакции с углеродом — окислителя:
Окислительно-восстановительные реакции используются на производстве (все металлургические процессы, синтез аммиака, производство кислот) и играют важную роль в процессах жизнедеятельности (процессы дыхания, горения и фотосинтеза).
В заключение подчеркнём единство окислительно–восстановительных процессов. Ведь если какой-то элемент или вещество окисляется (отдаёт электроны), то другое вещество обязательно восстанавливается (принимает эти электроны) с соблюдением электронного баланса. Эти процессы неразрывно связаны между собой.
Без изменения степеней окисления элементов протекают, например, реакции ионного обмена.

Окислительно-восстановительные реакции.
Шпаргалка по всей теме курса.
Читайте также:

