Доклад по химии бор
Обновлено: 20.05.2024
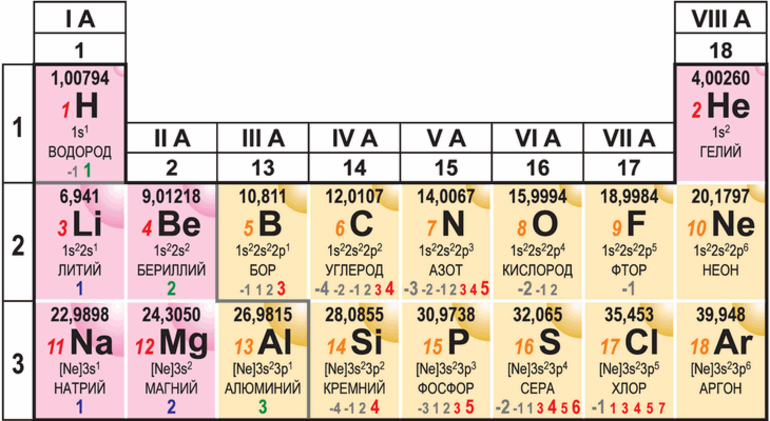
Бор— элемент главной подгруппы третьей группы, второго периода периодической системы химических элементов Д.И.Менделеева, с атомным номером 5. Обозначается символом B ( Borium ). В свободном состоянии бор— бесцветное, серое или красное кристаллическое либо тёмное аморфное вещество. Известно более 10 аллотропных модификаций бора, образование и взаимные переходы которых определяются температурой, при которой бор был получен.
История и происхождение названия химического элемента Бор
Впервые получен в 1808 году французскими физиками Ж. Гей-Люссаком и Л. Тенаром нагреванием борного ангидрида B2O3 с металлическим калием. Через несколько месяцев бор получил Х. Дэви электролизом расплавленного B2O3.
Получение
Наиболее чистый бор получают пиролизом бороводородов. Такой бор используется для производства полупроводниковых материалов и тонких химических синтезов.
1. Метод металлотермии (чаще восстановление магнием или натрием):


2. Термическое разложение паров бромида бора на раскаленной (1000—1200°C) танталовой проволоке в присутствии водорода:

Физические свойства
Чрезвычайно твёрдое вещество (уступает только алмазу, нитриду углерода, нитриду бора (боразону), карбиду бора, сплаву бор-углерод-кремний, карбиду скандия-титана). Обладает хрупкостью и полупроводниковыми свойствами (широкозонный полупроводник).
Химические свойства
По многим физическим и химическим свойствам неметалл бор напоминает кремний.
Химический бор довольно инертен и при комнатной температуре взаимодействует только со фтором:

.
При нагревании бор реагирует с другими галогенами с образованием тригалогенидов, с азотом образует нитрид бора BN, с фосфором— фосфид BP, с углеродом— карбиды различного состава (B4C, B12C3, B13C2). При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты, образуется оксид B2O3:

С водородом бор напрямую не взаимодействует, хотя известно довольно большое число бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов с кислотой:

При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов:


Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3.

При отсутствии окислителей бор устойчив к действию растворов щелочей. В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты .

Оксид бора — типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты:

При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты— бораты (содержащие анион BO3 3- ), а тетрабораты, например:

Применение
Элементарный бор
Бор (в виде волокон) служит упрочняющим веществом многих композиционных материалов.
Также бор часто используют в электронике для изменения типа проводимости кремния.
Бор применяется в металлургии в качестве микролегирующего элемента, значительно повышающего прокаливаемость сталей.
Соединения бора
Карбид бора применяется в компактном виде для изготовления газодинамических подшипников.
Отдельно также стоит указать на то что сплавы бор-углерод-кремний обладают сверхвысокой твёрдостью и способны заменить любой шлифовальный материал (кроме нитрида углерода, алмаза, нитрида бора по микротвёрдости), а по стоимости и эффективности шлифования (экономической) превосходят все известные человечеству абразивные материалы.
Сплав бора с магнием (диборид магния MgB2) обладает, на данный момент, рекордно высокой критической температурой перехода в сверхпроводящее состояние среди сверхпроводников первого рода. Появление вышеуказанной статьи стимулировало большой рост работ по этой тематике.
Бороводороды и борорганические соединения
Ряд органических производных бора (бороводороды) являются чрезвычайно эффективными ракетными топливами (диборан(B2H4), пентаборан, тетраборан и др.), а некоторые полимерные соединения с водородом и углеродом являются чрезвычайно стойкими к химическим воздействиям и высоким температурам, например широко известный пластик Карборан-22.
Биологическая роль
Бор — важный микроэлемент, необходимый для нормальной жизнедеятельности растений. Недостаток бора останавливает их развитие, вызывает у культурных растений различные болезни. В основе этого лежат нарушения окислительных и энергетических процессов в тканях, снижение биосинтеза необходимых веществ. При дефиците бора в почве в сельском хозяйстве применяют борные микроудобрения (борная кислота, бура и другие), повышающие урожай, улучшающие качество продукции и предотвращающие ряд заболеваний растений.
Роль бора в животном организме не выяснена. В мышечной ткани человека содержится (0,33—1)•10 – 4 % бора , в костной ткани (1,1—3,3)•10 – 4 % , в крови— 0,13мг/л. Ежедневно с пищей человек получает 1—3 мг бора. Токсичная доза— 4г.
Один из редких типов дистрофии роговицы связан с геном, кодирующим белок-транспортер, предположительно регулирующий внутриклеточную концентрацию бора.
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда

Бор (B, лат. borum ) — химический элемент 13-й группы, второго периода периодической системы (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе III группы, или к группе IIIA) с атомным номером 5. Бесцветное, серое или красное кристаллическое либо тёмное аморфное вещество. Известно более 10 аллотропных модификаций бора, образование и взаимные переходы которых определяются температурой, при которой бор был получен.
Содержание
- 1 История и происхождение названия
- 2 Нахождение в природе
- 3 Получение
- 4 Физические свойства
- 4.1 Изотопы бора
- 7.1 Элементарный бор
- 7.2 Соединения бора
- 7.3 Бороводороды и борорганические соединения
- 7.4 Боразон и его гексагидрид
![Бор]()
История и происхождение названия
Впервые получен в 1808 году французскими химиками Ж. Гей-Люссаком и Л. Тенаром нагреванием борного ангидрида B2O3 с металлическим калием. Через несколько месяцев бор получил Хэмфри Дэви электролизом расплавленного B2O3.
Название элемента произошло от арабского слова бурак (араб. بورق ) или персидского бурах (перс. بوره ), которые использовались для обозначения буры.
Нахождение в природе
Основные минеральные формы бора:
Также различают несколько типов месторождений бора:
![Бор]()
- Месторождения боратов в магнезиальных скарнах:
- людвигитовые и людвигито-магнетитовые руды;
- котоитовые руды в доломитовых мраморах и кальцифирах;
- ашаритовые и ашарито-магнетитовые руды.
- борные руды, отложенные из продуктов вулканической деятельности;
- переотложенные боратовые руды в озёрных осадках;
- погребённые осадочные боратовые руды.
- месторождения боратов в галогенных осадках;
- месторождения боратов в гипсовой шляпе над соляными куполами.
Крупнейшее месторождение России находится в Дальнегорске (Приморье). Оно относится к боросиликатному типу. В этом одном компактном месторождении сосредоточено не менее 3 % всех мировых запасов бора. На действующем при месторождении горно-химическом предприятии выпускается боросодержащая продукция, которая удовлетворяет потребности отечественной промышленности. При этом 75 % продукции идёт на экспорт в Корею, Японию и Китай.
Получение
- Наиболее чистый бор получают пиролизом бороводородов. Такой бор используется для производства полупроводниковых материалов и тонких химических синтезов.
- Метод металлотермии (чаще восстановление магнием или натрием):
- Термическое разложение паров бромида бора на раскалённой (1000—1200 °C) вольфрамовой проволоке в присутствии водорода (метод Ван-Аркеля):
Физические свойства
![Бор]()
Чрезвычайно твёрдое вещество (уступает только алмазу, нитриду бора (боразону), карбиду бора, сплаву бор-углерод-кремний, карбиду скандия-титана). Обладает хрупкостью и полупроводниковыми свойствами (широкозонный полупроводник).
У бора — самый высокий предел прочности на разрыв 5,7 ГПа.
Изотопы бора
В природе бор находится в виде двух изотопов 10 B (19,8 %) и 11 B (80,2 %).
10 B имеет очень высокое сечение захвата тепловых нейтронов, равное 3837 барн (для большинства нуклидов это сечение близко к единицам или долям барна), причём при захвате нейтрона образуются два нерадиоактивных ядра (альфа-частица и литий-7), очень быстро тормозящиеся в среде, а проникающая радиация (гамма-кванты) при этом отсутствует, в отличие от аналогичных реакций захвата нейтронов другими нуклидами:
10 B + n → 11 B* → α + 7 Li + 2,31 МэВ.
Поэтому 10 B в составе борной кислоты и других химических соединений применяется в атомных реакторах для регулирования реактивности, а также для биологической защиты от тепловых нейтронов. Кроме того, бор применяется в нейтрон-захватной терапии рака.
Кроме двух стабильных, известно ещё 12 радиоактивных изотопов бора, из них самым долгоживущим является 8 B с периодом полураспада 0,77 с.
Происхождение
Все изотопы бора возникли в межзвёздном газе в результате расщепления тяжелых ядер космическими лучами, или при взрывах сверхновых.
Химические свойства
![Бор]()
По многим физическим и химическим свойствам неметалл бор напоминает кремний.
Химически бор довольно инертен и при комнатной температуре взаимодействует только со фтором:
При нагревании бор реагирует с другими галогенами с образованием тригалогенидов, с азотом образует нитрид бора BN, с фосфором — фосфид BP, с углеродом — карбиды различного состава (B4C, B12C3, B13C2). При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты, образуется оксид B2O3:
С водородом бор напрямую не взаимодействует, хотя известно довольно большое число бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов кислотой:
При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов:
Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3.
При отсутствии окислителей бор устойчив к действию растворов щелочей. Растворяется в расплаве смеси гидроксида и нитрата калия:
В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты H3BO3.
Оксид бора B2O3 — типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты:
При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты — бораты (содержащие анион BO3 3− ), а тетрабораты, например:
В 2014 г. исследователями из Германии был получен бис(диазаборолил) бериллия, в котором атомы бериллия и бора образуют двухцентровую двухэлектронную связь (2c-2e), впервые полученную и нехарактерную для соседних элементов в Периодической таблице.
Применение
Элементарный бор
Бор (в виде волокон) служит упрочняющим веществом многих композиционных материалов.
Также бор часто используют в электронике в качестве акцепторной добавки для изменения типа проводимости кремния.
Бор применяется в металлургии в качестве микролегирующего элемента, значительно повышающего прокаливаемость сталей.
Бор применяется и в медицине при бор-нейтронозахватной терапии (способ избирательного поражения клеток злокачественных опухолей).
Соединения бора
Карбид бора применяется в компактном виде для изготовления газодинамических подшипников.
Отдельно также стоит указать на то, что сплавы бор-углерод-кремний обладают сверхвысокой твёрдостью и способны заменить любой шлифовальный материал (кроме алмаза, нитрида бора по микротвёрдости), а по стоимости и эффективности шлифования (экономической) превосходят все известные человечеству абразивные материалы.
Сплав бора с магнием (диборид магния MgB2) обладает, на данный момент, рекордно высокой критической температурой перехода в сверхпроводящее состояние среди сверхпроводников первого рода. Появление вышеуказанной статьи стимулировало большой рост работ по этой тематике.
Борная кислота применяется также в медицине и ветеринарии.
Нитрид бора, активированный углеродом, является люминофором со свечением от синего до жёлтого цвета под действием ультрафиолета. Обладает самостоятельной фосфоресценцией в темноте и активируется органическими веществами при нагреве до 1000 °C. Изготовление люминофоров из нитрида бора, состава BN/C не имеет промышленного назначения, но широко практиковалось химиками-любителями в первой половине XX века.
Боросиликатное стекло — стекло обычного состава, в котором заменяют щелочные компоненты в исходном сырье на окись бора (B2O3).
Фторид бора BF3 при нормальных условиях является газообразным веществом, используется как катализатор в оргсинтезе, а также как рабочее тело в газонаполненных детекторах тепловых нейтронов благодаря захвату нейтронов бором-10 с образованием ядер лития-7 и гелия-4, ионизирующих газ (см. реакцию выше).
Бороводороды и борорганические соединения
Ряд производных бора (бороводороды) являются эффективными ракетными топливами (диборан B2H6, пентаборан, тетраборан и др.), а некоторые полимерные соединения бора с водородом и углеродом стойки к химическим воздействиям и высоким температурам (как широко известный пластик Карборан-22).
Боразон и его гексагидрид
Нитрид бора (боразон) подобен (по составу электронов) углероду. На его основе образуется обширная группа соединений, в чём-то подобных органическим.
Так, гексагидрид боразона (H3BNH3, похож на этан по строению) при обычных условиях твёрдое соединение с плотностью 0,78 г/см 3 , содержит почти 20 % водорода по массе. Его могут использовать водородные топливные элементы, питающие электромобили.
Биологическая роль
Бор — важный микроэлемент, необходимый для нормальной жизнедеятельности растений. Недостаток бора останавливает их развитие, вызывает у культурных растений различные болезни. В основе этого лежат нарушения окислительных и энергетических процессов в тканях, снижение биосинтеза необходимых веществ. При дефиците бора в почве в сельском хозяйстве применяют борные микроудобрения (борная кислота, бура и другие), повышающие урожай, улучшающие качество продукции и предотвращающие ряд заболеваний растений.
Роль бора в животном организме не выяснена. В мышечной ткани человека содержится (0,33—1)⋅10 −4 % бора , в костной ткани (1,1—3,3)⋅10 −4 % , в крови — 0,13 мг/л. Ежедневно с пищей человек получает 1—3 мг бора. Токсичная доза — 4 г. ЛД₅₀ ≈ 6 г/кг массы тела.
Один из редких типов дистрофии роговицы связан с геном, кодирующим белок-транспортер, предположительно регулирующий внутриклеточную концентрацию бора.
Бор — простой элемент химической таблицы Менделеева. Открыт был около 200 лет назад, но до сих пор остается весьма загадочным веществом. Нет данных, что бор присутствует в природе в чистом виде, зато он встречается в составе более сотни минералов бора, в воде морей и соленых озер, в нефтяных водах, в вулканических и гейзерных породах.
Свойства бора
Если просмотреть несколько вполне авторитетных справочников, то можно с удивлением обнаружить значительные различия в числовых показателях. Так, внешний вид кристаллов бора описывается как серый, бесцветный и темно-бурый порошок. Вещество — кристаллическое или аморфное. Температура плавления колеблется от 2075 до 2300 °С, температура кипения — от 2550 до 3860 °С.
Свойства бора зависят от процентного соотношения изотопов. Известно, что бор мигрирует в природе; в процессе миграции соотношение изотопов может меняться, но что вызывает это перераспределение изотопов, точно не известно до сих пор.
Альтернативная органика
Бороводороды похожи на углеводороды. В перспективе, на основе бороводородов ученые надеются получать более энергоэффективное топливо для авиации, химически и термически стойкие полимеры.
Применение
— Фторид бора используется в счетчиках нейтронов.
— Бура и борная кислота применяются в медицине в качестве антисептика, лекарства от эпилепсии. Бор используют в радиотерапии злокачественных опухолей. Соединения бора входят в состав препаратов против болезней суставов.
— Соединения бора с водородом, а также с водородом и углеродом применяются в ракетном топливе, в производстве стойких к агрессивным веществам и высоким температурам пластиков.
— Аморфную форму нитрида бора иногда называют белым графитом и используют аналогично — в качестве высокотемпературной смазки. Как из графита получают алмаз, также при высоких давлениях получают боразон — исключительно твердый, огнестойкий и химически стойкий материал.В магазине Prime Chemicals Group по хорошим ценам продаются различные реактивы в розницу и оптом, в том числе борная кислота, а также лабораторная посуда, средства защиты, лабораторное оборудование и приборы. Есть доставка по Москве и Московской области, перед оформлением заказа можно получить консультацию квалифицированных менеджеров.
Порядковая таблица Менделеева является одним из самых великих изобретений XX века, поэтому немудрено, что изучать ее интересно не только детям, но и взрослым, для которых уроки химии остались в далеком прошлом. Пятый по атомному счету химический элемент бор не является исключением, ведь сегодня про него можно узнать много полезной информации, так как вещество получило широкое применение в разных сферах человеческой жизнедеятельности.
![Характеристика бора]()
Основные характеристики бора
Бор относится ко второму периоду, являясь тринадцатым элементом таблицы Менделеева и давая по меньшей мере десять аллотропных веществ различной модификации. Образование этих производных, представляющих собой простые вещества одного элемента, обычно напрямую зависит от температурного режима, при котором была получена сама первообразная (в этом случае бор).
Физические свойства
В естественной среде вещество может встречаться в разных видах, в одном случае будучи совершенно беспигментным, а в другом имея серый, красный или темно-бурый окрас. Меняться может и структура элемента, который имеет либо твердую кристаллизованную форму, либо выглядит как конденсат, что указывает на его аморфное состояние. Удивительно, но бор вполне справедливо считается одним из самых твердых элементов в мире, уступая в своей прочности только алмазу и еще нескольким представителям периодической системы.
Что касается его точных характеристик, то среди самых важных из них стоит выделить:
![Таблица менделеева]()
- Молярная атомная масса вещества соответствует 10,821 г/моль.
- Радиус атома равен 98 пм.
- Плотность элемента в нормальных условиях составляет 2,34 грамма на сантиметр кубический.
- Предел прочности на разрыв равен 5,7 ГПа, что автоматически делает бор абсолютным рекордсменом по этому показателю среди других элементов.
- Температура кипения соответствует 4138 Кельвина, что эквивалентно 3865 градусам Цельсия. При этом плавиться супертвердый и прочный элемент начинает только после того, как столбик термометра достигает 2075 градусов.
- Удельная теплота плавления и испарения равняется 23,6 и 504,5 кДж/моль, соответственно.
- Показатель молярной теплоемкости составляет 11,09 Дж/Кмоль.
- Молярный объем равен 4,6 сантиметра кубических на моль.
- Коэффициент теплопроводности вещества соответствует 27,4 Вт/мК.
- Температура Дебая, при которой возбуждаются все моды колебаний в рассматриваемом твердом теле, равняется 1250 Кельвина.
![Бор химический элемент]()
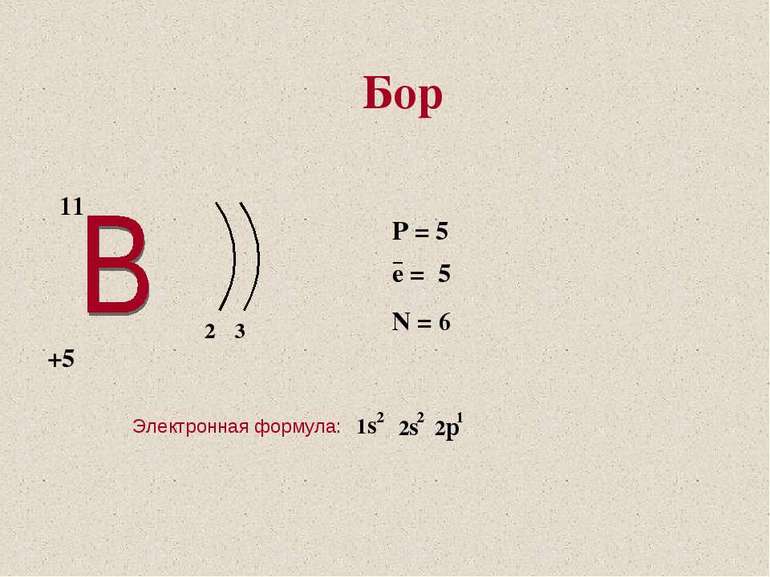
Электронная формула бора выглядит так: [He] 2s 2 2p 1 . В твердом состоянии вещество образует кристаллическую решетку с ромбоэдрической структурой строения и величинами a=10,17 и c=65.18 А, дающими коэффициент соотношения, равный 0,576. Несмотря на всю свою твердость, бор обладает хрупкостью и является полупроводником широкозонного типа. Не является металлом, относясь к группе неметаллов, хотя основные свойства бора очень близки с кремниевыми.
В естественной среде вещество можно встретить только в виде одного из двух изотопов 10 В и 11 В, притом что количество первого из них составляет 19,8% от общих запасов, тогда как процентная доля второго соответствует показателю в 80,12%. Каждый изотоп имеет свои особенности. К примеру, первый вариант демонстрирует крайне высокое ядерное эффективное сечение тепловых (медленных) нейронов, образуя на выходе два нерадиоактивных ядра, характеризующихся очень быстрыми тормозящимися свойствами в естественной среде.
Примечательно, что эти два изотопа относятся к стабильным, но помимо них существует еще не менее 12 изотопных конфигураций со своей валентностью и радиоактивными особенностями. Если рассматривать наиболее долгоиграющую производную, то ей, несомненно, является 8 В, период полураспада которой составляет 0,77 секунды.
Химические особенности
Название бора в периодической таблице представляет собой одну только латинскую букву B. Специалисты выделяют особую инертность этого элемента, из-за которой в нормальной среде он способен вступать в прямое химическое взаимодействие только с таким веществом, как фтор. Если же произвести его нагревание, то можно получить на выходе различные тригалогенидные производные начиная с нитрида бора, образуемого при соединении с азотом, и заканчивая фосфидом BP, который получается при взаимодействии с фосфором.
При использовании углерода получаются карбидовые смеси, имеющие разный состав и свойства. В открытом пространстве нагревание приводит к тому, что вещество быстро сгорает, выделяя большой объем тепловой энергии и образуя оксид B2O3, точное определение которого — ангидрид борной кислоты. Что касается водорода, то считается, будто бор не способен вступать с ним в прямой контакт, хотя науке известно довольно внушительное число всевозможных бороводородов, образуемых во время обработки щелочных боридов кислотными соединениями.
![Электронная формула бора]()
Если же прибегать к сильному нагреванию, то можно провести довольно интересный опыт, демонстрирующий восстановительные качества вещества, с помощью которого будет вполне реально выделить кремний, фосфор и другие элементы из их оксидных соединений. Стоит отметить, что в случае отсутствия окислителей в среде бор становится резистентным по отношению к действиям различных щелочных составов. В то же время он свободно плавится в гидроксидах, смешанных с нитратом калия.
Среди прочих параметров химической составляющей элемента стоит обозначить:
- Величина ковалентного радиуса бора равна 82 пм.
- Радиус иона соответствует 23 пм с максимальной погрешностью в большую сторону +3e.
- Показатель электроотрицательности составил 2,04 условные единицы по шкале Полинга.
- Степени окисления химического элемента равны -3/0/+3.
- Энергия ионизации в первом электроне равняется 800,2 кДж/моль.
![Свойства бора]()
Влияние на бор оказывает горячая азотная среда, а также его растворение в серной кислоте или в смеси концентрированных кислот, именуемой царской водкой, в результате чего образуется борная кислота, часто применяемая в медицине. Эта же составляющая имеет свойство содержаться в любом оксиде бора с возможностью выделения при взаимодействии с водой.
Если же прибегнуть к соединению бора с различными щелочами, то можно будет получить на выходе соли (тетрабораты), которые не стоит путать с привычными боратами, представляющими собой соли борной кислоты. Следует признать, что химические свойства элемента еще не являются до конца изученными и ежегодно исследователи делают новые открытия. Например, в 2014 году немецкие специалисты сумели вывести и распространить уникальную в своем роде двуцентровую связь двухэлектродного типа, получение которой стало возможным благодаря взаимодействию атомов бора и бериллия.
Интересные факты об элементе
Первыми учеными, которым удалось получить бор в чистом виде, стали известные в свое время французские химики по имени Жозеф Луи Гей-Люссак и Луи Жак Тенар. Произошло это знаковое событие в 1808 году в процессе нагревания борной кислоты с металлическим калием. Спустя всего лишь несколько месяцев это же открытие посчастливилось сделать другому светиле Гемфри Дэви из Британии, который смог вывести бор путем электролиза предварительно расплавленного бесцветного ангидрита.
Содержание в естественной среде
Различные боросодержащие минералы в избытке встречаются не только в земной коре, но и в морской воде, всевозможных соленых источниках, вулканах и даже в некоторых нефтяных месторождениях, практически во всех случаях тесно взаимодействуя с кислородом и его различными соединениями. А вот в чистом виде в природе бор не найти, несмотря на то, что его соединительные производные демонстрируют многомиллионные процентные доли.
![Применение бора]()
Так, все минеральные формы вещества условно делятся на две группы: боросиликаты (датолит и данбурит), а также бораты (бура, гидроборацит, ашарит, калиборит, иниоит). Классифицируются по типу нахождения элемента и основные его месторождения, среди которых принято выделять:
- Скарны магнезиального типа, под которыми могут подразумеваться людвигитовые/людвигито-магнетитовые, катоитидовые или ашаритовые/ашарито-магнетидовые руды. Здесь в основном добываются бораты.
- Известковые скарны (датолитовые и данбуритовые руды, богатые боросиликатами).
- Грейзены, представляющие собой метасоматические породы, которые состоят из кварца и слюды, турмалиновые концентрации и гидротермальные источники, также дающие боросиликаты.
- Вулканогенно-осадочные месторождения, которые включают в себя борную руду, отложившуюся в результате вулканической активности, бораты, переотложившиеся в осадках соленых озер, а также аналогичные руды в погребенных осадочных прослойках.
- Галогенно-осадочные источники, в состав которых входят бораты, хранящиеся в галогенных осадках и гипсовых наростах соляных куполов.
![Добыча бора]()
Добывается бор и на территории Российской Федерации. Так, крупнейшее месторождение этого элемента находится в небольшом городе Приморского края Дальнегорске, давая не менее 3 процентов вещества от общих мировых запасов.
Тут же располагаются и производственные мощности, сосредоточенные на обработке и выпуске различной борсодержащей продукции, изготавливаемой для промышленности России. Однако далеко не все объемы оседают на Родине, ведь около 75 процентов добываемого сырья идет на экспорт в такие соседние страны, как Япония, Китай и Корея.
Получение и применение
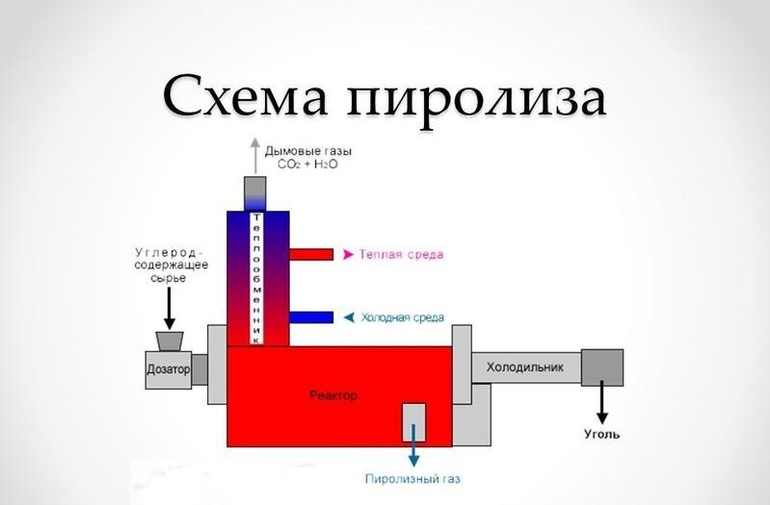
В настоящее время бор выводится несколькими способами, самым востребованным из которых является именуемый пиролизом процесс разложения борсодержащих водородных соединений на отдельные элементы, так как они позволяют выводить вещество в наиболее чистом виде. Что касается применения бора такого класса, то обычно он идет в ход для изготовления полупроводниковых элементов и самых тонких сплавов.
Кроме того, актуальным продолжает оставаться метод металлотермии, под которым подразумевается восстановление основных составляющих соединения. В качестве последних чаще всего используются магниевые и натриевые оксиды. Применяется и термическое разложение паров бромида с водородом, которое проводится непосредственно на вольфрамовой проволоке посредством ее нагревания до максимальных температур, колеблющихся в диапазоне от 1000 до 1200 градусов Цельсия.
![Схема пиролиза]()
Что касается области применения, то, благодаря своей высокой степени твердости, бром широко используется для усиления различных композитов. Помимо прочего, вещество улучшает качества проводимости кремния, с которым оно имеет очень много общего, по сути выступая в качестве акцепторной добавки или примеси в кристаллической решетке, добавляющей просветов в ее структуре. Также из бора изготавливаются микрогелирующие компоненты, активно применяемые в металлургии для проката стали.
Но главная польза от бора, безусловно, заключается в его терапевтических свойствах, ведь его часто используют для лечения опухолевых новообразований, благодаря возможности избирательного воздействия на злокачественные клетки в организме. Что касается вреда, который может нанести элемент человеку, то в настоящее время эта область является не до конца изученной.
Огромное применение получили и всевозможные борсодержащие соединения, ведь чего только стоит борная кислота, которая активно используется не только в медицине, но и в ветеринарии, в ювелирном деле и даже в такой серьёзнейшей отрасли, как атомная энергетика. Нельзя не отметить и ту роль, которую бор играет в биологической среде, являясь одним из самых важных элементов для полноценного развития и синтеза абсолютного большинства растительных культур.
Кроме того, от количества бора в почве напрямую зависит урожай, поэтому необходимо проводить постоянный ее анализ. В случае недостатка этого элемента крупные фермеры в обязательном порядке проводят удобрение грунта борсодержащими минеральными удобрениями, что дает им в итоге определенные привилегии.
Порядковая таблица Менделеева является одним из самых великих изобретений XX века, поэтому немудрено, что изучать ее интересно не только детям, но и взрослым, для которых уроки химии остались в далеком прошлом. Пятый по атомному счету химический элемент бор не является исключением, ведь сегодня про него можно узнать много полезной информации, так как вещество получило широкое применение в разных сферах человеческой жизнедеятельности.
![Химический элемент бор (В) - строение, общая характеристика и свойства]()
Основные характеристики бора
Бор относится ко второму периоду, являясь тринадцатым элементом таблицы Менделеева и давая по меньшей мере десять аллотропных веществ различной модификации. Образование этих производных, представляющих собой простые вещества одного элемента, обычно напрямую зависит от температурного режима, при котором была получена сама первообразная (в этом случае бор).
Физические свойства
В естественной среде вещество может встречаться в разных видах, в одном случае будучи совершенно беспигментным, а в другом имея серый, красный или темно-бурый окрас. Меняться может и структура элемента, который имеет либо твердую кристаллизованную форму, либо выглядит как конденсат, что указывает на его аморфное состояние. Удивительно, но бор вполне справедливо считается одним из самых твердых элементов в мире, уступая в своей прочности только алмазу и еще нескольким представителям периодической системы.
Что касается его точных характеристик, то среди самых важных из них стоит выделить:
![Химический элемент бор (В) - строение, общая характеристика и свойства]()
- Молярная атомная масса вещества соответствует 10,821 г/моль.
- Радиус атома равен 98 пм.
- Плотность элемента в нормальных условиях составляет 2,34 грамма на сантиметр кубический.
- Предел прочности на разрыв равен 5,7 ГПа, что автоматически делает бор абсолютным рекордсменом по этому показателю среди других элементов.
- Температура кипения соответствует 4138 Кельвина, что эквивалентно 3865 градусам Цельсия. При этом плавиться супертвердый и прочный элемент начинает только после того, как столбик термометра достигает 2075 градусов.
- Удельная теплота плавления и испарения равняется 23,6 и 504,5 кДж/моль, соответственно.
- Показатель молярной теплоемкости составляет 11,09 Дж/Кмоль.
- Молярный объем равен 4,6 сантиметра кубических на моль.
- Коэффициент теплопроводности вещества соответствует 27,4 Вт/мК.
- Температура Дебая, при которой возбуждаются все моды колебаний в рассматриваемом твердом теле, равняется 1250 Кельвина.
![Химический элемент бор (В) - строение, общая характеристика и свойства]()
Электронная формула бора выглядит так: [He] 2s 2 2p 1 . В твердом состоянии вещество образует кристаллическую решетку с ромбоэдрической структурой строения и величинами a=10,17 и c=65.18 А, дающими коэффициент соотношения, равный 0,576. Несмотря на всю свою твердость, бор обладает хрупкостью и является полупроводником широкозонного типа. Не является металлом, относясь к группе неметаллов, хотя основные свойства бора очень близки с кремниевыми.
В естественной среде вещество можно встретить только в виде одного из двух изотопов 10 В и 11 В, притом что количество первого из них составляет 19,8% от общих запасов, тогда как процентная доля второго соответствует показателю в 80,12%. Каждый изотоп имеет свои особенности. К примеру, первый вариант демонстрирует крайне высокое ядерное эффективное сечение тепловых (медленных) нейронов, образуя на выходе два нерадиоактивных ядра, характеризующихся очень быстрыми тормозящимися свойствами в естественной среде.
Примечательно, что эти два изотопа относятся к стабильным, но помимо них существует еще не менее 12 изотопных конфигураций со своей валентностью и радиоактивными особенностями. Если рассматривать наиболее долгоиграющую производную, то ей, несомненно, является 8 В, период полураспада которой составляет 0,77 секунды.
Химические особенности
Название бора в периодической таблице представляет собой одну только латинскую букву B. Специалисты выделяют особую инертность этого элемента, из-за которой в нормальной среде он способен вступать в прямое химическое взаимодействие только с таким веществом, как фтор. Если же произвести его нагревание, то можно получить на выходе различные тригалогенидные производные начиная с нитрида бора, образуемого при соединении с азотом, и заканчивая фосфидом BP, который получается при взаимодействии с фосфором.
При использовании углерода получаются карбидовые смеси, имеющие разный состав и свойства. В открытом пространстве нагревание приводит к тому, что вещество быстро сгорает, выделяя большой объем тепловой энергии и образуя оксид B2O3, точное определение которого — ангидрид борной кислоты. Что касается водорода, то считается, будто бор не способен вступать с ним в прямой контакт, хотя науке известно довольно внушительное число всевозможных бороводородов, образуемых во время обработки щелочных боридов кислотными соединениями.
![Химический элемент бор (В) - строение, общая характеристика и свойства]()
Если же прибегать к сильному нагреванию, то можно провести довольно интересный опыт, демонстрирующий восстановительные качества вещества, с помощью которого будет вполне реально выделить кремний, фосфор и другие элементы из их оксидных соединений. Стоит отметить, что в случае отсутствия окислителей в среде бор становится резистентным по отношению к действиям различных щелочных составов. В то же время он свободно плавится в гидроксидах, смешанных с нитратом калия.
Среди прочих параметров химической составляющей элемента стоит обозначить:
- Величина ковалентного радиуса бора равна 82 пм.
- Радиус иона соответствует 23 пм с максимальной погрешностью в большую сторону +3e.
- Показатель электроотрицательности составил 2,04 условные единицы по шкале Полинга.
- Степени окисления химического элемента равны -3/0/+3.
- Энергия ионизации в первом электроне равняется 800,2 кДж/моль.
![Химический элемент бор (В) - строение, общая характеристика и свойства]()
Влияние на бор оказывает горячая азотная среда, а также его растворение в серной кислоте или в смеси концентрированных кислот, именуемой царской водкой, в результате чего образуется борная кислота, часто применяемая в медицине. Эта же составляющая имеет свойство содержаться в любом оксиде бора с возможностью выделения при взаимодействии с водой.
Если же прибегнуть к соединению бора с различными щелочами, то можно будет получить на выходе соли (тетрабораты), которые не стоит путать с привычными боратами, представляющими собой соли борной кислоты. Следует признать, что химические свойства элемента еще не являются до конца изученными и ежегодно исследователи делают новые открытия. Например, в 2014 году немецкие специалисты сумели вывести и распространить уникальную в своем роде двуцентровую связь двухэлектродного типа, получение которой стало возможным благодаря взаимодействию атомов бора и бериллия.
Интересные факты об элементе
Первыми учеными, которым удалось получить бор в чистом виде, стали известные в свое время французские химики по имени Жозеф Луи Гей-Люссак и Луи Жак Тенар. Произошло это знаковое событие в 1808 году в процессе нагревания борной кислоты с металлическим калием. Спустя всего лишь несколько месяцев это же открытие посчастливилось сделать другому светиле Гемфри Дэви из Британии, который смог вывести бор путем электролиза предварительно расплавленного бесцветного ангидрита.
Содержание в естественной среде
Различные боросодержащие минералы в избытке встречаются не только в земной коре, но и в морской воде, всевозможных соленых источниках, вулканах и даже в некоторых нефтяных месторождениях, практически во всех случаях тесно взаимодействуя с кислородом и его различными соединениями. А вот в чистом виде в природе бор не найти, несмотря на то, что его соединительные производные демонстрируют многомиллионные процентные доли.
![Химический элемент бор (В) - строение, общая характеристика и свойства]()
Так, все минеральные формы вещества условно делятся на две группы: боросиликаты (датолит и данбурит), а также бораты (бура, гидроборацит, ашарит, калиборит, иниоит). Классифицируются по типу нахождения элемента и основные его месторождения, среди которых принято выделять:
- Скарны магнезиального типа, под которыми могут подразумеваться людвигитовые/людвигито-магнетитовые, катоитидовые или ашаритовые/ашарито-магнетидовые руды. Здесь в основном добываются бораты.
- Известковые скарны (датолитовые и данбуритовые руды, богатые боросиликатами).
- Грейзены, представляющие собой метасоматические породы, которые состоят из кварца и слюды, турмалиновые концентрации и гидротермальные источники, также дающие боросиликаты.
- Вулканогенно-осадочные месторождения, которые включают в себя борную руду, отложившуюся в результате вулканической активности, бораты, переотложившиеся в осадках соленых озер, а также аналогичные руды в погребенных осадочных прослойках.
- Галогенно-осадочные источники, в состав которых входят бораты, хранящиеся в галогенных осадках и гипсовых наростах соляных куполов.
![Химический элемент бор (В) - строение, общая характеристика и свойства]()
Добывается бор и на территории Российской Федерации. Так, крупнейшее месторождение этого элемента находится в небольшом городе Приморского края Дальнегорске, давая не менее 3 процентов вещества от общих мировых запасов.
Тут же располагаются и производственные мощности, сосредоточенные на обработке и выпуске различной борсодержащей продукции, изготавливаемой для промышленности России. Однако далеко не все объемы оседают на Родине, ведь около 75 процентов добываемого сырья идет на экспорт в такие соседние страны, как Япония, Китай и Корея.
Получение и применение
В настоящее время бор выводится несколькими способами, самым востребованным из которых является именуемый пиролизом процесс разложения борсодержащих водородных соединений на отдельные элементы, так как они позволяют выводить вещество в наиболее чистом виде. Что касается применения бора такого класса, то обычно он идет в ход для изготовления полупроводниковых элементов и самых тонких сплавов.
Кроме того, актуальным продолжает оставаться метод металлотермии, под которым подразумевается восстановление основных составляющих соединения. В качестве последних чаще всего используются магниевые и натриевые оксиды. Применяется и термическое разложение паров бромида с водородом, которое проводится непосредственно на вольфрамовой проволоке посредством ее нагревания до максимальных температур, колеблющихся в диапазоне от 1000 до 1200 градусов Цельсия.
![Химический элемент бор (В) - строение, общая характеристика и свойства]()
Что касается области применения, то, благодаря своей высокой степени твердости, бром широко используется для усиления различных композитов. Помимо прочего, вещество улучшает качества проводимости кремния, с которым оно имеет очень много общего, по сути выступая в качестве акцепторной добавки или примеси в кристаллической решетке, добавляющей просветов в ее структуре. Также из бора изготавливаются микрогелирующие компоненты, активно применяемые в металлургии для проката стали.
Но главная польза от бора, безусловно, заключается в его терапевтических свойствах, ведь его часто используют для лечения опухолевых новообразований, благодаря возможности избирательного воздействия на злокачественные клетки в организме. Что касается вреда, который может нанести элемент человеку, то в настоящее время эта область является не до конца изученной.
Огромное применение получили и всевозможные борсодержащие соединения, ведь чего только стоит борная кислота, которая активно используется не только в медицине, но и в ветеринарии, в ювелирном деле и даже в такой серьёзнейшей отрасли, как атомная энергетика. Нельзя не отметить и ту роль, которую бор играет в биологической среде, являясь одним из самых важных элементов для полноценного развития и синтеза абсолютного большинства растительных культур.
Кроме того, от количества бора в почве напрямую зависит урожай, поэтому необходимо проводить постоянный ее анализ. В случае недостатка этого элемента крупные фермеры в обязательном порядке проводят удобрение грунта борсодержащими минеральными удобрениями, что дает им в итоге определенные привилегии.
Читайте также: