В какой части мозга человека формируется ощущение боли кратко
Обновлено: 05.07.2024
Механизмы восприятия боли: головной мозг и боль
Согласно определению Международной ассоциации по изучению боли, боль — это неприятное чувствительное и эмоциональное переживание, связанное с истинным или потенциальным повреждением ткани или описываемое в терминах такого повреждения.
В составе спинномозговых нервов находятся дистальные отростки ганглионарных клеток, иннервирующих соматические ткани, в том числе кожу, париетальную плевру и брюшину, мышцы, суставные капсулы и кости. Проксимальные отростки отдают ветви на уровне зоны выхода задних корешков, далее в составе дорсолатерального пути Лиссауэра поднимаются вверх, пропуская пять или более сегментов спинного мозга, а затем оканчиваются в пластинах I, II и IV заднего рога. Аналогичные волокна тройничного нерва оканчиваются в спинномозговом ядре тройничного нерва.
Дистальные нервные отростки, направляющиеся от внутренних органов, имеют общую периневральную оболочку с постганглионарными волокнами симпатического ствола. Проксимальные отростки пересекаются с волокнами пути Лиссауэра и заканчиваются в этой же области. Считают, что перекрест соматических и висцеральных афферентных окончаний на дендритах центральных болевых нейронов объясняет возникновение отраженной боли при таких состояниях, как инфаркт миокарда или острый аппендицит.

б) Сенситизация ноцицепторов. При повреждении тканей из них происходит выброс различных активных веществ — брадикининов, простагландинов и лейкотриенов, которые понижают порог возбудимости ноцицепторов. При повреждении С-волокон происходит также активация аксон-рефлексов, в окружающие ткани высвобождаются субстанция Р и кальцитонин ген-связанный пептид (CGRP), стимулируя выброс гистамина тучными клетками. Гистаминовые рецепторы, которые могут располагаться на нервных окончаниях (Глава 8), способы стимулировать синтез арахидоновой кислоты за счет гидролиза мембранных фосфолипидов.
Фермент циклооксигеназа превращает арахидоновую кислоту в простагландины. (Механизм действия аспирина и других нестероидных противовоспалительных препаратов заключается в угнетении этого фермента и снижении синтеза простагландинов.)
В результате возникают длительная активация большого числа С-волокон и сенситизация механических ноцицепторов. Клинически это проявляется аллодинией, при которой даже легкое прикосновение к какой-то области вызывает болевые ощущения, и гипералгезией, когда даже незначительные болезненные стимулы воспринимают как сильнейшую боль.
Для синдрома раздраженного кишечника характерна сенситизация ноцицептивных интерорецепторов брюшной стенки. Такой механизм развития болевого синдрома характерен также для интерстициального цистита.
Сенситизация нейронов С-волокон может также происходить за счет изменения транскрипции генов, когда аномальные натриевые каналы встраиваются в клеточную мембрану нейронов заднего спинномозгового ганглия. В этом месте может возникать спонтанная электрическая активность, которая, как считают, может быть ответственна за неэффективность анальгетиков, блокирующих проведение нервного импульса на высоких уровнях.
Вирус может поддерживать боль за счет активации механизма транскрипции генов, который был описан выше. Центральные пути болевой чувствительности Центральные ноцицептивные нейроны подразделяют на две группы—специфические, с небольшой зоной периферической иннервации (около 1 см 2 ), а также имеющие широкий динамический диапазон (более 2 см 2 ). Это механические ноцицепторы, которые кодируют тактильные стимулы как импульсы низкой чистоты и болевые стимулы как импульсы высокой частоты.
Согласно общепринятому мнению, спиноталамический путь (или переднебоковой, учитывая его расположение в спинном мозге) состоит из различных волокон, которые отвечают как за различение болевых, температурных и тактильных стимулов (неоспиноталамический, или прямой, путь), так и за аффективную, двигательную и вегетативную реакции на боль (палеоспиноталамический, или непрямой, путь).
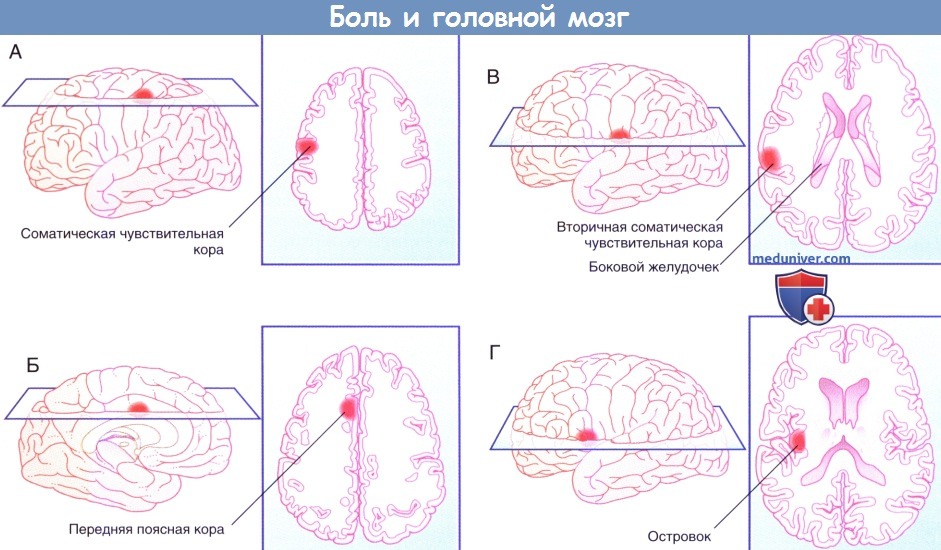
Зоны повышенной метаболической активности, возникающие при воздействии на правое предплечье болезненным горячим стимулом.
г) Прямой путь болевой чувствительности. Прямой путь для туловища и конечностей начинается от заднего рога спинного мозга и в составе спиноталамического пути направляется к задней части вентрального заднелатерального ядра таламуса с противоположной стороны. На голове и шее он начинается в спинномозговом ядре тройничного нерва и по тройнично-таламическим волокнам идет к задней части медиального ядра противоположного таламуса. Отсюда волокна преимущественно направляются к первичной соматической чувствительной коре (SI) и частично к верхней части латеральной борозды (SII). Установлена соматотопическая организация этой области, что удалось выявить при помощи проведения ПЭТ головного мозга во время воздействия теплового стимула на различные участки лица.
На рисунках ниже изображены проекции к задней теменной коре и SII.
В SII число ноцицептивных нейронов меньше, однако они также могут получать зрительную информацию. Они связаны с островком, который получает импульсы непосредственно от таламуса. При стимуляции островка в организме возникают вегетативные реакции (повышение частоты сердечных сокращений, вазоконстрикция, потоотделение). Интересно, что при повреждении островка человек перестает воспринимать болевые стимулы как неприятные, но при этом он все еще может локализовать стимул и определять его интенсивность. Такое состояние называют асимболией боли.
д) Непрямой путь болевой чувствительности. Непрямой путь — полисинаптический, в составе спиноретикулярного и тройнично-ретикулярного путей он направляется к дорсальному медиальному ядру таламуса, проецируясь (в том числе) к передней поясной коре. Эта область отвечает за аффективный компонент боли. Доказательством этого служит тот факт, что у пациентов с хроническим болевым синдромом успешно выполняют хирургическое пересечение (цингулотомию) или удаление (цингулэктомию) поясной коры. Пациенты сообщают, что сила болевых ощущений не изменилась, но боль при этом не кажется им такой нестерпимой. Точно такой же эффект дают инъекции морфия, вероятно, потому, что в передней поясной коре сосредоточено наибольшее число опиоидных рецепторов.
Резкий удар или внезапно возникшая боль любого происхождения способна вызвать у человека чувство страха. Его появление связано с активацией спиномезенцефалических волокон, идущих к ретикулярной формации среднего мозга, а также к миндалевидному телу и ядру мозга, которое в первую очередь отвечает за чувство страха (см. основной текст). Считают, что часть волокон может идти наверх в составе дорсолатерального пути Лиссауэра или рядом с ним; наличие этих волокон может объяснить сохранение болевого синдрома у некоторых из пациентов, перенесших хордотомию.
е) Центральная боль. Центральная боль практически всегда возникает вследствие активации центральных проецирующих боль нейронов (ЦПБН) спиноталамического и спиноретикулярного путей. За эти процессы отвечают следующие три механизма.
• Длительная активация глутаматных NMDA-рецепторов стимулами от заднего корешка, которую наблюдают в течение нескольких недель или месяцев. В результате развивается долгосрочная потенциация ЦПБН.
• Порог возбудимости ЦПБН может еще больше снижаться путем запуска транскрипции определенных генов за счет появления дополнительных глутаматных рецепторов на их нейронах.
Один из видов центральной боли — таламическая боль, которая возникает при инсульте в области белого вещества около заднего вентрального ядра таламуса. Появление сильнейшей боли в противоположной половине тела может быть связано с нарушением нормальных тормозных влияний, которые поступают в задние отделы таламуса от близлежащих ретикулярных ядер.
Все люди рано или поздно сталкиваются с болью, но мало кто знает где и как формируется болевое ощущение.
В данной статье нам хотелось бы приоткрыть завесу тайны механизмов передачи боли.
Как мы чувствуем боль? Давайте на минутку представим себе, что кто-то, конечно же, не Вы, порезал палец острым кухонным ножом. По какому же пути необходимо пройти болевому импульсу от поврежденного пальца, чтобы достигнуть головного мозга, где в конечном итоге и формируется ощущение боли?
Болевые рецепторы, находящиеся в коже в результате травмы активируются, благодаря выходу из поврежденных клеток различных химических веществ, таких как гистамин, субстанцию Р, серотонин (5HT), брадикинин и простагландины.
Болевые импульсы, генерируемые этими рецепторами, передаются затем по чувствительным спинномозговым (сенсорным) нервам, клеточные тела которых сгруппированы в небольшое образование, именуемое спинномозговым ганглием (узлом).
Поступившие в спинной мозг болевые импульсы обрабатываются в заднем роге, после чего ответно формируются импульсы, летящие через двигательные нервы к мышцам руки, приводя к её быстрому отдергиванию от повреждающего агента, в данном случае лезвия ножа. Такую основу имеет под собой безусловный (автоматический) рефлекс, не требующий участия головного мозга, или сознательной деятельности.
В зависимости от функционального состояния заднего рога спинного мозга (см. о воротной теории боли и феномене сенситизации заднего рога ниже), болевые сигналы вместе с тем направляются вверх по спино-таламическому пути спинного мозга к специфической структуре головного мозга, называемой таламус.
В дальнейшем, таламус, обработав посупившие к нему импульсы, отправляет специфические сигналы в центры, контролирующие кровяное давление, пульс, дыхание и эмоции. Вот почему в случае остро возникшей боли происходит учащение сердцебиения и дыхания, повышается кровяное давление, а также происходят знакомые всем нам эмоциональные и поведенческие изменения: появляется болезненная гримаса, человек дует на поврежденный палец или быстро трясет им в воздухе.
Между тем, болевые импульсы не останавливаются в таламусе, а передаются дальше в первичную сенсорную кору – специфическую область полушарий головного мозга, где происходит конечная обработка полученных сигналов.
Принято считать, что в таламусе все же происходит частичное восприятие поступающих болевых импульсов, однако их наиболее тонкая дискриминация (распознавание), происходит в первичной сенсорной коре полушарий головного мозга.
Важно отметить, что сперва, сразу после воздействия болевого раздражителя, формируется острое, с мгновенным началом, кратковременное болевое ощущение, передаваемое от области повреждения к задним рогам спинного мозга по толстым быстропроводящим сенсорным (чувствительным) волокнам - А-дельта волокнам.
За ним следует тупая, имеющая медленное начало, более длительная боль, передающаяся от травмированного участка в задний рог по волокнам меньшего диаметра с низкой скоростью проведения - C волокнам. Почему это важно? Предлагаем Вам ознакомиться с воротной теорией боли.
Воротная теория боли
Почему, получив то или иное повреждение мы незамедлительно потираем травмированный участок?
Потирание поврежденного участка приводит к возбуждению тактильных рецепторов (реагирующих на прикосновение) кожи, которые активируются и начинают посылать импульсы в задний рог спинного мозга через А-бета волокна. Эти сигналы, поступив в спинной мозг, блокируют проведение болевых импульсов, поступающих по С-волокнам, то есть закрывают ворота на боль.
На механизме блокирования ворот на боль основаны многие методы лечения, такие как иглоукалывание – стимулирут А-дельта волокна, а также ряд физиопроцедур (чрезкожная нейростимуляция, электромышечная стимуляция и т.д.). Ниже хотелось бы рассмотреть еще один, обратный воротному механизму феномен – сенситизацию заднего рога.
Феномен сенситизации заднего рога
В течение часа после травмы, происходят специфические изменения в заднем роге спинного мозга, получившие название феномена сенситизации, основной смысл которого заключается в том, что все поступающие в спинной мозг стимулы более легко проводятся по спинному мозгу в головной, а не блокируются на уровне заднего рога, препятствуя тем самым информационной перегрузке головного мозга.
Сенситизация обусловлена активацией Н-метил-Д-аспартам (NMDA) рецепторов. На блокаде этих рецепторов основан обезболивающий эффект ряда лекарственных препаратов.
Клинически сенситизация проявляется снижением порога восприятия как болевой, так и любой другой, будь то температурной, тактильной, вибрационной чувствительности в той области, за которую ответственен сенситизированный задний рог.
Порог болевой чувствительности изменяется по двум направлениям:
Стимулы, которые ранее расценивались как безболезненные, воспринимаются как боль;
Самые незначительные болевые импульсы воспринимаются как интенсивная боль.
Обычно, после травмы, явления сенситизации проходят одновременно с заживленинем поврежденных тканей. Напротив, у определенной части людей она сохраняется гораздо дольше, что в определенной степени можеть объяснять развитие хронических болевых синдромов. В ряде случаев, длительная сенситизация объясняется сохранением активного очага в поврежденной когда-то ткани, который посылает болевые импульсы в спинной мозг, поддерживая тем самым произошедшие в нем перестройки. В других - точная причина этого феномена неизвестна. Однако замечено, что существует тесная взаимосвязь между эмоциями и феноменом сенситизации заднего рога. Наличие у человека тревожных и депрессивных расстройств приводит к ослаблению нисходящих тормозных влияний на спинной мозг со стороны головного, что может приводить к поддержанию сенситизации.
Исходя из выше сказанного, методами лечения хронических болевых синдромов являются:

Обзор
Они знают, что такое боль.
Автор
Редакторы



Спонсором приза зрительских симпатий выступила компания BioVitrum.
Какая бывает боль?

Классификация боли, предложенная Клиффордом Вульфом [1], включает в себя четыре типа: ноцицептивная, воспалительная, невропатическая и функциональная. Кроме того, стоит отметить и психогенную боль.
Эпизод I: Пойманная угроза
Чтобы определить любой сигнал, наш организм использует внушительный арсенал белков-рецепторов. Их задача заключается в том, что они реагируют на строго определенный внешний фактор и передают сигнал об этом связывании при помощи конформационных изменений [2], влекущих за собой и изменение биохимических свойств этого рецептора. Переданные от рецептора сигналы усиливаются каскадом белковых взаимодействий в клетке, могут передаваться с помощью нервной или эндокринной систем и, в конечном итоге, приводят к физиологическому ответу.
Нейроны, работающие в ноцицептивной системе, различаются по набору рецепторов. Среди этих нейронов выделяются четыре группы: несущие рецепторы температуры, химического воздействия, механического воздействия и полимодальные (с рецепторами всех раздражителей).
Одни из важнейших рецепторов, реагирующих на тепло, — белки группы TRP. Это ионные каналы, неспецифичные к катиону, — при открытии они пропускают в клетку натрий, магний и кальций, в результате чего в клетке возникает потенциал действия, необходимый для передачи нервного импульса. Этих доблестных воинов термочувствительности несколько: TRPV1–TRPV4 и TRPM8. Первые активируются при повышенной температуре, второй же реагирует на холод. Эти каналы обладают интересной особенностью — помимо температуры, они могут активироваться химическими стимулами.
Биохимические механизмы этой активации отличаются от температурной, но в мозге возникают в ответ на эти химические стимулы практически те же ощущения, что и на изменение температуры. А теперь вспомните, какие продукты питания вызывают ощущение обжигания, а какие — холода? Думаю, почти каждый читатель сталкивался с этими продуктами. Острота перца чили обусловлена тем, что содержащийся в нем капсаицин активирует рецептор TRPV1 (такие вещества называются агонистами) [3]. А ментол, содержащийся в мяте, — агонист TRPM8, и вызывает чувство прохлады (рис. 2) [4].

Но если можно с помощью небольших молекул заставить нас чувствовать эффект ноцицепции, то, может, с помощью других молекул можно этот рецептор заблокировать? Да! Разработка антагонистов TRPV1 [3], которые, блокируя рецептор, могут снижать болевые ощущения, например, от капсаицина, ведется с 1990-х годов, однако большинство препаратов пока не достигли рынка (рис. 3). Интересно, что эти препараты предлагается применять для лечения невропатической боли, то есть той, когда рецепторы активируются без внешней причины. Достигнут ли фармкомпании успеха — покажет время.

Рисунок 3. Один из первых разработанных антагонистов TPRV1 — капсазепин. Этот препарат находится сейчас на стадии клинических испытаний. Вообще, успех подобного рода лекарств может стать новой вехой в истории фармакологии анальгетиков — блокирование ноцицепторов вместо ослабления болевого импульса на более поздних стадиях.
Механоноцицепторы — куда более разнородная и многообразная группа рецепторов, чем терморецепторы. Среди них стоит отдельно выделить рецепторы, активируемые, помимо давления, сигнальным олигопептидом брадикинином. Его рецептор В-1 синтезируется в поврежденных клетках — например, при получении травмы. Связывая брадикинин, он активирует сигнальный каскад, приводящий к возникновению боли. Интересно, что в число прямых эффектов от связывания рецептора входит усиление воспаления — то есть поддержание стимула для дальнейшей активации болевых рецепторов: чем больше боли, тем больше боли. Поэтому частая активация В-1 (например, постоянным воспалением при аутоиммунных заболеваниях) может стать причиной развития хронической боли [5].
Рецепторы, воспринимающие различные химические раздражители (ирританты), тоже разнообразная, а местами малоизученная группа. Среди них особо примечателен член уже знакомого нам семейства TRP — TRPA1. Этот рецептор активируется совершенно разными молекулами, зачастую, вступая с ними в реакцию, что приводит к необратимости эффекта. В числе широко известных ирринантов, активирующих TRPA1, — аллилизоцианат, содержащийся в знаменитой японской приправе васаби, и аллицин, содержащийся в чесноке (рис. 4).

Рисунок 4. Вкус васаби сильно отличается от чесночного, однако за восприятие остроты этих приправ отвечает один рецептор — TRPA1. Серосодержащие летучие вещества этих растений способны активировать рецептор и дальнейшую ноцицептивную передачу. Эти агенты пригождаются ученым при изучении химических основ работы рецепторов.
Отдельно стоит упомянуть боль, возникающую при воспалении. Ключевое вещество, на которое реагируют ноцицепторы, — гистамин, который некоторые клетки нашей иммунной системы (например тучные) выбрасывают в кровь в ответ на стимулы к воспалению. Гистамин связывается со своими рецепторами (из семейства GPCR). Активация гистаминового рецептора 1 типа (H1) приводит к активации фосфолипазы С (PLC) и гидролизу фосфатидилинозитолбисфосфата (PIP2) с образованием инозитолтрифосфата (IP3), который затем запускает высвобождение Ca 2+ из эндоплазматической сети. Кальций, связавшись с кальмодулином, активирует протеинкиназу С, которая, при помощи дальнейшего фосфорилирования регуляторных киназ, подавляет экспрессию потенциал-зависимых калиевых каналов 7 типа (Kv1.7), что приводит к деполяризации мембраны и проведению болевого импульса [7]. Интересно, что гистаминовые рецепторы 3 типа, которые локализованы в ЦНС, могут ингибировать проведение определенных ноцицептивных импульсов [8].
Стоит отметить, что другие активные игроки воспалительного процесса — простагландины — действуют похоже: в результате связывания простагландина Е2 с рецептором PTGER2 активируется протеинкиназа А, которая, в свою очередь, увеличивает экспрессию уже знакомого нам TRPV1 [9].
Эпизод II: Атака нервных волокон | Кондукция
Aβ-волокна работают еще быстрее (30–100 м/с) и сильно миелинизированы. Механорецепторы, расположенные в этих волокнах, крайне чувствительны, поэтому функция этих волокон — проведение сигналов о слабых раздражителях. Избыточная активация волокон Aβ вызывает аллодинию — боль, возникающую от причин, обычно ее не вызывающих, — например, от сидения на стуле.
Волокна типа C проводят нервный импульс медленно (0,5–2 м/с); в основном это сигналы от высокочувствительных механорецепторов и хеморецепторов.
Волокна C и Aδ работают синергично, обеспечивая основную массу болевых ощущений.
Эпизод III: Месть эндорфинов
Сигнал о боли достиг нейронов задних рогов спинного мозга, и уже очень скоро будет жарко. Хотя постойте, может, можно что-нибудь сделать? Может, сигнал несет организму чрезмерные страдания, превышающие пользу? А может, наоборот, сигнал недостаточен для осознания всей беды? В спинном мозге происходит модуляция ноцицептивного сигнала. Это поле для нейрохимической битвы двух сил — тормозящей и усиливающей.
По своей природе опиоидные рецепторы тоже являются GPCR, однако — ингибиторными. Будучи активированными, они подавляют работу аденилатциклазы, снижают уровень внутриклеточного цАМФ и, через киназных посредников активируют работу калиевых каналов, которая приводит к реполяризации клеточной мембраны. В конечном итоге эти меры замедляют проведение нервного импульса.
Кроме описанной системы, в ослаблении боли принимают участие всем известные тормозные нейромедиаторы — гамма-аминомаслянная кислота (ГАМК) [11] и глицин [12]; а опосредованно — многие другие сигнальные молекулы.
Одним из очень интересных модуляторов боли является субстанция Р. Это олигопептидный нейромедиатор, связывающийся с метаботропными рецепторами нейрокинина (NKR). NK1R, являясь уже знакомым нам GPCR, вызывает каскад реакций фосфорилирования через протеинкиназу С. В результате в клетке возрастает экспрессия генов натриевого канала Nav1.8, а в нейроне-ноцицепторе увеличивается синтез и наших старых знакомых — NMDA и TRPV1. Кроме того, субстанция Р снижает активность низкопорогового калиевого канала (Kv1.4) в чувствительных к капсаицину нейронах спинального ганглия и, таким образом, сенсибилизирует ноцицепторы. Интересно, что знаменитые грызуны-долгожители — голые землекопы [14] — практически не имеют в ЦНС субстанции Р, благодаря чему становятся нечувствительными ко многим видам боли [15].
То, в каком виде сигнал дойдет до головного мозга, определяется балансом между противоборствующими сторонами и силой изначального сигнала.
Часть IV: Новая проекция
В сером веществе спинного мозга различают 10 слоев (пластин Рекседа), каждый из которых отличается от других функционалом входящих в его состав нейронов, и, как следствие, — выполняемыми функциями. Чтобы нервный импульс попал на кору больших полушарий, сначала он должен пройти по восходящим путям этих пластин.
Синапс волокон Aδ и C со вторичными афферентными нейронами находится в дорсальном роге спинного мозга. Волокна Aδ и C передают информацию ноцицептивно-специфическим нейронам в I и II пластинах. Кроме того, импульс проецируется и на нейроны других пластин. Это нужно для того, чтобы впоследствии задействовать вторичные системы реакции мозга на боль (благодаря этому боль запоминается).
После того, как импульс проходит модуляцию в задних рогах, он передается нейронам восходящих трактов спинного мозга, каждый из которых имеет определенную функцию в распознавании боли.
Наиболее важны среди них спиноталамический тракт, участвующий в узнавании боли, спинопарабрахиальный тракт, участвующий в вегетативной и мотивационной регуляции реакции на боль, и спиномезенцефалический тракт, участвующий в активации нисходящих анальгетических путей, о действии которых мы говорили раньше.
Часть V: Головной мозг наносит ответный удар
Обработка информации о боли в головном мозге — самая разнообразная и индивидуальная для каждого человека часть работы ноцицепторной системы.
Стоит отметить, что у боли есть два разных компонента, за восприятие которых отвечают разные области мозга. Сенсорно-дискриминационные аспекты включают силу боли и ее локализацию, в то время как аффективно-эмоциональный компонент боли включает неприятный характер восприятия.
Для того чтобы мозг правильно локализовал источник боли, нервный импульс затем обрабатывается соматосенсорной корой.
Часть VI: Возвращение к наболевшему
Все мы ощущаем физическую боль при повреждениях нервных тканей нашего тела. Нервные импульсы направляются в мозг как сигнал, что тело необходимо отремонтировать. Сам мозг не может распознать боль, он может только интерпретировать эти сигналы, запустить необходимые механизмы восстановления и помочь нам понять, что что-то идет не так. Боль является важной защитной реакцией, ведь без нее мы могли бы нанести себе непоправимый вред. Существует редкое заболевание — врожденная анальгезия или синдром Бельмондо. Люди с таким синдромом обладает меньшей болевой чувствительностью или даже ее полным отсутствием.
Откуда таблетка знает, где у меня болит?
Правда ли, что мозг не чувствует боли?
Да, сам мозг не способен чувствовать боль, несмотря на то, что он состоит из нервных тканей. Дело в том, что когда происходит повреждение тканей мозга, не задействуется центр боли. Нервные клетки все так же посылают импульсы, но в данном случае — самим себе. Поскольку в этом процессе не участвует ЦНС, отклика не происходит. Поэтому операции на головном мозге проводятся без анестезии. А, например, при мигрени болит не мозг или череп, а реагируют нервные окончания соседних зон — мышцы, глаза, слизистые оболочки, вены.
Можно ли этим управлять?
Эффект плацебо, известный феномен сознания, очередной раз доказывает, что наш мозг удивителен. Просто веря в то, что таблетка поможет, мы способны вылечиться, даже если эта таблетка — пустышка. А когда в детстве мама дула на больной пальчик и успокаивала нас своей лаской, боль сразу отступала. Но это работает и в обратную сторону — сильные эмоциональные переживания могут спровоцировать вполне реальную физическую боль и даже развитие заболеваний.
Соответственно, нам надо научиться управлять болью, чтобы она не управляла нами. Для этого нужно осознанно отслеживать все реакции своего организма, понимать их причины, взаимосвязь свои поступков и чувств. Это все — аспекты критического мышления, которое развивается так же, как и другие функции мозга. Освоив технику критического мышления, вы сможете лучше понимать себя и свои мотивы, управлять своим состоянием для принятия взвешенных объективных решений.
Головной мозг расположен в полости черепа. Он защищен костями черепа и тремя мозговыми оболочками: мягкой, паутинной и твердой, между которыми циркулирует ликвор, который обеспечивает амортизацию головного мозга, предохраняет его от сотрясений при изменении положения тела.
2. Из каких отделов состоит головной мозг человека? Какие отделы входят в состав ствола мозга. Отразите это в виде общей схемы.
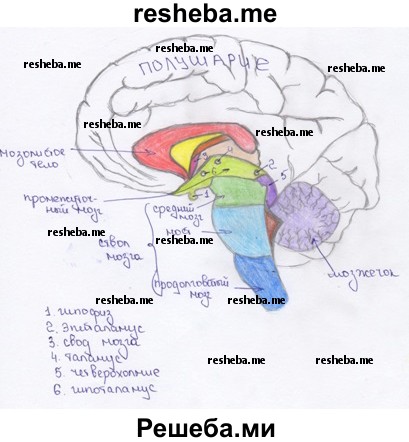
3. В чем сходство и различие в функциях продолговатого мозга и спинного мозга?
Продолговатый мозг является непосредственным продолжением спинного мозга выше затылочного отверстия и имеет сходное с ним строение. И продолговатый, и спинной мозг несут проводниковую и рефлекторную функции. Различие в расположении в продолговатом мозге скопления ядер, формирующих центры дыхания и кровообращения, центры некоторых пищеварительных (сосания, глотания, желудочной секреции) и защитных (кашля, чихания, рвоты, мигания) рефлексов.
4. Объясните, почему травмы в месте сочленения черепа с позвоночником часто приводят к смерти человека. В каких ситуациях это может произойти?
5. С повреждением какого отдела головного мозга связано нарушение мимики у человека?
За мимику человека отвечает лицевой нерв, центр которого расположен в мосте.
6. Как устроен мозжечок? К чему может привести его повреждение?
Мозжечок обеспечивает поддержание мышечного тонуса и позы тела, координирует движения тела, делая их более точными и согласованными, управляет сохранением равновесия, так как в мозжечок поступает информация от мышц, сухожилий, суставов и двигательных центров головного мозга. При разрушении червя мозжечка человек не может ходить и стоять, нарушается чувство равновесия. При поражениях полушарий наблюдается уменьшение тонуса мышц, сильная дрожь конечностей, нарушение точности и быстроты произвольных движений, быстрая утомляемость. Также расстраивается устная и письменная речь.
7. Какой отдел головного мозга отвечает за реакцию на зрительные и слуховые раздражители?
За реакцию на зрительные и слуховые раздражители отвечают четверохолмия среднего мозга.
8. В какой части мозга человека формируется ощущение боли?
Высшим центром болевой чувствительности является таламус.
9. Где расположен высший центр вегетативной нервной системы?
10. Какие из отделов головного мозга более развиты у человека по сравнению с другими позвоночными?
Строение головного мозга практически всех позвоночных сходно и состоит из 5 отделов. Для человека характерна большая дифференциация борозд и извилин больших полушарий по сравнению с другими позвоночными, большее развитие зрительных центров, так как только человек и приматы могут видеть всю цветовую гамму.
Читайте также:
- Как нижегородский староста относится к приглашению иностранцев для решения внутренних проблем кратко
- Как в первом диалоге чацкого и софьи раскрывается отношение героя к барской москве кратко
- Какими достижениями прославилась империя карла великого кратко
- За что можно уволить помощника воспитателя в доу
- Что такое мицвот кратко


