В чем заключаются структурные особенности аминокислот как мономеров белков кратко
Обновлено: 05.07.2024
Белки — высокомолекулярные органические соединения, состоящие из остатков α-аминокислот.
В состав белков входят углерод, водород, азот, кислород, сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.
Белки обладают большой молекулярной массой: яичный альбумин — 36 000, гемоглобин — 152 000, миозин — 500 000. Для сравнения: молекулярная масса спирта — 46, уксусной кислоты — 60, бензола — 78.
Аминокислотный состав белков
Белки — непериодические полимеры, мономерами которых являются α-аминокислоты. Обычно в качестве мономеров белков называют 20 видов α-аминокислот, хотя в клетках и тканях их обнаружено свыше 170.
В зависимости от того, могут ли аминокислоты синтезироваться в организме человека и других животных, различают: заменимые аминокислоты — могут синтезироваться; незаменимые аминокислоты — не могут синтезироваться. Незаменимые аминокислоты должны поступать в организм вместе с пищей. Растения синтезируют все виды аминокислот.
В зависимости от аминокислотного состава, белки бывают: полноценными — содержат весь набор аминокислот; неполноценными — какие-то аминокислоты в их составе отсутствуют. Если белки состоят только из аминокислот, их называют простыми. Если белки содержат помимо аминокислот еще и неаминокислотный компонент (простетическую группу), их называют сложными. Простетическая группа может быть представлена металлами (металлопротеины), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
Все аминокислоты содержат: 1) карбоксильную группу (–СООН), 2) аминогруппу (–NH2), 3) радикал или R-группу (остальная часть молекулы). Строение радикала у разных видов аминокислот — различное. В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы.
Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах.
Пептидная связь
Пептиды — органические вещества, состоящие из остатков аминокислот, соединенных пептидной связью.
Образование пептидов происходит в результате реакции конденсации аминокислот. При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой между ними возникает ковалентная азот-углеродная связь, которую и называют пептидной. В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно. Это приводит к образованию полипептидов. На одном конце пептида находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа (его называют С-концом).

Пространственная организация белковых молекул
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков.
Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.

Если молекула белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, — 10 20 . Имея 20 аминокислот, можно составить из них еще большее количество разнообразных комбинаций. В организме человека обнаружено порядка десяти тысяч различных белков, которые отличаются как друг от друга, так и от белков других организмов.
Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).

Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.

Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо.
Свойства белков
Купить проверочные работы
по биологии




Аминокислотный состав, структура белковой молекулы определяют его свойства. Белки сочетают в себе основные и кислотные свойства, определяемые радикалами аминокислот: чем больше кислых аминокислот в белке, тем ярче выражены его кислотные свойства. Способность отдавать и присоединять Н + определяют буферные свойства белков; один из самых мощных буферов — гемоглобин в эритроцитах, поддерживающий рН крови на постоянном уровне. Есть белки растворимые (фибриноген), есть нерастворимые, выполняющие механические функции (фиброин, кератин, коллаген). Есть белки активные в химическом отношении (ферменты), есть химически неактивные, устойчивые к воздействию различных условий внешней среды и крайне неустойчивые.
Внешние факторы (нагревание, ультрафиолетовое излучение, тяжелые металлы и их соли, изменения рН, радиация, обезвоживание)
могут вызывать нарушение структурной организации молекулы белка. Процесс утраты трехмерной конформации, присущей данной молекуле белка, называют денатурацией. Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные. Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций. Если денатурация не сопровождается разрушением первичной структуры, то она может быть обратимой, в этом случае происходит самовосстановление свойственной белку конформации. Такой денатурации подвергаются, например, рецепторные белки мембраны. Процесс восстановления структуры белка после денатурации называется ренатурацией. Если восстановление пространственной конфигурации белка невозможно, то денатурация называется необратимой.
Функции белков
| Функция | Примеры и пояснения |
|---|---|
| Строительная | Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран (липопротеины, гликопротеины), волос (кератин), сухожилий (коллаген) и т.д. |
| Транспортная | Белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ; в состав клеточных мембран входят особые белки, которые обеспечивают активный и строго избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно. |
| Регуляторная | Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например, гормон инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов. |
| Защитная | В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует остановке кровотечений. |
| Двигательная | Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных. |
| Сигнальная | В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды, таким образом осуществляя прием сигналов из внешней среды и передачу команд в клетку. |
| Запасающая | В организме животных белки, как правило, не запасаются, исключение: альбумин яиц, казеин молока. Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется, образуя комплекс с белком ферритином. |
| Энергетическая | При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов — воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы. |
| Каталитическая | Одна из важнейших функций белков. Обеспечивается белками — ферментами, которые ускоряют биохимические реакции, происходящие в клетках. Например, рибулезобифосфаткарбоксилаза катализирует фиксацию СО2 при фотосинтезе. |
Ферменты
Ферменты, или энзимы, — особый класс белков, являющихся биологическими катализаторами. Благодаря ферментам биохимические реакции протекают с огромной скоростью. Скорость ферментативных реакций в десятки тысяч раз (а иногда и в миллионы) выше скорости реакций, идущих с участием неорганических катализаторов. Вещество, на которое оказывает свое действие фермент, называют субстратом.
Ферменты — глобулярные белки, по особенностям строения ферменты можно разделить на две группы: простые и сложные. Простые ферменты являются простыми белками, т.е. состоят только из аминокислот. Сложные ферменты являются сложными белками, т.е. в их состав помимо белковой части входит группа небелковой природы — кофактор. У некоторых ферментов в качестве кофакторов выступают витамины. В молекуле фермента выделяют особую часть, называемую активным центром. Активный центр — небольшой участок фермента (от трех до двенадцати аминокислотных остатков), где и происходит связывание субстрата или субстратов с образованием фермент-субстратного комплекса. По завершении реакции фермент-субстратный комплекс распадается на фермент и продукт (продукты) реакции. Некоторые ферменты имеют (кроме активного) аллостерические центры — участки, к которым присоединяются регуляторы скорости работы фермента (аллостерические ферменты).

Для реакций ферментативного катализа характерны: 1) высокая эффективность, 2) строгая избирательность и направленность действия, 3) субстратная специфичность, 4) тонкая и точная регуляция. Субстратную и реакционную специфичность реакций ферментативного катализа объясняют гипотезы Э. Фишера (1890 г.) и Д. Кошланда (1959 г.).
Скорость ферментативных реакций зависит от: 1) температуры, 2) концентрации фермента, 3) концентрации субстрата, 4) рН. Следует подчеркнуть, что поскольку ферменты являются белками, то их активность наиболее высока при физиологически нормальных условиях.
Большинство ферментов может работать только при температуре от 0 до 40 °С. В этих пределах скорость реакции повышается примерно в 2 раза при повышении температуры на каждые 10 °С. При температуре выше 40 °С белок подвергается денатурации и активность фермента падает. При температуре, близкой к точке замерзания, ферменты инактивируются.
При увеличении количества субстрата скорость ферментативной реакции растет до тех пор, пока количество молекул субстрата не станет равным количеству молекул фермента. При дальнейшем увеличении количества субстрата скорость увеличиваться не будет, так как происходит насыщение активных центров фермента. Увеличение концентрации фермента приводит к усилению каталитической активности, так как в единицу времени преобразованиям подвергается большее количество молекул субстрата.

Для каждого фермента существует оптимальное значение рН, при котором он проявляет максимальную активность (пепсин — 2,0, амилаза слюны — 6,8, липаза поджелудочной железы — 9,0). При более высоких или низких значениях рН активность фермента снижается. При резких сдвигах рН фермент денатурирует.
Скорость работы аллостерических ферментов регулируется веществами, присоединяющимися к аллостерическим центрам. Если эти вещества ускоряют реакцию, они называются активаторами, если тормозят — ингибиторами.

Классификация ферментов
По типу катализируемых химических превращений ферменты разделены на 6 классов:
- оксиредуктазы (перенос атомов водорода, кислорода или электронов от одного вещества к другому — дегидрогеназа),
- трансферазы (перенос метильной, ацильной, фосфатной или аминогруппы от одного вещества к другому — трансаминаза),
- гидролазы (реакции гидролиза, при которых из субстрата образуются два продукта — амилаза, липаза),
- лиазы (негидролитическое присоединение к субстрату или отщепление от него группы атомов, при этом могут разрываться связи С–С, С–N, С–О, С–S — декарбоксилаза),
- изомеразы (внутримолекулярная перестройка — изомераза),
- лигазы (соединение двух молекул в результате образования связей С–С, С–N, С–О, С–S — синтетаза).
Классы в свою очередь подразделены на подклассы и подподклассы. В действующей международной классификации каждый фермент имеет определенный шифр, состоящий из четырех чисел, разделенных точками. Первое число — класс, второе — подкласс, третье — подподкласс, четвертое — порядковый номер фермента в данном подподклассе, например, шифр аргиназы — 3.5.3.1.
Белки — неразветвленные гетерополимеры. Их мономерами выступают аминокислоты.
Структура аминокислот
Белки состоят из аминокислот со схожим строением. При этом стоит отметить, что при всей схожести они никогда не являются точной копией друг друга.
Любая аминокислота включает 2 части:
- общую, содержащую аминогруппу ( - NH) и карбоксильную группу ( - COOH);
- боковой радикал.
При этом радикал аминокислот структурно всегда разный. В белке всегда есть 20 различных аминокислот. В них, в свою очередь — 20 различных боковых цепей. Самая простая такая цепь — глицин: у нее боковой радикал является свободным атомом водорода.
При нейтральных значениях pH, карбоксильная группа свободной аминокислоты диссоциирует: отдает протон и приобретает отрицательный заряд.
Аминогруппа свободной аминокислоты может присоединять к себе протон и приобретать положительный заряд. Это приводит к тому, что аминокислоты переходят в состояние цвиттер-иона — одна часть получает положительный заряд, а другая — отрицательный.
Структура радикалов аминокислот очень разная и зависит от таких критериев как полярность и строение. По этим критериям они и классифицируются, хотя такую классификацию можно выделить условно. Зато она наглядно показывает все грани химической структуры аминокислот.
Находясь в нейтральной среде, радикалы аминокислот (большинство) приобретают частичный или полный полярный заряд. Заряженные радикалы вступают в контакт с полярными радикалами в той же белковой молекуле за счет электростатического взаимодействия. Если взаимодействие происходит с низкомолекулярными веществами, то контакт происходит и в других белковых молекулах.
Пространственная структура белка, то, как он взаимодействует с другими белками и прочими молекулами (взаимодействия рецептор-лиганд, фермент-субстрат) зависит от наличия и расположения заряженных и полярных радикалов.
Типы радикалов аминокислот
Все радикалы аминокислот делят на следующие группы:
- заряженные радикалы. В составе бокового радикала содержатся аминогруппа и карбоксильная группа;
- циклические радикалы. Это радикалы с циклической структурой. К примеру, такой радикал есть у триптофана, в цикле которого содержится азот;
- нециклические радикалы. У них гидрофобная структура. Такие радикалы есть в глицине, лейцине, валине, метионине;
- полярные радикалы (некоторые их называют полярные аминокислоты). Такие радикалы встречаются в нескольких аминокислотах: валине, глицине, глутамине, метионине;
- неполярные и гидрофобные радикалы. Те, у которых нет заряда, и которые не взаимодействуют с водой и прочими молекулами с полюсами. Особенность такой структуры белка в том, что она представляет собой сгруппированное внутри молекулы ядро, что сводит к минимуму контакт с водой. Среди аминокислот с такими радикалами выделяют аланин, валин, пролин, триптофан, лейцин и др.
Еще выделяют серосодержащие аминокислоты (метионин, цистеин) и ароматические (триптофан, фенилаланин).
Каждый год во всем мире производят больше 200 тысяч аминокислот, которые приобретают как биологическое, так и прикладное значение. К примеру, в лабораторных условиях сегодня получают глутаминовую кислоту, глицин, лизин, метионин.
Основные свойства аминокислот
Если говорить о свойствах аминокислот, то лучше рассматривать их на конкретных примерах. Вот некоторые аминокислоты и их свойства:
- Глутаминовая кислота. Находит применение в психиатрии для лечения слабоумия, а также в случае каких-либо последствий родовых травм. Широко используется в комплексной терапии язвенной болезни и гипоксии. Ощутимо делает лучше вкус мясных продуктов.
- Аспарагиновая кислота. Отвечает за повышение потребления кислорода в сердечной мышце. Поэтому логично ее использование в составе лекарственного препарата Панангин, который назначают, чтобы скорректировать аритмию и ишемическую болезнь сердца.
- Метионин. Защищает организм в случаях отравления различными токсинами, бактериальными инфекциями, прочими ядами. Демонстрирует радиопротекторные свойства.
- Глицин. Специфический медиатор, который тормозит механизмы деятельности в ЦНС. С его помощью лечат хронический алкоголизм. Оказывает успокаивающее воздействие.
- Лизин. Используется как основная пищевая и кормовая добавка. Еще его применяют как антиоксидант в пищевой промышленности, поскольку он не дает пищевым продуктам портиться.
Заменимые и незаменимые аминокислоты
Обычно аминокислоты делят на заменимые и незаменимые.
Незаменимые аминокислоты поступают в организм человека с пищей, поскольку внутри организма синтезироваться не могут. Например, валин, лейцин, треонин и др. Отдельно стоит упомянуть гистидин — это для новорожденных аминокислота. В случае, если наблюдается дефицит таких аминокислот в организме человека, то он не может нормально функционировать.
Заменимые аминокислоты организм синтезирует самостоятельно из азота или других аминокислот, в том числе — незаменимых. Все остальные 11 аминокислот являются заменимыми.
Заменимые аминокислоты тоже должны поступать в человеческий организм. Если это не будет происходить, то для восполнения такой нехватки будут использоваться незаменимые аминокислоты и, соответственно, ослаблять таким образом защитные силы организма.
Есть две аминокислоты, которые можно назвать целиком метаболически заменимыми: серин и глутаминовая кислота.
Деление на заменимые и незаменимые аминокислоты в некоторых случаях не совсем корректно. К примеру, тирозин считается заменимой аминокислотой. Но важно одно условие: чтобы было достаточно фенилаланина. Аргинин считается заменимой аминокислотой и синтезируется в организме человека, но бывают такие состояния и метаболические особенности, при которых аргинин можно назвать незаменимой аминокислотой.
Согласно исследованиям в этой области, биосинтез заменимых аминокислот в объемах, покрывающих потребности организма, не представляется возможным. И те, и другие аминокислоты являются важной составляющей живого организма и условием нормального его функционирования.

Аминокислоты. Белки
Ключевые слова конспекта: Аминокислоты. Глицин. Пептидная связь. Белки. Качественные реакции на белки. Денатурация белка. ДНК. Ген.
Строение аминокислот
Аминокислоты представляют собой твёрдые кристаллические вещества, многие из них хорошо растворимы в воде, некоторые имеют сладкий вкус.

Способы получения и химические свойства аминокислот

В промышленности аминокислоты получают биотехнологическим путём как продукты жизнедеятельности микроорганизмов. Кроме того, разработано несколько лабораторных способов получения аминокислот. Один из них может быть представлен следующей схемой:
Простейшую аминокислоту называют аминоуксусной кислотой или глицином, её формула H2N—СН2—СООН.


Какие же свойства проявляют аминокислоты — кислотные или основные? Оказывается, подобно амфотерным неорганическим соединениям, в зависимости от природы реагента аминокислоты могут проявлять свойства как кислоты, так и основания. Например, глицин реагирует со щелочами с образованием солей, проявляя свойства кислоты:

В реакциях с кислотами глицин проявляет свойства органических оснований — аминов:
Понятие о пептидах и белках

Важное химическое свойство аминокислот — способность взаимодействовать друг с другом с отщеплением молекулы воды, образуя пептиды:

Между двумя остатками аминокислот образуется пептидная связь:
Получившийся в результате реакции дипептид может вступать в реакции с другими молекулами аминокислот, образуя полимеры — белки. Поскольку в результате этой реакции, помимо высокомолекулярного вещества, образуется второй продукт — вода, такой процесс относят к реакциям поликонденсации.
О важности белков для живых организмов свидетельствует тот факт, что в большинстве иностранных языков соединения такого типа называют протеинами (от греч. protos — первый). На Земле не существует ни одного живого организма, включая простейшие одноклеточные и бактерии, который не состоял бы из белковых молекул.
Структура и функции белков
Молекулы белков имеют также вторичную и третичную структуру. Характеристика этих структур белковых молекул приведена в таблице.

В зависимости от того, какую функцию выполняет белок в организме, различно его отношение к воде. Большинство белков в воде не растворяется, например кератины, которые составляют основу волос, ногтей, перьев, рогов и т. д. Для некоторых белков выполнение их функций невозможно без растворения. Так, в воде растворяются многие белки, выполняющие функции природных катализаторов, — ферменты.
Химические свойства белков
Для обнаружения белка проводят качественные реакции на белки. Белки дают фиолетовое окрашивание в щелочной среде под действием свежеприготовленного осадка гидроксида меди(II). Эту пробу называют биуретовой реакцией.
Вторую качественную реакцию на белки называют ксантопротеиновой. При действии на раствор белка концентрированной азотной кислоты образуется белый осадок, который быстро приобретает жёлтую окраску, а при добавлении водного раствора аммиака становится оранжевым.
Для обнаружения в белках соединений серы используют следующий тест. При горении серосодержащих белков появляется характерный запах жжёного рога.

Одно из важнейших химических свойств белков — реакции гидролиза. В присутствии природных катализаторов (ферментов) или сильных кислот молекулы воды расщепляют полимерную белковую молекулу до аминокислот:
Белки играют ключевую роль почти во всех структурах живых организмов и происходящих в них процессах.
В каждой клетке организма синтезируется множество белков. Информация о структуре всех белков организма зашифрована в ещё одних природных биополимерах — молекулах дезоксирибонуклеиновых кислот (ДНК). Мономеры ДНК — нуклеотиды. Молекулы ДНК человека содержат примерно 3,1 млрд пар нуклеотидов. Участок молекулы ДНК, отвечающий за синтез одного белка, называют геном.

§ 3. Органические вещества. Аминокислоты. Олигопептиды
Низкомолекулярные органические вещества характеризуются сравнительно небольшой молекулярной массой и относительно простым строением. Это аминокислоты, моносахариды, нуклеотиды, карбоновые кислоты, спирты и т. п. Сложные по структуре соединения, молекулярная масса которых составляет от нескольких тысяч до миллионов, называют высокомолекулярными. К ним относятся белки, полисахариды и нуклеиновые кислоты. Молекулы этих веществ состоят из множества повторяющихся звеньев — мономеров, которые могут быть одинаковыми или различаться по составу. Из курса химии вы знаете, что такие соединения называются полимерами. Мономерами белков являются аминокислоты, мономерами полисахаридов — моносахариды, молекулы нуклеиновых кислот построены из нуклеотидов (рис. 3.1).
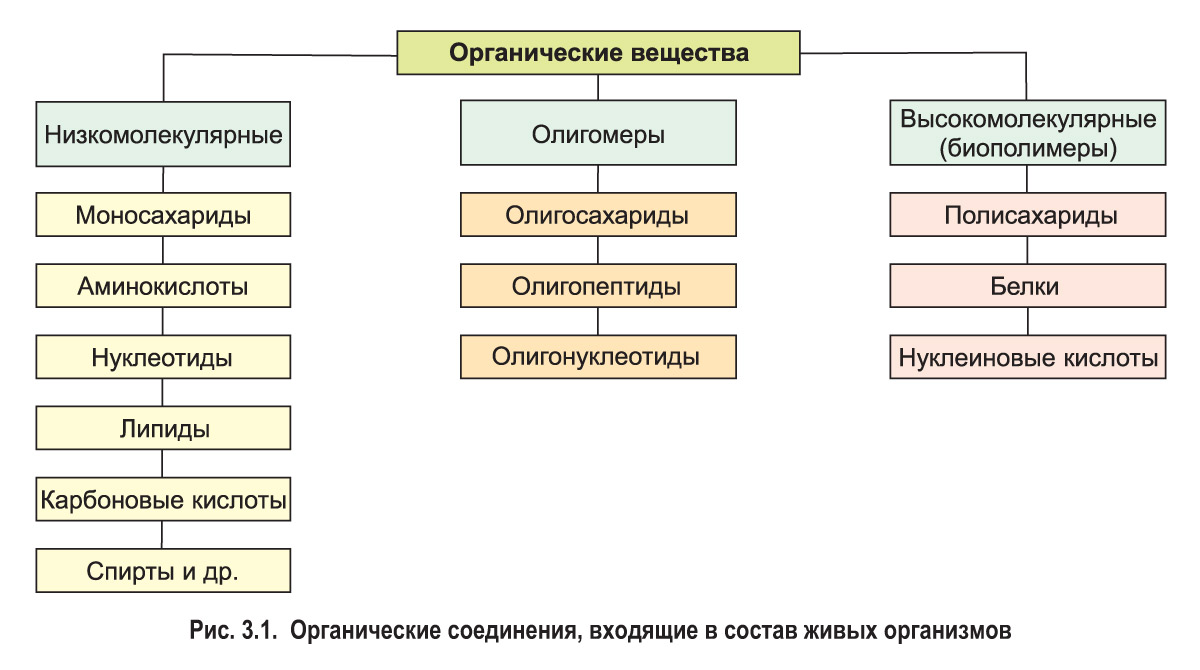
Белки , полисахариды и нуклеиновые кислоты содержатся в клетках всех живых организмов и выполняют исключительно важные биологические функции, поэтому их называют биологическими полимерами (биополимерами).
*Полимеры, в состав которых входят одинаковые либо разные мономерные звенья , но при этом в их чередовании наблюдается определенная закономерность, называются регулярными . В структуре нерегулярных полимеров подобная закономерность отсутствует. Например, если мы обозначим два типа мономеров буквами А и Б, то полимеры, имеющие структуру . А—А—А—А—А—А. или . А—Б—А—Б—А—Б. будут являться регулярными. Среди биополимеров встречаются как регулярные — полисахариды, так и нерегулярные — белки и нуклеиновые кислоты.
Кроме полимеров существуют также олигомеры. Их молекулы образованы сравнительно небольшим числом мономеров — как правило, до 10. К этой группе относятся олигопептиды, олигосахариды и олигонуклеотиды (см. рис. 3.1).*
Из всех групп органических веществ в клетках растений преобладают полисахариды, а в клетках животных — белки. Но несмотря на некоторые различия в количественном соотношении тех или иных органических соединений, вещества, принадлежащие к определенной группе, у всех живых организмов выполняют сходные функции. При этом наибольшее разнообразие биологических функций характерно для белков.
Читайте также:
- Что такое яйла в крыму кратко
- Событийная общность как источник развития детей и взрослых кратко
- Использование элементов игры в различных видах деятельности детей кратко
- Почему отношение к интеграции в системе массового образования чаще всего критическое кратко
- Какие типы онтогенеза различают у животных в чем их особенности кратко

