В чем различие в строении внешнего энергетического уровня у металлов и неметаллов кратко
Обновлено: 05.07.2024
Чем различается строение атомов металлов и неметаллов? Укажите положение элементов-неметаллов в Периодической системе Д. И. Менделеева.
Атомы большинства неметаллов содержат 4-7 электронов на внешнем энергетическом уровне, а металлы 1-3 электронов. По сравнению с атомами металлов атомы неметаллов той же группы или периода имеют меньший радиус атома.
Элементы-неметаллы занимают "правый фланг" элементов А-групп, они расположены справа сверху от диагонали бор – астат, проходящей по неметаллам и условно разделяющей элементы на металлы и неметаллы.

Все химические элементы условно можно разделить на неметаллы и металлы. Знаете ли вы, по каким признакам они отличаются? Как определить их положение в таблице химических элементов? На эти и другие вопросы вы найдете ответы в нашей статье.
Положение неметаллов и металлов: таблица Менделеева
По внешним признакам и физическим свойствам не всегда можно выяснить, к какой группе относится химический элемент. Свойства металлов и неметаллов можно определить по расположению в периодической таблице.
Для этого нужно зрительно провести диагональ от бора до астата, от 5 до 85 номера. В правом верхнем углу будут преимущественно находиться неметаллы. Их в таблице меньшинство, всего 22 элемента. Металлы находятся в правой части периодической таблицы наверху - в основном в I, II и III группах.
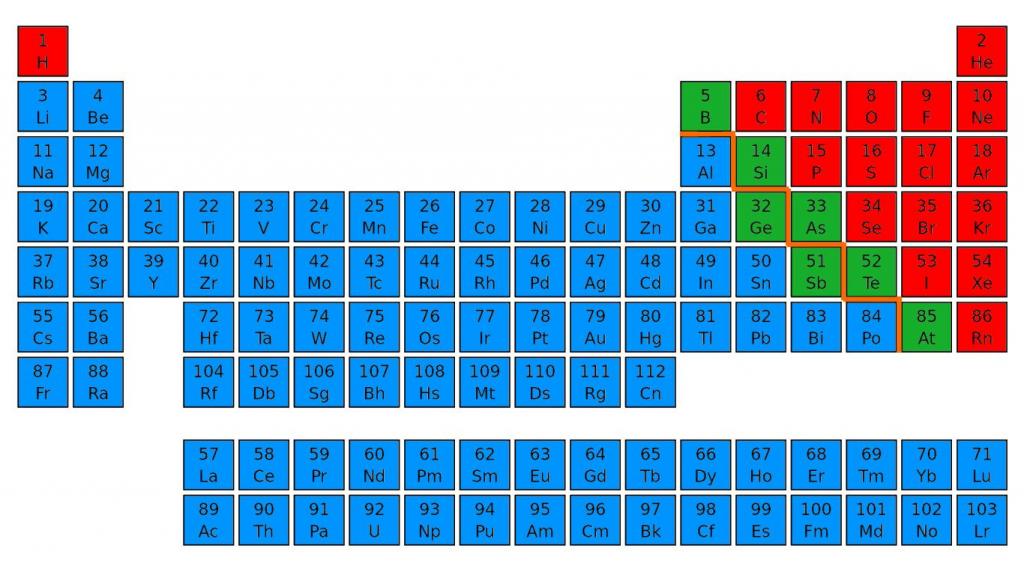
Энергетический уровень
Отличия неметаллов и металлов первоначально обусловлены строением их атомов. Начнем с количества электронов на внешнем энергетическом уровне. У атомов металлов оно варьирует от одного до трех. Как правило, они обладают большим радиусом, поэтому атомы металлов достаточно легко отдают наружные электроны, так как имеют сильные восстановительные свойства.
У неметаллов число электронов на внешнем уровне больше. Это объясняет их окислительную активность. Неметаллы присоединяют недостающие электроны, полностью заполняя энергетический уровень. Самые сильные окислительные свойства проявляют неметаллы второго и третьего периода VI-VII групп.
Заполненный энергетический уровень содержит 8 электронов. Самой большой окислительной способностью обладают галогены с валентностью I. Среди них лидирует фтор, так как у этого элемента нет свободных орбиталей.

Строение металлов и неметаллов: кристаллические решетки
Физические свойства веществ определяются порядком расположения элементарных частиц. Если условно соединить их воображаемыми линиями, то получится структура, которая называется кристаллической решеткой. В ее узлах могут находиться разные структуры: атомы, молекулы или заряженные частицы - ионы.
У некоторых неметаллов формируется атомная кристаллическая решетка, частицы которой соединены ковалентными связями. Вещества с таким строением твердые и нелетучие. К примеру, фосфор, кремний и графит.
В молекулярной кристаллической решетке связь между элементарными частицами слабее. Обычно подобные неметаллы находятся в жидком или газообразном агрегатном состоянии, но в некоторых случаях - это твердые легкоплавкие неметаллы.
В любом образце металла часть атомов теряет наружные электроны. При этом они превращаются в положительно заряженные частицы - катионы. Последние снова соединяются с электронами, образуя нейтрально заряженные частицы - в металлической решетке одновременно находятся катионы, электроны и атомы.

Физические свойства
Начнем с агрегатного состояния. Традиционно принято считать, что все металлы - твердые вещества. Исключением является только ртуть, тягучая жидкость серебристого цвета. Ее пары являются контаминантом - токсичным веществом, вызывающим отравление организма.
Еще одна характерная черта - металлический блеск, который объясняется тем, что поверхность металла отражает световые лучи. Еще одна важная особенность - электро- и теплопроводность. Это свойство обусловлено наличием в металлических решетках свободных электронов, которые в электрическом поле начинают двигаться направленно. Лучше всех проводит тепло и ток ртуть, наименьшими показателями обладает серебро.
Металлическая связь обусловливает ковкость и пластичность. По этим показателям лидирует золото, из которого можно раскатать лист толщиной в человеческий волос.
Чаще всего физические свойства металлов и неметаллов противоположны. Так, последние характеризуются невысокими показателями электро- и теплопроводности, отсутствием металлического блеска. При обычных условиях неметаллы находятся в газообразном или жидком состоянии, а твердые всегда хрупкие и легкоплавкие, что объясняется молекулярным строением неметаллов. Алмаз, красный фосфор и кремний - тугоплавкие и нелетучие, это вещества с немолекулярным строением.

Что такое полуметаллы
В периодической таблице между металлами и неметаллами находится ряд химических элементов, которые занимают промежуточное положение. Их называют полуметаллами. Атомы полуметаллов связаны ковалентной химической связью.
Эти вещества совмещают признаки металлов и неметаллов. К примеру, сурьма является кристаллическим веществом серебристо-белого цвета и вступает в реакцию с кислотами, образуя соли - типичные металлические свойства. С другой стороны, сурьма - очень хрупкое вещество, которое не поддается ковке, а измельчить его можно даже вручную.
Итак, типичные неметаллы и металлы обладают противоположными свойствами, но деление это достаточно условно, поскольку ряд веществ сочетает в себе и те и другие признаки.
В таблице Д.И. Менделеева металлы находят-
ся в I, II, III группах, в побочных подгруппах
всех групп. Кроме того, металлами являются наи-
более тяжелые элементы IV, V, VI и VII групп.
Особенностью строения атомов металлов является
небольшое число электронов во внешнем энерге-
тическом уровне, не превышающее трех. Атомы
металлов имеют, как правило, большие атомные
радиусы. В отличие от металлов, неметаллы имеют
на последнем слое от 4 до 8 электронов (кроме бора,
у которого на внешнем энергетическом уровне 3
электрона).
Химики разделили все простые вещества на металлы и неметаллы. Они сильно различаются по строению, физическим и химическим свойствам. Многие из них легко отличить визуально, например медь – металл, а бром – неметалл. Однако чтобы не допустить ошибку при классификации элементов, лучше опираться на знание четких признаков, свойственных металлам и неметаллам.
Определение
Элементы, отдающие электроны с внешнего энергетического уровня, называют металлами. Металлы – это, как правило, твердые вещества (особняком стоит ртуть, которая при нормальных условиях является жидкостью).
Элементы, принимающие электроны на внешний энергетический уровень, являются неметаллами. Они находятся в различных агрегатных состояниях. Кислород и азот – это газы, бром – жидкость, а к твердым веществам относятся, например, мышьяк, углерод и бор.
Сравнение
Все металлы наделены металлическим блеском, они превосходные проводники электрического тока и тепла. Большинство из них пластичны, при физическом воздействии металлы легко меняют форму. Неметаллы, наоборот, плохие проводники тепла и электрического тока.
Строение металлов и неметаллов – главная отличительная характеристика. Неметаллы – обладатели большего числа неспаренных электронов, размещающихся на внешних уровнях. Металлы имеют металлическую кристаллическую решетку. А неметаллам присущи молекулярные (к примеру, кислороду, хлору и сере) и атомарные (углероду, образующему алмаз) кристаллические решетки.

У металлов маленькая электроотрицательность, а значит и окислительно-восстановительный потенциал невелик. Они, как правило, принимают электроны и окисляются, проявляя восстановительные свойства. Неметаллы, наделенные большой электроотрицательностью и значительным окислительно-восстановительным потенциалом, могут выступать как в качестве окислителей, так и в качестве восстановителей (такое возможно в присутствии наиболее мощного окислителя).
У металлов есть весьма интересное свойство – амфотерность. Амфотерным металлам присущи свойства и металлов, и неметаллов. Например, цинк, находясь в состоянии высшей степени окисления, ведет себя как неметалл.
- В физических свойствах.
- В строении атомов.
- В кристаллических решетках.
- В химических свойствах.
- В способности проявлять окислительно-восстановительные свойства.
- В амфотерности металлов.
(21 оценок, среднее: 4,43 из 5)
Читайте также:

