В чем причины малой химической активности простого вещества азота кратко
Обновлено: 05.07.2024
В поликлинике тоже врядли будет. Поищи в косметических салонах, которые занимаются удалением бородавок и папиллом. Только не совсем понятно, как ты его собираешься хранить и транспортировать ?
У него же температура - около минус 200 градусов.
По этой причине жидкий азот хранят в специальных сосудах Дьюара с вакуумной изоляцией открытого типа или криогенных ёмкостях под давлением.
Чем угодно. Это зависит до какой степени надо сжать. Но чаще для этой цели применяют поршневые компрессоры или турбину, особенно если надо сделать его жидким. Ссылка намертво вешет эксплорер.
Elme Messer, фирма aga
наверно кислород или сексуальные шутка пасматри в таблицу менделеева на его периуды электроов, протоны нейтроны и вдумайся логически но не промальчиков. Но если не поймёш то погу дасканально абьеснить чо эта за связь
Неметаллы, образуют соединения с водородом, дают оксиды, их оксиды при реакции с водой дают кислоту, способны реагировать как с металлами, так и с галогенами.
FOR-DLE.ru - Всё для твоего DLE ;)
Привет, я Стас ! Я занимаюсь так называемой "вёрсткой" шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и "статейки" для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Упражнение 2 Каковы причины малой химической активности простого вещества азота?
В молекуле азота прочная тройная связь, образована тремя общими электронными парами, и для её разрыва необходимо задействовать большое количество энергии.
Упражнение 3 Какой объем газообразного азота может быть получен из 1000 м 3 воздуха, если потери в процессе фракционной перегонки сжиженного воздуха составляют 15%? Объёмная доля азота в воздухе составляет 78%.
Дано: V(воздуха)=1000 м 3 , ω(N2)=78%, ω(потери)=15%
Найти: V(N2)-?
Решение
1-й способ
1. Вычисляем теоретически возможный объём азота в воздухе объёмом 1000 м 3 :
Vтеор.(N2) =V (N2)•ω(N2):100% =1000 м 3 • 78%:100%=780 кг
2. Вычисляем массовую долю выхода азота :
ω( N2 )=100%-ω(потери)=100%-15%=85%
5. Вычисляем объем практического выхода азота:
Vпракт.(N2)=Vтеор.(N2)•ω(N2)=780 кг • 85%:100%=663 м 3
2-й способ
1. Вычисляем теоретически возможный объём азота в воздухе объёмом 1000 м 3 :
Vтеор.(N2) =V (N2)•ω(N2):100% =1000 м 3 • 78%:100%=780 м 3
2. Вычисляем объём потери азота:
V(потери) =V теор.(N2)•ω(потери)=780 кг • 15%:100%=117 м 3
3. Вычисляем объем практического выхода азота:
Vпракт.(N2)=Vтеор.(N2)-V(потери)=780 м3 - 117 м3=663 м 3
Ответ: 663 м 3
Упражнение 4 Используя знания по биологии, охарактеризуйте биологическую роль азота.
Азот — элемент, необходимый для существования жизни, т.к. входит в состав белков и нуклеиновых кислот. Без азотсодержащих соединений невозможно выращивания растений .
Химическая активность азота особенно наглядно выявляется в свойствах его аллотропной модификации, которая образуется при пропускании через разреженный ( до 1 мм давления) азот электрического разряда. Выходя из зоны разряда, азот образует вихрящийся клуб яркого желтого света. Свечение азота, подвергнутого действию электрических разрядов, продолжается иногда много часов после прекращения разряда, причем - спектр этого свечения обнаруживает сходство со спектром северных сиший. [1]
Сравните химическую активность азота с кислородом и хлором и объясните, почему химическая активность азота значительно ниже, чем у хлора и кислорода. [2]
Сравните химическую активность азота с кислородом и хлором и объясните, почему химическая активность азота значительно ниже, чем у хлора и кислорода. [3]
Чем объясняется небольшая химическая активность азота в свободном состоянии. [4]
Лишь при нагревании химическая активность азота возрастает и он взаимодействует с некоторыми металлами - литием, магнием, кальцием, титаном. При очень высоких температурах азот нспосрсд - ствсяпо соединяется с водородом и кислородом. [5]
Сравните химическую активность азота с кислородом и хлором и объясните, почему химическая активность азота значительно ниже, чем у хлора и кислорода. [6]
Сравните химическую активность азота с кислородом и хлором и объясните, почему химическая активность азота значительно ниже, чем у хлора и кислорода. [7]
Жидкий и газообразный азот в последнее время не считается абсолютно инертным веществом. Химическая активность азота проявляется в особых случаях и настолько мала, что в ракетной технике его надежно используют в контакте с весьма агрессивными и химически активными или взрывоопасными горючими. [8]
Отсюда понятно, почему у металлурга / вырабатывается под влиянием его практики иной взгляд на азот, чем у химика-технолога. Металлург, имея дело с азотом в условиях и высоких температур и недостатка кислорода, не может не считаться с химической активностью азота , гак - как ему постоянно приходится то бороться с - ней, то использовать ее для достижения нужных результатов. [9]
Отсюда понятно, почему у металлурга вырабатывается под влиянием его практики иной взгляд на азот, чем у химика-технолога. Металлург, имея дело с азотом в условиях и высоких температур и недостатка кислорода, не может не считаться с химической активностью азота , так как ему постоянно приходится то бороться с ней, то использовать ее для достижения нужных результатов. [10]
Молекула азота состоит из 2 атомов. Оба атома в молекуле азота крепко связаны. Этим объясняется малая химическая активность свободного азота. При обычных условиях азот не реагирует ни с металлами ( кроме лития), ни с металлоидами. При повышении температуры химическая активность азота увеличивается главным образом по отношению к металлам. [11]
Химическое строение молекулы азота с позиций МВС и ММО характеризуется исключительной прочностью, несравнимой ни с какими другими двухатомными молекулами. Особая устойчивость молекулярного азота во многом определяет химию этого элемента. И кратность, и порядок связи в молекуле азота равны трем. Все это является причиной очень большой величины энтальпии диссоциации молекул азота и высокой их термической устойчивости. Поэтому азот не горит и не поддерживает горения других веществ. Напротив, он сам в молекулярном виде является конечным продуктом окисления многих азотсодержащих веществ. При повышенной температуре он взаимодействует с другими активными металлами также с образованием нитридов. Образующийся при электрических разрядах атомарный азот уже при обычных условиях взаимодействует с серой, фосфором, ртутью. С галогенами азот непосредственно не соединяется. Химическая активность азота резко повышается в условиях высоких температур ( 2500 - 3000 С), тлеющего и искрового электрического разряда и в присутствии катализаторов. Так, при повышенных температурах и давлениях в присутствии катализатора азот непосредственно соединяется с водородом, кислородом, углеродом и другими элементами. [12]
Химическое строение молекулы азота с позиций МВС и ММО характеризуется исключительной прочностью, несравнимой ни с какими другими двухатомными молекулами. Особая устойчивость молекулярного азота во многом определяет химию этого элемента. Кроме того, на разрыхляющих молекулярных орбиталях нет ни одного электрона. Все это является причиной очень большой величины энтальпии диссоциации молекул азота и высокой их термической устойчивости. Поэтому азот не горит и не поддерживает горения других веществ. Напротив, он сам в молекулярном виде является конечным продуктом окисления многих азотсодержащих веществ. В условиях повышенных температур он взаимодействует с другими активными металлами также с образованием нитридов. Образующийся при электрических разрядах атомарный азот уже при обычных условиях взаимодействует с серой, фосфором, ртутью. С галогенами азот непосредственно не соединяется. Химическая активность азота резко повышается в условиях высоких температур ( 2500 - 3000 С), тлеющего и искрового электрического разряда и в присутствии катализаторов. Так, при повышенных температурах и давлениях и в присутствии катализаторов азот непосредственно соединяется с водородом, кислородом, углеродом и другими элементами. [13]
Химическое строение молекулы азота с позиций МВС и ММО характеризуется исключительной прочностью, несравнимой ни с какими другими двухатомными молекулами. Особая устойчивость молекулярного азота во многом определяет химию этого элемента. И кратность, и порядок связи в молекуле азота равны трем. Все это является причиной очень большой величины энтальпии диссоциации молекул азота и высокой их термической устойчивости. Поэтому азот не горит и не поддерживает горения других веществ. Напротив, он сам в молекулярном виде является конечным продуктом окисления многих азотсодержащих веществ. При комнатной температуре азот реагирует лишь с литием с образованием нитрида лития LigN. При повышенной температуре он взаимодействует с другими активными металлами также с образованием нитридов. С галогенами азот непосредственно не соединяется. Химическая активность азота резко повышается в условиях высоких температур ( 2500 - 3000 С), тлеющего и искрового электрического разряда и в присутствии катализаторов. Так, при повышенных температурах и давлениях в присутствии катализатора азот непосредственно соединяется с водородом, кислородом, углеродом и другими элементами. [14]

В этой статье мы рассмотрим характеристики азота в химии, узнаем, какие степени окисления может иметь азот и поговорим о важнейших соединениях, в состав которых входит этот химический элемент.
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Азот (N2) — первый представитель V группы главной подгруппы и 2 периода периодической системы химических элементов Д. И. Менделеева. Если рассматривать местоположение азота в длиннопериодной таблице Менделеева, то там он занимает лидирующее место в 15 группе. Для представителей этой группы было предложено название пниктогены (от греческого корня πνῑ́γω — удушливый, плохо пахнущий). Явно это относится к водородным соединениям представителей данной группы.
Электронное строение азота
Рассмотрим строение атома и электронную конфигурацию азота, а затем сделаем некоторые заключения.
Атомный или порядковый номер азота равен 7, что соответствует количеству электронов и протонов в ядре. Молярная масса равна 14,00728 г/моль, а количество нейтронов в атоме этого изотопа равно семи.
Теперь перейдем к электронному строению. В основном состоянии электронная формула азота: 1s 2 2s 2 2p 3 , в сокращенном виде — [He]2s 2 2p 3 . На внешнем энергетическом уровне 5 валентных электронов, среди которых 3 неспаренных p-электрона.

Исходя из такой конфигурации, азот может образовывать только 3 связи по обменному механизму и еще одну по донорно-акцепторному механизму. Это связано с тем, что на втором подуровне у азота больше нет вакантных орбиталей, куда могли бы распариться электроны с 2s-подуровня. Отсюда вытекает максимальная валентность азота IV.
Для азота характерен весь спектр возможных степеней окисления от −3 до +5.
Давайте рассмотрим шкалу, где отражены соединения азота в различных веществах.

Строение молекулы азота
Азот — двухатомная молекула, атомы которой связаны между собой прочной тройной связью. Длина связи — 0,110 нм.

Почему именно тройная связь и из чего она состоит?
Напомним, что у каждого атома в молекуле азота 3 неспаренных электрона, которые и образуют впоследствии тройную связь, которая, в свою очередь, состоит из одной сигма-связи и двух пи-связей.
Физические свойства азота
Азот как простое вещество — бесцветный газ, который не имеет запаха и плохо растворяется в воде. По своей молярной массе азот легче, чем воздух. Благодаря наличию тройной неполярной связи и относительно маленьким радиусам атомов азот имеет низкие температуры кипения и плавления: tпл = −210 °С и tкип = −196 °С. Аллотропных модификаций азот не имеет. Несмотря на то, что основное состояние азота — газообразное, он бывает еще и жидким. Например, 1 литр жидкого азота при нагревании до 20 °С превращается в 700 литров газообразного азота. Более подробную информацию можно узнать в нашем видео:
Химические свойства азота
Азот химически малоактивен из-за наличия все той же тройной связи. Она же обуславливает малую термическую устойчивость соединений азота при нагревании. В химических реакциях азот может проявлять себя и как окислитель, и как восстановитель благодаря широкому спектру возможных степеней окисления.
Как восстановитель азот реагирует:
Эти реакции проходят при температуре выше 1000 градусов Цельсия либо в электрическом заряде.
Как окислитель азот реагирует:
азот реагирует при обычных условиях только с литием, а с щелочноземельными металлами — только при нагревании;
реакция протекает обратимо в присутствии металлического железа в качестве катализатора.
Рассмотрим способы получения азота. В промышленности его получают фракционной перегонкой жидкого воздуха, а вот в лаборатории азот получают иначе. Вот лишь некоторые способы:
реакция взаимодействия хлорида аммония и нитрита натрия
NaNO2 + NH4Cl = N2 + NaCl + 2H2O
разложение некоторых солей аммония (на примере нитрита аммония)
NH4NO2 = N2 + 2H2O
Азот — основной компонент любого белка в организме человека. Давайте рассмотрим способы получения исходных компонентов для синтеза собственных белков.

Важнейшие соединения азота
Аммиак
В первую очередь поговорим о водородном соединении азота — аммиаке. Аммиак — бесцветный газ с характерным резким запахом. Давайте рассмотрим строение молекулы аммиака:

Аммиак имеет форму тригональной пирамиды. Этот газ очень ядовит и способен вызывать химический ожог глаз, а пары сильно раздражают слизистые оболочки органов дыхания. В то же время аммиак обладает достаточно высокой растворимостью в воде из-за образования водородных связей с молекулами воды. Вас когда-нибудь приводили в чувства после потери сознания ваткой, смоченной чем-то гадко пахнущим? Поздравляю, это было ваше первое знакомство с раствором аммиака в воде.
Поговорим теперь о химических свойствах этого газа.
В отличие от самого азота, аммиак является крайне реакционноспособным соединением. Так как азот находится в аммиаке в своей низшей степени окисления (−3), то аммиак проявляет только восстановительные свойства.
Например, аммиак реагирует с кислородом (при нагревании):
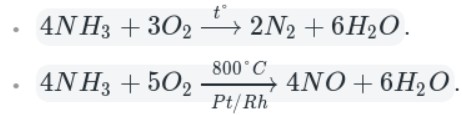
Как видно из уравнений, аммиак вступает в реакции окисления, а продукты его окисления напрямую зависят от силы окислителя и условий проведения реакций.
Со сложными веществами — окислителями аммиак реагирует следующим образом:
С кислотами аммиак реагирует благодаря своим оснóвным свойствам, что приводит к образованию различных солей:
А теперь рассмотрим получение аммиака. Различают два типа способов: промышленный и лабораторный.
Промышленный способ — синтез из простых веществ:
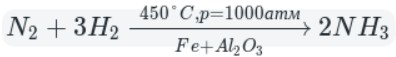
В данном способе аммиак собирают в перевернутую вверх дном колбу, так как аммиак легче воздуха.

Азотная кислота
Азотная кислота — одна из важнейших неорганических кислот. Это летучая бесцветная жидкость с резким запахом, которая способна смешиваться с водой в любых пропорциях.
Получают ее в промышленности в несколько этапов. Рассмотрим подробнее каждый из них:
Окисление аммиака кислородом воздуха на платиновом катализаторе
4NH3 + 5O2 = 4NO + 6H2O
Окисление оксида азота (II)
2NO + O2 = 2NO2
Поглощение образующегося оксида азота (IV) водой в избытке воздуха
4NO2 + O2 + 2H2O = 4HNO3
Для азотной кислоты характерны особые химические свойства исходя из ее концентрации.
Например, с металлами данная кислота никогда не будет реагировать с выделением газообразного водорода. Рассмотрим таблицу с примерами металлов с различными концентрациями азотной кислоты:

Также азотная кислота как сильный окислитель способна окислять некоторые неметаллы до их кислот. Давайте рассмотрим примеры:

Оксиды азота
В отличие от других химических элементов, азот образует большое число оксидов: N2O, NO, N2O3, NO2, N2O4 и N2O5, каждый из которых является кислотным. В таблице показали, какой оксид какой кислоте соответствует:

Оксид азота (I) N2O. Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде. У этого оксида есть и другие названия, самое распространенное из них — закись азота. Оксид азота (I) применяли в медицине в качестве наркоза более 200 лет назад. При вдыхании этого газа человека охватывает радость и безудержный смех, отчего оксид получил еще одно название — веселящий газ.
Оксид азота (II) NO. Несолеобразующий оксид, который при нормальный условиях является бесцветным газом, плохо растворяется в воде и в больших концентрациях ядовит для человека.
Оксид азота (III) N2O3. Соединение очень неустойчивое и существует только при низких температурах. В твердом и жидком состоянии оксид азота (III) окрашен в ярко-синий цвет. При температуре выше 0 градусов разлагается до оксида азота (II) и оксида азота (IV).
Оксиды азота (IV) NO2 и N2O4. Твердый оксид азота (IV) бесцветный, так как состоит из молекул N2O4. При нагревании появляется коричневая окраска, которая усиливается с повышением температуры по мере увеличения NO2 в смеси. Эти оксиды хорошо растворимы в воде и взаимодействуют с ней.
Оксид азота (V) N2O5. Азотный ангидрид, который образуется в виде летучих бесцветных гигроскопичных кристаллов. Это крайне неустойчивое вещество, которое распадается в течение нескольких часов. При нагревании распадается со взрывом на оксид азота (IV) и газообразный кислород.
Читайте также:

