Теории кислот и оснований план урока
Обновлено: 08.07.2024
Упр. №1. “Химический дождь”. (См. Приложение 1. Презентация к уроку). Между какими ионами произойдёт взаимодействие? Составьте уравнения реакций.
Пятиминутка. (Приложение 2) Отметьте в таблице знаком “+” пары веществ, между которыми возможны реакции ионного обмена, идущие до конца. 1 вариант – с образование осадка, 2 вариант – с образованием газообразного вещества и воды.
| Реагирующие вещества | K2CO3 | KOH | AgNO3 | FeCl3 | HNO3 |
| NaOH | |||||
| CuCl2 | |||||
| HCl |
III. Усвоение новых знаний и способов действия
Рассмотрим в свете теории ЭД свойства веществ, растворы которых обладают электропроводностью: кислоты, основания и соли.
– Дайте определение кислот с точки зрения теории ЭД.
– Озвучьте схему, приведите примеры.
Упр. №2. Составьте уравнения возможных реакций растворов кислот с веществами. Охарактеризуйте их с позиции теории ЭД.
Углубленное изучение химии. Неорганические основания и кислоты.
| Вложение | Размер |
|---|---|
| 11_kl.mru_neorganicheskie_osnovaniya_i_kisloty.doc | 47 КБ |
Предварительный просмотр:
11 кл – углубленное изучение химии
Неорганические основания и кислоты.
Татьяна Михайловна Русинова,
учитель химии ВКК,
МАОУ гимназия №35
- повторить и обобщить знания о неорганических основаниях и кислотах,
используя деятельностный подход;
- совершенствовать умения формулировать проблему и искать пути
решения на основе здравых рассуждений;
- рассмотреть влияние среды на путь ОВР в проблемно-поисковой ситуации;
- создать условия для индивидуальной траектории развития одаренных обучающихся. Задания такого типа выделены красным шрифтом.
Оборудование: 1) на демонстрационном столе: растворы кислот, щелочей,
индикаторы, колба с водой.
2) мультимедийное приложение к уроку – презентация.
3) на каждом ученическом столе:
Доска: Неорганические основания и кислоты.
Повторение и обобщение знаний.
кислоты амфотерные основания
I. Учащимся сообщается тема и цель урока. Слайд 1,2.
- Какие вещества называют гидроксидами (продукты взаимодействия
оксидов Ме и неМе с Н 2 О).
К доске приглашаются 3 учащихся и выполняют задания: привести примеры гидроксидов, структурную формулу одного из них, пояснить причину свойств, привести уравнения ступенчатой диссоциации.
- будет ли диссоциировать ступенчато гидроксид железа (Ш)? приведи аргументы.
-Дать определения кислотам и основаниям с разных точек зрения
а) с точки зрения состава (Иоганн Рудольф Глаубер, впервые
разработал способы получения концентрированных кислот – серной,
азотной, соляной; слайд 3.
б) с точки зрения теории диссоциации (Сванте Аррениус, за теорию
электролитической диссоциации получил Нобелевскую премию);
в) с точки зрения протолитической теории (Т.М. Лаури (Лоури) и Й.Н.
Бренстед), Слайд 5.
- дать полную характеристику (демонстрации)
гидроксиду железа (II), (III)
- вода – кислота или основание? Почему? (демонстрации)
- Что такое рН? Какие значения рН в кислотах? В щелочах? Слайд 7.
(рН – важный диагностический признак, широко применяемый в
- придумай другую величину выражения среды раствора
- Как экспериментально доказать присутствие в растворе Н 3 0 + или
ОН - ? (демонстрации индикаторов)
- какая кислота сильнее – серная или ортофосфорная? Почему?
(демонстрации). (Сила кислоты зависит от степени ее диссоциации,
от степени окисления атома неметалла, образующего кислоту).
- какая кислота сильнее сернистая или серная? Почему? Как это
Ответы вызванных к доске. Дополнительный вопрос на
-Почему кислородсодержащие кислоты можно отнести к
гидроксидам? (В их составе присутствует гидроксогруппа, некоторые
кислородсодержащие кислоты можно получить реакцией
II. Итак, ионы, определяющие реакцию среды, могут быть донорами или акцепторами электронов, следовательно, в каких реакциях они должны участвовать? – ОВР.
-Попробуем сформулировать предположение, гипотезу , которую можно доказать или опровергнуть экспериментальным путем сейчас на уроке. (Учащиеся вместе с учителем формулируют гипотезу): кислоты и основания участвуют в ОВР, среда определяет путь протекания ОВР.
- Какой эксперимент можно поставить? – Взять окислитель (Самый доступный и известный – перманганат калия) и восстановитель (например, сульфит натрия) и провести реакцию между ними в присутствии гидроксидов, создающих разные среды.
- Учащимся предлагается лабораторная работа, стр. 24.
- с помощью каких других экспериментов можно установить влияние среды на ОВР? Можешь воспользоваться реактивами из числа предложенных или взять любые другие.
Техника безопасности: 1. этикетки веществ повернуты к экспериментатору;
2. работать над столом;
3. при попадании раствора кислоты или щелочи на
руки – сообщить учителю, нейтрализовать, смыть
III. Отчеты по лабораторной работе. Формулирование выводов.
- Гипотеза подтвердилась – кислоты и основания влияют на путь ОВР.
Слайд 8. Проверка правильности составления уравнений, отвечают 3
Н 3 0 + : 2KMnO 4 + 5Na 2 SO 3 +3H 2 SO 4 = 2MnSO 4 + 5Na 2 SO 4 + K 2 SO 4 +3H 2 O
H 2 O: 2KMnO 4 + 3Na 2 SO 3 + H 2 O = 2MnO 2 + 3Na 2 SO 4 +2KOH
ОН - : KMnO 4 + Na 2 SO 3 + 2KOH = 2K 2 MnO 4 + Na 2 SO 4 + H 2 O
- почему для создания кислой среды берут серную кислоту, но не азотную или соляную?
- Как и почему среда влияет на путь овр?
(Чем выше кислотность среды (меньше значение рН), тем глубже восстанавливается ион атома – окислителя. Наиболее глубокое восстановление – в кислой среде: Ионы водорода внедряются в перманганат – анион, ослабляют связь между атомом марганца и атомом кислорода, деформируют анион, поляризуют, облегчая тем самым действие восстановителя.)
- Какие другие критерии могут быть основанием для создания ТВОЕЙ теории кислот и оснований? Попробуй создать свою теорию, непохожую на известные.
IV. Проверка знаний по теме – закрепление. Учащиеся выполняют задания из пособия ЕГЭ – 2012, слайд 8:

Цель: формирование знаний об основаниях и кислотах, как о новом классе неорганических веществ.
Образовательные:
научить составлять формулы оснований и называть их;
определять отличительные признаки кислот и оснований;
сравнивать кислоты и основания по разным признакам;
находить степени окисления элементов в основаниях и кислотах.
Развивающие:
развивать способность к аналитическому мышлению;
развивать способность правильно строить свою речь и формулировать мысли.
Воспитательные:
способствовать воспитанию у обучающихся умения контролировать свои эмоции;
способствовать воспитанию усидчивости.
Тип урока: комбинированный
Ход урока:
Этапы урока
Деятельность учителя
Деятельность обучающихся
Примечания (ОВЗ)
Приветствие. Проверка готовности к уроку.
Дежурный докладывает об отсутсвующих.
2. Проверка домашнего задания.
1. Проверка письменной работы.
2. Работа по карточкам. Разноуровневые задания по определению степени окисления и называнию веществ, классификация оксидов. (Приложение 1.)
Один у доски на оценку воспроизводит упражнение. У остальных проверка о наличии выполненного задания.
Выполняют задание 10 минут.
Задание содержит формулы веществ и первую часть названия веществ и опорную схему классификации оксидов (Приложение2.)
3. Актуализация знаний.
Записываем тему урока: Кислоты и основания.
Что общего и что их отличает друг от друга?
Записывают в тетрадь
4. Изучение нового материала
Записываем в два столбика данные вещества.
Дайте определение кислотам.
Кислоты — это сложные вещества, которые состоят из атома водорода и кислотного остатка.
Посмотрите на формулы кислот, как их можно классифицировать?
Еще как можно их классифицировать?
Что такое основность?
Знакомимся с формулами кислот и учимся читать правильно формулы стр. 119
Обращаем внимание на вторую колонку веществ. Что общего между этими веществами?
Основания- это сложные вещества, которые состоят их атома металла и гидроксильной группы ОН.
Как можно классифицировать основания?
Учимся пользоваться таблицей растворимости.
Делят страницу пополам и записывают формулы в тетрадь.
Формулируют определение кислот.
Записываем определение в тетрадь.
Сравнивают и дают классификацию по содержанию кислорода.
Записывают схему в тетрадь
Сравнивают и дают классификацию по содержанию водорода.
Записывают схему в тетрадь.
Чтение параграфа стр. 21. Записываем определение.
Повторяем хором за учителем.
Сравнивают вещества во второй колонке и формулируют определение оснований.
Классифицируют по содержанию ОН групп.
Записывают схему в тетрадь.
Записывают схему в тетрадь.
Работают по таблице растворимости
Пользуясь учебником пар. 21 стр. 120, записывают определение в тетрадь.
Читают параграф стр. 119,. записывают в тетерадь
Находят в параграфе стр. 121 и записывают в тетрадь
Находят в параграфе 20 стр. 115 определение и записывают в тетрадь.
4. Закрепление изученного материала
Распределить вещества на оксиды (кислотные, основные, амфотерные), основания, кислоты (Приложение 3.)
Работают самостоятельно, проверяем через 10 минут
Работают по карточкам (Приложение 4)
5. Домашнее задание
Параграфы 20-21, таблица 4 стр. 118 выучить, названия кислот стр. 119 выучить.
Параграфы 20-21, сделать опорную карточку по таблице 4 стр. 118 и с формулами кислот.
Что нового узнал?
Что осталось непонятным?
Приложение 1.
Выпишите формулы оксидов и дайте им названия.
* Определите степень окисления в оксидах и распределите их на основные, кислотные, амфотерные, несолеобразующие.
Приложение 2.
Дайте названия оксидам и определите степень окисления.
Na2O – оксид _____________, CuO- оксид ________, CO — оксид ___________ (_), N2O3 - оксид ___________ (_), NO – оксид азота (_), К2O — оксид _________, Ag2O — оксид ___________, Mn2O5 — оксид _______ (V), SO3 — оксид ______ (_), Cr2O5 - оксид _______ (V).
Приложение 3.
Распределить вещества на оксиды (кислотные, основные, амфотерные, несолеобразующие), основания, кислоты:
Приложение 4.
Выберите формулы кислот и оснований и распределите ихи в две колонки.
Приложение 1.
Выпишите формулы оксидов и дайте им названия.
* Определите степень окисления в оксидах и распределите их на основные, кислотные, амфотерные, несолеобразующие.
Приложение 2.
Дайте названия оксидам и определите степень окисления.
Na2O – оксид _____________, CuO- оксид ________, CO — оксид ___________ (_), N2O3 - оксид ___________ (_), NO – оксид азота (_), К2O — оксид _________, Ag2O — оксид ___________, Mn2O5 — оксид _______ (V), SO3 — оксид ______ (_), Cr2O5 - оксид _______ (V).
Приложение 3.
Распределить вещества на оксиды (кислотные, основные, амфотерные, несолеобразующие), основания, кислоты:
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
Теории кислот и оснований. Сильные и слабые электролиты
Определение кислот и оснований было предложено шведским химиком Аррениусом в конце XIX в рамках теории диссоциации.
Кислота – вещество, которое диссоциирует в воде с образованием ионов водорода.
Основание – вещество, которое диссоциирует в воде с образованием гидроксид-ионов.
Данные определения иногда являются ограниченными и иногда неточными. Так, ион водорода Н + не существует в воде, поскольку Н + – голый протон, такая концентрация положительного заряда позволяет ему быстро реагировать с неподелённой парой на кислороде в молекуле воды:
Н 2 О + Н + = Н 3 О + (гидроксоний).
Кроме того, некоторые соединения не содержат ионов гидроксила ОН - , но все же обладают основными свойствами, например аммиак NH 3 . Поэтому существует более общее определение кислот и оснований, предложенное Брёнстедом и Лоури в начале XX века и широко используется в наши дни.
Кислота ( acid ) Брёнстеда-Лоури – донор протонов Н + .
Основание ( base ) Брёнстеда-Лоури – ацептор протонов.
Затем на основе электронных представлений Льюисом было еще более расширено понятие кислоты и основания.
Кислота Льюиса – молекула или ион, имеющие вакантные электронные орбитали, вследствие этого они способны принимать электронные пары.
Основание Льюиса – молекулы или ионы, способные быть донором электронных пар.
Кислоты и основания между собой классифицируются по способности отдавать Н + или ОН - , т.е. по способности диссоциировать, или, проще говоря, по силе. Сильные кислоты легко отдают протон, по существу 100% кислоты диссоциирует на ионы. Слабая кислота диссоциирует с трудом, только небольшая её часть распадается на ионы. Точно такие же рассуждения применимы и для оснований.
Количественно способность к диссоциации выражается отношением числа продиссоциированных частиц ( N дисс. ) к исходному числу частиц ( N исх. ) и называется степенью диссоциации ():
Если α=1 , то все исходные частицы в растворе распались на ионы, такие электролиты сильные . Если α , то только часть частиц распалась на ионы, такие электролиты слабые .
Процесс электролитической диссоциации протекает обратимо, поэтому можно применять принцип Ле Шателье. Разбавление раствора будет смещать равновесие в сторону увеличения степени диссоциации. Таким образом, диссоциация слабых электролитов в разбавленных растворах протекает лучше, чем в концентрированных. Применение закона действующих масс к электролитической диссоциации слабых электролитов позволяет получить выражение для константы диссоциации (К).
Рассмотрим, равновесие в водном растворе слабого электролита – уксусной кислоты:
CH 3 COOH С H 3 COO - + H +
Запишем выражение для константы химического равновесия данного процесса:
Поскольку константа равновесия не зависит от концентрации, поэтому константы диссоциации электролитов можно найти в справочных таблицах, для уксусной кислоты К а =1,8·10 -5 , значение очень маленькое, это означает, что она будет посылать в раствор мало ионов и, соответственно, будет являться слабой. Это можно доказать, посчитав степень ее диссоциации, например в 0,1 М растворе: , что составляет всего 1,3 %. Т.е. только 1,3% всех молекул кислоты будут распадаться на ионы. Здесь α – степень диссоциации кислоты, а выражение для расчета степени диссоциации – есть закон разбавления Оствальда:
Таблица. 3. Константа и степень диссоциации
ортофосфорной кислоты
В водных растворах слабых оснований рассуждения идентичны, например диссоциация NH 4 OH :
Выражение для константы диссоциации водного раствора аммиака:
Общие выражения для расчета констант диссоциации кислоты (19) и основания
УМК по химии для 8 класса О. С. Габриеляна.
Тип урока: изучение нового материала.
Форма урока: урок-исследование.
Цель урока: рассмотреть свойства кислот в свете теории электролитической диссоциации.
Задачи урока:
- Образовательные: на основе повторения и обобщения ранее изученного материала и в ходе знакомства с новым материалом углубить знания учащихся о свойствах кислот, отработать умение составления ионных уравнений реакций.
- Воспитательные: формировать мировоззренческие понятия о познаваемости природы, воспитывать чувство патриотизма и уважения к своей Родине, чувство коллективизма при работе в группах, уверенность в своих силах.
- Развивающие: развивать познавательный интерес к предмету, память, мышление, наблюдательность в ходе эксперимента; продолжить развитие навыков работы с химическими веществами и лабораторным оборудованием в процессе выполнения лабораторного опыта.
Оборудование и материалы: таблица растворимости, плакат “Химические свойства кислот”, карты-исследований, карточки-инструктажи, карточки с домашним заданием;
ТСО: проектор, видеофильм “Взаимодействие оксида меди с серной кислотой”.
Ход урока
I. Организационный момент
Приветствие учителя. Проверка готовности класса к уроку. Психологический настрой учащихся. Создание спокойной, деловой обстановки.
II. Повторение изученного материала
Я хочу начать наш урок с эпиграфа: “Один опыт я ставлю выше, чем тысячу мнений, рождённых только воображением”. Это изречение принадлежит великому русскому учёному М. В. Ломоносову. Из этих слов становится ясно, какую значимость придавал он опыту. Именно поэтому Михаил Васильевич в течение 7 лет настойчиво добивался организации химической лаборатории. “Профессор химии без лаборатории никакой пользы учинить не может, точно так же, как профессор астрономии без обсерватории”.
В итоге первая химическая лаборатория была учреждена в России в 1748 г. В ней было выполнено большое количество исследований, было сделано много открытий.
Не случайно наш урок начался со слов этого великого учёного. Сегодня мы с вами будем работать в рамках химической лаборатории, в которой, как и М.В.Ломоносов, будем проводить исследования. В нашей лаборатории мы будем изучать кислоты с точки зрения теории электролитической диссоциации. Сегодня на уроке мы рассмотрим химические свойства кислот в свете теории электролитической диссоциации. Это цель нашего урока. Тема нашего урока: “Кислоты, их классификация и свойства” (Запись даты и темы урока в тетради).
Вспомним основные понятия электролитической диссоциации:
– На какие группы делятся вещества по отношению к электрическому току? (Электролиты и неэлектролиты.)
– Дайте определение понятию “электролит”? (Это вещество, водный раствор или расплав, которого проводит электрический ток.)
– Приведите примеры электролитов? (Растворы и расплавы солей и щелочей, растворы кислот.)
– Дайте определение понятию “неэлектролит”? (Это вещество, водный раствор и расплав которого не проводит электрический ток.)
– Приведите примеры неэлектролитов? (Нерастворимые соли и основания, оксиды, простые вещества, органические вещества.)
– Дайте определение понятию “электролитическая диссоциация”? (Это распад электролита на ионы при расплавлении или растворении в воде.)
– Дайте определение кислоте из курса? (Это сложное вещество, состоящее из атомов водорода и кислотного остатка.)
Существует несколько классификаций кислот. Откройте учебник на странице 157, таблица № 10.
– Как могут классифицироваться кислоты?
Если кислоты электролиты, то они тоже могут диссоциировать. Сейчас я вам предлагаю написать диссоциацию серной и соляной кислот.
HСl → H + + Cl –
– Дайте определение кислоте с точки зрения теории электролитической диссоциации? (Это электролит, диссоциирующий в водном растворе на катион водорода и анион кислотного остатка.)
Мы повторили основные понятия, необходимые для дальнейшего изучения химических свойств кислот.
III. Изучение нового материала
Переходим к изучению химических свойств кислот.
Все химические свойства кислот представлены на плакате.
На доске прикрепляю карточки (зачитываю химические свойства)
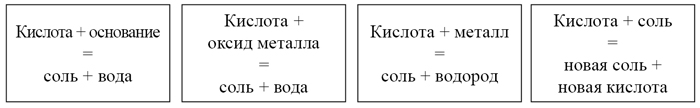
Ни одна наука не нуждается в эксперименте в такой степени как химия. Ее основные законы, теории и выводы опираются на факты, поэтому постоянный контроль опытом необходим”. Поэтому опытным путем докажем химические свойства кислот, соблюдая технику безопасности.
Инструкция “Меры безопасности при работе с кислотами”, инструкция проведения опыта), учащиеся разделены на 4 группы. Перед выполнением лабораторного опыта, учащиеся читают инструкцию (приложение 2).
Лабораторный опыт “Взаимодействие кислот с щелочами (основаниями)”
Порядок выполнения работы:
- В пробирку налейте 2 мл раствора гидроксида натрия и прибавьте 1–2 капли фенолфталеина. Что вы наблюдаете?
- К раствору щелочи с фенолфталеином приливайте по каплям соляную кислоту, периодически взбалтывая содержимое пробирки. Что вы наблюдаете?
- Составьте молекулярное и ионные уравнения проделанной реакции.
Лабораторный опыт “ Взаимодействие кислот с солями”
Порядок выполнения работы:
- В пробирку налейте 2 мл серной кислоты и прибавьте несколько капель хлорида бария. Что вы наблюдаете?
- Напишите молекулярное и ионные уравнения проделанной реакции
Лабораторный опыт “Взаимодействие кислот с металлами”
Порядок выполнения работы:
- В пробирку положите 2 гранулы цинка и прилейте соляную кислоту, закройте пробирку пробкой. Подождите некоторое время, чтобы она заполнилась водородом, затем откройте пробку и поднесите зажженную спичку к отверстию.
- Что вы наблюдаете?
- Напишите молекулярное уравнение проделанной реакции.
Лабораторный опыт “Взаимодействие кислот с основными оксидами” (видеофрагмент)
После выполнения работы 4 учащихся от каждой группы выходят к доске и пишут уравнения реакции под соответствующими карточками. В это время 4 других учащихся представляют отчет о проделанной работе.
Затем зачитываю применение кислот в быту. Уксусная и лимонная кислота применяется для удаления пятен от ржавчины на хлопчатобумажных, льняных и шерстяных белых тканях. 1 чайная ложка на 1 стакан воды, подогреть до кипения и ткань с пятном несколько раз окунуть в раствор или пятно протереть раствором, а затем кислоту тщательно смыть водой, лучше с добавлением несколько капель нашатырного спирта – для нейтрализации кислоты.
IV. Закрепление
Задание: составьте возможные уравнения реакций взаимодействия перечисленных веществ с раствором серной кислоты. Из букв, соответствующих правильным ответам, вы составите название одного из элементов четвертого периода таблицы Д. И. Менделеева.
III. Подведение итогов урока
Подведем итоги урока. Сегодня в рамках химической лаборатории мы исследовали кислоты с точки зрения теории электролитической диссоциации. Давайте ещё раз обратимся к эпиграфу, с которого мы начали наш урок: “Один опыт я ставлю выше, чем тысячу мнений рождённых только воображением”. Этим мудрым высказыванием М. В. Ломоносова давайте завершим наш урок.
IV. Домашнее задание
Учащиеся получают необычное домашнее задание разного уровня сложности “Кем вы считаете себя в химии?”: кандидатом наук, профессором или академиком. Ученые степени расположены в порядке возрастания от кандидата наук до академика. Самая высшая учёная степень – академик. Дома ученики выбирают посильный для себя вариант работы с той учёной степенью, на которую они претендуют. Каждый вариант работы включает 2 задания, одно из них носит творческий характер. К следующему уроку выполняется первое задание, на выполнение второго задания даётся одна неделя.
Читайте также:

