Применение полимеразной цепной реакции пцр план урока
Обновлено: 15.05.2024
3. Концепция полимеразная цепная реакция (ПЦР)
Полимеразная цепная реакция (ПЦР) —
экспериментальный метод молекулярной
биологии, позволяющий добиться
значительного увеличения малых концентраций
определённых фрагментов нуклеиновой
кислоты (ДНК) в биологическом материале
(пробе).
Помимо амплификации ДНК, ПЦР позволяет
производить множество других манипуляций с
нуклеиновыми кислотами (введение мутаций,
сращивание фрагментов ДНК) и широко
используется в биологической и медицинской
практике, например, для диагностики
заболеваний (наследственных, инфекционных),
для установления отцовства, для клонирования
генов, выделения новых генов.
4. Проведение ПЦР
Метод основан на многократном
избирательном копировании
определённого участка нуклеиновой
кислоты ДНК при помощи ферментов в
искусственных условиях (in vitro). При
этом происходит копирование только
того участка, который удовлетворяет
заданным условиям, и только в том
случае, если он присутствует в
исследуемом образце. В отличие от
амплификации ДНК в живых
организмах, (репликации), с помощью
ПЦР амплифицируются относительно
короткие участки ДНК.
В обычном ПЦР-процессе длина копируемых ДНК-участков
составляет не более 3000 пар оснований. С помощью смеси
различных полимераз, с использованием добавок и при
определённых условиях длина ПЦР-фрагмента может
достигать 20—40 тысяч пар нуклеотидов. Это всё равно
значительно меньше длины хромосомной ДНК
эукариотической клетки. Например, геном человека состоит
примерно из 3 млрд пар оснований
6. Компоненты реакции
Для проведения ПЦР в простейшем случае требуются
следующие компоненты:
ДНК-матрица, содержащая тот участок ДНК, который
требуется амплифицировать.
Два праймера, комплементарные противоположным концам
разных цепей требуемого фрагмента ДНК.
Термостабильная ДНК-полимераза — фермент, который
катализирует реакцию полимеризации ДНК. Полимераза для
использования в ПЦР должна сохранять активность при
высокой температуре длительное время, поэтому используют
ферменты, выделенные из термофилов — Thermus aquaticus
(Taq-полимераза), Pyrococcus furiosus (Pfu-полимераза),
Pyrococcus woesei (Pwo-полимераза) и другие.
Дезоксирибонуклеозидтрифосфаты (dATP, dGTP, dCTP, dTTP).
Ионы Mg2+, необходимые для работы полимеразы.
Буферный раствор, обеспечивающий необходимые условия
реакции — рН, ионную силу раствора. Содержит соли, бычий
сывороточный альбумин.
Чтобы избежать испарения реакционной смеси, в пробирку
добавляют высококипящее масло, например, вазелиновое. Если
используется амплификатор с подогревающейся крышкой,
этого делать не требуется.
Добавление пирофосфатазы может увеличить выход ПЦРреакции. Этот фермент катализирует гидролиз пирофосфата,
побочного продукта присоединения нуклеотидтрифосфатов к
растущей цепи ДНК, до ортофосфата. Пирофосфат может
ингибировать ПЦР-реакцию.
8. Праймеры
Специфичность ПЦР основана на образовании комплементарных
комплексов между матрицей и праймерами, короткими синтетическими
олигонуклеотидами длиной 18—30 оснований. Каждый из праймеров
комплементарен одной из цепей двуцепочечной матрицы и ограничивает
начало и конец амплифицируемого участка.
После гибридизации матрицы с праймером , последний служит затравкой
для ДНК-полимеразы при синтезе комплементарной цепи матрицы (см.
ниже).
Важнейшая характеристика праймеров — температура плавления (Tm)
комплекса праймер-матрица.
Tm — температура, при которой половина ДНК-матриц образует комплекс с
олигонуклеотидным праймером. Усредненная формула подсчета Tm для
короткого олигонуклеотида (и для длинных ДНК фрагментов), с учетом
концентрации ионов K+ и DMSO:
В случае неверного выбора длины и
нуклеотидного состава праймера или
температуры отжига возможно образование
частично комплементарных комплексов с
другими участками матричной ДНК, что может
привести к появлению неспецифических
продуктов. Верхний предел температуры
плавления ограничен оптимумом температуры
действия полимеразы, активность которой
падает при температурах выше 80 °C.
При выборе праймеров желательно
придерживаться следующих критериев:
GC-состав ~ 40—60 %;
близкие Tm праймеров (отличия не более, чем
на 5 °C);отсутствие неспецифических вторичных
структур — шпилек и димеров желательно,
чтобы на 3’-конце был гуанин или цитозин,
поскольку они образуют три водородные связи
с молекулой матрицы, делая гибридизацию
более стабильной.
10. Амплификатор
11. Ход реакции
12. 1. Денатурация
Двухцепочечную ДНК-матрицу нагревают до 94—96 °C
(или до 98 °C, если используется особенно
термостабильная полимераза) на 0,5—2 мин, чтобы
цепи ДНК разошлись. Эта стадия называется
плавлением (денатурацией), так как разрушаются
водородные связи между двумя цепями ДНК. Обычно,
перед первым циклом проводят длительный прогрев
реакционной смеси в течение 2—5 мин для полной
денатурации матрицы и праймеров.
13. 2. Отжиг
Когда цепи разошлись, температуру понижают, чтобы праймеры
могли связаться с одноцепочечной матрицей. Эта стадия
называется отжигом. Температура отжига зависит от состава
праймеров и обычно выбирается на 5 градусов меньше, чем
температура плавления праймеров. Неправильный выбор
температуры отжига приводит либо к плохому связыванию
праймеров с матрицей (при завышенной температуре), либо к
связыванию в неверном месте и появлению неспецифических
продуктов (при заниженной температуре). Время стадии отжига
— 30 сек, одновременно, за это время полимераза уже успевает
синтезировать несколько сотен нуклеотидов. Поэтому
рекомендуется подбирать праймеры с температурой плавления
выше 60 °C и проводить отжиг и элонгацию одновременно, при
60—72 °C.
14. 3. Элонгация
15. Использование в вирусологии
1. Медицинская диагностика
ПЦР дает возможность существенно ускорить и
облегчить диагностику наследственных и вирусных
заболеваний. Нужный ген амплифицируют с
помощью ПЦР с использованием соответствующих
праймеров, а затем секвенируют для определения
мутаций. Вирусные инфекции можно обнаруживать
сразу после заражения, за недели или месяцы до
того, как проявятся симптомы заболевания.
2.Клонирование генов:
Клонирование генов (не путать с клонированием организмов) — это
процесс выделения генов и, в результате генноинженерных
манипуляций, получения большого количества продукта данного гена.
ПЦР используется для того, чтобы амплифицировать ген, который
затем вставляется в вектор — фрагмент ДНК, переносящий
чужеродный ген в тот же самый или другой, удобный для
выращивания, организм. В качестве векторов используют, например,
плазмиды или вирусную ДНК. Вставку генов в чужеродный организм
обычно используют для получения продукта этого гена — РНК или,
чаще всего, белка. Таким образом в промышленных количествах
получают многие белки для использования в сельском хозяйстве,
медицине и др.
Клонирование гена с использованием плазмиды.
(1) Хромосомная ДНК организма A. (2) ПЦР. (3) Множество копий гена организма А.
(4) Вставка гена в плазмиду. (5) Плазмида с геном организма А. (6) Введение плазмиды
в организм В. (7) Умножение количества копий гена организма А в организме В.
ПЦР – полимеразная цепная реакция, в ходе которой амплифицируются определенные участки ДНК. ПЦР была изобретена американским ученым Кэри Мюллисом в 1983 году. Широкие возможности, сравнительная дешевизна и простота ПЦР позволили использовать этот метод генетического анализа в разных областях научных исследований. В основе ПЦР лежит естественный для клеток процесс репликации (рис. 1). Отличие ПЦР от репликации состоит в том, что ПЦР происходит in vitro и воспроизводит репликацию частично.

6- фрагмент Оказаки (затравка)
Рис. 1. Репликация ДНК
Основные компоненты реакции:
dNTP (нуклеотидтрифосфаты), Taq-полимераза, праймеры, Mg 2+ , ПЦР-буфер, деионизованная вода, исследуемая ДНК. Полимеразная цепная реакция делится на циклы. Каждый цикл состоит из нескольких стадий: денатурация, отжиг праймеров, наращивание (комплементарное достраивание) цепи. Для каждой стадии характерны своя температура и временной интервал. Количество ампликонов разной длины, образующихся в конце ПЦР, теоретически можно рассчитать, если знать места отжига праймеров. Классическим примером является отжиг одного праймера по одному разу на каждой из цепей ДНК. Необходимо, чтобы при этом 3'-концы праймеров были впереди по отношению друг к другу (рис.1). Два двухцепочечных фрагмента (ампликона), которые появляются в конце 3 цикла в этом примере, дадут через n циклов следующее количество копий: F = 2∙2 n , где F-количество двухцепочечных фрагментов ДНК, а n - количество циклов.

Рис. 2. Амплификация ДНК (окончание на следующей странице)

P – праймер, ffffffff – наращиваемая цепь
Рис. 2. Амплификация ДНК
Действовать самовольно и наугад.
Лекция 6. Подбор праймеров
Концентрация праймеров обычно варьирует в пределах 0,1-1 мкМ. Более высокая концентрация праймеров может приводить к образованию неспецифических продуктов.
Праймеры подбирают с учетом следующих требований:
а) содержание оснований Г и Ц в праймере должно находиться в пределах 40-60 %;
б) основания Г и Ц должны быть равномерно распределены по всей длине праймера;
в) желательно чтобы на 3’-конце праймера находилось основание Г или Ц, так как это увеличивает эффективность ПЦР;
г) следует избегать наличия 3 и более оснований Г или Ц на 3’-конце праймера, поскольку это может приводить к ошибочному спариванию праймера с ГЦ-богатыми участками ДНК;
д) праймеры не должны формировать стабильных дуплексов сами на себя или друг с другом;
е) участки отжига должны быть уникальными, т.е. праймеры не должны иметь длинных комплементарных участков вне специфических мест отжига;
ж) температура плавления (Тm) данной пары праймеров должна быть сходной и находиться в пределах 55-65 о С.
Для ориентировочного подсчета температуры плавления используют формулу:
где А, Т, Г, Ц, – количество соответствующих нуклеотидов в праймере. Более точные результаты можно получить при использовании формулы:
где М – ионная сила раствора (в молях/л), L – длина олигонуклеотида. Эта формула пригодна для олигонуклеотидов длиной 14-70 оснований (Сулимова и др., 2006).
Занятие 1. Выделение ДНК
Для этапа выделения ДНК используется, как правило, свежий биологический материал, в котором ДНК находится в целостном состоянии. Все факторы, которые приводят к разрыву ковалентных связей в исследуемой ДНК и загрязняют пробы чужеродной ДНК, обусловливают ошибки при проведении ПЦР и должны быть упразднены. К таковым, прежде всего, нужно отнести высокую температуру (40–50 о C и выше), электромагнитное излучение (ультрафиолет, рентгеновские лучи), радиационное излучение (α, β, γ-лучи), присутствие жизни на исследуемом материале (бактерии, грибы). Наиболее оптимальным местом хранения ДНК является морозильная камера. При температуре -5 – -20 о С ДНК в клетках может сохраняться достаточно длительное время, не разрушаясь. Для хранения материала в течение 1-2 суток используется холодильник (2-8 о C).
Для выделения ДНК лучше всего подходит ткань, где клетки активно делятся и растут.
Мертвая ткань и ткани опорно-трофической функции, где ДНК встречается в полуразрушенном состоянии, дают слабый выход ампликонов (фото 6).
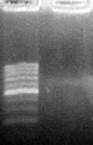
М – маркер молекулярных весов ДНК (длина фрагментов от 100 до 1000 п. н. с шагом в 100 п. н.)
О – отсутствие продуктов амплификации ДНК
Фото 6. Отрицательная ПЦР-реакция (праймер OPA 14) с ДНК, выделенной из плавников пеленгаса
Объем материала, необходимый для выделения достаточного количества ДНК, зависит от размера клеток. Чем меньше размер клеток, тем меньше необходимо исследуемого вещества. Если ПЦР состоит из 40 циклов, то теоретически достаточно и одной клетки для того, чтобы обнаружить наработанные ДНК-фрагменты. Чем меньше исследуемого материала (количества клеток), тем аккуратней нужно проводить исследование, чтобы не загрязнить пробу.
1. лизирующий раствор;
2. отмывочный раствор;
3. сорбент универсальный;
4. ТЕ-буфер для элюции ДНК.
Хранится набор при температуре 2-25 о С. Рассчитан на выделение ДНК из 100 проб.
1. Отобрать необходимое количество одноразовых пробирок. Промаркировать пробирки.
2. Растереть пробы в ступке с добавлением 100 мкл дистиллята и перенести пробы по отдельным пробиркам.
3. Лизирующий раствор (если он хранился при 2-8 о С) прогреть при 65 о С до полного растворения кристаллов. В пробирки добавить по 300 мкл лизирующего раствора.
4. Пробы тщательно перемешать на вортексе и прогреть 5 мин при 65 о С. Процентрифугировать 5 с при 5 тыс. об/мин на центрифуге. Если проба растворилась не полностью, процентрифугировать пробирку на микроцентрифуге 5 мин при 12 тыс. об/мин и использовать для выделения ДНК надосадочную жидкость, перенеся ее в новую пробирку.
5. Тщательно ресуспендировать сорбент на вортексе. В каждую пробирку отдельным наконечником добавить по 20 мкл ресуспендированного сорбента. Перемешать на вортексе, поставить в штатив (планшет) на 2 минуты, еще раз перемешать и оставить в штативе на 5 минут.
6. Осадить сорбент в пробирках центрифугированием при 5 тыс. об/мин в течение 30 с. Удалить супернатант, используя дозатор с переменным объемом и меняя наконечник для каждой пробирки.
7. Добавить в пробирки по 500 мкл раствора для отмывки, перемешать на вортексе до полного ресуспендирования сорбента, процентрифугировать 30 с при 10 тыс. об/мин на микроцентрифуге.
8. Удалить супернатант, используя дозатор с переменным объемом и меняя наконечник для каждой пробирки.
9. Повторить отмывку еще раз, следуя пункту 8., удалить супернатант полностью.
10. Поместить пробирки в термостат при 65 о С на 5-10 мин для подсушивания сорбента (осадок приобретает цвет мела). При этом крышки пробирок должны быть открыты.
11. В пробирки добавить по 100 мкл ТЕ-буфера для элюции ДНК. Перемешать на вортексе. Переместить в термостат при 65 о С на 5 мин, периодически встряхивая на вортексе.
12. Процентрифугировать пробирки при 12 тыс. об/мин в течение 1 мин на микроцентрифуге. Супернатант содержит очищенную ДНК, пробы готовы к постановке ПЦР.
Очищенную ДНК можно хранить в течение недели при 2-8 о С и в течение 1 года при минус 20 о С. Эффективность выделения ДНК составляет 50-70 %.
Выделить ДНК из листьев комнатных растений.
Выделить ДНК из полиэдров вируса ядерного полиэдроза непарного шелкопряда.
Занятие 2. Амплификация ДНК
Основой данного этапа ПЦР является программируемый амплификатор. Амплификатор в зависимости от стадии изменяет температурный режим пробирок и временной интервал.
Амплификация ДНК включает в себя 3 стадии*:
1. денатурация ДНК (0,5-1 минута, 93 о С),
2. отжиг праймеров (0,5-1 минута, 35-40 о С),
3. наращивание цепи (1 минута, 72 о С).
*Температура и продолжительность цикла подходят для праймеров типа OPA.
Амплификация фрагмента определенной длины, который образуется при классическом отжиге праймера, изображенном на рис. 2, происходит по следующей математической формуле:
F= 2(n-1) + 2 2 (n-2) + 2 3 (n-3) + 2 4 (n-4) + 2 5 (n-5) +. +2 n -1 (a) ,
где n – количество циклов, F – количество одноцепочечных фрагментов в начале цикла n+1 (денатурация).
Количество нарабатываемых двухцепочечных фрагментов описывается следующей математической формулой:
F= 2 1 (n-2) + 2 2 (n-3) + 2 3 (n-4) + 2 4 (n-5) + 2 5 (n-6) +. +2 n -2 (b),
где n- количество циклов, F-количество двухцепочечных фрагментов.
Рассмотрим значения формулы b для каждого цикла:
5-й цикл – 14n-48 и т. д.
Каждое значение фрагментов для любого цикла можно представить в следующем виде:
(2 n-1 -2)n – (2 n-1 -2)(n-2) – 2(n-2) = F,
2(2 n-1 -2) – 2(n-2) = F,
Количество ампликонов с каждым циклом(n) увеличивается почти в два раза. При n→ ∞ это можно записать в следующем виде:
lim 2 n -1 – 2(n – 1)/ 2 n – 2n = 1/2
Для проведения данного этапа ПЦР (амплификации) используют разные приемы. Рассмотрим два из них.
2. Обычный прием предусматривает помещение пробирок в амплификатор при комнатной температуре. После достижения амплификатором температуры в 94 о С начинается процесс денатурации и т. д.
1. смесь нуклеотидтрифосфатов, 2 mM;
2. 5-кратный реакционный буфер, без Mg 2+ ;
3. сульфат магния, 50 mM;
4. деионизованная вода, стерильная, автоклавированная;
5. Taq-полимераза, 5 ед/мкл;
6. воск для ПЦР, 14%-ный, плавление при 37 о С;
7. минеральное масло, вазелиновое;
8. исследуемая ДНК.
Такой набор рассчитан на 200 реакций в объеме 25 мкл. Хранится набор при температуре 2-8 о С.
Смешивание реактивов проводится в такой пропорции (возможны вариации):
1. смесь нуклеотидтрифосфатов – 2,5 мкл;
2. 5-кратный реакционный буфер – 5 мкл;
3. сульфат магния – 1,5 мкл;
4. деионизованная вода – 3 мкл;
5. Taq-полимераза – 0,5 мкл;
6. минеральное масло – 11,5 мкл;
7. исследуемая выделенная ДНК – 5мкл;
8. праймер – 1 мкл.
Общий объем: 30 мкл.
Амплификация ДНК длится приблизительно 2,5 – 3,5 часа (30-40 циклов).
Количество праймера, необходимое для амплификации одного ДНК-фрагмента с одной молекулы ДНК в течение n циклов (рис. 2), описывается математической формулой:
P=2 n +1 – 2, где n - количество циклов, а Р - количество молекул праймера.
1. Промаркировать пробирки.
2. Смешать реактивы, исследуемую ДНК и праймер в пропорции описанной выше. Процентрифугировать на вортексе в течение 1 минуты, чтобы на стенках пробирок не осталось реагентов.
3. Выбрать подходящую программу на амплификаторе, загрузить пробирки в амплификатор и запустить амплификацию.
4. По окончанию амплификации можно приступать к 3-му этапу ПЦР (детекции продуктов амплификации).
Пробирки с наработанными фрагментами ДНК можно хранить при температуре 2-8 о С в течение двух недель.
Провести амплификацию ДНК, выделенной из листьев комнатных растений с использованием праймеров серии OPA.
Провести амплификацию ДНК, выделенной из полиэдров вируса ядерного полиэдроза непарного шелкопряда со специфическими праймерами: а) 5’- GCC GGC GGA ACT GGC CCA -3’, б) 5’- CGA CGT GGT GGC ACG GCG -3’.
Задачи и вопрoсы
1.Дана последовательность ДНК:
5’-A T C G C C G C A A C G A G A C G A C T G C G C A T C G T C T C G T T G C G – 3’
3’- T A G C G G C G T T G C T C T G C T G A C G C G T A G C A G A G C A A C G C - 5’.
В ходе ПЦР будет использоваться праймер со следующей последовательностью 5’-C G C A A C G A G A C-3’. Установите длину ампликона.
2. В ходе этапа выделения было получено ДНК 888 клеток. Был подобран праймер, который обусловливает амплификацию фрагмента ДНК длиной 500 п. н. Достаточно ли 29 циклов ПЦР для визуальной детекции данного фрагмента?
3. Дана последовательность ДНК:
5’-A T G C G G C A T T G G A G A C T C T C T G A G C A C T G C G C A T C G C A A -3’
3’-T A C G C C G T A A C C T C T G A G A G A C T C G T G A C G C G T A G C G T T -5’.
В ходе ПЦР могут быть использованы следующие праймеры:
а. 5’-G C G G C A T T G G-3’,
б. 5’-G A C T C T C T G A-3’,
в. 5’-T T G C GA T G C G-3’,
г. 5’-A G A C T C T C T G-3’.
Отжиг каких пар праймеров даст продукты амплификации? Какой длины будут ампликоны, если смешать все праймеры?
4. Если бы Кэри Мюллис в 1983 году (25 декабря) запустил амплификацию одного фрагмента ДНК из одной клетки эпителия кожи, то сколько бы копий ампликона наработалось к сегодняшнему дню? Скорость ПЦР – 1 цикл в день.
5. В ходе ПЦР было получено 7 фрагментов разной длины. ДНК было выделено из 7 клеток. Использовался только один тип праймера. Сколько раз отжегся праймер в первом цикле ПЦР?
Сколько раз отжегся праймер во втором цикле ПЦР?
6. В ходе ПЦР образуется 1 фрагмент ДНК. ДНК была выделена из одной клетки. Полимеразная цепная реакция была прервана во время стадии денатурации ДНК 9-го цикла. Насколько уменьшилось количество свободных молекул праймера?
8. Во время детекции продуктов амплификации можно видеть, что некоторые ампликоны имеют разную толщину. Почему?
9. Почему для проведения ПЦР нельзя использовать
ДНК-полимеразу человека, растительное масло, обычную воду?
10. В ходе ПЦР амплифицируется 1 ДНК-фрагмент. ПЦР была прервана на 35 цикле (III стадия). В ходе ПЦР используется праймер 5’-C A T C A T C A T -3’. Какой будет длина ДНК-фрагмента, если объединить все молекулы праймера, которые успели отжечься к этому моменту?
11. Сколько нужно молекул праймера, чтобы амплифицировался 1 фрагмент ДНК в течение 26 циклов?
12. В составе генома человека приблизительно 3,2 миллиарда пар нуклеотидов. В ходе ПЦР амплифицируется фрагмент ДНК длиной 512 п.н. Сколько понадобится циклов ПЦР, чтобы сумма двухцепочечных ампликонов по количеству п. н. стала в 7 раз больше, чем геном человека?
В.В. Оберемок
Методические рекомендации
К применению ПЦР-метода
для студентов 5 курса дневной формы обучения
специальности 8. 070402
профессионального направления подготовки
для студентов 3 курса дневной формы обучения
профессионального направления подготовки
Рекомендовано к печати научно-методическим
советом ТНУ от 02.11.2006
Теоретическая часть (лекции)
Лекция 1. Смысл полимеразной цепной реакции (ПЦР). 4
Лекция 2. Оборудование для ПЦР-метода. 7
Лекция 3. Организация ПЦР-лаборатории и
правила поведения в ней…. 9
Лекция 4. Типичные ошибки при использовании
Лекция 5. Применение ПЦР-метода для разных видов
научно-исследовательской работы. 12
Лекция 6. Подбор праймеров………………………………..15
Практическая часть (лабораторные занятия)
Занятие 1. Выделение ДНК . 18
Занятие 2. Амплификация ДНК. 21
Занятие 3. Детекция продуктов
амплификации ДНК (электрофорез). 24
Задачи и вопросы. 27
Краткий словарь терминов и
дополнительные сведения. 29
Список рекомендуемой и цитируемой литературы………..34
Список рекомендуемых веб-сайтов…………………….…. 34
Лекция 1. Смысл полимеразной цепной реакции (ПЦР)
ПЦР – полимеразная цепная реакция, в ходе которой амплифицируются определенные участки ДНК. ПЦР была изобретена американским ученым Кэри Мюллисом в 1983 году. Широкие возможности, сравнительная дешевизна и простота ПЦР позволили использовать этот метод генетического анализа в разных областях научных исследований. В основе ПЦР лежит естественный для клеток процесс репликации (рис. 1). Отличие ПЦР от репликации состоит в том, что ПЦР происходит in vitro и воспроизводит репликацию частично.

6- фрагмент Оказаки (затравка)
Рис. 1. Репликация ДНК
Основные компоненты реакции:
dNTP (нуклеотидтрифосфаты), Taq-полимераза, праймеры, Mg 2+ , ПЦР-буфер, деионизованная вода, исследуемая ДНК. Полимеразная цепная реакция делится на циклы. Каждый цикл состоит из нескольких стадий: денатурация, отжиг праймеров, наращивание (комплементарное достраивание) цепи. Для каждой стадии характерны своя температура и временной интервал. Количество ампликонов разной длины, образующихся в конце ПЦР, теоретически можно рассчитать, если знать места отжига праймеров. Классическим примером является отжиг одного праймера по одному разу на каждой из цепей ДНК. Необходимо, чтобы при этом 3'-концы праймеров были впереди по отношению друг к другу (рис.1). Два двухцепочечных фрагмента (ампликона), которые появляются в конце 3 цикла в этом примере, дадут через n циклов следующее количество копий: F = 2∙2 n , где F-количество двухцепочечных фрагментов ДНК, а n - количество циклов.
Презентация на тему: " 1 Основы метода Полимеразной Цепной Реакции (ПЦР) ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ УЧРЕЖДЕНИЕ НАУКИ Центральный научно-исследовательский институт эпидемиологии." — Транскрипт:
1 1 Основы метода Полимеразной Цепной Реакции (ПЦР) ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ УЧРЕЖДЕНИЕ НАУКИ Центральный научно-исследовательский институт эпидемиологии (ФГУН ЦНИИЭ Роспотребнадзора)
2 2 Строение нуклеиновых кислот Нуклеиновые кислоты ДНК дезоксирибонуклеиновая кислота. Содержит генетическую информацию. РНК рибонуклеиновая кислота, участвует в синтезе белка. Нуклеотиды – мономеры, из которых состоят нуклеиновые кислоты.
3 3 ДНК- структура Генетический материал в человеческой клетке представлен двойной цепью ДНК, содержащей в целом 3 миллиарда пар оснований. Если нить ДНК вытянуть, то ее длина составит около 2 метров.Примечательно, что ДНК настолько компактно свернута в спираль, что в составе клеточного ядра ее диаметр составляет тысячную миллиметра. Две нити ДНК свернуты таким образом, что они формируют двойную спираль. В свою очередь, эта двойная спираль также свернута в спираль с тем, чтобы она могла разместиться внутри клетки.
4 4 Строение нуклеотидов Каждый нуклеотид состоит из фосфатной группы, пятиуглеродного сахара ( пентозы) и азотсодержащего основания. Когда нуклеотиды полимеризуются фосфатная группа одного нуклеотида связывается с сахаром другого нуклеотида, а последний в свою очередь ковалентно связан с молекулой азотистого основания. Нуклеотиды – присоединяются друг к другу таким образом, что фосфатная группа одного присоединяется ковалентно к сахару другого и образуют сахаро-фосфатный остов молекулы. Азотистые основания располагаются по одну сторону от него.
5 5 Строение нуклеотидов
6 6 Состав нуклеотидов Дезоксиаденозинтрифосфат = д АТФДезоксигуанозинтрифосфат = дГТФ Дезоксицитидинтрифосфат = д ЦТФДезокситимидинтрифосфат = дТТФ
7 7 Образование цепи ДНК 5-G-A-A-T-C-T-A-C-A-3
8 8 Образование двухцепочечной ДНК. Принцип комплементарности. дЦМФ дГМФ д ТМФдАМФ дГМФ дЦМФ д АМФдТМФ
9 9 Комплементарность Комплементарность – последовательность нуклеотидов в одной цепи автоматически определяет строго соответствующую ей последовательность нуклеотидов в комплементарной ей цепи.Так азотистое основание Аденин (А) всегда взаимодействует только с комплементарным ему азотистым основанием Тимин (Т) в молекулах ДНК. Комплементарность оснований обеспечивается системой водородных связей
10 10 Функции ДНК 1. ДНК является носителем генетической информации. Функция обеспечивается фактом существования генетического кода. 2. Воспроизведение и передача генетической информации в поколениях клеток и организмов. Функция обеспечивается процессом репликации. 3. Реализация генетической информации в виде белков, а так же любых других соединений, образующихся с помощью белков- ферментов.Функция обеспечивается процессами транскрипции и трансляции.
11 11 Полимеразная цепная реакция для детекции РНК Геномы некоторых вирусов, имеющих большое клиническое значение, состоят не из ДНК, а из РНК. Наиболее значимые из них – вирусы иммунодефицита человека (ВИЧ), гепатита с (ВГС) и семейство энтеровирусов
13 13 Рибонуклеиновая кислота 5-G-C-U-A-3 Химическая структура РНК по сравнению с ДНК отличается двумя особенностями. Во- первых, вместо присутствующего в ДНК тимидина в РНК содержится урацил, в котором СН 3 -группа при одном из атомов углерода заменена водородом. Во-вторых, в сахаре РНК, рибозе, к 2- углероду присоединена ОН- группа, а не атом водорода, как в дезоксирибозе, входящей в состав ДНК. При синтезе РНК и ДНК 5-конец присоединяемого нуклеотида (в данном случае аденозинтрифосфата) взаимодействует с 3- гидроксилом последнего в цепи нуклеотида с образованием фосфодиэфирной связи (отщепляется пирофосфат).
14 14 Репликация ДНК Определение : процесс, осуществляемый комплексом ферментов и белков, выполняющих топологическую функцию, суть которого в образовании идентичных копий ДНК для передачи генетической информации в поколениях клеток и организмов, называют репликацией ДНК.
15 15 Механизм репликации ДНК в клетке
16 16 Центральная догма молекулярной биологии Генетическая информация сначала переводится на язык рибонуклеотидов (ДНК транскрибируется в РНК), а затем – аминокислот (РНК транслируется в белки). Гены – это только те сегменты ДНК, которые кодируют белки
17 17 Геном как фундаментальный таксономический признак Структурная организация генома является фундаментальным таксонмическим признаком,лежащими в основе систематики животного и растительного мира. В соответствии со структурной организацией генома все живые организмы разделяютя на два надцарства: прокариот и эукариот. К прокариотам относят организмы, геном которых не заключен в ядро, ограниченное ядерной мембраной, и его редупликация не сопровождается митозом. Клетки эукариот содержат оформленное ядро, и редупликация их генома сопровождается митозом. Митоз-деление клеточного ядра, при котором образуются два дочерних ядра с наборами хромосом, идентичными наборам родительской клетки.
18 18 РЕГУЛЯЦИЯ РАБОТЫ ГЕНОВ У ПРОКАРИОТ Геномная ДНК прокариот почти целиком состоит из белок-кодирующих генов. Они служат матрицами для синтеза РНК, которые немедленно транслируются в белки. Последние регулируют работу генов и выполняют другие функции в клетке. ТРАДИЦИОННЫЕ ПРЕДСТАВЛЕНИЯ О РЕГУЛЯЦИИ РАБОТЫ ГЕНОВ У ЭУКАРИОТ Гены у эукариот состоят из экзонов - последовательностей, каждая из которых кодирует часть белковой молекулы, и интронов - некодирующих участков. Транскрипции подвергается ген целиком, но затем из первичного транскрипта вырезаются интронные РНК, а экзонные РНК сшиваются друг с другом с образованием матричной РНК (мРНК). На ней синтезируется белок, а интронная РНК расщепляется за ненадобностью.
19 19 НОВЫЙ ВЗГЛЯД НА РЕГУЛЯЦИЮ РАБОТЫ ГЕНОВ ЭУКАРИОТ Некоторые интронные РНК и даже часть экзонных принимают участие в регуляции работы генов, связываясь с молекулами ДНК, другими РНК и белками. Воздействуя на синтез белков на различных уровнях, некодирующие РНК могут служить дополнительным источником генетической информации.
20 20 Репликация ДНК в клетке – прообраз Полимеразной Цепной Реакции. Полимеразная цепная реакция достаточно точно повторяет принципы естественной репликации ДНК. ПЦР представляет собой трехступенчатый процесс (цикл), который повторяется заданное количество раз
21 21 Основные компоненты ПЦР- смеси Буферный раствор Mg ++ Праймеры дНТФ ДНК-полимераза (Taq, Tth) Исследуемый препарат ДНК
22 22 Олигонуклеотидные праймеры из подобранной пары должны быть комплементарны противоположным цепям ДНК и при этом ограничивать выбранный участок так, что при их ферментативном удлинении вновь синтезируемые цепи ДНК будут расти навстречу друг другу. Из этого следует, что для выбора, и синтеза самих олигонуклеотидных праймеров исследователю должна быть известна какая-то часть последовательности ДНК в выбранных регионах. (Случаи использования в качестве затравочных молекул праймеров с произвольной выбранной последовательностью нуклеотидов не рассматриваются). Кроме того, на праймеры накладывается масса других ограничений с целью исключения их нежелательной гомологии, формирования вторичной структуры, при этом необходимо учесть также температуры отжига каждого из них на матрице ДНК. Все это достаточно подробно рассматривается в специальной температуре. Более того, существует множество специальных компьютерных программ, позволяющих выбрать наиболее оптимально подходящие праймеры для каждого эксперимента.
23 23 Праймеры - основа специфичности ПЦР ДНК - мишень ATGGTA Праймер - F GAACCCTTACGGCA CTTGGGAATGCCGT TACCATTGGGCAAGGTACCATGGTAACCCGTTCC Праймер - R GAACCCTTACGGCA ATGGTAACCCGTTCCATGGTACCATTGGGCAAGG ATGGTAACCCGTTCC AGGTACC 5` 3`
24 24 Анализ нуклеотидных последовательностей микроорганизмов для выбора праймеров
25 25 Термостабильная ДНК- полимераза – основа автоматизации цикличности ПЦР
26 26 Что касается фермента ДНК-полимеразы, то, несмотря на то, что в первых опытах по амплификации ДНК это был простой Кленовский фрагмент ДНК-полимеразы I и его использование для этой цели принципиально возможно и сейчас, в настоящее время необходимо применять термостабильные ДНК-полимеразы, выдерживающие температуру 95 о С в течение значительного промежутка времени. Периодический нагрев реакционной смеси до столь высокой температуры вызван циклическим характером протекания реакции амплификации ДНК и предназначен для денатурации цепей ДНК (как исходных, так и вновь синтезированных).
28 28 4 дезоксирибонуклеотида - строительный материал, который используется ДНК- полимеразой для синтеза комплементарной цепи ДНК. Буферный раствор. Смесь катионов и анионов в определенной концентрации, обеспечивающих оптимальные условия для реакции, а также стабильное значение рН. Mg ++. Используется диапазон рабочих концентраций mM. Увеличение концентрации Мg++ оказывает очень резкое влияние на специфичность и эффективность ПЦР.
29 29 Этапы ПЦР Денатурация ДНК (95 о С) Отжиг праймеров (55-65 о С) Полимеризация цепей ДНК (72 о С)
30 30 Цикличность реакции амплификации Отжиг праймеров Полимеризация Денатурация Отжиг праймеров Полимеризация Денатурация Отжиг праймеров Полимеризация Денатурация Отжиг праймеров Полимеризация Денатурация Отжиг праймеров Полимеризация Денатурация Отжиг праймеров Полимеризация Денатурация Отжиг праймеров Полимеризация Денатурация Отжиг праймеров Полимеризация Денатурация Отжиг праймеров Полимеризация Денатурация N=1 N=40 N – количество циклов ПЦР
31 31 Программируемые термостаты (амплификаторы)
32 32 Накопление продукта ПЦР
36 36 Тридцатый цикл Тридцатый цикл ПЦР. На этом этапе в реакционной смеси содержится практически одни короткие матрицы
37 37 Экспоненциальный характер течения ПЦР
38 38 Резюме по ПЦР Этот трехступенчатый цикл (денатурация, отжиг, удлинение цепи), занимающий 2-3 минуты, может быть повторен многократно. Этот процесс ПЦР называется амплификацией, потому, что происходит копирование изначальной последовательности и затем каждая копия, в свою очередь, копируется снова и снова, пока их число не достигнет миллионов. Каждая новая нить ДНК служит матрицей для ферментативного синтеза цепей в следующем цикле. Теоретически, каждый новый цикл удваивает количество копий ДНК; в первом цикле их образуется 2, затем 4, затем 8, затем 16, т.н происходит экспоненциальное нарастание количества копий. Это и есть Цепная реакция в методе ПЦР. Теоретически, в результате 20 циклов образуется миллион копий, в результате 30 – миллиард. ПЦР позволяет получить количество материала, достаточное для детекции ДНК.
39 39 Электрофорез – метод детекции продуктов ПЦР
40 40 Размер ампликона можно оценить, сравнив его пробег с пробегом молекул ДНК известной длины, которые входят в состав маркера для ЭФ разделения ДНК 800 п.н. 500 п.н. 400 п.н. 300 п.н. 200 п.н. 100 п.н. Маркеры Ампликоны c b a a – 800 п.н. b – 450 п.н. c – 400 п.н.
43 43 Электрофорез в агарозном геле
45 45 М ОК ПК К+К ОК ПК К+ К- М
46 46 Основной принцип технологии Real-time PCR и гибридизационно-флуоресцентной детекции 1. Определение выхода продукта реакции после каждого цикла амплификации 2. Построение по этим данным кинетической кривой PCR 3. Определение относительной концентрации субстрата на основании анализа этой кривой Типы Real-time 1. Применение интеркалирующих флуоресцентных агентов, флуоресценция которых значительно возрастает при связывании с двухцепочечной ДНК. 2. Использование меченых флуоресцентными агентами олигонуклеотидных проб, комплементарных участкуPCR-продукта
48 48 Основные характеристики ПЦР Высокая чувствительность, основанная на экспоненциальном принципе накопления продукта. Высокая специфичность, основанная на выявлении уникальных для микро- (макро)-организма участков генетического материала. Метод прямого выявления возбудителя, основанный на универсальности способа хранения и передачи генетической информации живой материи.
49 49 Этапы ПЦР-анализа Обработка клинического материала ПЦР Детекция продуктов амплификации

Человечество вошло в третье тысячелетие с большим запасом знаний в области наук о жизни и большим потенциалом их практического использования. Человек может изменять наследственность окружающего его живого мира - бактерий, растений, животных и человека. Появились беспрецедентные возможности технологического прогресса (биотехнология и биоинженерия), открывшего также новые пути в медицине (генная терапия) и сельском хозяйстве (трансгенные, или генетически модифицированные, растения и животные). Все это возникло на базе революционных прорывов в науке (молекулярная биология), которые затем и породили биотехнологическую революцию. Появление генетически модифицированных организмов (ГМО) на продовольственном рынке несколько лет назад, и спрос на более точные и надежные методы для обнаружения иностранных (трансгенных или патогенных) ДНК в съедобных растениях, были движущей силой для внедрения полимеразной цепной реакции в реальном времени, как метода исследований в растениеводстве.
Полимеразная цепная реакция – экспериментальный метод молекулярной биологии, позволяющий добиться значительного увеличения малых концентраций определенных фрагментов нуклеиновой кислоты в биологическом материале. Такой процесс увеличения числа копий ДНК называется амплификацией. Копирование ДНК при полимеразной цепной реакции осуществляется специальным ферментом – полимеразой.
Открытию полимеразной цепной реакции предшествовало развитие молекулярно-биологических технологий.
В 1869г. И. Мишером была открыта ДНК. Биологическая функция нового вещества была не ясна.
В 1944г ученые О. Эвери, К. Мак-Леода и М.Мак-Карти провели ряд экспериментов по трансформации бактерий, доказавшие, что за трансформацию (приобретение болезнетворных свойств безвредной культурой в результате добавления в неё мёртвых болезнетворных бактерий) отвечают выделенные из пневмококков ДНК.
В 1955г. А. Корнберг открыл фермент, который назвал ДНК-полимеразой.
Этот фермент способен удлинять короткие олигонуклеотидные затравки (праймеры), присоединяя к 3'-концу цепи ДНК дополнительный нуклеотид, но для этого необходимо, чтобы праймер был связан с комплементарной цепью ДНК (матрицей). Раствор, в котором происходит эта реакция, должен содержать нуклеозидтрифосфаты (дНТФ), используемые в качестве строительных блоков.
В 1971г. Клеппе и соавт. представили данные, касающиеся состава ингредиентов реакционной смеси, и принципы использования коротких искусственно синтезированных молекул ДНК-праймеров для получения новых копий ДНК.
Однако возможность использования полимеразной цепной реакции в плане наработки большого количества копий нуклеиновых кислот еще не рассматривалась. Это было связано с техническими трудностями, обусловленными необходимостью трудоемкого синтеза праймеров, и нестабильностью фермента. В начале использования метода полимеразной цепной реакции после каждого цикла нагревания – охлаждения ДНК-полимеразу приходилось добавлять в реакционную смесь, так как она быстро инактивировалась при высокой температуре, необходимой для разделения цепей спирали ДНК. Процедура была очень неэффективной, требовала много времени и фермента.
В 1975г. Т. Брок и Х.Фриз открыли – грамотрицательную палочковидную экстремально термофильную бактерию, а в 1976 г. из нее была впервые
Преимуществом данного фермента была способность стабильно работать при повышенных температурах (оптимум 72-80 °C).
В 1983-1984 гг. К. Мюллис провел ряд экспериментов по разработке полимеразной цепной реакции и первым начал использовать полимеразу вместо неустойчивой к высоким температурам ДНК-полимеразы. Это позволило ускорить работы по разработке полимеразной цепной реакции. Кроме того, К. Мюллис вместе с Ф. Фалуном разработал алгоритм циклических изменений температуры в ходе полимеразной цепной реакции.
Таким образом, сформировался принцип использования полимеразной цепной реакции, как метода амплификации заданных фрагментов ДНК с полностью
или частично известной последовательностью.
Результатом открытия полимеразной цепной реакции стало почти немедленное практическое применение метода. В 1985 году Saiki с соавт. опубликовали статью, в которой была описана амплификация геномной последовательности β-глобина. С этого момента количество публикаций, о применении полимеразной цепной реакции в своих работах, стало увеличиваться в геометрической прогрессии.
В настоящее время предложены различные модификации полимеразной цепной реакции, показана возможность создания тест-систем для обнаружения микроорганизмов, выявления точечных мутаций, описаны десятки
различных применений метода.
Таким образом, открытие метода полимеразной цепной реакции стало одним из наиболее выдающихся событий в области молекулярной биологии за последние десятилетия. Это позволило поднять медицинскую диагностику на
качественно новый уровень.
В современной фитопатологии полимеразной цепной реакции применяют не только для диагностики патогенов растений. Эта техника широко используется для мониторинга болезней растений, а также для детекции возбудителей болезней в органах вегетирующих растений, семенах, фруктах и другой хранящейся продукции растениеводства. Она была применена для обнаружения вирусов многих экономически важных сельскохозяйственных культур и других культивируемых растений. Протоколы полимеразной цепной реакции были разработаны для многих важных фитопатогенных бактерий, и ряд праймеров, подходящих для их идентификации, приведен в соответствующих руководствах по идентификации фитопатогенных бактерий. Метод полимеразной цепной реакции применяется также для обнаружения фитопатогенных нематод, в частности с целью контроля золотистой и бледной картофельных нематод, являющихся карантинными объектами.
Полимеразная цепная реакция в растениеводстве - вирусные инфекции культурных растений вызывают ощутимые потери урожая, заметно ухудшают качество сельскохозяйственной продукции и все чаще рассматриваются как серьезная угроза продовольственной безопасности. Эта проблема касается всех продовольственных, кормовых и технических культур, возделываемых в любом регионе мира, и особенно актуальна для вегетативно размножаемых растений, поскольку прогрессирующее накопление вирусов в ряду поколений приводит к полному заражению и вырождению сорта. В настоящее время производство безвирусного семенного и посадочного материала основано, главным образом, на выбраковке зараженных и отборе здоровых растений для их последующего размножения.
При тотальном заражении сорта, когда отбор неэффективен, растения оздоравливают от вирусов с помощью термотерапии и культуры меристем. Однако, существующие методы оздоровления не гарантируют полного избавления от патогена.
Важнейшую роль в предупреждении распространения вирусных инфекций играет карантинный контроль продукции растениеводства, особенно импортируемого семенного и посадочного материала. Поэтому все этапы получения безвирусных растений должны сопровождаться анализами на присутствие вирусов.
Очевидно, что для осуществления такого отбора необходимо располагать чувствительными методами массовой диагностики вирусов.
На данный момент разработаны диагностические наборы для полимеразной цепной реакции анализа ряда наиболее распространенных патогенных микроорганизмов защищенного грунта, особенно важных при выращивании овощных культур, в первую очередь огурцов и томатов.
Применение таких диагностических наборов позволяет получить в течение нескольких часов быстрые и достоверные результаты, позволяющие сделать своевременную выбраковку семенного материала, а также при необходимости подобрать оптимальные состав и дозы реагентов для химической обработки растений, уменьшая тем самым потери урожая.
Сам метод полимеразной цепной реакции основан на многократном избирательном копировании определённого участка ДНК при помощи ферментов в искусственных условиях . При этом происходит копирование только того участка, который удовлетворяет заданным условиям, и только в том случае, если он присутствует в исследуемом образце. В отличие от ампли- фикации ДНК в живых организмах, с помощью полимеразной цепной реакции амплифицируются относительно короткие участки ДНК. В обычном ПЦР-процессе длина копируемых ДНК-участков составляет не более 3000 пар оснований. С помощью смеси различных полимераз, с использованием добавок и при определённых условиях длина ПЦР-фрагмента может достигать 20—40 тысяч пар нуклеотидов. Это всё равно значительно меньше длины хромосомной ДНК эукариотической клетки. Например, геном человека состоит примерно из 3 млрд пар оснований.
1. Механизм полимеразной цепной реакции
Для проведения полимеразной цепной реакции необходимо наличие в реакционной смеси ряда основных компонентов.
Праймеры– искусственно синтезированные олигонуклеотиды, имеющие, как правило, размер от 15 до 30 нуклеотидов, идентичные соответствующим участкам ДНК-мишени. Они играют ключевую роль в образовании продуктов реакции амплификации. Правильно подобранные праймеры обеспечивают специфичность и чувствительность тест-системы и должны отвечать ряду критериев: быть специфичными, не должны образовывать димеры и петли, область отжига праймеров должна находиться вне зон мутаций, делеций или инсеций в пределах видовой или иной специфичности, взятой в качестве критерия при выборе праймеров. При попадании на такую зону, отжиг праймеров не происходит, и, как следствие, возникает ложноотрипадании на такую зону, отжиг праймеров не происходит, и, как следствие, возникает ложноотрицательный результат.
Taq-полимераза– термостабильный фермент, обеспечивающий достраивание З'-конца второй цепи ДНК согласно принципу комплементарности.
Смесь дезоксинуклеотидтрифосфатов (дНТФ) – строительный материал, используемый Taq-полимеразой для синтеза второй цепи ДНК.
Буфер– смесь катионов и анионов в определенной концентрации, обеспечивающей оптимальные условия для реакции, а также стабильное значение рН.
Анализируемый образец– подготовленный к внесению в реакционную смесь препарат, который может содержать искомую ДНК, например, ДНК микроорганизмов, служащую мишенью для последующего многократного копирования.
Если в анализируемом образце присутствует искомая ДНК, то в процессе реакции амплификации с ней происходит ряд событий, которые обеспечиваются определенными температурными циклами. Каждый цикл амплификации состоит из трех этапов: денатурация, отжиг, элонгация (синтез).
2. Стадии постановки полимеразной цепной реакции
ПЦР-анализ состоит из трех стадий:
Для подготовки пробы к постановке полимеразной цепной реакции используют различные методики в зависимости от поставленных задач. Их суть заключается в извлечении ДНК из биопрепарата и удалении или нейтрализации посторонних примесей для получения препарата ДНК с чистотой, пригодной для постановки реакции амплификации.
На данный момент разработаны варианты постановки полимеразной цепной реакции, направленные на решение следующих задач: увеличение эффективности реакции и снижение риска образования неспецифических продуктов; реализацию возможности проведения как качественного, так и количественного анализа искомых участков молекулы ДНК.
На сегодняшний день существует несколько основных способов детекции результатов полимеразной цепной реакции: электрофоретический, гибридизационно-ферментный, гибридизационо-флуоресцентный.
3. Контроль полимеразной цепной реакции
Лаборатории, использующие в своей работе метод полимеразной цепной реакции, должны осуществлять следующие виды контроля: производственный, внутрилабораторный, внешний контроль работы лаборатории.
Читайте также:

