Почему водород находится в 1 и 7 группе в таблице менделеева кратко
Обновлено: 08.07.2024
Водород – первый элемент и один из двух представителей первого периода системы. Особенность строения электронной оболочки атома водорода (как и гелия) не позволяет однозначно решить, в какой группе периодической системы он должен находиться.
По электронной формуле 1s 1 он формально относится к s-элементам и является аналогом элементов I группы. С щелочными металлами его объединяет сходство атомного спектра, способность давать в растворах гидратированный положительно заряженный ион (H + ) (отсюда и восстановительная активность, в частности, способность вытеснять неактивные металлы из различных соединений, например под давлением из растворов их солей или при нагревании из оксидов). Водород и элементы IA группы проявляют степень окисления +1, являются типичными восстановителями и во всех соединениях одновалентны. Однако во многом водород отличается от щелочных металлов:
- В состоянии свободного иона H + водород не имеет ничего общего с ионами щелочных металлов. Протон на несколько порядков меньше катионов любых других элементов, обладает исключительно высоким поляризующим действием и благодаря высокой энергии ионизации атома водорода в соединениях практически не содержится.
- У атома водорода отсутствует эффект экранирования.
- Единственный электрон атома водорода является кайносимметричным.
- Энергия ионизации атома водорода намного больше энергии ионизации атомов щелочных металлов, что следует из пунктов 2 и 3:
В то же время водород схож и с галогенами, с которыми его связывает большое число признаков:
- Для завершения внешнего электронного слоя атому водорода, как и атомам галогенов не хватает одного электрона.
- Близкие значения энергии ионизации:
Можно провести много других аналогичных примеров линейной взаимосвязи свойств в ряду H2 – F2.
-
Большая энергия связи:
Как это неудивительно водород напоминает и элементы IV группы тем, что внешняя электронная оболочка атома заполнена как раз наполовину, как например у углерода.
Эти аналогии при некотором желании можно обнаружить и в химических свойствах, но, видимо, все же лучше признать, что из-за совершенно особенного строения атома настоящих аналогов в периодической системе химических элементов водород не имеет. Не случайно только для соединений водорода в степени окисления +1 имеет место специфический вид связи – водородной. Все это свидетельствует о том, что в периодической системе водороду должно быть отведено особое место. И некоторые авторы (Я. А. Угай) располагают его в одной протяженной клетке над элементами второго периода (исключая неон). И это вполне логично, т.к. первый период содержит всего 2 элемента, один из которых – инертный газ.
В то же время по аналогии с галогенами и щелочными металлами его условно располагают в VII и I группе периодической системы.
Так це ж химия еще школьная. Так как в состоянии отдать только единственный имеющийся электрон - потому и в 1-й группе. А так как для завершения внешнего энергетического уровня не хватает всего одного электрона, то в сёдьмой. То есть из-за своего строения Водород объединяет черты и той, и другой групп.
Дело в том, что водород объединяет в себе особенности элементов седьмой и первой групп. С одной стороны у водорода как и щелочных металлов на внешней оболочке лишь один электрон, что говорит о его положительной валентности, равной 1. Также данный газ может вытеснять некоторые металлы из солей. Но больше общих свойств с металлами у водорода нет, он является неметаллом, газом.
С другой стороны водород частично похож на галогены из седьмой группы. Его молекула также состоят из двух атомов. И водород и галогены - типичные неметаллы. Водород тоже может проявлять отрицательную валентность, когда вступает в соединения с металлами, в результате чего образуются металлические гидриды. Но этого мало, чтобы полностью отнести водород к галогенам.
Первая причина - электронная. Водород может отдать только один электрон (больше у него нет), чем он похож на щелочные металлы и может принять один электрон, чем он похож на галогены.
Вторая причина - в свойствах водорода. Он двухатомный газ (как галогены), но больше проявляет восстановительные свойства (как щелочные металлы). Может давать солеподобные гидриды (как галогены).
"усиление металлических свойств в периодах" - это круто! То есть от лития к неону (см. таблицу) усиливаются "металлические свойства". Мне как химику это было совершенно неизвестно! А вот в группе я легко могу объяснить: атомы становятся всё больше, наружные электроны всё дальше от ядра, притягиваются к нему всё слабее, а от другие электронов отталкиваются всё сильнее и потому легко отрываются от атома при первой возможности. Например, если кусок лития бросить в воду, то будет потихоньку растворяться с выделением водорода. А вот с цезием такой фокус не пройдет - потому что бросить его в воду невозможно - во всяком случае, на воздухе: он самовоспламенится еще раньше (разве только бросать в атмосфере аргона, но лучше этого не делать - даже калий взрывается).
108 ведь Хассий Hs.
109 Мейтнерий Mt.
110 Дармштадтий Ds.
Однако к сожалению химия была у меня давно, и сверялась по таблице образца 2010 года. Возможно произошли изменения и были добавлены новые элементы.
А группу галогенов и благородных газов, увы, не видно.
Я упоминала о побочной и главной подгруппе в своем ответе на ваш предыдущий вопрос.
Причина разделение группы на главную подгруппу (A) и побочную подгруппу (B латинская или Б русская) - различные химических свойства каждой подгруппы. Так VIIA группа представляет собой галогены - F фтор, Cl хлор, Br бром, I йод, At астат, которые являются типичными неметаллами, сильными окислителями. А вот в VIIB расположены Mn марганец, Tc технеций, Re рений, Bh борий, которые являются металлами. Вообще, все элементы побочных подгрупп являются металлами. В таблице ячейки с элементами побочных подгрупп обычно окрашивают в синий цвет, и символ пишут справа (элементы главных подгрупп - слева).
Водород в домашних условиях можно получить посредством электролиза. Обычно он выделяется при работе аккумуляторов. Поэтому в гаражах аккумуляторные устраивают отдельно. А бомбу из него не сделаешь. Для нее нужны дейтерий и тритий. А это уже не домашние технологии.
К середине XIX века было уже открыто 63 химических элемента. И разными учеными делались попытки найти закономерности этого набора: Иоганн Вольфганг Дёберейнер ("закон триад", 1817 для кальция, стронция, бария, 1829 - , , ), Джон Ньюлендс ("закон октав", по аналогии с музыкой, 1865), Юлиус Лотар Мейер (1864, опубликовал таблицу 28 элементов - 6 столбцов по валентностям).
Д.И.Менделеев знал об этих исследованиях. Но в отличие от Ю.Л.Мейера он учел атомные веса элементов, о чем сначала сообщил ведущим химикам мира, а затем опубликовал свое открытие в статье "Соотношение свойств с атомным весом элементов". Гениальность прозрения Д.И.Менделеева заключалась в том, что он в своей "периодической системе" оставил несколько клеток пустыми! О чём до него никому в голову не приходило. И таким образом известные элементы "вписались" в закон Менделеева. Более того, он имел большую внутреннюю уверенность, что существуют ещё неоткрытые элементы, для которых он оставил пустые клетки. Как показала жизнь, он оказался прав. Первый вариант таблицы, описывающей периодический закон Д.И.Менделеева выглядел так:
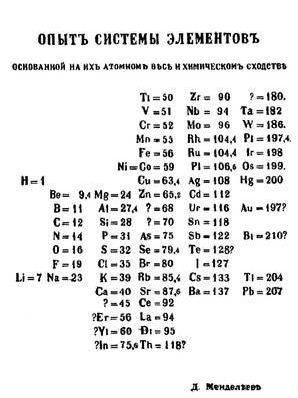
Вот так Менделеев создал Периодическую систему химических элементов.
Есть легенда, что Д.И.Менделеев увидел свою Периодическую таблицу во сне. Эту версию распространял профессор А.А.Иностранцев, желая позабавить своих студентов. Он рассказывал, якобы, что Д.И.Менделеев во сне отчетливо увидел свою таблицу, где элементы оказались расставлены, как нужно. А дальше уже студенты распространили эту байку, как и байку про "открытие водки 40%". Однако, основания для такой истории были. Д.И.Менделеев часто много работал, как говорится, "без сна и отдыха". Однажды его застал А.А.Иностранцев в крайне изможденном состоянии. А днем Д.И.Менделеев прилег отдохнуть и заснул. Когда он проснулся, он тут же на клочке бумаги записал итоговый вариант таблицы.
Сам же он к этой легенде относился скептически и говорил:
"Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово".
Водород можно отнести к 1-ой группе, поскольку он способен легко отдать свой единственный электрон, тем самым проявляя свойства щелочного металла (как литий, натрий, калий. ) , а к 7-ой группе, поскольку способен принять электрон для достижения "заветной" двойки - завершения энергетического уровня, тем самым проявляя свойства галогенов (хлора, брома. ) . Второе свойственно немного в меньшей степени, поэтому, как правило, информацию о водороде в периодической таблице помещают в первую группу, а в седьмой указывают символ элемента в скобках (особенно в старых вариантах) . Очень редко - наоборот
Водород проявляет как окислительные свойства, так и восстановительные)
Ведет себя как окислитель в степени +1
(кислоты, гидроксиды, органические соединения и т. д. :
Лимонная кислота С6Н8О7
Хлороводород НCl
Кремниевая кислота H2SiO3
Повареная соль, или гидроксид натрия NaOH)
а как восстановитель - в степени -1
(гидриды:
Гидрид натрия NaH
Гидрид кальция CaH2
Силан SiH4
Герман GeH4)
Периодический закон и периодическая система Д. И. Менделеева
В результате изучения данной темы вы научитесь:
- записывать электронные конфигурации элементов;
- устанавливать электронную структуру атома элемента по его положению в соответствующем периоде и подгруппе периодической системы, а значит, и его свойства;
- из рассмотрения электронной структуры невозбужденных атомов определять число электронов, которые могут участвовать в образовании химических связей, а также возможные степени окисления элементов;
- сравнивать относительную силу кислот и оснований.
Учебные вопросы:
1. Периодический закон Д.И. Менделеева
Периодический закон – величайшее достижение химической науки, основа всей современной химии. С его открытием химия перестала быть описательной наукой, в ней стало возможным научное предвидение.
Более детальное изучение строения вещества показало, что периодичность свойств элементов обусловлена не атомной массой, а электронным строением атомов.
Заряд ядра является характеристикой, определяющей электронное строение атомов, а следовательно, и свойства элементов. Поэтому в современной формулировке Периодический закон звучит так: свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от порядкового номера (от величины заряда ядра их атомов).
Выражением Периодического закона является периодическая система элементов.
2. Периодическая система Д. И. Менделеева
Периодическая система элементов Д. И. Менделеева состоит из семи периодов, которые представляют собой горизонтальные последовательности элементов, расположенные по возрастанию заряда их атомного ядра. Периоды 1, 2, 3, 4, 5, 6 содержат соответственно 2, 8, 8, 18, 18, 32 элемента. Седьмой период не завершен. Периоды 1, 2 и 3 называют малыми, остальные — большими.
Каждый период (за исключением первого) начинается атомами щелочных металлов (Li, Na, К, Rb, Cs, Fr) и заканчивается благородным газом (Ne, Ar, Kr, Xe, Rn), которому предшествует типичный неметалл. В периодах слева направо постепенно ослабевают металлические и усиливаются неметаллические свойства, поскольку с ростом положительного заряда ядер атомов возрастает число электронов на внешнем уровне.
В первом периоде, кроме гелия, имеется только один элемент — водород. Его условно размещают в IA или VIIA подгруппе, так как он проявляет сходство и со щелочными металлами, и с галогенами. Сходство водорода со щелочными металлами проявляется в том, что водород, как и щелочные металлы является восстановителем и, отдавая один электрон, образует однозарядный катион. Больше общего у водорода с галогенами: водород, как и галогены неметалл, его молекула двухатомна, он может проявлять окислительные свойства, образуя с активными металлами солеподобные гидриды, например, NaH, CaH2.
В четвертом периоде вслед за Са расположены 10 переходных элементов (декада Sc — Zn), за которыми находятся остальные 6 основных элементов периода (Ga — Кг). Аналогично построен пятый период. Понятие переходный элемент обычно используется для обозначения любого элемента с валентными d– или f–электронами.
Шестой и седьмой периоды имеют двойные вставки элементов. За элементом Ва расположена вставная декада d–элементов (La — Hg), причем после первого переходного элемента La следуют 14 f–элементов — лантаноидов ( Се — Lu). После Hg располагаются остальные 6 основных р-элементов шестого периода (Тl — Rn).
В седьмом (незавершенном) периоде за Ас следуют 14 f–элементов- актиноидов (Th — Lr). В последнее время La и Ас стали причислять соответственно к лантаноидам и актиноидам. Лантаноиды и актиноиды помещены отдельно внизу таблицы.
Таким образом, каждый элемент в периодической системе занимает строго определенное положение, которое отмечается порядковым, или атомным, номером.
В периодической системе по вертикали расположены восемь групп (I – VIII), которые в свою очередь делятся на подгруппы — главные, или подгруппы А и побочные, или подгруппы Б. Подгруппа VIIIБ-особая, она содержит триады элементов, составляющих семейства железа (Fе, Со, Ni) и платиновых металлов (Ru, Rh, Pd, Os, Ir, Pt).
Сходство элементов внутри каждой подгруппы — наиболее заметная и важная закономерность в периодической системе. В главных подгруппах сверху вниз усиливаются металлические свойства и ослабевают неметаллические. При этом происходит увеличение устойчивости соединений элементов в низшей для данной подгруппы степени окисления. В побочных подгруппах – наоборот – сверху вниз металлические свойства ослабевают и увеличивается устойчивость соединений с высшей степенью окисления.
3. Периодическая система и электронные конфигурации атомов
Поскольку при химических реакциях ядра реагирующих атомов не изменяются, то химические свойства атомов зависят от строения их электронных оболочек.
Заполнение электронных слоев и электронных оболочек атомов происходит в соответствии с принципом Паули и правилом Хунда.
Принцип Паули (запрет Паули)
Два электрона в атоме не могут иметь четыре одинаковых квантовых числа (на каждой атомной орбитали может находиться не более двух электронов).
Принцип Паули определяет максимальное число электронов, обладающих данным главным квантовым числом n (т.е. находящихся на данном электронном слое): Nn = 2n 2 . На первом электронном слое (энергетическом уровне) может быть не больше 2 электронов, на втором – 8, на третьем – 18 и т. д.
В атоме водорода, например, имеется один электрон, который находится на первом энергетическом уровне в 1s – состоянии. Спин этого электрона может быть направлен произвольно (ms = +1/2 или ms = –1/2). Следует подчеркнуть еще раз, что первый энергетический уровень состоит из одного подуровня – 1s, второй энергетический уровень – из двух подуровней – 2s и 2р, третий – из трех подуровней – 3s, 3p, 3d и т.д. Подуровень, в свою очередь, содержит орбитали, число которых определяется побочным квантовым числом l и равно (2l + 1). Каждая орбиталь условно обозначается клеткой, находящийся на ней электрон – стрелкой, направление которой указывает на ориентацию спина этого электрона. Значит, состояние электрона в атоме водорода можно представить как 1s 1 или изобразить в виде квантовой ячейки, рис. 1:

1s
Рис. 1. Условное обозначение электрона в атоме водорода на 1s орбитали
Для обоих электронов атома гелия n = 1, l = 0, ml = 0, ms = +1/2 и –1/2. Следовательно, электронная формула гелия 1s 2 . Электронная оболочка гелия завершена и очень устойчива. Гелий — благородный газ.
Согласно принципу Паули, на одной орбитали не может быть двух электронов с параллельными спинами. Третий электрон в атоме лития занимает 2s-орбиталь. Электронная конфигурация Li: 1s 2 2s 1 , а у бериллия 1s 2 2s 2 . Поскольку 2s-орбиталь заполнена, то пятый электрон у атома бора занимает 2р-орбиталь. При n = 2 побочное (орбитальное) квантовое число l принимает значения 0 и 1. При l = 0 (2s-состояние) ml = 0, а при l = 1 (2p – состояние) ml может быть равным +1; 0; –1. Состоянию 2р соответствуют три энергетические ячейки, рис. 2.
Рис. 2. Расположение электронов атома бора на орбиталях
Для атома азота (электронная конфигурация 1s 2 2s 2 2p 3 два электрона на первом уровне, пять — на втором) возможны два следующих варианта электронного строения, рис. 3:
1s 2s 2p 1s 2s 2p
Рис. 3. Возможные варианты расположения электронов атома азота на орбиталях
В первой схеме, рис. 3а, суммарный спин равен 1/2 (+1/2 –1/2 +1/2), во второй (рис. 3б) суммарный спин равен 3/2 (+1/2 +1/2 +1/2).
Расположение спинов определяется правилом Хунда, которое гласит: заполнение энергетических уровней происходит таким образом, чтобы суммарный спин был максимальным.
Таким образом, из двух приведенных схем строения атома азота устойчивому состоянию (с наименьшей энергией) отвечает первая, где все р-электроны занимают различные орбитали. Орбитали подуровня заполняются так: сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами.
Начиная с натрия, заполняется третий энергетический уровень с n = 3.
В атоме каждый электрон занимает свободную орбиталь с наиболее низкой энергией, отвечающей его наибольшей связи с ядром. В 1961 г. В.М. Клечковский сформулировал общее положение, согласно которому энергия электронных орбиталей возрастает в порядке увеличения суммы главного и побочного квантовых чисел (n + l), причем в случае равенства этих сумм, меньшей энергией обладает орбиталь с меньшим значением главного квантового числа n .
Последовательность энергетических уровней в порядке возрастания энергии примерно следующая:
Можно представить энергетический ряд орбиталей в виде схемы:

Рассмотрим распределение электронов на орбиталях атомов элементов четвертого периода. Строение атома калия:
+19K 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 1s 2s 2p3s 3p4s
Для записи дальнейших электронных формул в статье будем использовать сокращенную форму:

+19K [Ar]4s 1 [Ar] 4s
У кальция 4s-подуровень заполнен:

+20Ca [Ar]4s 2 [Ar] 4s
+24Cr [Ar]3d 5 4s 1 [Ar] 4s 3d
Рис. 4. Распределение электронов по орбиталям для атома хрома
Электронные конфигурации атомов Mn, Fe, Co, Ni, Cu и Zn отражены следующими формулами:
25Mn 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2
26Fe 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
27Co 1s 2 2s 2 2p 6 3s 2 3p 6 3d 7 4s 2
28Ni 1s 2 2s 2 2p 6 3s 2 3p 6 3d 8 4s 2
29Cu 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1
30Zn 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2
После цинка, начиная с 31 элемента — галлия вплоть до 36 элемента — криптона продолжается заполнение четвертого слоя (4р – оболочки). Электронные конфигурации этих элементов имеют следующий вид:
31Ga 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 1
32Ge 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 2
33As 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 3
34Se 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 4
35Br 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5 ,
36Kr 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6
Следует отметить, что если не нарушается запрет Паули, в возбужденных состояниях электроны могут располагаться на других орбиталях атомов.
4. Типы химических элементов
Все элементы периодической системы подразделяются на четыре типа:
1. У атомов s–элементов заполняются s–оболочки внешнего слоя (n). К s–элементам относятся водород, гелий и первые два элемента каждого периода.
2. У атомов р–элементов электронами заполняются р–оболочки внешнего уровня (np). К р -элементам относятся последние 6 элементов каждого периода (кроме первого).
3. У d–элементов заполняется электронами d–оболочка второго снаружи уровня (n–1) d . Это элементы вставных декад больших периодов, расположенных между s– и p– элементами.
4. У f–элементов заполняется электронами f–подуровень третьего снаружи уровня (n–2) f . К семейству f–элементов относятся лантаноиды и актиноиды.
Из рассмотрения электронной структуры невозбужденных атомов в зависимости от порядкового номера элемента следует:
Число энергетических уровней (электронных слоев) атома любого элемента равно номеру периода, в котором находится элемент. Значит, s–элементы находятся во всех периодах, р–элементы – во втором и последующих, d–элементы – в четвертом и последующих и f–элементы – в шестом и седьмом периодах.
Номер периода совпадает с главным квантовым числом внешних электронов атома.
Номер группы, как правило, указывает число электронов, которые могут участвовать в образовании химических связей. В этом состоит физический смысл номера группы. У элементов побочных подгрупп валентными являются электроны не только внешних, но и предпоследних оболочек. Это является основным различием в свойствах элементов главных и побочных подгрупп.
Элементы с валентными d– или f–электронами называются переходными.
Номер группы, как правило, равен высшей положительной степени окисления элементов, проявляемой ими в соединениях. Исключением является фтор – его степень окисления равна –1; из элементов VIII группы только для Os, Ru и Xe известна степень окисления +8.
5. Периодичность свойств атомов элементов
Такие характеристики атомов, как их радиус, энергия ионизации, сродство к электрону, электроотрицательность, степень окисления, связаны с электронным строением атома.
Различают радиусы атомов металлов и ковалентные радиусы атомов неметаллов . Радиусы атомов металлов вычисляются на основе межатомных расстояний, которые хорошо известны для большинства металлов на основе экспериментальных данных. При этом радиус атома металла равен половине расстояния между центрами двух соседних атомов. Аналогичным образом вычисляются ковалентные радиусы неметаллов в молекулах и кристаллах простых веществ. Чем больше атомный радиус, тем легче отрываются от ядра внешние электроны (и наоборот). В отличие от атомных радиусов, радиусы ионов – условные величины.
Слева направо в периодах величина атомных радиусов металлов уменьшается, а атомных радиусов неметаллов изменяется сложным образом, так как она зависит от характера химической связи. Во втором периоде, например, радиусы атомов сначала уменьшаются, а затем возрастают, особенно резко при переходе к атому благородного газа.
В главных подгруппах радиусы атомов увеличиваются сверху вниз, так как возрастает число электронных слоев.
Радиус катиона меньше радиуса соответствующего ему атома, причем с увеличением положительного заряда катиона его радиус уменьшается. Наоборот, радиус аниона всегда больше радиуса соответствующего ему атома. Изоэлектронными называют частицы (атомы и ионы), имеющие одинаковое число электронов. В ряду изоэлектронных ионов радиус снижается с уменьшением отрицательного и возрастанием положительного радиуса иона. Такое уменьшение имеет место, например в ряду: O 2– , F – , Na + , Mg 2+ , Al 3+ .
Энергия ионизации – энергия, необходимая для отрыва электрона от атома, находящегося в основном состоянии. Она обычно выражается в электронвольтах (1 эВ = 96,485 кДж/моль). В периоде слева направо энергия ионизации возрастает с увеличением заряда ядра. В главных подгруппах сверху вниз она уменьшается, т. к. увеличивается расстояние электрона до ядра и возрастает экранирующее действие внутренних электронных слоев.
В таблице 1 приведены значения энергий ионизации (энергий отрыва первого, второго и т.д. электронов) для некоторых атомов.
Во втором периоде при переходе от Li к Ne энергия отрыва первого электрона возрастает (см. таблицу 1). Однако, как видно из таблицы, энергия ионизации возрастает неравномерно: у следующих за бериллием и азотом соответственно бора и кислорода наблюдается ее некоторое уменьшение, что обусловлено особенностями электронного строения атомов.
Внешняя s–оболочка бериллия полностью заполнена, поэтому у следующего за ним бора электрон поступает на р-орбиталь. Этот р-электрон менее прочно связан с ядром, чем s–электрон, поэтому отрыв р–электронов требует меньшей затраты энергии.
Читайте также:
- Деятельность i iv государственных дум кратко
- Бригада каменщиков строит детский сад прораб стройки высчитал что 30 дней 6 человек 20 дней
- Содержание форма и структура плана воспитательной работы кратко
- Оперативный контроль игровая деятельность в доу
- Как лужин относится к людям к дуне и ее матери кратко

