Почему мы чувствуем боль кратко
Обновлено: 07.07.2024
Сайт предоставляет справочную информацию. Адекватная диагностика и лечение болезни возможны под наблюдением добросовестного врача. У любых препаратов есть противопоказания. Необходима консультация специалиста, а также подробное изучение инструкции!
Боль - это первый из описанных врачами Древней Греции и Рима симптомов – признаков воспалительного повреждения. Боль – это то, что сигнализирует нам о каком-либо неблагополучии, возникающем внутри организма или о действии некоего разрушающего и раздражающего фактора извне.
Боль, по мнению широко известного русского физиолога П. Анохина, призвана мобилизовывать разнообразные функциональные системы организма для его защиты от воздействия вредящих факторов. Боль включает в себя такие компоненты как: ощущение, соматические (телесные), вегетативные и поведенческие реакции, сознание, память, эмоции и мотивации. Таким образом, боль есть объединяющая интегративная функция целостного живого организма. В данном случае – человеческого организма. Ибо живые организмы, даже не обладая признаками высшей нервной деятельности, могут испытывать боль.
Имеются факты изменения электрических потенциалов у растений, которые фиксировались при повреждении их частей, а также такие же электрические реакции, когда исследователи наносили травму соседним растениям. Таким образом, растения реагировали на причиняемые им или соседним растениям повреждения. Только боль имеет такой своеобразный эквивалент. Вот такое интересное, можно сказать, универсальное свойство всех биологических организмов.
Виды боли – физиологическая (острая) и патологическая (хроническая)
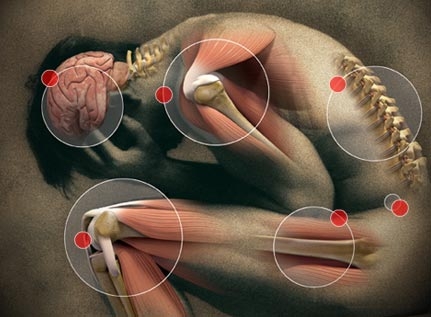
Боль бывает физиологической (острой) и патологической (хронической).
Острая боль
По образному выражению академика И.П. Павлова, является важнейшим эволюционным приобретением, и требуется для защиты от воздействия разрушающих факторов. Смысл физиологической боли заключается в отбрасывании всего, что угрожает жизненному процессу, нарушает равновесие организма с внутренней и внешней средой.
Хроническая боль
Это явление несколько более сложное, которое формируется в результате длительно существующих в организме патологических процессов. Процессы эти могут быть как врожденными, так и приобретенными в течение жизни. К приобретенным патологическим процессам относят следующие – длительное существование очагов воспаления, имеющих различные причины, всевозможные новообразования (доброкачественные и злокачественные), травматические повреждения, операционные вмешательства, исходы воспалительных процессов (например, образование спаек между органами, изменение свойств тканей, входящих в их состав). К врожденным патологическим процессам относятся следующие – различные аномалии расположения внутренних органов (например, расположение сердца снаружи грудной клетки), врожденные аномалии развития (например, врожденный дивертикул кишечника и прочие). Таким образом, длительно существующий очаг повреждения, приводит к постоянным и небольшим повреждениям структур организма, что также постоянно создает болевую импульсацию о повреждениях данных структур организма, затронутых хроническим патологическим процессом.
Так как данные повреждения минимальны, то и болевые импульсы довольно таки слабые, а боль становится постоянной, хронической и сопровождает человека повсеместно и практически круглосуточно. Боль становится привычной, однако никуда не исчезает и остается источником длительного раздражающего воздействия. Болевой синдром, существующий у человека шесть или более месяцев, приводит к значительным изменениям в организме человека. Происходит нарушение ведущих механизмов регуляции важнейших функций организма человека, дезорганизация поведения и психики. Страдает социальная, семейная и личностная адаптация данного конкретного индивида.
Как часто встречаются хронические боли?
Согласно исследованиям Всемирной Организации Здравоохранения (ВОЗ), каждый пятый житель планеты страдает хроническими болями, причиняемыми всевозможными патологическими состояниями, связанными с заболеваниями различных органов и систем организма. Это означает, что как минимум 20% людей страдают хроническими болями разной степени выраженности, различной интенсивности и длительности.
Для купирования болевых симптомов при острой и хронической боли, в частности при заболеваниях и травмах опорно-двигательного аппарата, чаще всего используются препараты группы НПВС. В 2020 году на российском рынке появился новый отечественный НПВС - селективный препарат Эторелекс (эторикоксиб). Препарат отличает более высокая, научно доказанная эффективность, нежели у стандартных противовоспалительных, а доступная стоимость (в сравнении с зарубежными аналогами) и высокая безопасность Эторелекса для ЖКТ – важный фактор в выборе назначения при необходимости продолжительной терапии.
Что такое боль и как она возникает? Отдел нервной системы ответственный за передачу болевой чувствительности, вещества вызывающие и поддерживающие болевые ощущения
Ощущение боли представляет собой сложный физиологический процесс, включающий периферические и центральные механизмы, и имеющий эмоциональную, психическую, а зачастую и вегетативную окраску. Механизмы болевого феномена полностью на сегодняшний день не раскрыты, несмотря на многочисленные научные исследования, которые продолжаются вплоть до сегодняшнего времени. Однако рассмотрим основные этапы и механизмы восприятия боли.
Нервные клетки, передающие болевой сигнал, виды нервных волокон
Самый первый этап восприятия боли представляет собой воздействие на болевые рецепторы (ноцицепторы). Данные болевые рецепторы расположены во всех внутренних органах, костях, связках, в коже, на слизистых оболочках различных органов, соприкасающихся с внешней средой (например, на слизистой кишечника, носа, горла и т.д.).
На сегодняшний день выделяют два основных вида болевых рецепторов: первые – это свободные нервные окончания, при раздражении которых возникает ощущение тупой, разлитой боли, а вторые представляют собой сложные болевые рецепторы, при возбуждении которых возникает чувство острой и локализованной боли. То есть характер болевых ощущений напрямую зависит от того, какие болевые рецепторы восприняли раздражающее воздействие. Относительно специфических агентов, которые могут раздражать болевые рецепторы, можно сказать, что к ним относятся различные биологически активные вещества (БАВ), образующиеся в патологических очагах (так называемые, алгогенные вещества). К данным веществам относятся различные химические соединения – это и биогенные амины, и продукты воспаления и распада клеток, и продукты локальных иммунных реакций. Все эти вещества, совершенно разные по химической структуре, способны оказывать раздражающее действие на болевые рецепторы различной локализации.
Простагландины – вещества, поддерживающие воспалительную реакцию организма
Однако, существует ряд химических соединений, участвующих в биохимических реакциях, которые сами непосредственно не могут воздействовать на болевые рецепторы, однако усиливают эффекты веществ вызывающих воспаление. К классу данных веществ, например, относятся простагландины. Простагландины образуются из особых веществ – фосфолипидов, которые составляют основу клеточной мембраны. Данные процесс протекает следующим образом: некий патологический агент (например, ферментов образуются простагландины и лейкотриены. Простагландины и лейкотриены в целом называются эйкозаноиды и играют важную роль в развитии воспалительной реакции. Доказана роль простагландинов в формировании болевых ощущений при эндометриозе, предменструальном синдроме, а также синдроме болезненных менструаций (альгодисменорее).
Итак, мы рассмотрели первый этап формирования болевого ощущения – воздействие на специальные болевые рецепторы. Рассмотрим, что происходит дальше, каким образом человек чувствует боль определенной локализации и характера. Для понимания данного процесса необходимо ознакомиться с проводящими путями.
Как болевой сигнал поступает в головной мозг? Болевой рецептор, периферический нерв, спинной мозг, таламус – подробнее о них
Биоэлектрический болевой сигнал, сформировавшийся в болевом рецепторе, по нескольким типам нервных проводников (периферическим нервам), минуя внутриорганные и внутриполостные нервные узлы, направляется к спинальным нервным ганглиям (узлам), расположенным рядом со спинным мозгом. Эти нервные ганглии сопровождают каждый позвонок от шейных до некоторых поясничных. Таким образом, образуется цепочка нервных ганглиев, идущая справа и слева вдоль позвоночного столба. Каждый нервный ганглий связан с соответствующим участком (сегментом) спинного мозга. Дальнейший путь болевого импульса из спинальных нервных ганглиев направляется в спинной мозг, который непосредственно соединен с нервными волокнами.
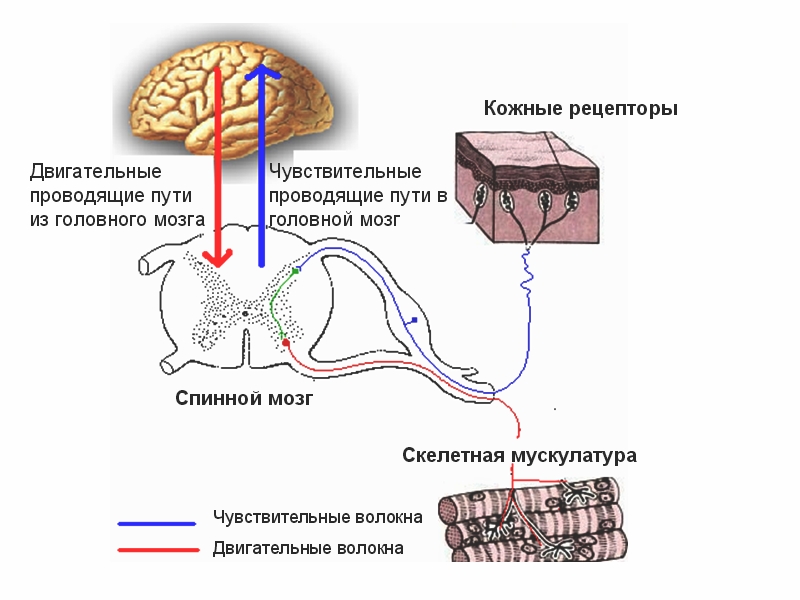
Поскольку спинной мозг имеет сегментарное строение, следовательно, в каждый сегмент спинного мозга входят нервные проводники со своей зоны ответственности. При наличии острого раздражителя с клеток задних рогов спинного мозга возбуждение может резко переключаться на клетки передних рогов спинномозгового сегмента, что вызывает молниеносную двигательную реакцию. Коснулись рукой горячего предмета – одернули сразу руку. При этом болевая импульсация все равно достигает коры головного мозга, и мы осознаем, что прикоснулись к горячему предмету, хотя руку уже рефлекторно отдернули. Подобные нервно-рефлекторные дуги для отдельных сегментов спинного мозга и чувствительных периферических участков могут различаться в построении уровней участия центральной нервной системы.
Как нервный импульс достигает головного мозга?
Перед достижением чувствительных участков коры головного мозга, болевая импульсация проходит, так называемую, предварительную обработку в определенных отделах центральной нервной системы. Это уже упомянутый таламус (зрительный бугор), гипоталамус, сетчатая (ретикулярная) формация, участки среднего и продолговатого мозга. Первый, и, пожалуй, один из самых важных фильтров на пути болевой чувствительности – это таламус. Все ощущения из внешней среды, от рецепторов внутренних органов – всё проходит через таламус. Невообразимое количество чувствительной и болевой импульсации проходит ежесекундно, днем и ночью через данный участок мозга. Мы не ощущаем, как происходит трение клапанов сердца, движение органов брюшной полости, всевозможных суставных поверхностей друг о друга – и всё это благодаря таламусу.
Как болевой импульс обрабатывается головным мозгом?

Задние ядра таламуса дают информацию о локализации источника боли, а срединные его ядра – о продолжительности воздействия раздражающего агента. Гипоталамус, как важнейший регуляторный центр вегетативной нервной системы, участвует в образовании вегетативного компонента болевой реакции опосредованно, через задействование центров регулирующих обмен веществ, работу дыхательной, сердечно-сосудистой и других систем организма. Ретикулярная формация координирует уже частично обработанную информацию. Особенно подчеркивается роль ретикулярной формации в формировании ощущения боли как некоего особого интегрированного состояния организма, с включением всевозможных биохимических, вегетативных, соматических составляющих. Лимбическая система мозга обеспечивает негативную эмоциональную окраску.Сам процесс осознания боли как таковой, определение локализации болевого источника (имеется ввиду конкретная область собственного тела) в совокупности со сложнейшими и разнообразнейшими реакциями на болевую импульсацию происходит непременно при участии мозговой коры.
Сенсорные участки коры головного мозга являются высшими модуляторами болевой чувствительности и играют роль, так называемого, коркового анализатора информации о факте, длительности и локализации болевого импульса. Именно на уровне коры происходит интеграция информации от различных видов проводников болевой чувствительности, что означает полновесное оформление боли как многогранного и многообразного ощущения.В конце прошлого века было выявлено, что каждый уровень построения болевой системы от рецепторного аппарата до центральных анализирующих систем мозга может обладать свойством усиления болевой импульсации. Как бы своего рода трансформаторные подстанции на линиях электропередач.
Приходится говорить даже о, так называемых, генераторах патологически усиленного возбуждения. Так, с современных позиций данные генераторы рассматриваются как патофизиологические основы болевых синдромов. Упомянутая теория системных генераторных механизмов позволяет объяснить, почему при незначительном раздражении болевой ответ бывает довольно значителен по ощущениям, почему после прекращения действия раздражителя ощущение боли продолжает сохраняться, а также помогает объяснить появление боли в ответ на стимуляцию зон кожной проекции (рефлексогенных зон) при патологии различных внутренних органов.
Хронические боли любого происхождения приводят к повышенной раздражительности, снижению работоспособности, потере интереса к жизни, нарушению сна, изменениям эмоционально-волевой сферы, часто доводят до развития ипохондрии и депрессии. Все указанные последствия уже сами по себе усиливают патологическую болевую реакцию. Возникновение подобной ситуации трактуется как образование замкнутых порочных кругов: болевой раздражитель – психо-эмоциональные нарушения – поведенческие и мотивационное нарушения, проявляющиеся в виде социальной, семейной и личностной дезадаптации – боль.
Антиболевая система (антиноцицептивная) – роль в организме человека. Порог болевой чувствительности
Наряду с существованием в организме человека болевой системы (ноцицептивной), существует еще и антиболевая система (антиноцицептивная). Что осуществляет антиболевая система? Прежде всего, для каждого организма существует свой, генетически запрограммированный порог восприятия болевой чувствительности. Данный порог позволяет объяснить, почему на раздражители одинаковой силы, продолжительности и характера разные люди реагируют по-разному. Понятие порога чувствительности – это универсальное свойство всех рецепторных систем организма, в том числе и болевых. Так же как и система болевой чувствительности, антиболевая система имеет сложное многоуровневое строение, начиная с уровня спинного мозга и заканчивая мозговой корой.
Как регулируется деятельность антиболевой системы?
Сложная деятельность антиболевой системы обеспечивается цепочкой сложных нейрохимических и нейрофизиологических механизмов. Основная роль в этой системе принадлежит нескольким классам химических веществ – мозговым нейропептидам, В их число входят и морфиеподобные соединения – эндогенные опиаты (бета-эндорфин, динорфин, различные энкефалины). Названные вещества могут считаться так называемыми эндогенными анальгетиками. Указанные химические вещества обладают угнетающим воздействием на нейроны болевой системы, активируют антиболевые нейроны, модулируют активность высших нервных центров болевой чувствительности. Содержание данных антиболевых веществ в центральной нервной системе при развитии болевых синдромов уменьшается. По всей видимости, этим и объясняется снижение порога болевой чувствительности вплоть до появления самостоятельных болевых ощущений на фоне отсутствия болевого раздражителя.
Следует также отметить, что в антиболевой системе наряду с морфиеподобными опиатными эндогенными анальгетиками большую роль играют и широко известные мозговые медиаторы, такие как: серотонин, норадреналин, дофамин, гамма-аминомасляная кислота (ГАМК), а также гормоны и гормоноподобные вещества – вазопрессин (антидиуретический гормон), нейротензин. Интересно, что действие мозговых медиаторов возможно как на уровне спинного, так и головного мозга. Резюмируя вышесказанное, можно заключить, что включение антиболевой системы позволяет ослабить поток болевой импульсации и снизить болевые ощущения. При возникновении каких-либо неточностей в работе данной системы любая боль может быть воспринята как интенсивная.
Таким образом, все болевые ощущения регулируются совместным взаимодействием ноцицептивной и антиноцицептивной систем. Только их согласованная работа и тонкое взаимодействие позволяет адекватно воспринимать боль и её интенсивность, в зависимости от силы и продолжительности воздействия раздражающего фактора.
Все люди рано или поздно сталкиваются с болью, но мало кто знает где и как формируется болевое ощущение.
В данной статье нам хотелось бы приоткрыть завесу тайны механизмов передачи боли.
Как мы чувствуем боль? Давайте на минутку представим себе, что кто-то, конечно же, не Вы, порезал палец острым кухонным ножом. По какому же пути необходимо пройти болевому импульсу от поврежденного пальца, чтобы достигнуть головного мозга, где в конечном итоге и формируется ощущение боли?
Болевые рецепторы, находящиеся в коже в результате травмы активируются, благодаря выходу из поврежденных клеток различных химических веществ, таких как гистамин, субстанцию Р, серотонин (5HT), брадикинин и простагландины.
Болевые импульсы, генерируемые этими рецепторами, передаются затем по чувствительным спинномозговым (сенсорным) нервам, клеточные тела которых сгруппированы в небольшое образование, именуемое спинномозговым ганглием (узлом).
Поступившие в спинной мозг болевые импульсы обрабатываются в заднем роге, после чего ответно формируются импульсы, летящие через двигательные нервы к мышцам руки, приводя к её быстрому отдергиванию от повреждающего агента, в данном случае лезвия ножа. Такую основу имеет под собой безусловный (автоматический) рефлекс, не требующий участия головного мозга, или сознательной деятельности.
В зависимости от функционального состояния заднего рога спинного мозга (см. о воротной теории боли и феномене сенситизации заднего рога ниже), болевые сигналы вместе с тем направляются вверх по спино-таламическому пути спинного мозга к специфической структуре головного мозга, называемой таламус.
В дальнейшем, таламус, обработав посупившие к нему импульсы, отправляет специфические сигналы в центры, контролирующие кровяное давление, пульс, дыхание и эмоции. Вот почему в случае остро возникшей боли происходит учащение сердцебиения и дыхания, повышается кровяное давление, а также происходят знакомые всем нам эмоциональные и поведенческие изменения: появляется болезненная гримаса, человек дует на поврежденный палец или быстро трясет им в воздухе.
Между тем, болевые импульсы не останавливаются в таламусе, а передаются дальше в первичную сенсорную кору – специфическую область полушарий головного мозга, где происходит конечная обработка полученных сигналов.
Принято считать, что в таламусе все же происходит частичное восприятие поступающих болевых импульсов, однако их наиболее тонкая дискриминация (распознавание), происходит в первичной сенсорной коре полушарий головного мозга.
Важно отметить, что сперва, сразу после воздействия болевого раздражителя, формируется острое, с мгновенным началом, кратковременное болевое ощущение, передаваемое от области повреждения к задним рогам спинного мозга по толстым быстропроводящим сенсорным (чувствительным) волокнам - А-дельта волокнам.
За ним следует тупая, имеющая медленное начало, более длительная боль, передающаяся от травмированного участка в задний рог по волокнам меньшего диаметра с низкой скоростью проведения - C волокнам. Почему это важно? Предлагаем Вам ознакомиться с воротной теорией боли.
Воротная теория боли
Почему, получив то или иное повреждение мы незамедлительно потираем травмированный участок?
Потирание поврежденного участка приводит к возбуждению тактильных рецепторов (реагирующих на прикосновение) кожи, которые активируются и начинают посылать импульсы в задний рог спинного мозга через А-бета волокна. Эти сигналы, поступив в спинной мозг, блокируют проведение болевых импульсов, поступающих по С-волокнам, то есть закрывают ворота на боль.
На механизме блокирования ворот на боль основаны многие методы лечения, такие как иглоукалывание – стимулирут А-дельта волокна, а также ряд физиопроцедур (чрезкожная нейростимуляция, электромышечная стимуляция и т.д.). Ниже хотелось бы рассмотреть еще один, обратный воротному механизму феномен – сенситизацию заднего рога.
Феномен сенситизации заднего рога
В течение часа после травмы, происходят специфические изменения в заднем роге спинного мозга, получившие название феномена сенситизации, основной смысл которого заключается в том, что все поступающие в спинной мозг стимулы более легко проводятся по спинному мозгу в головной, а не блокируются на уровне заднего рога, препятствуя тем самым информационной перегрузке головного мозга.
Сенситизация обусловлена активацией Н-метил-Д-аспартам (NMDA) рецепторов. На блокаде этих рецепторов основан обезболивающий эффект ряда лекарственных препаратов.
Клинически сенситизация проявляется снижением порога восприятия как болевой, так и любой другой, будь то температурной, тактильной, вибрационной чувствительности в той области, за которую ответственен сенситизированный задний рог.
Порог болевой чувствительности изменяется по двум направлениям:
Стимулы, которые ранее расценивались как безболезненные, воспринимаются как боль;
Самые незначительные болевые импульсы воспринимаются как интенсивная боль.
Обычно, после травмы, явления сенситизации проходят одновременно с заживленинем поврежденных тканей. Напротив, у определенной части людей она сохраняется гораздо дольше, что в определенной степени можеть объяснять развитие хронических болевых синдромов. В ряде случаев, длительная сенситизация объясняется сохранением активного очага в поврежденной когда-то ткани, который посылает болевые импульсы в спинной мозг, поддерживая тем самым произошедшие в нем перестройки. В других - точная причина этого феномена неизвестна. Однако замечено, что существует тесная взаимосвязь между эмоциями и феноменом сенситизации заднего рога. Наличие у человека тревожных и депрессивных расстройств приводит к ослаблению нисходящих тормозных влияний на спинной мозг со стороны головного, что может приводить к поддержанию сенситизации.
Исходя из выше сказанного, методами лечения хронических болевых синдромов являются:

Кто то сказал: "Чувствовать боль - значит быть живым". Возникновение боли и реакция организма на ее появление только недавно стали понятны в основных деталях. Исследователи всего мира вносили свой вклад в чрезвычайно важную картину взаимодействия различных систем организма. Так что же позволяет нам чувствовать боль и почему?

Восприятие физической боли передается в организме теми же механизмами, что и прочие его ощущения. Пусковым механизмом является раздражение чувствительных нервных окончаний в какой-либо периферической части тела прикосновением, надавливанием, воздействием температуры, запаха или другим способом. Раздражение в виде электрического импульса передается от рецепторов по нервным волокнам к спинному мозгу, а затем идет по нему до головного мозга и воспринимается специфическим отделом головного мозга, ответственным за это частное ощущение. Воспринимающая область головного мозга осознает "послание", и только здесь оно воспринимается как боль или запах, жар или холод. Если раздражение сильное и превышает порог чувствительности, который индивидуален для каждого человека, мы начинаем чувствовать боль, ожог. Если нервное окончание не работает, тогда боль не ощущается. Поэтому люди, рецепторы которых каким-либо образом утратили чувствительность, могут подвергаться значительной опасности, не замечая этого. При проказе защитная миелиновая оболочка нерва повреждается бактериями, и больной может получить травму, не заметив этого, так как не ощущает боли в пораженной части тела. С другой стороны, повреждение самого нерва может служить причиной сильнейшей боли.

Обзор
Они знают, что такое боль.
Автор
Редакторы



Спонсором приза зрительских симпатий выступила компания BioVitrum.
Какая бывает боль?

Классификация боли, предложенная Клиффордом Вульфом [1], включает в себя четыре типа: ноцицептивная, воспалительная, невропатическая и функциональная. Кроме того, стоит отметить и психогенную боль.
Эпизод I: Пойманная угроза
Чтобы определить любой сигнал, наш организм использует внушительный арсенал белков-рецепторов. Их задача заключается в том, что они реагируют на строго определенный внешний фактор и передают сигнал об этом связывании при помощи конформационных изменений [2], влекущих за собой и изменение биохимических свойств этого рецептора. Переданные от рецептора сигналы усиливаются каскадом белковых взаимодействий в клетке, могут передаваться с помощью нервной или эндокринной систем и, в конечном итоге, приводят к физиологическому ответу.
Нейроны, работающие в ноцицептивной системе, различаются по набору рецепторов. Среди этих нейронов выделяются четыре группы: несущие рецепторы температуры, химического воздействия, механического воздействия и полимодальные (с рецепторами всех раздражителей).
Одни из важнейших рецепторов, реагирующих на тепло, — белки группы TRP. Это ионные каналы, неспецифичные к катиону, — при открытии они пропускают в клетку натрий, магний и кальций, в результате чего в клетке возникает потенциал действия, необходимый для передачи нервного импульса. Этих доблестных воинов термочувствительности несколько: TRPV1–TRPV4 и TRPM8. Первые активируются при повышенной температуре, второй же реагирует на холод. Эти каналы обладают интересной особенностью — помимо температуры, они могут активироваться химическими стимулами.
Биохимические механизмы этой активации отличаются от температурной, но в мозге возникают в ответ на эти химические стимулы практически те же ощущения, что и на изменение температуры. А теперь вспомните, какие продукты питания вызывают ощущение обжигания, а какие — холода? Думаю, почти каждый читатель сталкивался с этими продуктами. Острота перца чили обусловлена тем, что содержащийся в нем капсаицин активирует рецептор TRPV1 (такие вещества называются агонистами) [3]. А ментол, содержащийся в мяте, — агонист TRPM8, и вызывает чувство прохлады (рис. 2) [4].

Но если можно с помощью небольших молекул заставить нас чувствовать эффект ноцицепции, то, может, с помощью других молекул можно этот рецептор заблокировать? Да! Разработка антагонистов TRPV1 [3], которые, блокируя рецептор, могут снижать болевые ощущения, например, от капсаицина, ведется с 1990-х годов, однако большинство препаратов пока не достигли рынка (рис. 3). Интересно, что эти препараты предлагается применять для лечения невропатической боли, то есть той, когда рецепторы активируются без внешней причины. Достигнут ли фармкомпании успеха — покажет время.

Рисунок 3. Один из первых разработанных антагонистов TPRV1 — капсазепин. Этот препарат находится сейчас на стадии клинических испытаний. Вообще, успех подобного рода лекарств может стать новой вехой в истории фармакологии анальгетиков — блокирование ноцицепторов вместо ослабления болевого импульса на более поздних стадиях.
Механоноцицепторы — куда более разнородная и многообразная группа рецепторов, чем терморецепторы. Среди них стоит отдельно выделить рецепторы, активируемые, помимо давления, сигнальным олигопептидом брадикинином. Его рецептор В-1 синтезируется в поврежденных клетках — например, при получении травмы. Связывая брадикинин, он активирует сигнальный каскад, приводящий к возникновению боли. Интересно, что в число прямых эффектов от связывания рецептора входит усиление воспаления — то есть поддержание стимула для дальнейшей активации болевых рецепторов: чем больше боли, тем больше боли. Поэтому частая активация В-1 (например, постоянным воспалением при аутоиммунных заболеваниях) может стать причиной развития хронической боли [5].
Рецепторы, воспринимающие различные химические раздражители (ирританты), тоже разнообразная, а местами малоизученная группа. Среди них особо примечателен член уже знакомого нам семейства TRP — TRPA1. Этот рецептор активируется совершенно разными молекулами, зачастую, вступая с ними в реакцию, что приводит к необратимости эффекта. В числе широко известных ирринантов, активирующих TRPA1, — аллилизоцианат, содержащийся в знаменитой японской приправе васаби, и аллицин, содержащийся в чесноке (рис. 4).

Рисунок 4. Вкус васаби сильно отличается от чесночного, однако за восприятие остроты этих приправ отвечает один рецептор — TRPA1. Серосодержащие летучие вещества этих растений способны активировать рецептор и дальнейшую ноцицептивную передачу. Эти агенты пригождаются ученым при изучении химических основ работы рецепторов.
Отдельно стоит упомянуть боль, возникающую при воспалении. Ключевое вещество, на которое реагируют ноцицепторы, — гистамин, который некоторые клетки нашей иммунной системы (например тучные) выбрасывают в кровь в ответ на стимулы к воспалению. Гистамин связывается со своими рецепторами (из семейства GPCR). Активация гистаминового рецептора 1 типа (H1) приводит к активации фосфолипазы С (PLC) и гидролизу фосфатидилинозитолбисфосфата (PIP2) с образованием инозитолтрифосфата (IP3), который затем запускает высвобождение Ca 2+ из эндоплазматической сети. Кальций, связавшись с кальмодулином, активирует протеинкиназу С, которая, при помощи дальнейшего фосфорилирования регуляторных киназ, подавляет экспрессию потенциал-зависимых калиевых каналов 7 типа (Kv1.7), что приводит к деполяризации мембраны и проведению болевого импульса [7]. Интересно, что гистаминовые рецепторы 3 типа, которые локализованы в ЦНС, могут ингибировать проведение определенных ноцицептивных импульсов [8].
Стоит отметить, что другие активные игроки воспалительного процесса — простагландины — действуют похоже: в результате связывания простагландина Е2 с рецептором PTGER2 активируется протеинкиназа А, которая, в свою очередь, увеличивает экспрессию уже знакомого нам TRPV1 [9].
Эпизод II: Атака нервных волокон | Кондукция
Aβ-волокна работают еще быстрее (30–100 м/с) и сильно миелинизированы. Механорецепторы, расположенные в этих волокнах, крайне чувствительны, поэтому функция этих волокон — проведение сигналов о слабых раздражителях. Избыточная активация волокон Aβ вызывает аллодинию — боль, возникающую от причин, обычно ее не вызывающих, — например, от сидения на стуле.
Волокна типа C проводят нервный импульс медленно (0,5–2 м/с); в основном это сигналы от высокочувствительных механорецепторов и хеморецепторов.
Волокна C и Aδ работают синергично, обеспечивая основную массу болевых ощущений.
Эпизод III: Месть эндорфинов
Сигнал о боли достиг нейронов задних рогов спинного мозга, и уже очень скоро будет жарко. Хотя постойте, может, можно что-нибудь сделать? Может, сигнал несет организму чрезмерные страдания, превышающие пользу? А может, наоборот, сигнал недостаточен для осознания всей беды? В спинном мозге происходит модуляция ноцицептивного сигнала. Это поле для нейрохимической битвы двух сил — тормозящей и усиливающей.
По своей природе опиоидные рецепторы тоже являются GPCR, однако — ингибиторными. Будучи активированными, они подавляют работу аденилатциклазы, снижают уровень внутриклеточного цАМФ и, через киназных посредников активируют работу калиевых каналов, которая приводит к реполяризации клеточной мембраны. В конечном итоге эти меры замедляют проведение нервного импульса.
Кроме описанной системы, в ослаблении боли принимают участие всем известные тормозные нейромедиаторы — гамма-аминомаслянная кислота (ГАМК) [11] и глицин [12]; а опосредованно — многие другие сигнальные молекулы.
Одним из очень интересных модуляторов боли является субстанция Р. Это олигопептидный нейромедиатор, связывающийся с метаботропными рецепторами нейрокинина (NKR). NK1R, являясь уже знакомым нам GPCR, вызывает каскад реакций фосфорилирования через протеинкиназу С. В результате в клетке возрастает экспрессия генов натриевого канала Nav1.8, а в нейроне-ноцицепторе увеличивается синтез и наших старых знакомых — NMDA и TRPV1. Кроме того, субстанция Р снижает активность низкопорогового калиевого канала (Kv1.4) в чувствительных к капсаицину нейронах спинального ганглия и, таким образом, сенсибилизирует ноцицепторы. Интересно, что знаменитые грызуны-долгожители — голые землекопы [14] — практически не имеют в ЦНС субстанции Р, благодаря чему становятся нечувствительными ко многим видам боли [15].
То, в каком виде сигнал дойдет до головного мозга, определяется балансом между противоборствующими сторонами и силой изначального сигнала.
Часть IV: Новая проекция
В сером веществе спинного мозга различают 10 слоев (пластин Рекседа), каждый из которых отличается от других функционалом входящих в его состав нейронов, и, как следствие, — выполняемыми функциями. Чтобы нервный импульс попал на кору больших полушарий, сначала он должен пройти по восходящим путям этих пластин.
Синапс волокон Aδ и C со вторичными афферентными нейронами находится в дорсальном роге спинного мозга. Волокна Aδ и C передают информацию ноцицептивно-специфическим нейронам в I и II пластинах. Кроме того, импульс проецируется и на нейроны других пластин. Это нужно для того, чтобы впоследствии задействовать вторичные системы реакции мозга на боль (благодаря этому боль запоминается).
После того, как импульс проходит модуляцию в задних рогах, он передается нейронам восходящих трактов спинного мозга, каждый из которых имеет определенную функцию в распознавании боли.
Наиболее важны среди них спиноталамический тракт, участвующий в узнавании боли, спинопарабрахиальный тракт, участвующий в вегетативной и мотивационной регуляции реакции на боль, и спиномезенцефалический тракт, участвующий в активации нисходящих анальгетических путей, о действии которых мы говорили раньше.
Часть V: Головной мозг наносит ответный удар
Обработка информации о боли в головном мозге — самая разнообразная и индивидуальная для каждого человека часть работы ноцицепторной системы.
Стоит отметить, что у боли есть два разных компонента, за восприятие которых отвечают разные области мозга. Сенсорно-дискриминационные аспекты включают силу боли и ее локализацию, в то время как аффективно-эмоциональный компонент боли включает неприятный характер восприятия.
Для того чтобы мозг правильно локализовал источник боли, нервный импульс затем обрабатывается соматосенсорной корой.
Часть VI: Возвращение к наболевшему
Читайте также:
- Что является структурной и функциональной единицей живых организмов определение кратко
- Как связан рост численности населения с емкостью среды кратко
- Что такое распознавание текста кратко
- Какие испытания проводятся после ремонта контакторов пускателей кратко
- Воспитательная деятельность функции школы социализация молодежи

