Почему газовая постоянная r называется универсальной кратко
Обновлено: 16.05.2024
Закон Авогадро — В равных объемах различных газов при постоянных температуре и давлении содержится одинаковое число молекул.
Из Закона Авогадро выводится 2 следствия:
Следствие 1: Один моль любого газа при одинаковых условиях занимает одинаковый объем
В частности, при нормальных условиях (T=0 °C (273К) и p=101,3 кПа) объём 1 моля газа, равен 22,4 л. Этот объём называют молярным объёмом газа Vm. Пересчитать эту величину на другие температуру и давление можно с помощью уравнения Менделеева-Клапейрона
2) Закон Гей-Люссака :
3) Закон Боля-Мариотта :
Следствие 2: Отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов
Эта постоянная величина называется относительной плотностью газов и обозначается D. Так как молярные объемы всех газов одинаковы (1-е следствие закона Авогадро), то отношение молярных масс любой пары газов также равна этой постоянной:
В Формуле мы использовали :
— Относительная плотность газа
— Универсальная газовая постоянная
Закон Бойля Мариотта — При постоянной температуре и массе идеального газа произведение его давления и объёма постоянно.
Это означает, что с ростом давления на газ его объем уменьшается, и наоборот. Для неизменного количества газа закон Бойля — Мариотта можно также интерпретировать следующим образом: при неизменной температуре произведение давления на объем является величиной постоянной. Закон Бойля — Мариотта выполняется строго для идеального газа и является следствием уравнения Менделеева Клапейрона. Для реальных газов закон Бойля — Мариотта выполняется приближенно. Практически все газы ведут себя как идеальные при не слишком высоких давлениях и не слишком низких температурах.
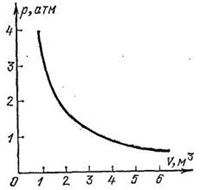
Чтобы было легче понять Закон Бойля Мариотта представим, что вы сдавливаете надутый воздушный шарик. Поскольку свободного пространства между молекулами воздуха достаточно, вы без особого труда, приложив некоторую силу и проделав определенную работу, сожмете шарик, уменьшив объем газа внутри него. Это одно из основных отличий газа от жидкости. В шарике с жидкой водой, например, молекулы упакованы плотно, как если бы шарик был заполнен микроскопическими дробинками. Поэтому вода не поддается, в отличие от воздуха, упругому сжатию.
Уравнение Менделеева Клапейрона :
Закон Гей Люссака :
В законе мы использовали :
— Давление в 1 сосуде
— Давление во 2 сосуде
Закон Гей Люссака — при постоянном давлении объём постоянной массы газа пропорционален абсолютной температуре
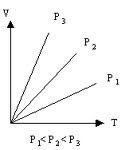
Объем V данной массы газа при постоянном давлении газа прямо пропорционален изменению температуры
Закон Гей-Люссака справедлив только для идеальных газов, реальные газы подчиняются ему при температурах и давлениях, далеких от критических значений. Является частным случаем уравнения Клайперона.
Уравнение Менделеева Клапейрона :
Закон Бойля Мариотта :
В законе мы использовали :
— Объем в 1 сосуде
— Температура в 1 сосуде
— Объем во 1 сосуде
— Температура в 1 сосуде
— Начальный объем газа
— Объем газа при температуре T
— Коэффициент теплового расширения газов
— Разность начальной и конечной температур
Физический смысл: Газовая постоянная численно равна работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 К
В системе СГС Газовая постоянная равна :
Удельная Газовая постоянная равна :
В формуле мы использовали :
— Универсальная газовая постоянная (постоянная Менделеева)
Закон Авогадро — В равных объемах различных газов при постоянных температуре и давлении содержится одинаковое число молекул.

Из Закона Авогадро выводится 2 следствия:
Следствие 1: Один моль любого газа при одинаковых условиях занимает одинаковый объем
В частности, при нормальных условиях (T=0 °C (273К) и p=101,3 кПа) объём 1 моля газа, равен 22,4 л. Этот объём называют молярным объёмом газа Vm. Пересчитать эту величину на другие температуру и давление можно с помощью уравнения Менделеева-Клапейрона
2) Закон Гей-Люссака :
3) Закон Боля-Мариотта :
Следствие 2: Отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов
Эта постоянная величина называется относительной плотностью газов и обозначается D. Так как молярные объемы всех газов одинаковы (1-е следствие закона Авогадро), то отношение молярных масс любой пары газов также равна этой постоянной:
В Формуле мы использовали :
— Относительная плотность газа
— Универсальная газовая постоянная
Закон Бойля Мариотта — При постоянной температуре и массе идеального газа произведение его давления и объёма постоянно.
Это означает, что с ростом давления на газ его объем уменьшается, и наоборот. Для неизменного количества газа закон Бойля — Мариотта можно также интерпретировать следующим образом: при неизменной температуре произведение давления на объем является величиной постоянной. Закон Бойля — Мариотта выполняется строго для идеального газа и является следствием уравнения Менделеева Клапейрона. Для реальных газов закон Бойля — Мариотта выполняется приближенно. Практически все газы ведут себя как идеальные при не слишком высоких давлениях и не слишком низких температурах.

Чтобы было легче понять Закон Бойля Мариотта представим, что вы сдавливаете надутый воздушный шарик. Поскольку свободного пространства между молекулами воздуха достаточно, вы без особого труда, приложив некоторую силу и проделав определенную работу, сожмете шарик, уменьшив объем газа внутри него. Это одно из основных отличий газа от жидкости. В шарике с жидкой водой, например, молекулы упакованы плотно, как если бы шарик был заполнен микроскопическими дробинками. Поэтому вода не поддается, в отличие от воздуха, упругому сжатию.
Уравнение Менделеева Клапейрона :
Закон Гей Люссака :
В законе мы использовали :
— Давление в 1 сосуде
— Давление во 2 сосуде
Закон Гей Люссака — при постоянном давлении объём постоянной массы газа пропорционален абсолютной температуре

Объем V данной массы газа при постоянном давлении газа прямо пропорционален изменению температуры
Закон Гей-Люссака справедлив только для идеальных газов, реальные газы подчиняются ему при температурах и давлениях, далеких от критических значений. Является частным случаем уравнения Клайперона.
Универса́льная га́зовая постоя́нная — термин, впервые введённый в употребление Д. Менделеевым в 1874 г. Численно равна работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 К.
Содержание
Общая информация

В 1874 году Д. Менделеев вычислил значение константы в уравнении Менделеева-Клапейрона (уравнении состояния идеального газа) для одного моля газа, используя закон Авогадро, согласно которому 1 моль различных газов при одинаковом давлении и температуре занимает одинаковый объём ().

В некоторых научных кругах эту постоянную принято называть постоянной Менделеева. Обозначается латинской буквой .
![~R=\;8</p>
<p>В Международной системе единиц (СИ) универсальная газовая постоянная равна [1] 3144621 \;\pm\; 00000075\;](https://test.academic.ru/dic.nsf/ruwiki/e82ff7c294754287fef6d9b655088f6c.jpg)
Дж ⁄(моль∙К) .

Эрг ⁄(моль∙К) .

Удельная газовая постоянная (R/M) для сухого воздуха: Дж ⁄(кг∙К)
Связь между газовыми константами

. Универсальная газовая постоянная более удобна при расчетах, когда число частиц задано в молях.
Примечания
См. также
- Термодинамика
- Физические константы
- Дмитрий Менделеев
- Количество вещества
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Универсальная газовая постоянная" в других словарях:
универсальная газовая постоянная — Постоянная (R) в уравнении состояния для моля идеального газа (pv = RT), одинаковая для всех веществ. [Сборник рекомендуемых терминов. Выпуск 103. Термодинамика. Академия наук СССР. Комитет научно технической терминологии. 1984 г.] Тематики… … Справочник технического переводчика
универсальная газовая постоянная — molinė dujų konstanta statusas T sritis Standartizacija ir metrologija apibrėžtis Apibrėžtį žr. priede. priedas( ai) Grafinis formatas atitikmenys: angl. molar gas constant; universal gas constant vok. allgemeine Gaskonstante, f; ideale… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
универсальная газовая постоянная — universalioji dujų konstanta statusas T sritis chemija apibrėžtis Idealiųjų dujų molinė būsenos lygties konstanta, lygi 8,314 J/K·mol. santrumpa( os) R atitikmenys: angl. gas constante per mole; universal gas constant rus. мольная газовая… … Chemijos terminų aiškinamasis žodynas
универсальная газовая постоянная — molinė dujų konstanta statusas T sritis fizika atitikmenys: angl. gas constant per mole; universal gas constant vok. ideale Gaskonstante, f; molare Gaskonstante, f; universelle Gaskonstante, f rus. универсальная газовая постоянная, f pranc.… … Fizikos terminų žodynas
универсальная газовая постоянная — Постоянная (R), входящая в управление состояния для моля идеального газа (pv = RT), одинаковая для всех идеальных газов … Политехнический терминологический толковый словарь
Газовая постоянная — Универсальная газовая постоянная R0 ≈ 8,314 кДж/(кмоль·K) фундаментальна физическая константа. Индивидуальная газовая постоянная R = R0/M, кДж/(кг·K) константа для газа или газовой смеси конкретной молярной массы … Википедия
универсальная газовая константа — molinė dujų konstanta statusas T sritis Standartizacija ir metrologija apibrėžtis Apibrėžtį žr. priede. priedas( ai) Grafinis formatas atitikmenys: angl. molar gas constant; universal gas constant vok. allgemeine Gaskonstante, f; ideale… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
Газовая постоянная — универсальная физическая постоянная R, входящая в уравнение состояния 1 моля идеального газа: pv = RT (см. Клапейрона уравнение), где р давление, v объём, Т абсолютная температура. Г. п. имеет физический смысл работы расширения 1 моля… … Большая советская энциклопедия
ГАЗОВАЯ ПОСТОЯННАЯ — (обозначение R), универсальная постоянная в газовом уравнении (см. ЗАКОН ИДЕАЛЬНОГО ГАЗА), также называемая универсальной молярной газовой постоянной, равна 8,314510 ДжК 1 моль 1 … Научно-технический энциклопедический словарь
ГАЗОВАЯ ПОСТОЯННАЯ — (R), универсальная фнз. постоянная, входящая в ур ние состояния 1 моля идеального газа: pv=RT (см. КЛАПЕЙРОНА УРАВНЕНИЕ), где р давление, v объём моля, Т абс. темп pa. Г. п. по своему физ. смыслу работа расширения 1 моля идеального газа под пост … Физическая энциклопедия
Впоследствии из какого идеального газа выведем уравнение идеального газа?
Уравнение идеального газа (PV = NRT) - Универсальная газовая постоянная, законы и выводы.
Тогда что такое r в PV nRT в банкомате?
P = Давление (атм) V = Объем (л) n = моль R = газовая постоянная = 0.0821 атм • л / моль• KT = Температура (Кельвин). Необходимы правильные единицы измерения.
Кроме того, какие единицы используются в законе об идеальном газе?
В единицах СИ p равно измеряется в паскалях, V измеряется в кубических метрах, n измеряется в молях, а T в кельвинах (шкала Кельвина представляет собой сдвинутую шкалу Цельсия, где 0.00 K = -273.15 ° C, минимально возможная температура).
Что подразумевается под уравнением идеального газа?
имя существительное. уравнение, которое приравнивает произведение давления и объема одного моля газа к произведению его термодинамической температуры и газовой постоянной. Уравнение является точным для идеального газа и является хорошим приближением для реальных газов при низких давлениях. Также называется: уравнение идеального газа, закон идеального газа.
Что значит идеальный газ?
: газ, в котором нет притяжения между молекулами, обычно : газ, точно соответствующий закону идеального газа.
Что такое постоянная R?
Как следствие, значение SI молярной газовой постоянной точно равно
8.31446261815324 Джек
-
1
Mol
-
1
.
| Значения R | Единицы |
|---|---|
| 8.31446261815324 | Дж⋅К - 1 Mol - 1 |
| 8.31446261815324 | m 3 ⋅Па⋅К - 1 Mol - 1 |
| 8.31446261815324 | кг⋅м 2 ⋅с - 2 ⋅К - 1 Mol - 1 |
| Другие общие единицы |
Что такое r в числе PV nRT?
Каков газовый закон для давления?
Газовые законы, законы, которые связывают давление, объем и температуру газа. Закон Бойля, названный в честь Роберта Бойля, гласит, что при постоянной температуре давление P газа изменяется обратно пропорционально его объему V, или ПВ = к, где k - постоянная.
Для чего используется закон идеального газа?
Можно использовать закон идеального газа для расчета объема потребленных или произведенных газов. Уравнение идеального газа часто используется для взаимного преобразования между объемами и молярными количествами в химических уравнениях. Начните с преобразования массы карбоната кальция в моли.
Считается ли универсальный газовый закон законом?
Универсальный газовый закон, или «Закон идеального газа”Показывает взаимодействие давления, объема и температуры с газообразным веществом.
Что называют идеальным газом Почему?
Идеальный газ - это газ, который по своему физическому поведению соответствует определенной идеализированной связи между давлением, объемом и температурой, называемой законом идеального газа.. … Газ не подчиняется уравнению, когда условия таковы, что газ или любой из составляющих его газов в смеси находится вблизи точки конденсации.
Каковы ограничения уравнения идеального газа?
Поскольку частицы идеальный газ не имеет объема, газ должен конденсироваться до нулевого объема. Проверка реальности: частицы реального газа занимают космос. Газ будет конденсироваться с образованием жидкости, имеющей объем. Закон о газе больше не применяется, потому что вещество больше не является газом!
Что такое идеальный газ и неидеальный газ?
Существуют два типа газов. Реальный газ и Идеальный газ. Поскольку размер частиц идеального газа чрезвычайно мал, а масса почти равна нулю и нет объема Идеальный газ также считается точечной массой. Молекулы реального газа занимают пространство, хотя они и являются мелкими частицами, но также имеют объем.
Что такое идеальный газ Почему?
Идеальный газ - это теоретический газ, состоящий из множества беспорядочно движущихся точечных частиц, которые не подвергаются межчастичным взаимодействиям. Идеальная газовая концепция полезна потому что он подчиняется закону идеального газа- упрощенное уравнение состояния, которое поддается анализу в рамках статистической механики.
Каковы характеристики идеального газа?
Каковы характеристики идеального газа?
- Молекулы газа находятся в постоянном беспорядочном движении. …
- Между молекулами газа нет притяжения или отталкивания.
- Частицы газа представляют собой точечные массы без объема.
- Все столкновения упругие. …
- Все газы при данной температуре имеют одинаковую среднюю кинетическую энергию.
Почему газовая постоянная R называется универсальной газовой постоянной?
Значение газовой постоянной R одинаково для всех газов и не зависит от природы газа.. Отсюда его называют универсальной газовой постоянной.
Какие единицы используются в PV nRT?
В уравнении идеального газа PV = nRT используются следующие единицы:
- P - давление, измеренное в паскалях.
- V - объем, измеренный в м. …
- n - количество молей.
- R - универсальная газовая постоянная, измеряемая в Дж / (К. Моль).
- T - температура, измеренная в Кельвинах.
Какой закон P1V1 P2V2?
Отношения для Закон Бойла можно выразить следующим образом: P1V1 = P2V2, где P1 и V1 - начальные значения давления и объема, а P2 и V2 - значения давления и объема газа после изменения.
Каковы 3 закона газа?
Газовые законы состоят из трех основных законов: Закон Чарльза, закон Бойля и закон Авогадро (все это позже объединится в Общее уравнение газа и Закон идеального газа).
Какова формула закона газа Бойля?
Это эмпирическое соотношение, сформулированное физиком Робертом Бойлем в 1662 году, гласит, что давление (p) данного количества газа изменяется обратно пропорционально его объему (v) при постоянной температуре; т.е. в форме уравнения, pv = k, постоянная.
Каковы 6 газовых законов?
Карты в этом наборе
•
сентябрь 24, 2020
Где мы используем идеальный газ?
Можно использовать закон идеального газа в задачах стехиометрии, в которых в химических реакциях участвуют газы. Стандартные температура и давление (STP) - полезный набор эталонных условий для сравнения других свойств газов. На STP газы имеют объем 22.4 л на моль.
Что такое настоящий газовый закон?
соотношение между давлением и объемом для газа обычно выражается как закон реального газа: (2.5.17) в котором v - молярный объем, z - коэффициент сжимаемости газа, R - универсальная газовая постоянная, а T - температура.
Термодинамика - это самостоятельный раздел физики, который изучает процессы перехода между состояниями системы, оперируя при этом макроскопическими характеристиками. Одним из важных объектов изучения термодинамики является идеальный газ. Данная статья посвящена рассмотрению концепции идеального газа и единицам измерения универсальной газовой постоянной.
Идеальный газ
Газовое агрегатное состояние материи характеризуется хаотичным расположением частиц, расстояние между которыми значительно больше их размеров. Эти частицы находятся в постоянном движении, поэтому газ не сохраняет свою форму и свой объем.
Вам будет интересно: Ретироваться — это значит уходить: толкование слова
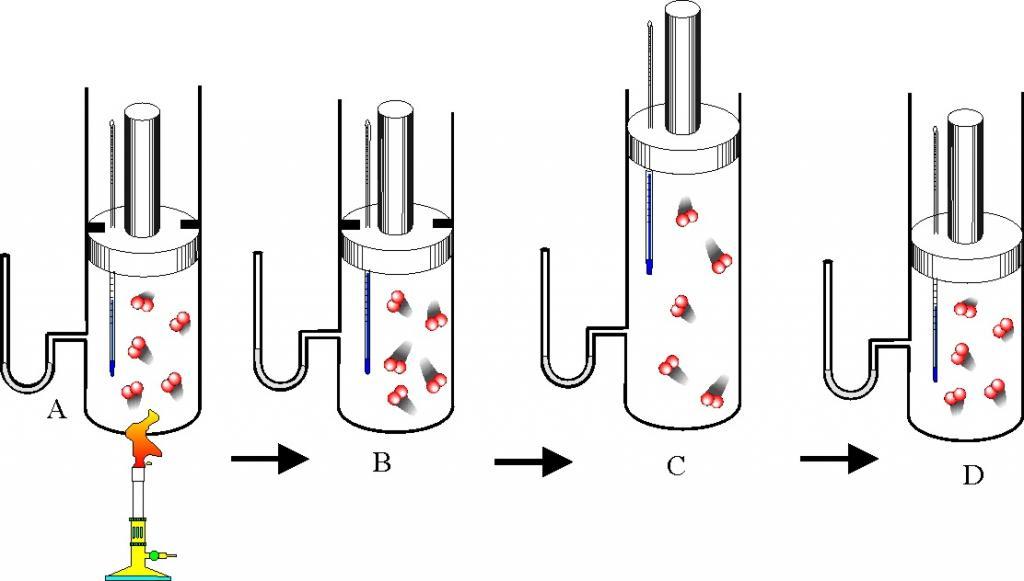
Идеальным газом называется любое вещество, размерами частиц которого и взаимодействиями между которыми можно пренебречь. В рамках концепции идеального газа считают, что любые столкновения частиц со стенками сосуда носят абсолютно упругий характер. Средняя кинетическая энергия частиц однозначно определяет температуру идеального газа.
Большинство реальных газов, которые находятся при не слишком высоких давлениях и не слишком низких температурах, можно считать с высокой точностью идеальными.
Универсальное уравнение состояния
Так называют уравнение, которое объединяет в рамках одного выражения все важные термодинамические параметры идеальной газовой системы. Запишем его:
Здесь P и V - давление в паскалях и объем в метрах кубических, n и T - количество вещества в молях и температура системы в Кельвинах. Это равенство также называется уравнением или законом Клапейрона-Менделеева в честь французского физика и инженера и русского химика XIX века, которые вывели это уравнение из накопленного предыдущими поколениями ученых экспериментального опыта.

Универсальное уравнение состояния системы позволяет получить любой газовый закон. Например, закон Гей-Люссака следует из него непосредственно, если положить постоянным объем во время термодинамического процесса.
Мы выше расшифровали 4 из 5 обозначений, присутствующих в формуле. Пятым является коэффициент R. Он называется универсальной газовой постоянной. Единицей измерения в СИ для него является джоуль на моль-кельвин (Дж/(моль*К)). Что это за величина, рассмотрим подробнее дальше в статье.
Постоянная R в физике
Выше мы увидели, что это некоторый коэффициент пропорциональности между давлением, объемом, температурой и количеством вещества. Единицей измерения универсальной газовой постоянной в системе СИ является Дж/(моль*К). Ее значение с точностью до трех знаков после запятой равно 8,314. Это число означает, что один моль идеального газа, будучи нагретым на 1 кельвин, в процессе своего расширения совершит работу 8,314 джоуля.
Постоянную R можно также интерпретировать несколько иначе: если затратить на нагрев одного моль газа энергию в 8,314 джоуля, то его температура возрастет на 1 кельвин. Иными словами, R характеризует связь между энергией и температурой для фиксированного количества вещества.
Заметим, что величина R в физике не является базовой (фундаментальной) константой такой, как скорость света или постоянная Планка. Поэтому с помощью выбора соответствующей температурной шкалы и количества частиц в системе можно добиться того, что R будет равно 1.
Впервые постоянную R в физику ввел Д. И. Менделеев, заменив ею в универсальном уравнении состояния Клапейрона ряд других констант. Отметим, что хотя величина R введена для газов, в современной физике она используется также в уравнениях Дюлонга и Пти, Клаузиуса-Моссотти, Нернста и в некоторых других.

Постоянные kB и R
Люди, которые знакомы с физикой, могли заметить, что существует еще одна постоянная величина, которая во всех физических уравнениях выступает в качестве переводного коэффициента между энергией и температурой. Эта величина называется постоянной Больцмана (kB). Она равна 1,38*10-23 Дж/К. Очевидно, что должна существовать математическая связь между kB и R. Такая связь действительно существует, она имеет следующий вид:
Здесь NA - это огромное число, которое называется числом Авогадро. Равно оно 6,02*1023. Если количество частиц системы равно NA, то говорят, что система содержит 1 моль вещества.
Таким образом, постоянная Больцмана и универсальная газовая постоянная, по сути, это один и тот же переводной коэффициент между температурой и энергией с той лишь разницей, что kB используется для микроскопических процессов, а R - для макроскопических.
Решение задачи
После знакомства с единицами измерения универсальной газовой постоянной предлагается получить их из универсального уравнения для идеального газа, которое было приведено в статье. Ниже на рисунке изображено это уравнение.
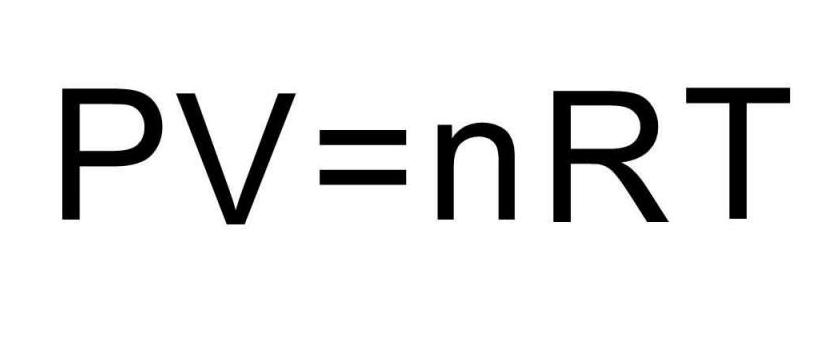
Выразим из него величину R, получаем:
Теперь подставим для каждой физической величины соответствующую единицу измерения и упростим полученное выражение:
[R] = [Па*м3/(моль*К)] = [Н/м2*м3/(моль*К)] = [Н*м/(моль*К)] = [Дж/(моль*К)].
Как видно, при получении единиц измерения для R мы упрощали только единицы измерения числителя. Сначала была использована формула для давления, а затем произведение единиц силы на единицы расстояния были преобразованы в единицы работы.
Читайте также:

