Почему белки называют полипептидами кратко
Обновлено: 05.07.2024
Белки — высокомолекулярные органические соединения, состоящие из остатков α-аминокислот.
В состав белков входят углерод, водород, азот, кислород, сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.
Белки обладают большой молекулярной массой: яичный альбумин — 36 000, гемоглобин — 152 000, миозин — 500 000. Для сравнения: молекулярная масса спирта — 46, уксусной кислоты — 60, бензола — 78.
Аминокислотный состав белков
Белки — непериодические полимеры, мономерами которых являются α-аминокислоты. Обычно в качестве мономеров белков называют 20 видов α-аминокислот, хотя в клетках и тканях их обнаружено свыше 170.
В зависимости от того, могут ли аминокислоты синтезироваться в организме человека и других животных, различают: заменимые аминокислоты — могут синтезироваться; незаменимые аминокислоты — не могут синтезироваться. Незаменимые аминокислоты должны поступать в организм вместе с пищей. Растения синтезируют все виды аминокислот.
В зависимости от аминокислотного состава, белки бывают: полноценными — содержат весь набор аминокислот; неполноценными — какие-то аминокислоты в их составе отсутствуют. Если белки состоят только из аминокислот, их называют простыми. Если белки содержат помимо аминокислот еще и неаминокислотный компонент (простетическую группу), их называют сложными. Простетическая группа может быть представлена металлами (металлопротеины), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
Все аминокислоты содержат: 1) карбоксильную группу (–СООН), 2) аминогруппу (–NH2), 3) радикал или R-группу (остальная часть молекулы). Строение радикала у разных видов аминокислот — различное. В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы.
Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах.
Пептидная связь
Пептиды — органические вещества, состоящие из остатков аминокислот, соединенных пептидной связью.
Образование пептидов происходит в результате реакции конденсации аминокислот. При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой между ними возникает ковалентная азот-углеродная связь, которую и называют пептидной. В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно. Это приводит к образованию полипептидов. На одном конце пептида находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа (его называют С-концом).

Пространственная организация белковых молекул
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков.
Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.

Если молекула белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, — 10 20 . Имея 20 аминокислот, можно составить из них еще большее количество разнообразных комбинаций. В организме человека обнаружено порядка десяти тысяч различных белков, которые отличаются как друг от друга, так и от белков других организмов.
Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).

Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.

Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо.
Свойства белков
Купить проверочные работы
по биологии




Аминокислотный состав, структура белковой молекулы определяют его свойства. Белки сочетают в себе основные и кислотные свойства, определяемые радикалами аминокислот: чем больше кислых аминокислот в белке, тем ярче выражены его кислотные свойства. Способность отдавать и присоединять Н + определяют буферные свойства белков; один из самых мощных буферов — гемоглобин в эритроцитах, поддерживающий рН крови на постоянном уровне. Есть белки растворимые (фибриноген), есть нерастворимые, выполняющие механические функции (фиброин, кератин, коллаген). Есть белки активные в химическом отношении (ферменты), есть химически неактивные, устойчивые к воздействию различных условий внешней среды и крайне неустойчивые.
Внешние факторы (нагревание, ультрафиолетовое излучение, тяжелые металлы и их соли, изменения рН, радиация, обезвоживание)
могут вызывать нарушение структурной организации молекулы белка. Процесс утраты трехмерной конформации, присущей данной молекуле белка, называют денатурацией. Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные. Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций. Если денатурация не сопровождается разрушением первичной структуры, то она может быть обратимой, в этом случае происходит самовосстановление свойственной белку конформации. Такой денатурации подвергаются, например, рецепторные белки мембраны. Процесс восстановления структуры белка после денатурации называется ренатурацией. Если восстановление пространственной конфигурации белка невозможно, то денатурация называется необратимой.
Функции белков
| Функция | Примеры и пояснения |
|---|---|
| Строительная | Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран (липопротеины, гликопротеины), волос (кератин), сухожилий (коллаген) и т.д. |
| Транспортная | Белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ; в состав клеточных мембран входят особые белки, которые обеспечивают активный и строго избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно. |
| Регуляторная | Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например, гормон инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов. |
| Защитная | В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует остановке кровотечений. |
| Двигательная | Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных. |
| Сигнальная | В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды, таким образом осуществляя прием сигналов из внешней среды и передачу команд в клетку. |
| Запасающая | В организме животных белки, как правило, не запасаются, исключение: альбумин яиц, казеин молока. Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется, образуя комплекс с белком ферритином. |
| Энергетическая | При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов — воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы. |
| Каталитическая | Одна из важнейших функций белков. Обеспечивается белками — ферментами, которые ускоряют биохимические реакции, происходящие в клетках. Например, рибулезобифосфаткарбоксилаза катализирует фиксацию СО2 при фотосинтезе. |
Ферменты
Ферменты, или энзимы, — особый класс белков, являющихся биологическими катализаторами. Благодаря ферментам биохимические реакции протекают с огромной скоростью. Скорость ферментативных реакций в десятки тысяч раз (а иногда и в миллионы) выше скорости реакций, идущих с участием неорганических катализаторов. Вещество, на которое оказывает свое действие фермент, называют субстратом.
Ферменты — глобулярные белки, по особенностям строения ферменты можно разделить на две группы: простые и сложные. Простые ферменты являются простыми белками, т.е. состоят только из аминокислот. Сложные ферменты являются сложными белками, т.е. в их состав помимо белковой части входит группа небелковой природы — кофактор. У некоторых ферментов в качестве кофакторов выступают витамины. В молекуле фермента выделяют особую часть, называемую активным центром. Активный центр — небольшой участок фермента (от трех до двенадцати аминокислотных остатков), где и происходит связывание субстрата или субстратов с образованием фермент-субстратного комплекса. По завершении реакции фермент-субстратный комплекс распадается на фермент и продукт (продукты) реакции. Некоторые ферменты имеют (кроме активного) аллостерические центры — участки, к которым присоединяются регуляторы скорости работы фермента (аллостерические ферменты).

Для реакций ферментативного катализа характерны: 1) высокая эффективность, 2) строгая избирательность и направленность действия, 3) субстратная специфичность, 4) тонкая и точная регуляция. Субстратную и реакционную специфичность реакций ферментативного катализа объясняют гипотезы Э. Фишера (1890 г.) и Д. Кошланда (1959 г.).
Скорость ферментативных реакций зависит от: 1) температуры, 2) концентрации фермента, 3) концентрации субстрата, 4) рН. Следует подчеркнуть, что поскольку ферменты являются белками, то их активность наиболее высока при физиологически нормальных условиях.
Большинство ферментов может работать только при температуре от 0 до 40 °С. В этих пределах скорость реакции повышается примерно в 2 раза при повышении температуры на каждые 10 °С. При температуре выше 40 °С белок подвергается денатурации и активность фермента падает. При температуре, близкой к точке замерзания, ферменты инактивируются.
При увеличении количества субстрата скорость ферментативной реакции растет до тех пор, пока количество молекул субстрата не станет равным количеству молекул фермента. При дальнейшем увеличении количества субстрата скорость увеличиваться не будет, так как происходит насыщение активных центров фермента. Увеличение концентрации фермента приводит к усилению каталитической активности, так как в единицу времени преобразованиям подвергается большее количество молекул субстрата.

Для каждого фермента существует оптимальное значение рН, при котором он проявляет максимальную активность (пепсин — 2,0, амилаза слюны — 6,8, липаза поджелудочной железы — 9,0). При более высоких или низких значениях рН активность фермента снижается. При резких сдвигах рН фермент денатурирует.
Скорость работы аллостерических ферментов регулируется веществами, присоединяющимися к аллостерическим центрам. Если эти вещества ускоряют реакцию, они называются активаторами, если тормозят — ингибиторами.

Классификация ферментов
По типу катализируемых химических превращений ферменты разделены на 6 классов:
- оксиредуктазы (перенос атомов водорода, кислорода или электронов от одного вещества к другому — дегидрогеназа),
- трансферазы (перенос метильной, ацильной, фосфатной или аминогруппы от одного вещества к другому — трансаминаза),
- гидролазы (реакции гидролиза, при которых из субстрата образуются два продукта — амилаза, липаза),
- лиазы (негидролитическое присоединение к субстрату или отщепление от него группы атомов, при этом могут разрываться связи С–С, С–N, С–О, С–S — декарбоксилаза),
- изомеразы (внутримолекулярная перестройка — изомераза),
- лигазы (соединение двух молекул в результате образования связей С–С, С–N, С–О, С–S — синтетаза).
Классы в свою очередь подразделены на подклассы и подподклассы. В действующей международной классификации каждый фермент имеет определенный шифр, состоящий из четырех чисел, разделенных точками. Первое число — класс, второе — подкласс, третье — подподкласс, четвертое — порядковый номер фермента в данном подподклассе, например, шифр аргиназы — 3.5.3.1.
Пептиды (греч. πεπτος — питательный) — семейство веществ, молекулы которых построены из остатков α-аминокислот, соединённых в цепь пептидными (амидными) связями —C(O)NH—.
Это природные или синтетические соединения, содержащие десятки, сотни или тысячи мономерных звеньев — аминокислот. Полипептиды состоят из сотен аминокислот, в противоположность олигопептидам, состоящим из небольшого числа аминокислот (не более 10-50), и простым пептидам (до 10).
- Полипептиды могут иметь в молекуле неаминокислотные фрагменты, например углеводные остатки.
- Природные полипептиды с молекулярной массой более 6000 дальтон называют белками.
Содержание
Терминология: Олигопептиды и Полипептиды
Грань между олигопептидами и полипептидами (тот размер, при котором белковая молекула перестаёт считаться олигопептидом и становится полипептидом) достаточно условна. Часто пептиды, содержащие менее 10-20 аминокислотных остатков, называют олигопептидами, а вещества с большим числом аминокислотных звеньев — полипептидами. Во многих случаях эта грань в научной литературе не проводится вообще и небольшая белковая молекула (такая, как окситоцин) упоминается как полипептид (или просто как пептид).
История
Пептиды впервые были выделены из гидролизатов белков, полученных с помощью ферментирования.
- Термин пептид предложен Э. Фишером, который к 1905 г. разработал общий метод синтеза пептидов.
В 1953 В. Дю Виньо синтезировал окситоцин, первый полипептидный гормон. В 1963 г., на основе концепции твердофазного пептидного синтеза (P. Меррифилд) были созданы автоматические синтезаторы пептидов. Использование методов синтеза полипептидов позволило получить синтетический инсулин и др. ферменты.
Семейства пептидов в этом разделе являются рибосомальными, обычно они обладают гормональной активностью.
Панкреатические молекулы полипептидного характера
- en:NPY
- Пептид YY
- APP Avian pancreatic polypeptide
- en:HPP Human pancreatic polypeptide
Опиоидные пептиды
Опиоидные пептиды — группа природных и синтетических пептидов, сходных с опиатами (морфин, кодеин и др.) по способности связываться с опиоидными рецепторами организма. Эндогенные морфиноподобные вещества были впервые выделены в 1975 году из целого мозга и гипофиза голубей, морских свинок, крыс, кроликов и мышей, а в 1976 году фракции таких олигопептидов были обнаружены в спинномозговой жидкости и крови человека . Различные виды этих олигопептидов получили название эндорфинов и энкефалинов. Лиганды опиоидных рецепторов были обнаружены и во многих периферических органах, тканях и биологических жидкостях. Присутствие опиоидов показано в гипоталамусе и гипофизе, плазме крови и спиномозговой жидкости, желудочно-кишечном тракте, лёгких, органах репродуктивной системы, иммунокомпетентных тканях и даже в коже. Наряду с эндорфинами обнаружены и так называемые экзорфины или параопиоиды — опиоидные пептиды, образующиеся при переваривании пищи. К настоящему времени опиоидные рецепторы и их эндогенные лиганды обнаружены практически во всех органах и тканях млекопитающих, а также у животных более низких ступеней классификации вплоть до простейших. Основная часть опиоидных пептидов образуется путём внутриклеточного расщепления высокомолекулярных предшественников, что приводит к образованию ряда биологически активных фрагментов, в том числе и опиоидных пептидов. Идентифицированы и наиболее изучены 3 таких предшественника: проопиомеланокортин (ПОМК), проэнкефалин А и продинорфин (проэнкефалин В). В состав ПОМК (локализованного главным образом в гипофизе) входят аминокислотные последовательности b-липотропина, АКТГ, a-, b- и g-меланоцитстимулирующих гормонов, a-, b- и g-эндорфинов. В настоящее время установлено, что основным источником энкефалинов (метионин-энкефалина и лейцин-энкефалина) в организме является проэнкефалин А, локализованный преимущественно в надпочечниках. В его составе содержится 4 аминокислотные последовательности мет-энкефалина и одна лей-энкефалина, а также ряд продленных форм мет-энкефалина: меторфамид, МЕРГЛ (мет-энкефалин-Arg6-Gly7-Leu8), МЕРФ (мет-энкефалин-Arg6-Phe7), пептид Ф и группы родственных пептидов, входящих в состав пептида Е: BAM 22, 20, 18, 12, взаимодействующих с опиоидными рецепторами mu-, kappa- и delta-типа. В структуре другого проэнкефалина — препроэнкефалина В (или продинорфина) — обнаружены последовательности a- и b-неоэндорфинов, динорфинов [динорфин 1-8, 1-17 (А), динорфин В (риморфин), 4кД-динорфин], обладающих наибольшим сродством к ОР k-типа, а также лей-энкефалина. Радиорецепторный анализ связывания эндорфинов и энкефалинов с опиоидными рецепторами показал, что сродство мет- и лей-энкефалинов к опиоидным рецепторам delta-типа выше, чем к рецепторам mu-типа; b-эндорфин имеет примерно одинаковое сродство к опиоидным рецепторам mu- и delta-типа, a- и g-эндорфины проявляют гораздо меньшее сродство к обоим типам рецепторов по сравнению с b-эндорфином. Несмотря на то, что мет-энкефалин взаимодействует преимущественно с опиоидными рецепторами d-типа, его аналоги с более длинной аминокислотной последовательностью — меторфамид и пептиды группы BAM (пептиды из мозгового вещества надпочечников) обладают противоположным профилем селективности взаимодействия с опиоидными рецепторами (mu > kappa > delta). Большинство эндогенных опиоидов в той или иной степени могут взаимодействовать с несколькими типами рецепторов. Так, b-эндорфин своим N-концевым фрагментом способен взаимодействовать с mu- и delta-опиоидными рецепторами, а С-концом с epsilon-рецепторами. В коже амфибий, а затем и в мозге и некоторых других органах теплокровных, обнаружен 4-ый предшественник ОП — продерморфин, который считается источником дерморфина (mu-агониста) и дельторфина (delta-агониста). В ЦНС обнаружены эндогенные пептиды, специфически взаимодействующие с mu-опиоидными рецепторами: Tyr-Pro-Trp-Phe-NH2 и Tyr-Pro-Phe-Phe-NH2, названные эндоморфинами, а также пептид ноцицептин, оказывающий свой анальгетический эффект через опиоидоподобные орфановые рецепторы.
Гемоглобин содержится в клетках крови эритроцитах, это безъядерные самые многочисленные форменные элементы крови двояковогнутой формы. Внутри эритроцитов содержится белок гемоглобин, имеющий четвертичную структуру, соединяющий глобулы с помощью гема-железа. Гемоглобин участвует в транспорте газов, главное кислорода. Соединяясь с кислородом гемоглобин превращается в химическое соединение – оксигемоглобин, имеющий светло алый цвет, и переносится с помощью эритроцитов во все клетки и ткани, обратно гемоглобин из клеток и тканей собирает углекислый газ, превращаясь карбогемоглобином.
Стр. 27. Вопросы и задания после §
1. Какое строение имеет белок?
Белок – это полимер, состоящий из мономеров-аминокислот, соединенных между собой пептидными связями. Так как белок имеют большую молекулярную массу и сложную пространственную структуру, белковые молекулы имеют различные пространственные структуры для компактного размещения в клетках. Белковые молекулы имеют четыре структуры. Первичная структура – это самая простая структура, представляющая собой полипептидную цепь из аминокислот. Вторичная структура – это полипептидная цепь закрученная в спираль. Третичная структура – это спиральная структура закручена в глобулы – компактные комочки. Четвертичная структура – это соединение нескольких глобул между собой с помощью межмолекулярных связей и атомов металла, например, такую структуру имеют не все белки.
2. Объясните, почему полимер белок еще называют полипептидом.
Белок – это полимер, соединенный пептидными связями, отсюда название – полипептид. Это разновидность прочной ковалентной связи между молекулами аминокислот. При взаимодействии аминогруппы -NH2 одной молекулы аминокислоты и карбоксильной группы -СООН другой аминокислоты образуется связь –С–N–, которая называется пептидной. Взаимодействие двух молекул аминокислоты образует дипептид, трех – трипептид, множества аминокислот – полипептид.
3. Чем первичная структура белка отличается от вторичной, от третичной?
Первичная структура – это самая простая структура, представляющая собой полипептидную цепь из аминокислот. Вторичная структура – это полипептидная цепь, закрученная в спираль. Для более прочного взаимодействия во вторичной структуре, происходит внутримолекулярное взаимодействие с помощью –S–S– сульфидных мостиков между витками спирали. Это обеспечивает прочность данной структуры. Третичная структура – это вторичная спиральная структура закручена в глобулы – компактные комочки. Эти структуры обеспечивают максимальную прочность и большую распространенность в клетках по сравнению с другими органическими молекулами.
4. Что представляет собой денатурации белка? Какие факторы могут ее вызывать?
Денатурация – это нарушения третичной пространственной структуры белковых молекул под действием различных физических, химических, механических и других факторов. Физические факторы – это температура, излучение, Химические факторы – это действие на белки любых химических веществ: растворители, кислоты, щелочи, концентрированные вещества и прочее. Механические факторы – встряхивание, давление, растяжение, скручивание и прочее.
6. Прокомментируйте утверждение о том, что белки имеют огромное значение в жизни любого организма.
Белки выполняют разнообразные функции в организмах: ферментативная, структурная, транспортная, двигательная, регуляторная, защитная, энергетическая. Функции белков довольно многочисленны и лежат в основе многообразия проявления жизни. Это компонент биологических мембран, перенос питательных веществ, например, гемоглобин, работа мышц, гормональная функция, защита организма – работа антигенов и антител, и прочие важнейшие функции в организме.
Пептидная связь – это разновидность прочной ковалентной связи между молекулами аминокислот. При взаимодействии аминогруппы -NH2 одной молекулы аминокислоты и карбоксильной группы -СООН другой аминокислоты образуется связь –С–N–, которая называется пептидной. Глобула – это конформация полимерной цепи, компактной расположение спирально закрученной структуры в пространстве. Незаменимые аминокислоты – это 9 из 20 аминокислот, которые не синтезируются самостоятельно организме, человек их должен получать с пищей.
Дано определение, состав, структура и функции белков организма человека. Приведена их классификация. Описаны синтез и катаболизм белков.
Белки (протеины, полипептиды)
Определение
Белки – высокомолекулярные азотсодержащие соединения, состоящие из аминокислот.
Молекулярная масса белков
Белки, являясь высокомолекулярными соединениями, характеризуются большими величинами молекулярной массы. Молекулярная масса измеряется в Дальтонах (1Да=1,66 10 -24 г.) Например, белок инсулин обладает молекулярной массой 6000 Да, миоглобин — 17000 Да, миозин – 500000 Да.
Состав белков
Несмотря на то, что в составе белковой молекулы могут входить десятки, сотни и тысячи аминокислот, все белки синтезируются из 20 видов аминокислот. Эти аминокислоты имеют следующие названия: глицин, аланин, серин, цистеин, треонин, метионин, валин, лейцин, изолейцин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, лизин, аргинин, фенилаланин, тирозин, триптофан, гистидин, пролин.
Структура белков
Различают четыре уровня структурной организации молекулы белка (рис.1).
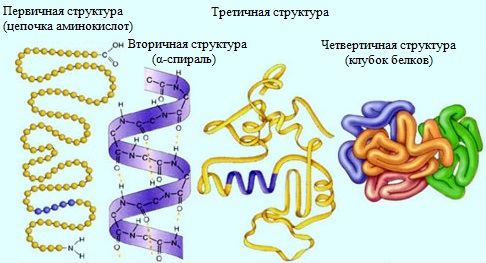
Рис.1. Структуры белков
Первичная структура. Аминокислоты соединяясь друг с другом пептидной связью образуют длинные неразветвленные цепи – полипептиды.
Вторичная структура. Эта структура белков характеризует их определенную пространственную организацию. Например, многие белки имеют форму спирали. Фиксируется вторичная структура дисульфидными и водородными связями.
Третичная структура. Третичная структура отражает пространственную организацию вторичной структуры. Например, вторичная структура в виде спирали может укладываться в пространстве в виде глобулы, то есть иметь шаровидную или эллипсовидную форму. Примером белка, обладающего третичной структурой является миоглобин.
Четвертичная структура. Этой структурой обладают некоторые белки. Четвертичная структура – сложное образование, состоящее из нескольких белков, имеющих свою первичную, вторичную и третичную структуры. Примером белка, обладающего четвертичной структурой является гемоглобин.
Классификация белков
Существуют разные классификации белков. Приведу две классификации.
Согласно первой классификации белки делятся на простые (протеины) и сложные (протеиды). Простые белки состоят только из аминокислот. Пример: альбумины и глобулины крови. В молекуле сложного белка, кроме аминокислот, имеется еще неаминокислотная часть. В зависимости от неаминокислотной части выделяют такие сложные белки как нуклеопротеиды (содержат нуклеиновую кислоту), липопротеиды (содержат липоид) и. т.д.
Согласно второй классификации белки делятся на группы на основе своей пространственной формы. Различают глобулярные и фибриллярные белки. Молекулы глобулярных белков имеют шаровидную или эллипсовидную форму. Примерами таких белков являются альбумины и глобулины крови. Молекулы фибриллярных белков вытянутые. Их длина значительно превышает их диаметр. Примером фибриллярного белка является белок коллаген.
Функции белков
Функции, которые выполняют белки в организме настолько важны, что белки еще называют протеинами (от греч. слова proteus – первый, главный). Различают следующие функции белков в организме человека.
- Структурная (строительная, пластическая). Белки являются универсальным строительным материалом, из которого строятся все структурные образования организма и прежде всего все клетки и внутриклеточные органеллы (например, миофибриллы мышечного волокна).
- Каталитическая. В организме человека имеются особые белки, являющиеся катализаторами химических реакций. Эти белки получили название ферменты или энзимы.
- Сократительная. Благодаря белкам, входящих в состав миофибрилл происходит сокращение мышц человека.
- Регуляторная. Белки могут взаимодействовать как с кислотами, так и с основаниями, поэтому белки являются важнейшими буферами организма, поддерживающими кислотность внутренней среды организма на необходимом уровне.
- Транспортная. Белковые молекулы достаточно большие и хорошо растворяются в воде. Поэтому они могут переносить различные нерастворимые в воде соединения. Белок гемоглобин участвует в переносе кислорода от легких к различным органам. Белки крови – альбумины переносят с током крови различные нерастворимые в воде вещества (жиры, жирные кислоты, гормоны).
- Защитная. Белки крови глобулины участвуют в свертывании крови и в обеспечении иммунитета.
- Энергетическая. Окисление белков сопровождается выделением энергии.
Перевариваривание белков в организме человека
В организм человека с пищей попадает в сутки около 100 г белков.
Расщепление белков начинается в полости желудка под воздействием желудочного сока, содержащего протеолитический фермент пепсин. Под воздействием пепсина в белках разрываются пептидные связи, образующие первичную структуру. В результате белковые молекулы превращаются в смесь полипептидов различной длины.
Дальнейшее переваривание белков протекает в тонкой кишке под воздействием ферментов: трипсина, химотрипсина и эсталазы, которые синтезируются в поджелудочной железе. В результате полипептиды расщепляются до олигопептидов, состоящих из нескольких аминокислот.
Завершается переваривание белков в тонкой кишке под воздействием ферментов кишечного сока. Образовавшиеся в результате этого процесса аминокислоты всасываются в кровь и по воротной вене поступают в печень и далее попадают в большой круг кровообращения.
Синтез белков
Синтез белков протекает в четыре этапа.
Первый этап синтеза белков протекает в ядрах клеток и называется транскрипцией.
Второй этап синтеза белков протекает в цитоплазме клетки и называется рекогницией.
Третий этап синтеза белков протекает на рибосомах и называется трансляцией.
Четвертый этап синтеза белков протекает в эндоплазматической сети и комплексе Гольджи и называется процессингом.
Более подробно синтез белков в мышечных волокнах описан в отдельной статье.
Катаболизм белков
В организме человека происходят одновременно два процесса: синтез белков и их распад (катаболизм). В тканях организма катаболизм белков происходит под воздействием внутриклеточных протеиназ, которые называются катепсинами. Эти ферменты локализованы в лизосомах.
Также катаболизм белков осуществляется особыми мультиферментными комплексами, которые называются протеосомы.
По данным С.С. Михайлова (2009) в сутки внутриклеточному протеолизу подвергается 200-300 г собственных белков организма. При этом при распаде как пищевых, так и собственных белков организма образуются одни и те же 20 видов аминокислот.
Литература
- Михайлов С.С. Спортивная биохимия. – М.: Советский спорт, 2009.– 348 с.
Похожие записи:
Тест времени реакции на сигнал
Представлена программа расчета времени реакции на сигнал, предназначенная для использования в учебных целях, например на занятиях по…
Саркоплазматическая гипертрофия мышц
Дано определение и описаны механизмы саркоплазматической гипертрофии скелетных мышц. Показано, что этот вид гипертрофии мышц широко…
Классификация типов конституции человека М.В. Черноруцкого
Рассмотрена классификация типов конституции человека, разработанная выдающимся терапевтом М.В. Черноруцким в 1925 году. Классификация типов конституции человека М.В.
Читайте также:

