Открытие какой частицы сыграло большую роль в понимании строения атомного ядра кратко
Обновлено: 05.07.2024
АТОМНОГО ЯДРА СТРОЕНИЕ. Ядро представляет собой центральную часть атома (см. также АТОМА СТРОЕНИЕ). В нем сосредоточены положительный электрический заряд и основная часть массы атома; по сравнению с радиусом электронных орбит размеры ядра чрезвычайно малы: 10 –15 –10 –14 м. Ядра всех атомов состоят из протонов и нейтронов, имеющих почти одинаковую массу, но лишь протон несет электрический заряд. Полное число протонов называется атомным номером Z атома, который совпадает с числом электронов в нейтральном атоме. Ядерные частицы (протоны и нейтроны), называемые нуклонами, удерживаются вместе очень большими силами; по своей природе эти силы не могут быть ни электрическими, ни гравитационными, а по величине они на много порядков превышают силы, связывающие электроны с ядром.
Первое представление об истинных размерах ядра давали опыты Резерфорда по рассеянию альфа-частиц в тонких металлических фольгах. Частицы глубоко проникали сквозь электронные оболочки и отклонялись, приближаясь к заряженному ядру. Эти опыты явно свидетельствовали о малых размерах центрального ядра и указали на способ определения ядерного заряда. Резерфорд установил, что альфа-частицы приближаются к центру положительного заряда на расстояние примерно 10 –14 м, а это позволило ему сделать вывод, что таков максимально возможный радиус ядра.
На основе таких предположений Бор построил свою квантовую теорию атома, успешно объяснившую дискретные спектральные линии, фотоэффект, рентгеновское излучение и периодическую систему элементов. Однако в теории Бора ядро рассматривалось как положительный точечный заряд.
Ядра большинства атомов оказались не только очень малы – на них никак не действовали такие средства возбуждения оптических явлений, как дуговой искровой разряд, пламя и т.п. Указанием на наличие некой внутренней структуры ядра явилось открытие в 1896 А.Беккерелем радиоактивности. Оказалось, что уран, а затем и радий, полоний, радон и т.п. испускают не только коротковолновое электромагнитное излучение, рентгеновское излучение и электроны (бета-лучи), но и более тяжелые частицы (альфа-лучи), а они могли исходить лишь из массивной части атома. Резерфорд использовал альфа-частицы радия в своих опытах по рассеянию, которые послужили основой формирования представлений о ядерном атоме. (В то время было известно, что альфа-частицы – это атомы гелия, лишенные своих электронов; но на вопрос – почему некоторые тяжелые атомы спонтанно испускают их, ответа еще не было, как не было и точного представления о размерах ядра.)
Открытие изотопов.
Сравнивая на своем масс-спектрографе массу атома неона с известными массами других элементов, Томсон в 1912 неожиданно обнаружил, что неону вместо одной соответствуют две параболы. Расчеты масс частиц показали, что одна из парабол отвечает частицам с массой 20, а другая – с массой 22. Это явилось первым свидетельством того, что атомы определенного химического элемента могут иметь различные массовые числа. Поскольку измеренное (среднее) массовое число оказалось равным 20,2, Томсон высказал предположение, что неон состоит из атомов двух типов, на 90% с массой 20 и на 10% с массой 22. Поскольку оба типа атомов в природе существуют в виде смеси и их нельзя разделить химическим путем, массовое число неона оказывается равным 20,2.
Наличие двух типов атомов неона наводило на мысль о том, что и другие элементы могут представлять собой смеси атомов. Последующие масс-спектрометрические измерения показали, что большинство природных элементов представляют собой смеси от двух до десяти различных сортов атомов. Атомы одного и того же элемента с различной массой называют изотопами. У некоторых элементов существует только один изотоп, что требовало теоретического объяснения, как и факт разной распространенности элементов, а также существование радиоактивности лишь у определенных веществ.
Отметим, что в атомную единицу массы входит масса одного электрона, а масса самого легкого изотопа водорода почти на 1% больше 1 а.е.м.
Открытие нейтрона.
Открытие изотопов не прояснило вопрос о строении ядра. К этому времени были известны лишь протоны – ядра водорода и электроны, а потому естественной была попытка объяснить существование изотопов различными комбинациями этих положительно и отрицательно заряженных частиц. Можно было бы думать, что ядра содержат А протонов, где А – массовое число, и А - Z электронов. При этом полный положительный заряд совпадает с атомным номером Z.
Лишь спустя десятилетие, после того как естественная радиоактивность была глубоко исследована, а радиоактивное излучение стали широко применять, чтобы вызывать искусственное превращение атомов, было надежно установлено существование новой составной части ядра. В 1930 В.Боте и Г.Беккер из Гисенского университета проводили облучение лития и бериллия альфа-частицами и с помощью счетчика Гейгера регистрировали возникающее при этом проникающее излучение. Поскольку на это излучение не оказывали влияния электрические и магнитные поля и оно обладало большой проникающей способностью, авторы пришли к выводу, что испускается жесткое гамма-излучение. В 1932 Ф.Жолио и И.Кюри повторили опыты с бериллием, пропуская такое проникающее излучение через парафиновый блок. Они обнаружили, что из парафина выходят протоны с необычно высокой энергией, и заключили, что, проходя через парафин, гамма-излучение в результате рассеяния порождает протоны. (В 1923 было установлено, что рентгеновские лучи рассеиваются на электронах, давая комптоновский эффект.)
Дж.Чедвик повторил эксперимент. Он также использовал парафин и с помощью ионизационной камеры (рис. 1), в которой собирался заряд, возникающий при выбивании электронов из атомов, измерял пробег протонов отдачи.
Чедвик использовал также газообразный азот (в камере Вильсона, где вдоль следа заряженной частицы происходит конденсация водяных капелек) для поглощения излучения и измерения пробега атомов отдачи азота. Применив к результатам обоих экспериментов законы сохранения энергии и импульса, он пришел к выводу, что обнаруженное нейтральное излучение – это не гамма-излучение, а поток частиц с массой, близкой к массе протона. Чедвик показал также, что известные источники гамма-излучения не выбивают протонов.
Тем самым было подтверждено существование новой частицы, которую теперь называют нейтроном. Расщепление металлического бериллия происходило следующим образом:
Альфа-частицы 4 2He (заряд 2, массовое число 4) сталкивались с ядрами бериллия (заряд 4, массовое число 9), в результате чего возникали углерод и нейтрон.
Открытие нейтрона явилось важным шагом вперед. Наблюдаемые характеристики ядер теперь можно было интерпретировать, рассматривая нейтроны и протоны как составные части ядер. На рис. 2 схематически показана структура нескольких легких ядер.
Нейтрон, как теперь известно, на 0,1% тяжелее протона. Свободные нейтроны (вне ядра) претерпевают радиоактивный распад, превращаясь в протон и электрон. Это напоминает о первоначальной гипотезе составной нейтральной частицы. Однако внутри стабильного ядра нейтроны связаны с протонами и самопроизвольно не распадаются.
Ядерная связь.
Первоначальное предположение Праута о том, что все атомные массы должны быть целыми кратными массы атома водорода, очень близко к истине, в частности, применительно к изотопам. Отклонения крайне малы, всегда не более 1%, а в большинстве случаев не более 0,1%. Детальное изучение масс изотопов доведено до высочайшей степени совершенства: погрешность измерения в настоящее время, как правило, не превышает нескольких миллионных.
Установлено, что число нейтронов примерно совпадает с числом протонов в атоме, т.е.
В действительности в более тяжелых ядрах имеется некоторый избыток нейтронов. Поскольку нейтрон не заряжен, силы, удерживающие нейтроны и протоны в ядре, по своей природе не являются электростатическими; кроме того, одноименные заряды отталкиваются. То обстоятельство, что ядра очень трудно расщепить, указывает на существование больших сил ядерного притяжения. Несмотря на малость расстояний, гравитационное притяжение между нуклонами все же слишком слабо, чтобы обеспечить стабильность ядра.
Согласно Эйнштейну, полная энергия изолированной системы сохраняется, а масса является одной из форм энергии: E = mc 2 . Чтобы расщепить такую связанную систему, как ядро стабильного атома, на составляющие ее нейтроны и протоны, ей необходимо сообщить энергию. Это означает, что масса нейтронов и протонов превышает массу ядра на величину
где Mp и Mn – массы свободного протона и нейтрона, а MA,Z – масса ядра с зарядом Z и массовым числом А. Эта разница масс, выраженная в единицах энергии, называется энергией связи. Коэффициент для пересчета таков:
1 а.е.м. = 931,14 МэВ,
где 1 МэВ = 10 6 эВ. Таким образом, энергия связи EB = D Mc 2 есть энергия, необходимая для расщепления ядра на отдельные нейтроны и протоны.
Средняя энергия связи, приходящаяся на один нуклон, EB/A, довольно регулярно изменяется с увеличением числа нуклонов в ядре (рис. 3). Самым легким ядром после протона является дейтрон 2 1H, расщепление которого требует энергии 2,2 МэВ, т.е. 1,1 МэВ на нуклон. Альфа-частица 4 2He связана гораздо сильнее, чем ее соседи: ее энергия связи составляет 28 МэВ. У ядер с массовым числом, превышающим 20, средняя энергия связи, приходящаяся на нуклон, остается почти постоянной, равной примерно 8 МэВ.
Энергия связи ядер на много порядков величины превышает энергию связи валентных электронов в атоме и атомов в молекуле. Чтобы удалить из атома водорода его единственный электрон, достаточно энергии 13,5 эВ; для удаления же внутренних электронов в свинце, связанных наиболее прочно, необходима энергия, равная 0,1 МэВ. Следовательно, все ядерные процессы связаны с энергиями, значительно превышающими те, с которыми мы имеем дело в обычных химических реакциях или при обычных температурах и давлениях.
Естественная радиоактивность.
С явления естественной радиоактивности началась ядерная физика. Альфа-, бета- и гамма-излучения, испускаемые ураном, имеют ядерное происхождение, тогда как оптические и рентгеновские спектры соответствуют электронной структуре атома. Альфа-частицы оказались ядрами гелия. Бета-частицы по своему заряду и массе идентичны электронам оболочки атома, однако их ядерное происхождение было четко продемонстрировано изменением заряда распадающегося ядра. Кроме того, энергия гамма-излучения значительно превышает энергию, которую могут излучать электроны из внешней оболочки атома, следовательно, это проникающее излучение имеет ядерное происхождение.
Важная роль радиоактивности в физике ядра связана с тем, что радиоактивное излучение несет информацию о типах частиц и энергетических уровней ядра. Например, испускание альфа-частиц из ядра и относительная устойчивость образования из двух протонов и двух нейтронов косвенно указывает на возможность существования альфа-частиц внутри ядра.
Различие между естественной и искусственно наведенной радиоактивностью не очень существенно для понимания строения ядра, однако изучение естественных радиоактивных рядов позволило сделать важные выводы относительно возраста Земли и использовать такие элементы в качестве источников бомбардирующих частиц задолго до того, как были изобретены ускорители частиц.
Искусственные превращения ядер.
Опыты с естественно радиоактивными элементами показали, что на скорость радиоактивного распада нельзя повлиять обычными физическими средствами: теплом, давлением и т.п. Таким образом, поначалу казалось, что нет какого-либо эффективного метода исследования структуры естественно стабильных изотопов. Однако в 1919 Резерфорд обнаружил, что ядра можно расщеплять, бомбардируя их альфа-частицами. Первым расщепленным элементом был азот, который в виде газа заполнял камеру Вильсона. Альфа-частицы, испускаемые ториевым источником, сталкивались с ядрами азота, поглощались ими, в результате чего испускались быстрые протоны. При этом происходила реакция
В результате такой реакции атом азота превращается в атом кислорода. В этом примере энергии связи ядер аналогичны теплу, которое выделяется при химической реакции, хотя и значительно превышают его. Впоследствии аналогичные результаты были получены и с многими другими элементами. Используя различные методы, можно измерить энергии и углы вылета испускаемых заряженных частиц, что обеспечивает проведение количественных экспериментов.
Следующим шагом явилось открытие, сделанное Дж.Кокрофтом и Э.Уолтоном в 1932. Они установили, что искусственно ускоренные пучки протонов с энергией 120 кэВ (т.е. значительно меньшей, чем у альфа-частиц в опытах Резерфорда) способны вызывать расщепление атомов лития в процессе
Два ядра гелия (альфа-частицы) одновременно вылетают в противоположные стороны. Причина, по которой эта реакция протекает при низкой энергии, заключается в прочной связи альфа-частиц; при добавлении протона к массе ядра 7 Li сообщается энергия, которая почти равнозначна массам двух альфа-частиц. Остальная энергия, необходимая для протекания реакции, черпается из кинетической энергии бомбардирующих протонов.
Энергетические уровни ядер и ядерные модели.
Изучение ядерных реакций убедительно продемонстрировало существование энергетических уровней ядер. Эти уровни представляют собой состояния ядра с определенной энергией, которым приписаны определенные квантовые числа, как и энергетическим уровням атома (см. также АТОМА СТРОЕНИЕ). По аналогии с оптической спектроскопией исследование излучений, испускаемых ядром при переходах между энергетическими уровнями, называется ядерной спектроскопией. Однако, как можно видеть из рис. 4, расстояние между энергетическими уровнями ядер значительно больше, чем между электронными уровнями атомов, а к ядерным излучениям, кроме электромагнитного, относятся также излучения электронов, протонов, альфа-частиц и частиц других типов.
О существовании у ядра дискретных энергетических уровней свидетельствует то, что возбуждение ядра, приводящее к испусканию излучения, происходит лишь при определенных энергиях бомбардирующих частиц, а также то, что энергии испускаемых частиц соответствуют переходам между определенными уровнями. Например, можно измерить число протонов, образующихся при бомбардировке бора-10 моноэнергетическими дейтронами в результате реакции
В 1932 Дж.Бартлетт заметил, что все стабильные ядра, расположенные между 4 He и 16 О, относятся к последовательности
4 He + n + p + n + p +.
тогда как между 16 О и 36 Аr аналогичная последовательность приобретает вид
16 O + n + n + p + p + n + n +.
Составное ядро и модель капли.
Размеры и форма ядра.
Впервые размеры ядра правильно оценил Резерфорд, использовав для этой цели рассеяние альфа-частиц. Его первые эксперименты показали, что размеры заряженной части ядра – порядка 10 –14 м. Более поздние и более точные эксперименты позволили установить, что радиус ядра приблизительно пропорционален А 1/3 и, следовательно, плотность ядерного вещества почти постоянна. (Она колоссальна: 100 000 т/мм 3 .)
С открытием нейтрона стало ясно, что он представляет собой идеальное средство исследования ядра, поскольку нейтральные частицы, проходя на значительном удалении от ядра, не испытывают отклонения под действием заряда ядра. Другими словами, нейтрон сталкивается с ядром, если расстояние между их центрами оказывается меньше суммы их радиусов, а в противном случае не отклоняется. Опыты по рассеянию пучка нейтронов показали, что радиус ядра (в предположении сферической формы) равен:
R = r0A 1/3 ,
Ядерные силы и мезоны.
Хотя существование пи-мезонов и ободрило сторонников теории Юкавы, на ее основе оказалось весьма трудно правильно предсказать такие детальные свойства ядерных сил, как их насыщение, энергии связи и энергии ядерных уровней. Трудности математического характера не позволили точно установить, что именно предсказывает эта теория. Ситуация еще более усложнилась после открытия новых типов мезонов, которые, как считается, имеют отношение к ядерным силам. См. также МОМЕНТЫ АТОМОВ И ЯДЕР; УСКОРИТЕЛЬ ЧАСТИЦ; ЧАСТИЦЫ ЭЛЕМЕНТАРНЫЕ; РАДИОАКТИВНОСТЬ.
Айзенбуд Л., Вигнер Е. Структура ядра. М., 1959
Престон М. Физика ядра. М., 1964
Кук Ш. Структура атомных ядер. М., 1967
Лейн А. Теория ядра. М., 1967
Федянин В. К. Электромагнитная структура ядер и нуклонов. М., 1967
Широков Ю.М., Юдин Н.П. Ядерная физика. М., 1980
Робертсон Б. Современная физика в прикладных науках. М., 1985

Большая часть массы всех элементов на Земле сосредоточена в элементарных частицах, называемых протонами и нейтронами (общее название – нуклоны). Поговорим кратко о протонах и нейтронах в составе атомных ядер.
Протоны и нейтроны
В самом начале XXв в опытах Э. Резерфорда было установлено, что практически вся масса и положительный заряд атома сосредоточен в компактном ядре. Вокруг ядра по весьма далеким (по отношению к размеру ядра) орбитам вращаются электроны. Атом в целом нейтрален, потому, что заряд электронов и ядра одинаков.
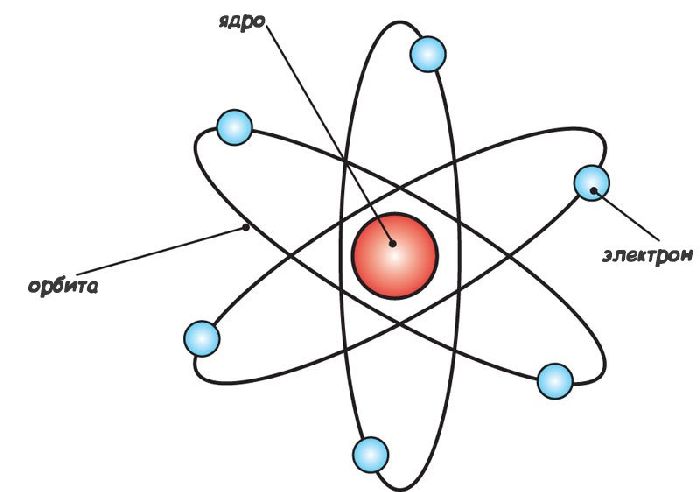
Рис. 1. Планетарная модель атома.
Дальнейшие опыты Э. Резерфорда привели в 1919 г к открытию протона, и к пониманию, что весь положительный заряд ядра обеспечивается наличием в его составе протонов. Протон – это достаточно тяжелая частица, тяжелее электрона в 1830 раз, что примерно равно одной атомной единице массы. Его положительный заряд по модулю равен заряду электрона. Ядро самого легкого элемента – водорода – имеет единичный заряд, и состоит из одного протона, вокруг которого обращается один электрон.
В 1930 году Д. Чедвиком был открыт нейтрон. Это еще одна элементарная частица, почти с такой же массой, как у протона, но не имеющая заряда, и входящая в состав ядер.
Ядерные Силы
Возникает вопрос – если протоны обеспечивают положительный заряд ядра, то почему существуют ядра элементов с зарядом больше единицы ? Ведь протоны, заряженные одинаково, должны отталкиваться друг от друга!
Нуклоны удерживает вместе особое Сильное (или ядерное) взаимодействие. Особенность ядерного взаимодействия в том, что его переносчики (глюоны и составленные из них пионы) – не только переносят сильное взаимодействие, но и сами в нем участвуют. Поэтому они не могут далеко удаляться друг от друга, и радиус действия ядерных сил не превышает размеры ядер. Эти силы значительно больше кулоновских сил отталкивания, и поэтому ядра, содержащие много положительных протонов стабильны.
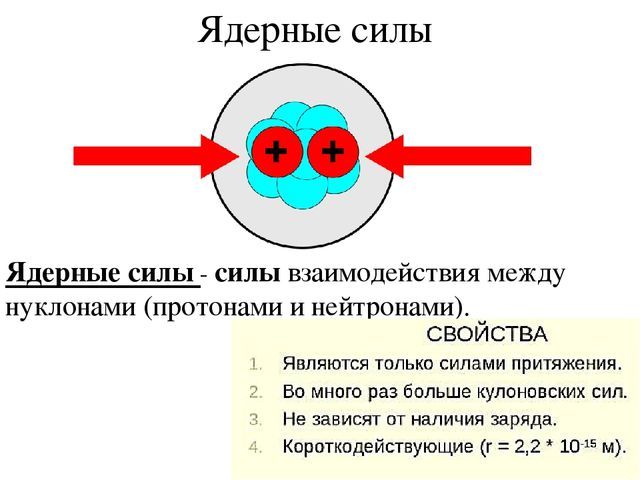
Рис. 2. Ядерные силы.
Эти же силы определяют стабильность нейтрона в составе ядер. Свободный нейтрон – это нестабильная частица с периодом полураспада около 600 сек. Ядерные взаимодействия делают распад нейтрона в ядрах с малым их числом $N$ энергетически невыгодным.
Протонно-нейтронная модель ядра
Таким образом, в состав атомного ядра входят протоны и нейтроны, которые удерживаются вместе короткодействующим Сильным взаимодействием. Число протонов в ядре $Z$ соответствует номеру элемента в Периодической Системе Менделеева. Общее число нуклонов в ядре $A$ соответствует массовому числу элемента:
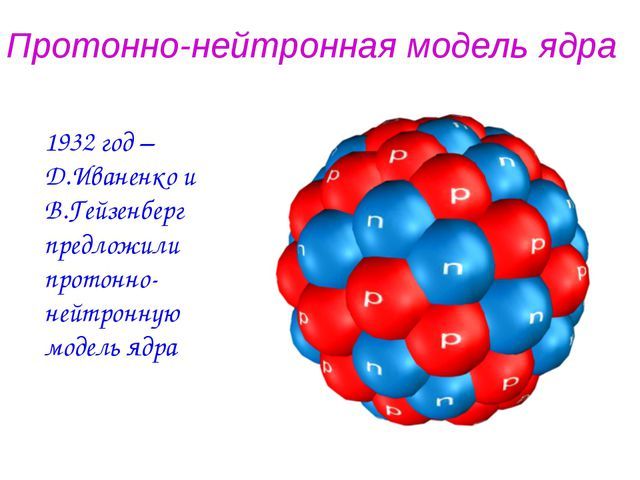
Рис. 3. Протонно-нейтронная модель ядра.
Чем больше протонов в ядре – тем больше силы кулоновского отталкивания, и тем менее стабильно ядро. Наличие $N$ нейтронов в ядре стабилизирует его.
Для тяжелых элементов, содержащих в ядре много протонов, число нейтронов должно быть еще больше. Так, например, ядро наиболее распространенного в природе свинца-208 содержит 82 протона и 126 нейтронов. Однако, если число нейтронов становится слишком большим, становится энергетически выгоден распад нейтрона, а с распадом нейтрона уменьшаются ядерные силы, и ядро распадается. Именно поэтому наиболее стабильными являются ядра со средним числом нейтронов и протонов.
Что мы узнали?
Ядро атома состоит из элементарных частиц – протонов и нейтронов, которые удерживаются вместе особыми ядерными силами. Число протонов в ядре соответствует номеру элемента в Периодической системе. Общее число нуклонов – соответствует массовому числу.
На уроке рассматриваются: понятия атомное ядро, опыты Резерфорда, планетарная модель строения атома; сравниваются модели атома Томсона и Резерфорда, даны некоторые сведения о фактах, подтверждающих сложное строение атома, о работах учёных по созданию модели строения атома.
Атомное ядро — тело малых размеров, в котором сконцентрирована почти вся масса и весь положительный заряд атома.
Размеры ядра: диаметр порядка 10 -12 —10 -13 см (у разных ядер диаметры различны).
Размер атома: примерно 10 -8 см, т. е. от 10 до 100 тысяч раз превышает размеры ядра.
Планетарная модель атома Резерфорда: в целом атом нейтрален, в центре атома расположено положительно заряжённое ядро, в котором сосредоточена почти вся масса атома, электроны движутся по орбитам вокруг ядра, заряд ядра, как и число электронов в атоме, равен порядковому номеру элемента в периодической системе Д.И.Менделеева.
Ядро атома водорода названо протоном и рассматривается как элементарная частица.
Ядро атома водорода имеет положительный заряд, равный по модулю заряду электрона, и массу, примерно в 1836,1 раза больше массы электрона.
Частота излучений атома водорода составляет ряд серий: серия Бальмера, серия Лаймана, серия Пашена и другие, каждая из которых образуется в процессе перехода атома в одно из энергетических состояний.
Обязательная литература по теме урока:
Основное содержание урока
Долгое время, физика накапливала факты о свойстве вещества для полного представления о строении атома. И только в XIX веке изучение атомического строения вещества существенно сдвинулось с точки покоя.
Большую роль в развитии атомистической теории сыграл выдающийся русский химик Дмитрий Иванович Менделеев, разработавший в 1869 году периодическую систему элементов, в которой впервые был поставлен вопрос о единой природе атомов.
Важным свидетельством сложной структуры атомов явились исследования спектров, излучаемые веществом, которые привели к открытию линейчатых спектров атомов. В начале XIX века в излучении атома водорода были открыты спектральные линии в видимой части спектра.
Идеи электронной структуры атома теоретически и гипотетически формулировались учёными. В 1896 году Хендрик Лоренц создал электронную теорию о том, что электроны являются частью атома. Эту гипотезу в 1897 году подтвердили эксперименты Джозефа Джона Томсона. Им был сформулирован вывод о том, что существуют частицы с наименьшим отрицательным зарядом - электроны и они являются частью атомов.
Таким образом, к началу XX века учёные сделали вывод о том, что атомы материи имеют сложную внутреннюю структуру. Они являются электрически нейтральными системами, а носителями отрицательного заряда атомов являются лёгкие электроны, масса которых составляет лишь малую долю массы атомов. Однако модель атома Томсона находилась в полном противоречии с экспериментами по изучению распределения положительных зарядов.
Электрон – наименьшая электроотрицательная заряжённая элементарная частица
Масса покоя электрона me = 9,1·10 -31 кг;

- отношение заряда электрона к его массе.
Немецкий физик Филипп фон Ленард в 1903 году проводил опыты, в которых пучок быстрых электронов легко проходил через тонкую металлическую фольгу. На основании этого Ленард предположил, что атом состоит из нейтральных частиц или нейтральных дуплетов с совмещённым положительным и отрицательным зарядами, рассредоточенными в атоме, где большая площадь представляет собой пустоту.

В 1904 году японский физик Хентаро Нагаока выдвинул гипотезу о том, что атом состоит из тяжелого положительно заряженного ядра, окруженного кольцами из большого числа электронов, колебания которых и являются причиной испускания атомных спектров, по аналогии с теорией устойчивости колец Сатурна.

Но в физике уже более 200 лет существует главное правило: окончательный выбор между гипотезами может быть сделан только на основе опыта. Эксперименты, проведенные в первый раз Эрнестом Резерфордом, сыграли решающую роль в понимании структуры атома.

30.08.1871 г. – 19.10.1937 г.
Британский физик новозеландского происхождения
Лауреат Нобелевской премии по химии 1908 года
Для экспериментального изучения распределения положительного заряда, а значит, и массы внутри атома Эрнест Резерфорд в 1906 г. предложил применить зондирование атома α-частицами, скорость которых составляет 1/15 скорости света.
Эти частицы возникают при распаде, например, радия и некоторых других радиоактивных элементов. Сами же α-частицы – это ионизированные атомы гелия, положительный заряд гелия в два раза больше заряда электрона +2He. Этими частицами Резерфорд бомбардировал атомы тяжёлых элементов (золото, медь и др.). Если бы электроны были равномерно распределены по всему объёму атома (по модели атома Томсона), электроны не могли бы заметно изменять траекторию α –частиц, так как размеры и масса электронов в 8000 раз меньше массы α-частиц. Точно так же камушек в несколько десятков граммов при столкновении с автомобилем не может изменить его скорость.
Изменение направления движения α-частиц может вызвать только массивная часть атома, при этом положительно заряжённая. Весь прибор размещался в сосуде, из которого был откачан воздух. Радиоактивный препарат, помещался внутри свинцового цилиндра, вдоль которого был высверлен узкий канал. Пучок α -частиц из канала падал на тонкую фольгу из тяжёлого металла. После рассеяния α-частицы попадали на полупрозрачный экран, покрытый сульфидом цинка. Столкновение каждой частицы с экраном сопровождалось сцинтилляцией (вспышкой света), которую можно было наблюдать в микроскоп.
Чтобы обнаружить отклонение α-частиц на большие углы Резерфорд окружил фольгу экранами. Сотрудники Резерфорда вели счёт α-частиц, попадающих в регистрирующее устройство при отклонении их на от первоначального направления на определённый угол φ (фи). Данные из серии опытов, за определённый период времени, приведены в таблице:
Первые результаты, полученные Резерфордом, казалось бы, подтверждали справедливость модели атома Томсона: частицы пролетали сквозь фольгу, почти не отклоняясь от своего первоначального направления.
Передадим слово самому Резерфорду:
Действительно, чтобы быстрая и массивная частица в результате столкновения полетела назад, она должна была столкнуться с чем-то еще более массивным и очень малым по своим размерам (рис. 26.3).

Читайте также:

