Определение окислительных свойств веществ план урока
Обновлено: 08.07.2024
Обучающие: Познакомить учащихся с новой классификацией химических реакций по признаку изменения степеней окисления элементов – с окислительно-восстановительными реакциями (ОВР); научить учащихся расставлять коэффициенты методом электронного баланса.
Развивающие: Продолжить развитие логического мышления, умений анализировать и сравнивать, формирование интереса к предмету; показать разнообразие и значение ОВР в природе и повседневной жизни.
Воспитательные: Формировать научное мировоззрение учащихся; совершенствовать трудовые навыки.
Методы и методические приемы. Рассказ, беседа, демонстрация средств наглядности, самостоятельная работа учащихся.
Оборудование и реактивы:
· штатив с пробирками;
· раствор сульфата меди (II), раствор гидроксида натрия, железная кнопка;
· периодическая система Д. И.Менделеева.
Эпиграфом нашего урока будут слова Станислава Лема:
На предыдущих уроках мы с вами познакомились с различными видами классификации химических реакций. Итак, какие бывают реакции?
(Обратимые и необратимые, гомогенные и гетерогенные, зкзо- и эндотермические, каталитические и не каталитические, реакции соединения, разложения, замещения и обмена).
Т.о., все химические реакции делятся на:
Дайте характеристику реакциям по всем известным признакам классификации.
Сегодня мы познакомимся с новой классификацией химических реакций.
Открываем рабочие тетради и записываем тему урока – ОВР. Что означает эта аббревиатура, мы расшифруем позднее.
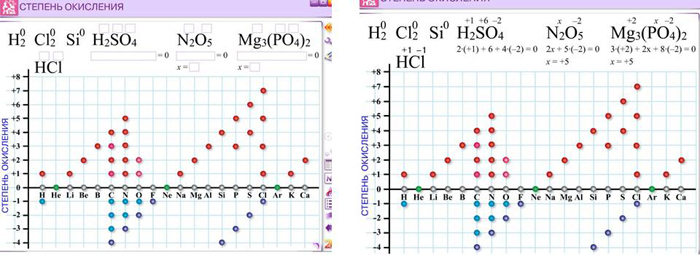
Что такое СО? (СО – это условный заряд атома ХЭ в соединении, вычисленный на основе предположения, что все соединения состоят только из ионов). СО численно равна валентности. Различие состоит в том, что валентность обозначается римскими цифрами и не имеет знака, а СО – арабскими, имеет знак, который ставится перед значением СО. У простых веществ и неполярных молекул СО равна нулю. Сумма СО атомов в молекуле всегда равна нулю.
Определите СО элементов в следующих веществах:
HNO3, Mg(NO3)2, Zn, H2SO4, Br2, H3PO4, Cu2O, O3, NaNO2, КMnO4.
Проведите реакции между раствором сульфата меди (II) и:
1) раствором гидроксида натрия
2) железной кнопкой.
Укажите признаки химических реакций, запишите молекулярные уравнения и определите степень окисления каждого элемента.

Сравните эти реакции. Чем они отличаются друг от друга? Изменились ли степени окисления элементов в этих реакциях? ( В первом уравнении степени СО не изменились, а во втором изменились – у меди и железа) . По какому признаку можно классифицировать реакции? ( По изменению СО).
Вторая реакция относится к окислительно-восстановительным. Попробуйте дать определение окислительно-восстановительных реакций.
(ОВР – реакции, протекающие с изменением СО элементов).
Т.о., многообразие классификаций химических реакций по различным признакам можно дополнить ещё одним – реакции, протекающие с изменением и без изменения СО.
Что же произошло в результате ОВР? До реакции у железа была степень окисления 0, после реакции стала +2. Как видим, СО повысилась, следовательно, железо отдает 2 электрона.
У меди до реакции степень окисления +2, после реакции – 0. Как видим, СО понизилась. Следовательно, медь принимает 2 электрона.
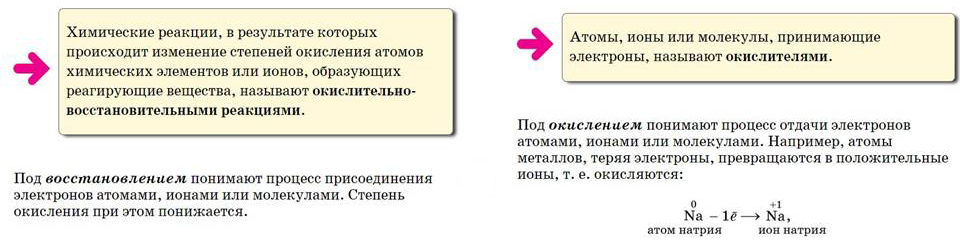
Железо отдает электроны, оно является восстановителем, а процесс передачи электронов называется окислением.
Медь принимает электроны, она – окислитель, а процесс присоединения электронов называется восстановлением. Запишем схемы этих процессов:

Какое определение можно дать процессам восстановления и окисления?
Запишите определения в тетрадь.
«Окислитель как отъявленный злодей,
Как пират, бандит, агрессор, Бармалей,
Отнимает электроны - и ОК!
Потерпев урон, восстановитель
Восклицает: «Вот я, помогите!
Но никто не помогает и ущерб
Отдать электроны – окислиться.
Взять электроны – восстановиться.
Т.о., металлы – это сильные восстановители, а неметаллы – сильные окислители. Поэтому в ПС в периодах слева направо восстановительные свойства будут уменьшаться, а окислительные – увеличиваться; в группах главных подгруппах сверху вниз восстановительные свойства – увеличиваться, а окислительные – уменьшаться.
Для подбора коэффициентов в уравнениях окислительно-восстановительных реакций используют метод электронного баланса.
5 K ClO 3 + 6P = 5KCl + 3P 2 O 5
слайд 11
Какие из приведенных схем уравнений можно отнести к ОВР? Определите типы реакций.
1) СаСО3 → СаО + СО2
2) 2KMnO4 → K2MnО4 + MnО2 + О2↑
3) N2 + 3Н2 → 2NН3
4) N2O5 + H2O → 2HNO3
5) Mg + 2HCl → MgCl2 + H2↑
6) AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
7) 2CuS + 3О2 → 2СuО + 2SО2↑
Вывод: Окислительно-восстановительными будут являться все реакции замещения, те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество, а также реакции горения.
Все реакции ионного обмена не ОВР.
Окислительно-восстановительные процессы встречаются не только на уроках химии. Это и дыхание, и обмен веществ в организме, порча пищевых продуктов, процессы фотосинтеза у растений, брожения, гниения, сгорание топлива, выплавка металлов и другие процессы.
Напрашивается вопрос, возможно ли было возникновение жизни на нашей планете без участия окислительно-восстановительных процессов? (Нет).
слайды 14-18 (Выполнение тестовых заданий. Проверка.)
Вывод: Т.о., на сегодняшнем уроке мы познакомились с новой классификацией химических реакций по признаку изменения степеней окисления элементов – с окислительно-восстановительными реакциями и выяснили, что коэффициенты в уравнениях ОВР можно расставить методом электронного баланса.
Домашнее задание: §44, упр.1,7 /data/files/d1486492769.pptx (Окислительно-восстановительные реакции.)
Окислительно-восстановительные реакции принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. Важнейшие процессы на планете связаны с этим типом химических реакций. Человечество давно пользовалось ОВР, вначале не понимая их сущности. Лишь к началу XX века была создана электронная теория окислительно – восстановительных процессов. На уроке предстоит вспомнить основные положения этой теории, метод электронного баланса, научиться составлять уравнения химических реакций, протекающих в растворах, и выяснить от чего зависит механизм таких реакций.
| Вложение | Размер |
|---|---|
| urok_himii_v_11_po_teme_ovr.doc | 801.5 КБ |
Предварительный просмотр:
учитель химии: Данилов К.Е.
Тема урока: Окислительно-восстановительные реакции.
Цель урока: Обобщить, систематизировать и расширить знания учащихся об окислительно-восстановительных реакциях, важнейших окислителях и продуктах их восстановления.
- Закрепить умение определять степени окисления элементов, окислитель и восстановитель, расставлять коэффициенты методом электронного баланса.
- Совершенствовать умение определять окислительно-восстановительные свойства веществ, прогнозировать продукты реакций в зависимости от активности металлов, концентрации кислот и реакции среды раствора.
- Выработать умение составлять уравнения химических реакций, протекающих в различных средах на примере соединений марганца.
- Показать разнообразие и значение ОВР в природе и повседневной жизни.
- Продолжить подготовку к ЕГЭ по химии.
1. Организационный момент
Добрый день! Хорошего вам настроения!
Окислительно-восстановительные реакции принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. Важнейшие процессы на планете связаны с этим типом химических реакций. Человечество давно пользовалось ОВР, вначале не понимая их сущности. Лишь к началу XX века была создана электронная теория окислительно – восстановительных процессов. На уроке предстоит вспомнить основные положения этой теории, метод электронного баланса, научиться составлять уравнения химических реакций, протекающих в растворах, и выяснить от чего зависит механизм таких реакций.
2. Повторение и обощение изученного ранее материала
Для вас тема ОВР не нова, она проходит красной нитью через весь курс химии. Поэтому предлагаю повторить некоторые понятия и умения по данной теме.
/ Степень окисления – это условный заряд атома химического элемента в соединении, вычисленный на основе предположения, что все соединения состоят только из ионов. Степень окисления может быть положительной, отрицательной или равняться нулю, что зависит от природы соответствующих соединений./
Одни элементы имеют постоянные степени окисления, другие — переменные.
Например, к элементам с постоянной положительной степенью окисления относят щелочные металлы: Li +1 , Na +1 , K +1 , Rb +1 , Cs +1 , Fr +1 , следующие элементы II группы периодической системы: Ве +2 , Mg +2 , Ca +2 , Sr +2 , Ва +2 , Ra +2 , Zn +2 , а также элемент III А группы - А1 +3 и некоторые другие. Металлы в соединениях всегда имеют положительную степень окисления.
Из неметаллов постоянную отрицательную степень окисления (-1) имеет F.
В простых веществах, образованных атомами металлов или неметаллов, степени окисления элементов равны нулю, например: Na°, Al°, Fe°, Н 2 0 , О 2 0 , F 2 0 , Cl 2 0 , Br 2 0 .
Для водорода характерны степени окисления: +1 (Н 2 0), -1 (NaH).
Для кислорода характерны степени окисления: -2 (Н 2 0), -1 (Н 2 О 2 ), +2 (OF 2 ).
Следует помнить, что в целом молекула электронейтральна, поэтому в любой молекуле алгебраическая сумма степеней окисления равна нулю, а в сложном ионе – заряду иона.
Например, рассчитаем степень окисления хрома в дихромате калия K 2 Cr 2 O 7 .
- Степень окисления калия +1, кислорода -2.
- Подсчитаем число отрицательных зарядов: 7 • (-2) = -14
- Число положительных зарядов должно быть + 14. На калий приходится два положительных заряда, следовательно, на хром – 12.
- Так как в формуле два атома хрома, 12 делим на два: 12 : 2 = 6.
- + 6 – это степень окисления хрома.
Проверка: алгебраическая сумма положительных и отрицательных степеней окисления элементов равна нулю, молекула электронейтральна.
Самостоятельная работа № 1 по инструктивной карте: пользуясь приведенными сведениями, рассчитайте степени окисления элементов в соединениях: MnO 2 , H 2 SO 4 , K 2 SO 3 , H 2 S, KMnO 4.
/ Окислительно – восстановительные реакции – это такие реакции, в которых одновременно протекают процессы окисления и восстановления и, как правило, изменяются степени окисления элементов./
Рассмотрим процесс на примере взаимодействия цинка с разбавленной серной кислотой:

При составлении этого уравнения используется метод электронного баланса. Метод основан на сравнении степеней окисления атомов в исходных веществах и продуктах реакции. Основное требование при составлении уравнений этим методом: число отданных электронов должно быть равно числу принятых электронов.
- Окислительно - восстановительные реакции – это такие реакции, при которых происходит переход электронов от одних атомов, молекул или ионов к другим.
- Окисление – это процесс отдачи электронов, степень окисления при этом повышается.
- Восстановление – это процесс присоединения электронов, степень окисления при этом понижается.
- Атомы, молекулы или ионы, отдающие электроны, окисляются; являются восстановителями.
Атомы, ионы или молекулы, принимающие электроны, восстанавливаются; являются окислителями. - Окисление всегда сопровождается восстановлением, восстановление связано с окислением.
- Окислительно – восстановительные реакции – единство двух противоположных процессов: окисления и восстановления.
Самостоятельная работа № 2 по инструктивной карте: методом электронного баланса найдите и поставьте коэффициенты в следующей схеме окислительно –восстановительной реакции:
MnO 2 + H 2 SO 4 → MnSO 4 + O 2 + H 2 O (2MnO 2 + 2H 2 SO 4 → 2MnSO 4 + O 2 +2H 2 O)
Однако научиться находить коэффициенты в ОВР еще не значит уметь их составлять. Нужно знать поведение веществ в ОВР, предусматривать ход реакций, определять состав образующихся продуктов в зависимости от условий реакции.
Для того чтобы разобраться, в каких случаях элементы ведут себя как окислители, а в каких – как восстановители, нужно обратиться к периодической системе Д.И.Менделеева. Если речь идет о простых веществах, то восстановительные свойства должны быть присущи тем элементам, которые имеют больший по сравнению с остальными атомный радиус и небольшое (1 - 3) число электронов на внешнем энергетическом уровне. Поэтому они могут сравнительно легко их отдавать. Это в основном металлы. Наиболее сильными восстановительными свойствами из них обладают щелочные и щелочноземельные металлы, расположенные в главных подгруппах I и II групп (например, натрий, калий, кальций и др.).
Наиболее типичные неметаллы, имеющие близкую к завершению структуру внешнего электронного слоя и значительно меньший по сравнению с металлами того же периода атомный радиус, довольно легко принимают электроны и ведут себя в окислительно-восстановительных реакциях как окислители. Наиболее сильными окислителями являются легкие элементы главных подгрупп VI – VII групп, например фтор, хлор, бром, кислород, сера и др.
Вместе с тем надо помнить, что деление простых веществ на окислители и восстановители так же относительно, как и деление на металлы и неметаллы. Если неметаллы попадают в среду, где присутствует более сильный окислитель, то они могут проявлять восстановительные свойства. Элементы в разных степенях окисления могут вести себя по-разному.
Если элемент имеет свою высшую степень окисления, то он может быть только окислителем. Например, в HN +5 O 3 азот в состоянии + 5 может быть только окислителем и принимать электроны.
Только восстановителем может быть элемент, находящийся в низшей степени окисления. Например, в N -3 Н 3 азот в состоянии -3 может отдавать электроны, т.е. является восстановителем.
Элементы в промежуточных положительных степенях окисления могут, как отдавать, так и принимать электроны и, следовательно, способны вести себя как окислители или восстановители в зависимости от условий. Например, N +3 , S +4 . Попадая в среду с сильным окислителем, ведут себя как восстановители. И, наоборот, в восстановительной среде они ведут себя как окислители.
По окислительно – восстановительным свойствам вещества можно разделить на три группы:
- окислители
- восстановители
- окислители - восстановители
Самостоятельная работа № 3 по инструктивной карте: в какой из приведенных схем уравнений реакций MnO 2 проявляет свойства окислителя, а в какой – свойства восстановителя:
- 2MnO 2 + O 2 + 4KOH = 2K 2 MnO 4 + 2H 2 O (MnO 2 – восстановитель)
- MnO 2 + 4HCI = MnCI 2 + CI 2 + 2H 2 O (MnO 2 – окислитель)
3. Углубление и расширение знаний
Важнейшие окислители и продукты их восстановления
1. Серная кислота - Н 2 SO 4 является окислителем
А) Уравнение взаимодействия цинка с разбавленной Н 2 SO 4 (слайд 3)
Какой ион является окислителем в данной реакции? (H + )
Продуктом восстановления металлом, стоящим в ряду напряжения до водорода, является H 2 .
Б) Рассмотрим другую реакцию – взаимодействие цинка с концентрированной Н 2 SO 4 (слайд 4)
Какие атомы меняют степень окисления? (цинк и сера)
Концентрированная серная кислота (98%) содержит 2% воды, и соль получается в растворе. В реакции участвуют фактически сульфат – ионы. Продуктом восстановления является сероводород.
В зависимости от активности металла продукты восстановления концентрированной Н 2 SO 4 разные: H 2 S, S, SO 2 .
Чем выше активность металла, тем дальше (глубже) идет восстановление серы (вплоть до низшей степени окисления - 2) (слайд 5)
На схемах указаны продукты, содержание которых максимально среди возможных продуктов восстановления кислот
2. Другая кислота – азотная – также окислитель за счет нитрат – иона NO 3 - . Окислительная способность нитрат – иона значительно выше иона H + , и ион водорода не восстанавливается до атома, поэтому при взаимодействии азотной кислоты с металлами, никогда не выделяется водород, а образуются различные соединения азота. Это зависит от концентрации кислоты и активности металла. Разбавленная азотная кислота восстанавливается глубже, чем концентрированная (для одного и того же металла) (слайд 6)
На схемах указаны продукты, содержание которых максимально среди возможных продуктов восстановления кислот
Au + 3HCI (конц.) + HNO 3 (конц.) = AuCI 3 + NO + 2H 2 O
3. Наиболее сильным окислителем из числа простых веществ является фтор. Но он слишком активен, и его трудно получить в свободном виде. Поэтому в лабораториях в качестве окислителя используют перманганат калия KMnO 4 . Его окислительная способность зависит от концентрации раствора, температуры и среды.
Реакции окисления – восстановления могут протекать в различных средах. В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами: среда влияет на изменение степеней окисления атомов.
Обычно для создания кислотной среды добавляют серную кислоту. Соляную и азотную применяют реже, т.к. первая способна окисляться, а вторая сама является сильным окислителем и может вызвать побочные процессы. Для создания щелочной среды применяют гидроксид калия или натрия, нейтральной – воду.
Лабораторный опыт: (правила ТБ)
В четыре пронумерованные пробирки налито по 1-2 мл разбавленного раствора перманганата калия. В первую пробирку добавьте несколько капель раствора серной кислоты, во вторую – воду, в третью – гидроксид калия, четвертую пробирку оставьте в качестве контрольной. Затем в первые три пробирки прилейте, осторожно взбалтывая, раствор сульфита натрия. Отметьте. Как изменяется окраска раствора в каждой пробирке. (слайды 7, 8)
Результаты лабораторного опыта:
Продукты восстановления KMnO 4 (MnO 4 - ):
- в кислой среде – Mn +2 (соль), бесцветный раствор;
- в нейтральной среде – MnO 2 , бурый осадок;
- в щелочной среде - MnO 4 2- , раствор зеленого цвета. (слайд 9,)
К схемам реакций:
KMnO 4 + Na 2 SO 3 + H 2 SO 4 → MnSO 4 + Na 2 SO 4 + K 2 SO 4 + H 2 O
KMnO 4 + Na 2 SO 3 + H 2 O → MnO 2 ↓ + Na 2 SO 4 + KOH
KMnO 4 + Na 2 SO 3 + КOH → Na 2 SO 4 + K 2 MnO 4 + H 2 O
Подберите коэффициенты методом электронного баланса. Укажите окислитель и восстановитель (слайд 10)
(Задание разноуровневое: сильные учащиеся записывают продукты реакции самостоятельно)

Вы проделали лабораторный опыт, предложите вещество, с помощью которого можно очистить халат.
Пятна от раствора перманганата калия быстро выводятся раствором пероксида водорода, подкисленным уксусной кислотой:
2KMnO 4 + 9H 2 O 2 + 6CH 3 COOH = 2Mn(CH 3 COO) 2 +2CH 3 COOK + 7O 2 + 12H 2 O
Старые пятна перманганата калия содержат оксид марганца (IV), поэтому будет протекать еще одна реакция:
MnO 2 + 3H 2 O 2 + 2CH 3 COOH = Mn(CH 3 COO) 2 + 2O 2 + 4H 2 O (слайд 12)
После выведения пятен кусок ткани необходимо промыть водой.
Значение окислительно – восстановительных реакций
В рамках одного урока невозможно рассмотреть все многообразие окислительно-восстановительных реакций. Но их значение в химии, технологии, повседневной жизни человека трудно переоценить.
Ученик: Окислительно-восстановительные реакции лежат в основе получения металлов и сплавов, водорода и галогенов, щелочей и лекарственных препаратов.
С окислительно – восстановительными реакциями связано функционирование биологических мембран, многие природные процессы: обмен веществ, брожение, дыхание, фотосинтез. Без понимания сущности и механизмов протекания окислительно-восстановительных реакций невозможно представить работу химических источников тока (аккумуляторов и батареек), получение защитных покрытий, виртуозную обработку металлических поверхностей изделий.
Для целей отбеливания и дезинфекции пользуются окислительными свойствами таких наиболее известных средств, как пероксид водорода, перманганат калия, хлор и хлорная, или белильная, известь.
Хлор как сильный окислитель используют для стерилизации чистой воды и обеззараживания сточных вод.
4. Закрепление изученного материала
- В кислой среде KMnO 4 восстанавливается до:
- соль Mn +2
- MnO 2
- K 2 MnO 4
- Концентрированная H 2 SO 4 при обычной температуре пассивирует:
- Zn
- Сu
- AI
- Концентрированная HNO 3 не реагирует с металлом:
- Ca
- Au
- Mg
- Разбавленная HNO 3 с активными металлами восстанавливается до:
- NO
- N 2
- N 2 O
- Какой продукт восстановления KMnO 4 пропущен: 2KMnO 4 + 3K 2 SO 3 + H 2 O = + 3K 2 SO 4 + 2KOH
- MnO 2
- 2MnSO 4
- K 2 MnO 4
(взаимопроверка тестов в парах)
5. Домашнее задание
Используя схемы, данные на уроке, закончите уравнения реакций и расставьте в них коэффициенты методом электронного баланса:
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
Цель урока: углубить и расширить знания учащихся об окислительно-восстановительных свойствах веществ на основе строения атома.
1) образовательные: продолжить формирование навыка записи уравнений окисления, восстановления, определения окислителей и восстановителей в реакциях; расставлять коэффициенты методом электронного баланса.
2) развивающие: п родолжить развитие умений анализировать и сравнивать, делать выводы, работать с текстом учебника, составлять алгоритм и работать по нему.
3) воспитательные: формировать научное мировоззрение учащихся.
2. Совершенствовать трудовые навыки, воспитывать культуру интеллектуального труда; уверенности в себе, умение работать в парах.
Учащиеся имеют возможность научиться определять конечные продукты для ОВР на простых примерах.
Метапредметные:
Регулятивные УУД: 1. Самостоятельно обнаруживать и формулировать учебную проблему.
2. Определять цель учебной деятельности, действовать по алгоритму.
3. Контролировать процесс и результаты своей деятельности, сверять свои действия с целью и при необходимости исправлять ошибки самостоятельно .
Познавательные УУД: 1. Оперировать понятийным аппаратом химии.
2. Анализировать, сравнивать, классифицировать, устанавливать причинно-следственные связи, находить и использовать нужную информацию.
Коммуникативные УУД: 1. Сотрудничать в группе, анализировать, учиться доказывать.
Личностные УУД: 1.Выражает и аргументирует свою позицию. Соблюдают нормы и правил поведения.
Тип урока: Урок открытия новых знаний
1. Организационный момент.
Учитель: Приветствие. Улыбнитесь друг другу, повернитесь друг к другу, улыбнитесь мне.
1) ОВР – окислительно –восстановительная реакция.
2) При восстановлении атомы, ионы отдают электроны.
3) При восстановлении степень окисления понижается.
4) Атомы, ионы, молекулы, отдающие электроны- это восстановители.
5) В задании 1 с.268 ОВР под буквами б и г
Проверьте свои ответы.
1) ОВР – это окислительно-восстановительная реакция. - да
2) При восстановлении атомы, ионы отдают электроны. -нет
3) При окислении степень окисления повышается. -нет
4) Атомы, ионы, молекулы, отдающие электроны- это восстановители. -да
5) В задании 1 с.268 ОВР под буквами б и г -да
Самопроверка. Учитель: Оцените себя
3. Постановка учебной проблемы.
NH 3 - восстановитель HNO 3 –окислитель NO – окислитель и восстановитель
Выдвижение гипотез учащимися.
Затруднение. (не могут ответить)
Формулировка проблемы: Как определить окислительно-восстановительные свойства веществ.
Цель: научиться определять окислительно-восстановительные свойства веществ.
Учитель: Как вы собираетесь решить проблему, каким способом?
Если мы не можем сами ответить на вопрос, какие источники информации нам помогут? (учебник, Интернет, справочники)
Откройте учебник на с. 267, прочитайте информацию (2Зная формулу вещества…) до («Восстановители..)
4. Первичное закрепление.
Один учащийся на доске приводит пример своего алгоритма, остальные сверяются с его решением и делают вывод о правильности или неправильности решения.
Запишите алгоритм в тетрадь.
1. Определить с.о. элемента
2. Оценить способность принимать или отдавать электроны.
3. Сделать вывод о свойствах вещества
NH 3 - восстановитель HNO 3 –окислитель NO – окислитель и восстановитель
Азот в аммиаке имеет с.о. -3, но не может больше принимать электроны, а только отдавать, поэтому св-ва восстановительные.
В азотной кислоте с.о. +5, не может больше отдавать, только принимает, поэтому окислитель.
В оксиде азота степень окисления промежуточная +2, может и принимать и отдавать, является окислителем и восстановителей.
5.Самостоятельная работа с самопроверкой.
Задание: Определите, какое вещество обладает только окислительными, только восстановительными, а какое и окислительными и восстановительными:
ок-ль вос-ль ок-ль и вос-ль )
Раз - подняться, подтянуться
Два - нагнуться, разогнуться
Три – в ладоши три хлопка,
Головою три кивка.
На четыре руки шире,
Пять- руками помахать,
Шесть – на место тихо сесть.
6. Включения в систему знаний и повторения
Железо образует 2 хлорида железа со с.о. железа +2 и +3.
Кто прав? Почему?
Как решить задачу?
Учитель: Чем являются металлы? (восстановителями) Значит, железо в обеих реакция будет восстановителем.
Учитель: А что является окислителем для первой реакции? (водород) а для второй? (хлор)
Составьте уравнения окисления для обеих реакций.
Для 1 уравнения: 2 H +1 +2 e → H 2 0 вос-е; ок-ль
Для 2 уравнения: Cl 2 0 + 2 e → 2 Cl -1 вос-е; ок-ль
Какой окислитель заберет у железа 3 электрона, а какой 2? Как определить? (в ряду ЭО водород находится левее хлора)
Озвучьте свое решение
Хлор более электроотрицательный, чем волород, поэтому будет принимать 3 электрона, а водород - 2 электрона.
Дописываем уравнения окисления железа и расставляем коэффициенты.
Fe 0 -2 e → Fe +2 ок-е; вос-ль 1
Fe 0 -3 e → Fe +3 ок-е; вос-ль 2
2 Fe + 3 Cl 2 → 2 FeCl 3
Итак, ответ: 1-б, 2-а.
Сравните своё решение с правильным. Чье решение было верным?
7. Домашнее задание: п. 44, учить определения, С. 269 зад. 7(а)
8. Рефлексия:
Сожмите пальцы в кулачок и разгибайте по одному :
Большой - если вы узнали на уроке что-то новое
Указательный – если этими знаниями вы будете пользоваться
Средний - если вам сегодня пригодились уже имеющиеся знания
Безымянный– если вы работали добросовестно
Мизинец – если вам понравился урок

Цель: актуализировать, систематизировать и углубить знания учащихся об окислительно–восстановительных реакциях; усвоение учащимися стандартного минимума знаний по теме.
Образовательные задачи:
- повторить основные понятия об окислении и восстановлении, степени окисления, окислителях и восстановителях, рассмотреть сущность окислительно-восстановительных реакций;
- совершенствовать умение учащихся выражать сущность окислительно–восстановительных реакций методом электронного баланса, закрепляя понятия процессов окисления, восстановления;
- дать представление о составлении ОВР электронно-ионным методом;
- рассмотреть классификацию окислительно–восстановительных реакций. Научить старшеклассников определять признаки, положенные в основу классификации окислительно–восстановительных реакций, и различать реакции межмолекулярные, внутримолекулярные, дисмутации;
- совершенствовать практические навыки при выполнении лабораторных опытов;
- познакомить учащихся с заданиями ЕГЭ, проверяющие данные элементы содержания.
Развивающие задачи:
- способствовать формированию и развитию познавательного интереса учащихся к предмету;
- формирование умений анализировать, сопоставлять, и обобщать знания по теме.
Воспитательные задачи:
- воспитание осознанной потребности в знаниях;
- развитие любознательности;
- воспитание активности и самостоятельности при изучении данной темы, умения слушать своих одноклассников.
Тип урока: комбинированный.
Оборудование и реактивы: растворы KMnO4, H2SO4, Na2SO3, КOH(конц). Пробирки лабораторные, спиртовка, пробиркодержатель, лучинка. ПСХЭ Д.И.Менделеева, персональный компьютер, медиапроектор.
Повторение и обобщение изученного ранее материала. Объяснение новой темы.
Форма организации работы с учащимися: фронтальная, индивидуальная
Методы обучения: частично - поисковый
Общий метод (частично – поисковый).
Частный метод (словесно – наглядно – практический).
Конкретный метод (объяснение с элементами беседы).
Организационный момент (cообщение темы, постановка цели и задач урока)
Актуализация знаний (учитель показывает значение окислительно-восстановительных реакций).
Окислительно-восстановительные реакции чрезвычайно распространены. Они играют огромную роль в процессах обмена веществ в живых организмах. С ними связано дыхание, гниение, брожение, фотосинтез. Окислительно-восстановительные реакции обеспечивают круговорот веществ в природе. Их можно наблюдать при сгорании топлива, коррозии и выплавке металлов. С их помощью получают щелочи, кислоты, соли, оксиды и многие другие важнейшие соединения, необходимые человечеству. Окислительно-восстановительные реакции лежат в основе преобразования энергии взаимодействующих химических веществ в электрическую энергию в аккумуляторах, гальванических элементах.
Повторение и обобщение изученного ранее материала
Учитель проецирует на экран демонстрационный вариант ЕГЭ по химии 2020 года. И организует беседу, направленную на актуализацию важнейших опорных знаний о степени окисления, понятий теории ОВР.
- Что такое степень окисления?
Степень окисления – это условный заряд атома химического элемента в соединении, вычисленный исходя из предположения, что оно состоит только из ионов. (Степень окисления может быть положительной, отрицательной или равняться нулю, что зависит от природы соответствующих соединений.)
- Вспомните алгоритм определения степени окисления химического элемента в неорганических соединениях.
(на примере выполнение задания №3 учащиеся вспоминают правила определения степени окисления элемента в неорганических соединениях)
Затем для закрепления умения определять степень окисления элементов по формулам соединений, учитель организует самостоятельную работу.
Самостоятельная работа (фронтальная письменная работа, 1 ученик выполняет задание у доски)
Задание 2
Учитель напоминает, что в сложном ионе алгебраическая сумма степеней окисления атомов равна заряду иона, и предлагает учащимся выполнить следующее задание.
Задание 3.
Определите степень окисления элементов в ионах: Cr2O , SO , P2O , NH , ClO , BrO , CrO , AsO , BrO .
№21. Установите соответствие между уравнением реакции и свойством элемента азота, которое он проявляет в этой реакции.
УРАВНЕНИЕ РЕАКЦИИ СВОЙСТВО АЗОТА
Б) 3СuO + 2NH3 = N2 + 3Cu + 3H2O 2) является восстановителем
В) 4NH3 + 5O2 = 4NО + 6H2O 3) является и окислителем,
Г) 6Li + N2 = 2Li3N и восстановителем
4) не проявляет окислительно-
Окислитель – частица, принимающая электроны.
Восстановитель – частица, отдающая электроны.
- Что называется процессом восстановления? Как изменяется степень окисления элемента при восстановлении?
Восстановление – процесс принятия электронов, при этом степень окисления элемента понижается.
- Что называется процессом окисления? Как изменяется степень окисления элемента при окислении?
Окисление - процесс отдачи электронов, при этом степень окисления элемента повышается.
Задание 4 .
(Учащиеся выполняют задание по вариантам, после выполнения – самопроверка с ответами, показанными учителем на экране).
Какие из перечисленных ниже процессов представляют собой: окисление (О), какие – восстановление (В)? Определите число отданных или принятых электронов.
Вариант I Вариант II Вариант III Вариант IV
Cl 2Cl -1 1. Se 0 →Se -2 1. 2H +1 →H 1. Fe 0 → Fe +3
S -2 → S 0 2. Cu +2 → Cu 0 2. Fe 0 → Fe +2 2. N +5 → N +3
Cs 0 → Cs +1 3. Cr 0 → Cr +3 3. Fe +2 → Fe +3 3. N +3 → N +5
Sn +2 → Sn +4 4. H → 2H +1 4. S +4 → S 0 4. Cu +2 → Cu 0
Fe +3 → Fe +2 5. 2O -2 → O 5. S +4 → S +6 5. Sn +4 → Sn +2
Ni 0 → Ni +2 6. Cr +6 → Cr +3 6. S 0 → S +4 6. H → 2H +1
Вариант I Вариант II Вариант III Вариант IV
О: 2,3,4,6 О: 3,4,5 О: 2,3,5,6 О: 1,3,6
В: 1,5 В: 1,2,6 В: 1,4 В: 2,4,6
В результате выполнения этой работы учитель предлагает учащимся сформулировать
Правила определения функции соединения в ОВР (записывают в тетрадь).
Если элемент проявляет в соединении высшую степень окисления, то это соединение может быть окислителем.
Если элемент проявляет в соединении низшую степень окисления, то это соединение может быть восстановителем.
Если элемент проявляет в соединении промежуточную степень окисления, то это соединение может быть как восстановителем, так и окислителем.
Задание 5.
Предскажите функции веществ в окислительно-восстановительных реакциях: H2SO4, SO2, S, H2S.
H2 O4 – окислитель, так как элемент сера проявляет в данном соединении высшую степень окисления (+6).
H2 - восстановитель, так как элемент сера проявляет в данном соединении низшую степень окисления (-2).
O2, - окислитель и восстановитель, так как элемент сера проявляет в данном соединении промежуточную степень окисления
Углубление и расширение знаний.
Учитель знакомит учащихся с некоторыми важнейшими восстановителями и окислителями, предлагает провести лабораторный опыт, предварительно вспомнив правила техники безопасности).
Важнейшие восстановители: HCl; HBr; NH3; H2S; MnSO4; из простых веществ – С, Н2, металлы.
Лабораторный опыт (инструкция для учащихся)
Опыт 1. Налейте в пробирку немного раствора KMnO4, добавьте к нему концентрированный раствор щелочи, затем раствор сульфита натрия и взболтайте. Что наблюдаете? Обратите внимание на изменение цвета раствора. Составьте схему проведенной реакции.
- Как уравнять данную реакцию? Как называются реакции, в которых степень окисления элементов изменяется?
- Окислительно-восстановительные реакции.
(Учитель демонстрирует на экран задание 30 и предлагает учащимся сравнить его со схемой составленной ими реакции)
Для выполнения заданий 30, 31 используйте следующий перечень веществ: сульфит натрия, гидрокарбонат аммония, перманганат калия, дихромат калия, серная кислота, гидроксид калия. Допустимо использование водных растворов этих веществ.
№30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает реакция с изменением цвета раствора. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель в этой реакции
- в отличие от заданий базового и повышенного уровня, выполнение которых основано на умении определять степени окисления элементов и знании ОВР, в заданиях высокого уровня предлагается составить достаточно сложное уравнение ОВР методом электронного баланса.
Составление уравнений окислительно-восстановительных реакций методом электронного баланса
- Метод основан на сравнении степеней окисления атомов в исходных веществах и продуктах реакции и на балансировании числа электронов, смещенных от восстановителя к окислителю. Применяется метод для составления уравнений реакций, протекающих в любых фазах. В этом универсальность и удобство метода.
Учитель предлагает учащимся рассмотреть алгоритм составления уравнений ОВР методом электронного баланса (приложение 1).
Учащиеся уравнивают схему реакции
S +4 - 2 → S +6 1 ок-ся, вос-тель
и выполняют следующий лабораторный опыт.
Лабораторный опыт (инструкция для учащихся)
Опыт 2. К 1-2 мл раствора KMnO4 добавьте воду и затем раствор сульфита натрия. Что наблюдаете? Как изменился цвет раствора? Составьте уравнение реакции методом электронного баланса.
S +4 - 2 → S +6 3 ок-ся, вос-тель
Опыт 3. К 1-2 мл раствора KMnO4 добавьте несколько капель серной кислоты, затем осторожно взбалтывая раствор сульфита натрия. Что наблюдаете? Обратите внимание на изменение цвета раствора. Составьте уравнение реакции методом электронного баланса.
S +4 - 2 → S +6 5 ок-ся, вос-тель
- Итак, при составлении уравнений реакций, мы использовали метод электронного баланса. Несмотря на его универсальность, он имеет недостатки. Так, при выражении сущности реакций, протекающих в растворах, не отражается существование реальных частиц. Поэтому, в случае очень сложных ОВР, когда участвуют в качестве окислителя и восстановителя не просто атомы или ионы, а частицы с определенным зарядом, используют электронно–ионный метод составления ОВР. Учащимся, которые при поступлении в вуз будут сдавать экзамен по химии, этот метод следует знать. При составлении ОВР таким методом обязательно знание среды ОВР (кислая, щелочная, нейтральная).
Электронно–ионный метод дает возможность в конечном итоге выйти практически сразу на все коэффициенты уравнения. Почему электронно–ионный? Так как большинство ОВР происходят в растворах, среда может быть щелочной, нейтральной, то все вещества в растворах находятся в виде катионов и анионов, т.к. прошла их диссоциация. В схеме баланса записываются не отдельные элементы, а катионы и анионы, в состав которых они входят. Вещества, которые не диссоциируют, записываются молекулярной формулой. Обязательно учитываются количество кислородных атомов в этих частицах и самое главное – среда. Если время урока позволяет, то учащимся можно показать этот метод на определенной ОВР.
Использованная литература:
- Настольная книга учителя химии. 8 класс. О.С. Габриелян, Н.П.Воскобойникова, А.В.Яшукова (М.:Дрофа). 2003г.
- ЭФУ Химия 8 класс. О.С. Габриелян, (М.:Дрофа).
- Рабочая тетрадь к учебнику О.С. Габриеляна Химия 8 класс. О.С. Габриелян, А.С. Сладков (М.:Дрофа-2013).
Цели урока:
- обучающие: познакомить учащихся с новой классификацией химических реакций по признаку изменения степеней окислений элементов – окислительно-восстановительными реакциями, повторить понятия “окислитель”, “восстановитель”, “окисление”, “восстановление”;
- развивающие: продолжить развитие логического мышления, формирование интереса к предмету, используя современные технологии в обучении.
- воспитательные: формировать научное мировоззрение обучающихся, формирование культуры межличностного общения: оценивать свою работу..
Средства обучения:
Учебник: ЭФУ Габриелян О.С. Химия.8 класс:– М.: Дрофа, 2015
Ход урока
1. Организационный этап
Подготовка обучающихся к работе на уроке. Правила работы и ТБ в смарт-классе при работе с ноутбуками
2. Актуализация знаний обучающихся
Работа по литературе 1:
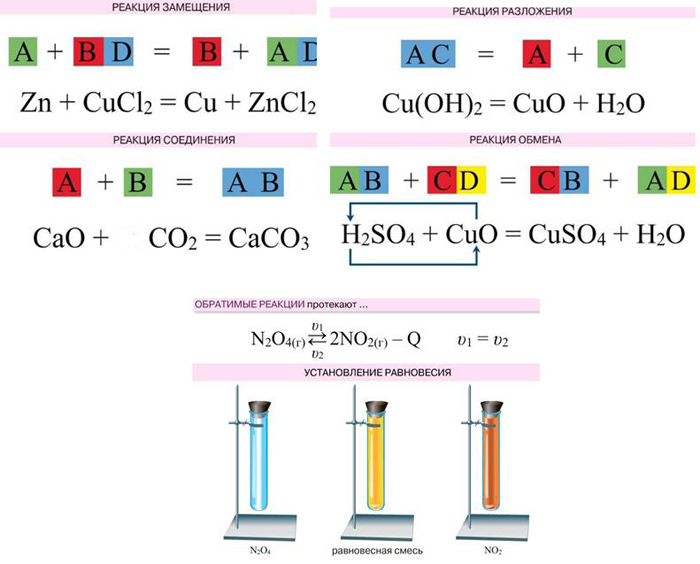
1. По типу и составу реагирующих и образующихся веществ бывают реакции:
а) соединения;
б) разложения;
в) замещения;
г) обмена (в том числе и реакция нейтрализации).
2. По агрегатному состоянию веществ (фазе) различают реакции:
а) гомогенные;
б) гетерогенные.
3. По тепловому эффекту реакции делятся на:
а) экзотермические (в том числе реакции горения);
б) эндотермические.
4. По использованию катализатора выделяют реакции:
а) каталитические (в том числе ферментативные);
б) некаталитические.
5. По направлению различают реакции:
а) обратимые;
б) необратимые.
Б) Дать полную характеристику реакции синтеза оксида серы(6) из оксида серы(4) и кислорода:
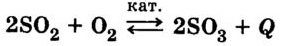
3. Усвоение новых знаний по ЭФУ
А) Вспомним что такое С.О. и как он меняется при ХР. (Повторение с последующей проверкой по средству обучения 2.)
Б) Объяснение материала по ЭФУ стр. 263–265.

В) Работа по электронному приложению ЭФУ.

Г) Работа по литературе 2

4. Первичное закрепление знаний
А) Обучающиеся выполняют задание. ЭЛЕКТРОННОГО ПРИЛОЖЕНИЯ

При затруднении используем стр. 264-265 ЭФУ.
Б) Выполнение задания по электронному приложению, нахождение окислителя, восстановителя, переход электронов, работа у доски.

При затруднении используем стр. 263 ЭФУ.
В) Выполнение интерактивных заданий по литературе 2




5. Первичная проверка понимания изученного

Б) Упр 2 по ЭФУ

ДЗ: изучить параграф 44 до стр.265, упр 3 стр. 269.
6. Рефлексия
Почему нужно изучать ОВР?
Окислительно-восстановительные реакции многообразны, они лежат в основе очень важных реакций: фотосинтез, дыхание, гниение, брожение, коррозия, электролиз, горение.
Читайте также:

