Охарактеризуйте явление аллотропии какие факторы его обуславливают кратко
Обновлено: 08.07.2024
Из нашей статьи вы узнаете, что такое аллотропия. Это понятие широко распространено в природе. К примеру, кислород и озон - это вещества, состоящие только из химического элемента оксигена. Как это возможно? Давайте разбираться вместе.
Определение понятия
Аллотропией называют явление существования одного химического элемента в виде двух или более простых веществ. Его открывателем по праву считается химик и минеролог из Швеции Йенс Берцелиус. Аллотропия - это явление, которое имеет много общего с полиморфизмом кристаллов. Это вызвало долгие споры среди ученых. В настоящее время они пришли к мнению, что полиморфизм характерен только для твердых простых веществ.
Причины аллотропии
Образовывать несколько простых веществ могут не все химические элементы. Способность к аллотропии обусловлена строением атома. Чаще всего она встречается у элементов, имеющих переменное значение степени окисления. К ним относятся полу- и неметаллы, инертные газы и галогены.
Аллотропия может быть обусловлена несколькими причинами. К ним относится разное количество атомов, порядок их соединения в молекулу, параллельность спинов электронов, тип кристаллической решетки. Рассмотрим данные виды аллотропии на конкретных примерах.
Кислород и озон
Данный вид аллотропии - пример того, как разное количество атомов одного химического элемента определяет физические и химические свойства вещества. Это касается и физиологического влияния на живые организмы. Так, кислород состоит из двух атомов оксигена, озон - из трех.
В чем же отличия этих веществ? Оба они газообразны. Кислород не имеет цвета, вкуса и запаха, он в полтора раза легче озона. Это вещество хорошо растворяется в воде, причем с понижением температуры скорость этого процесса только увеличивается. Кислород необходим всем организмам для дыхания. Поэтому это вещество является жизненно важным.
Озон имеет голубой цвет. Его характерный запах ощущал каждый из нас после дождя. Он резкий, но довольно приятный. По сравнению с кислородом, озон более химически активен. В чем же причина? При разложении озона образуется молекула кислорода и свободный атом оксигена. Он тут же вступает в реакции соединения, образуя новые вещества.
Удивительные свойства углерода
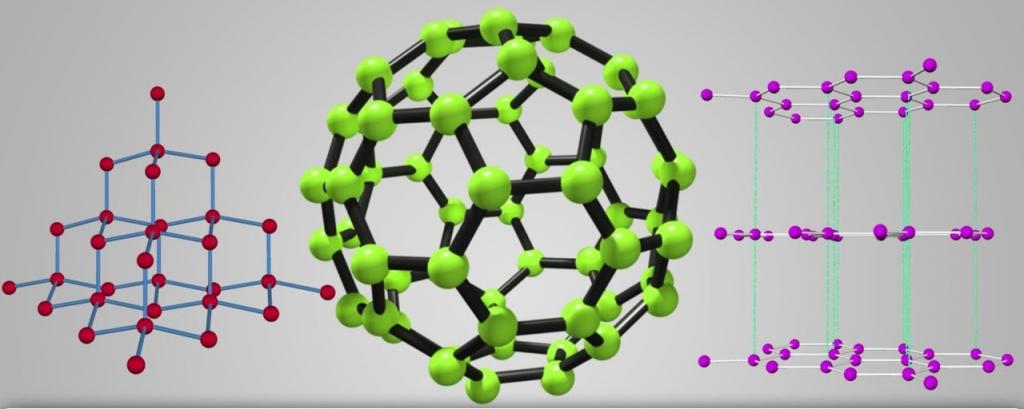
А вот количество атомов в молекуле углерода всегда остается неизменным. При этом он образует абсолютно разные вещества. Самыми распространенными модификациями углерода являются алмаз и графит. Первое вещество считается самым твердым на планете. Это свойство обусловлено тем, что атомы в алмазе связаны прочными ковалентными связями по всем направлениям. В совокупности они образуют трехмерную сеть из тетраэдров.

У графита прочные связи формируются только между атомами, расположенными в горизонтальной плоскости. По этой причине разломать графитовый стержень вдоль практически невозможно. А вот связи, которые соединяют горизонтальные слои углерода между собой, очень слабые. Поэтому каждый раз, когда мы проводим простым карандашом по бумаге, на ней остается серый след. Это и есть слой углерода.
Аллотропия серы
Причина модификаций серы также заключается в особенностях внутренней структуры молекул. Самой устойчивой формой является ромбическая. Кристаллы этого вида аллотропии серы называют ромбоидальными. Каждый из них образован коронообразными молекулами, в состав каждой из которой входит 8 атомов. По физическим свойствам ромбическая сера является твердым веществом желтого цвета. Она не только не растворяется в воде, но даже не смачивается ею. Показатели тепло- и электропроводности очень низкие.

Структура моноклинной серы представлена параллелепипедом со скошенными углами. Визуально это вещество напоминает иглы темно-желтого цвета. Если серу расплавить, а потом поместить в холодную воду, образуется ее новая модификация. Ее первоначальная структура разрушится до полимерных цепей разной длины. Так получают пластическую серу - резиноподобную массу коричневого цвета.
Модификации фосфора
Ученые насчитывают 11 видов фосфора. Его аллотропия была открыта практически случайно, как и само это вещество. В поисках философского камня алхимик Бранд получил светящуюся сухую субстанцию в результате выпаривания мочи. Это был белый фосфор. Данное вещество характеризуется большой химической активностью. Достаточно повышения температуры до 40 градусов, чтобы белый фосфор вступил в реакцию с кислородом и воспламенился.

Для фосфора причина аллотропии - это изменение в структуре кристаллической решетки. Изменить ее можно только при определенных условиях. Так, увеличив давление и температуру в атмосфере углекислого газа, получают красный фосфор. Химически он менее активен, поэтому для него не характерно свечение. При нагревании он превращается в пар. Мы наблюдаем это каждый раз, зажигая обычные спички. Терочная поверхность как раз содержит красный фосфор.
Итак, аллотропия - это существование одного химического элемента в виде нескольких простых веществ. Чаще всего встречается среди неметаллов. Основными причинами этого явления считаются разное количество атомов, образующих молекулу вещества, а также изменение конфигурации кристаллической решетки.
Листаю фотографии с лицами моих учеников. Сколько их, таких родных и любимых, стали докторами и сегодня спасают наши жизни. Тепло на сердце от мысли, что в каждом из них осталась и частица моей души. Задержала внимание на фото белокурой девочки, веселой и озорной непоседы. Юля Кучеренко - лучик солнца, выдумщица, быстро увлеклась решением задач по химии, разбирая их с особым азартом. Ее фраза "Даешь Белавина устно!" стала крылатой. Юля успевала везде - школа, репетитор по русскому языку, репетитор по химии и биологии, репетитор по английскому языку, конный спорт, любимая собака. Вечером, после занятий, она звонила маме с вопросом: "Мамуля, ты не забыла выпить лекарство?". Вот как описывала Юля Кучеренко нашу работу:
Валентина Георгиевна Богунова - лучший преподаватель в моей жизни! Объясню почему. В школе обучали плохо. Много читала и разбиралась сама, потому как знала - хочу стать врачом, и такие предметы, как биология и химия, мне крайне необходимы. За один учебный год Валентина Георгиевна разложила мне все знания "по полочкам". Все, что я знаю по этим предметам, это только благодаря моему любимому Учителю - Валентине Георгиевне! На ее занятиях было настолько интересно, что нам не хотелось уходить! Она - преподаватель, который действительно умеет слушать! Который объяснит, если ты что-то не понял, причем столько раз, сколько нужно тебе, пока не поймешь. Если бы не она, то я бы не поступила в медицинский. Плюс я обрела хороших друзей, с которыми мы до сих пор общаемся! Огромное ей спасибо! Никогда не забуду её.
Как сложилась судьба Юли Кучеренко, я раскажу в конце статьи, а пока пора продолжить наши занятия по химии.
Вещество - это однородный вид материи, каждая частица которого обладает одинаковыми физическими свойствами: агрегатное состояние, цвет, плотность, температура плавления и кипения, тепло- и электропроводность. Единичная частица вещества (молекула или атом) обладает химическими свойствами и может превращаться в другие вещества.
Простое вещество
Простые вещества состоят из атомов одного химического элемента (азот, кислород, водород, сера, медь, ртуть, железо и др.)
NB! Простые вещества, молекулы которых состоят из двух атомов:
1) Все простые газы (H2, O2, N2 и др.), кроме благородных газов (VIIIA-группа: He, Ne, Ar, Kr и др.)
2) Все галогены (F2, Cl2, Br2, I2)
Чем понятие "простое вещество" отличается от понятия "химический элемент"?
Вещество можно "пощупать" нашими органами чувств или с помощью приборов, поскольку оно обладает физическими свойствами. Так, простое вещество азот - бесцветный газ, без вкуса и запаха, абсолютно безвреден, немного легче воздуха, мало растворим в воде, температура плавления -210 °С, температура кипения -196 °С. Газообразный азот состоит из двухатомных молекул, между атомами в молекуле - тройная связь, поэтому молекула азота очень прочная, энергия химической связи составляет 945 кДж/моль.
Химический элемент - вид атомов с определенным зарядом ядра. Это абстрактное понятие, не обладающее физическими свойствами. Так, химический элемент азот находится во втором периоде, пятой группы главной подгруппы, порядковый номер – 7, относительная атомная масса Ar – 14,008. Атом азота имеет 7 электронов, из них 5 на внешнем уровне (5 валентных электронов). Азот - один из самых электроотрицательных элементов (3,04 по шкале Полинга), уступает только хлору (3.16), кислороду (3,44) и фтору (3,98).
Один и тот же элемент может образовывать разные простые вещества. Это явление называется аллотропией. Различные простые вещества, состоящие из атомов одного элемента, называются аллотропными модификациями.
Явление аллотропии может быть вызвано двумя причинами:
1. Разным числом атомов в молекуле
Молекула фосфора в газообразном состоянии состоит из четырех атомов (Р4), а при температуре выше 1400°С - из двух атомов (Р2).
Кислород имеет две аллотропные модификации — кислород О2 и озон О3.
2. Образованием различных кристаллических форм.
Фосфор образует несколько аллотропных модификаций - белый, черный и красный фосфор, структура, физические свойства и химическая активность которых сильно отличаются.
Углерод образует четыре аллотропные модификации - алмаз, графит, карбин и фуллерен.
NB! Аллотропные модификации имеют одинаковые химические свойства, но отличаются химической активностью.
Сложное вещество
Сложные вещества состоят из атомов разных химических элементов. Например, в состав воды Н2О входят атомы элементов водорода и кислорода.
Выполняю обещание. Итак, кем же стала моя ученица Юля Кучеренко? Сегодня Юля Чаплина (Кучеренко) - преуспевающая бизнес-леди с тремя высшими образованиями. Она замужем, является соучредителем замечательного хозяйства "Ферма Кулачево" , производящего экологически чистую и очень вкусную продукцию, которая пользуется огромным спросом.
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте, или на Facebook. Я обязательно отвечу вам.

Явление аллотропии обусловлено либо различным составом молекул простого вещества (аллотропия состава), либо способом размещения атомов или молекул в кристаллической решётке (аллотропия формы).
Содержание
История
Понятие аллотропии введено в науку Й. Берцелиусом в 1841 году для обозначения разных форм существования элементов; одновременно он предполагал, по-видимому, применить его и к изомерии соединений. После принятия гипотезы А. Авогадро в 1860 году стало понятно, что элементы могут существовать в виде многоатомных молекул, например, О2 — кислород и О3 — озон.
В начале XX века было признано, что различия в кристаллической структуре простых веществ (например, углерода или фосфора) также являются причиной аллотропии. В 1912 году В. Оствальд отметил, что аллотропия элементов является просто частным случаем полиморфизма кристаллов, и предложил от него отказаться. Однако, по настоящее время они используются параллельно. Аллотропия относится только к простым веществам, независимо от их агрегатного состояния; полиморфизм — только к твёрдому состоянию независимо от того, простое это вещество или сложное. Таким образом, эти термины совпадают для простых твёрдых веществ (кристаллическая сера, фосфор, железо и др.) [1] .
Примеры аллотропии


В настоящее время известно более 400 разновидностей простых веществ. Способность элемента к образованию аллотропных форм обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов.
Как правило, большее число аллотропных форм образуют элементы, имеющие переменные значения координационного числа или степени окисления (олово, фосфор). Другим важным фактором является катенация — способность атомов элемента образовывать гомоцепные структуры (например, сера). Склонность к аллотропии более выражена у неметаллов, за исключением галогенов и благородных газов, и полуметаллов.
Принято обозначать различные аллотропические формы одного и того же элемента строчными буквами греческого алфавита; причём форму, существующую при самых низких температурах, обозначают буквой α, следующую — β и т. д.
Неметаллы
Водород может существовать в виде орто- и пара-водорода. В молекуле орто-водорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины параллельны, а у пара-водорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — антипараллельны.
Множество модификаций: алмаз, графит, фуллерен, карбин, графен, углеродные нанотрубки, лонсдейлит и др. Точное число модификаций указать затруднительно вследствие разнообразия форм связывания атомов углерода между собой. Наиболее многочисленны молекулярные структуры фуллеренов и нанотрубок.
Известно 11 аллотропных модификаций фосфора. Основные модификации: белый, красный и чёрный фосфор. Белый фосфор ядовит, светится в темноте, способен самовоспламеняться, красный фосфор не ядовит, не светится в темноте, сам по себе не воспламеняется.
Две аллотропные модификации: О2 — кислород и О3 — озон. Кислород бесцветен, не имеет запаха; озон имеет выраженный запах, имеет бледно-фиолетовый цвет, он более бактерициден.
Большое число аллотропных модификаций, второе место после углерода. Основные модификации: ромбическая, моноклинная и пластическая сера.
Красный цикло-Se8, серый полимер Se и чёрный селен.
Полуметаллы
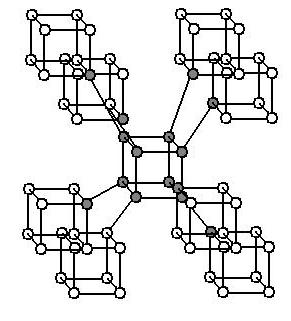
Бор существует в аморфном и кристаллическом видах. Аморфный бор – порошок бурого цвета. Обладает большей реакционной способностью, чем кристаллический бор. Кристаллический бор – вещество черного цвета. Известно более 10 аллотропных модификаций бора, которые кристаллизуются в ромбической и тетрагональной сингониях. Наиболее устойчивая модификация – β-ромбический бор – состоит из икосаэдров B12, которые образуют слои, объединенные в бесконечную структуру.
Различают две основные аллотропные модификации кремния - аморфную и кристаллическую. Решётка кристаллической модификации кремния - атомная, алмазоподобная. Также выделяют поликристаллический и монокристаллический кремний.
Три основные аллотропные модификации: жёлтый мышьяк (неметалл, состоящий из молекул As4 - структура, аналогичная белому фосфору), серый мышьяк (полуметаллический полимер), чёрный мышьяк (неметаллическая молекулярная структура, аналогичная красному фосфору).
Две аллотропные модификации: α-Ge - полуметалл с алмазоподобной кристаллической решёткой и β-Ge - с металлической структурой, аналогичной β-Sn.
Известны четыре металлических аллотропных модификаций сурьмы, существующих при различных давлениях, и три аморфные модификации (взрывчатая, чёрная и жёлтая сурьма), из которых наиболее устойчива металлическая форма серебристо-белого цвета с синеватым оттенком
Полоний существует в двух аллотропных металлических модификациях. Кристаллы одной из них – низкотемпературной – имеют кубическую решетку (α-Po), а другой – высокотемпературной – ромбическую (β-Po). Фазовый переход из одной формы в другую происходит при 36 °C, однако при обычных условиях полоний находится в высокотемпературной форме вследствие разогрева собственным радиоактивным излучением.
Металлы
Среди металлов, которые встречаются в природе в больших количествах (до U, без Tc и Pm), 28 имеют аллотропные формы при атмосферном давлении: Li, Be, Na, Ca, Sc, Ti, Mn, Fe, Co, Sr, Y, Zr, Sn, La, Ce, Pr, Nd, Sm, Gd, Tb, Dy, Yb, Hf, Tl, Th, Pa, U. Также важны аллотропные формы ряда металлов, образующиеся при их технологической обработке: Ti при 882˚C, Fe при 912˚C и 1394˚C, Co при 422˚C, Zr при 863˚C, Sn при 13˚C и U при 668˚C и 776˚C.
Олово существует в трех аллотропных модификациях. Серое олово (α-Sn) мелкокристаллический порошок, полупроводник, имеющий алмазоподобную кристаллическую решётку, существует при температуре ниже 13,2 °С. Белое олово (β-Sn) - пластичный серебристый металл, устойчивый в интервале температур 13,2—161 °С. Высокотемпературное гамма-олово (γ-Sn), имеющее ромбическую структуру, отличается высокой плотностью и хрупкостью, устойчиво между 161 и 232 °С (температура плавления чистого олова).
Энантиотропные и монотропные переходы


Переход одной аллотропной модификации в другую происходит при изменении температуры или давления (или одновременном воздействии обоих факторов) и связан со скачкообразным изменением свойств вещества. Этот процесс бывает обратимым (энантиотропным) и необратимым (монотропным).
Примером энантиотропного перехода может служить превращение ромбической серы в моноклинную α-S (ромб.) ↔ β-S (монокл.) при 95,6 °C. При обычной температуре стабильной является ромбическая модификация серы, которая при нагревании до 95,6 °С при нормальной давлении переходит в моноклинную форму. Последняя при охлаждении ниже 95,6 °С вновь переходит в ромбическую форму.
К монотропному переходу относится превращение белого фосфора P4 под давление 1,25 ГПа и температуре 200 °C в более стабильную модификацию — чёрный фосфор. При возвращении к обычным условиям обратный переход не происходит. Переход из нестабильной формы в стабильную в принципе возможен при любой температуре, а обратный — нет, то есть определенная точка перехода отсутствует. Еще один пример — превращение графита в алмаз при давлении 6 ГПа и температуре 1500 °C в присутствии катализатора (никель, хром, железо и другие металлы). В обоих случаях давление способствует превращению, поскольку образуется вещества с более высокой плотностью, чем исходные.

Аллотропные модификации (аллотропные видоизменения) – простые вещества, образованные одним химическим элементом, но имеющие различное строение и свойства.
*Цитирирование задания со ссылкой на учебник производится исключительно в учебных целях для лучшего понимания разбора решения задания.
Похожие решебники
Популярные решебники 11 класс Все решебники

Главная задача сайта: помогать школьникам и родителям в решении домашнего задания. Кроме того, весь материал совершенствуется, добавляются новые сборники решений.
Химия изучает свойства и строение простых веществ. В большинстве своем они остаются неизменными в любых ситуациях. Однако есть ряд элементов, способных менять свои свойства в различных своих состояниях. Такое явление называется аллотропией. Знание о поведении элементов, подверженных аллотропии, расширяет понимание устройства мира и поведения в нем веществ и элементов.
Определение
Аллотропия - это возможность элемента трансформироваться в другой. В некоторых случаях даже в два или три. Если переводить название термина с греческого языка, то аллотропия - это "другое свойство". То есть буквальный перевод раскрывает сущность явления.
Виды аллотропии

Аллотропия, свойственная некоторым веществам, условно делится на два вида - по составу и по строению. В первом случае различно число атомов в молекуле. Во втором - строение кристаллической решетки.
В химии аллотропия - это изменение вещества независимо от того, жидкое оно, твердое или газообразное. Единственное отступление от терминологии появляется в работе с твердыми веществами, их строение сложнее, для их трансформации используется слово "полиморфизм", в переводе с греческого означающее "многообразный".
Каким веществам свойственна аллотропия
Не все вещества способны преобразоваться из сложных в простые даже под действием температур или других воздействий. Это может происходить только с теми из них, у которых есть способность к образованию гомоцепных структур или хорошо окисляющихся. Именно поэтому аллотропия веществ свойственна неметаллам. Хотя справедливости ради следует сказать, что есть металлы, способные преобразовываться в простые элементы, но это, скорее, полуметаллы.
Примеры аллотропии
Для понимания процесса существует ряд примеров преобразования вещества, причем оно бывает обратимым и необратимым. То есть вещество может после воздействия на него температуры или давления вернуться к первоначальному состоянию. Но бывает так, что оно остается в видоизмененном состоянии. Например, ромбическая сера - при нагревании ее до температуры 95,5 градуса по Цельсию она преобразуется в моноклинную форму. При снижении температуры до 95,5 градуса наступает обратное преобразование - из моноклинной формы в ромбическую.
Другой пример аллотропии - это изменение белого фосфора в черный. В данном случае для проведения преобразования требуется температура в 200 градусов по Цельсию и давление в 1,25 г Па. При воздействии тех же температур и давления на преобразованный черный фосфор он не сможет вернуться к первоначальному состоянию.
Как уже упоминалось, явление аллотропии свойственно и некоторым металлам. Но из-за сложности их структуры переходы из одного в другое состояние могут чередоваться. Например, в нормальных условиях белое олово является пластичным металлом, но при нагревании его при температуре 173 градуса по Цельсию оно перестраивает свою кристаллическую решетку до очень хрупкого состояния, а при снижении температуры до 13 градусов кристаллическая решетка принимает вид кубической алмазоподобной и делает вещество порошкообразным.
Модификации неметаллов

Самыми яркими и многообразными физическими свойствами аллотропии обладает углерод. Он способен перерождаться в самое большое количество аллотропных форм, причем с различными не только свойствами, но и строением кристаллической решетки. Взять, например, графит и алмаз. Формы одного вещества, но с разными строениями кристаллических решеток – графит чуть плотнее порошка, а алмаз - самое крепкое вещество на земле. И это уже не говоря об углеродных нанотрубках, лонсдейлите, фуллерене, карбине и других формах углерода.
Аллотропия характерна для серы. В нормальных условиях структура вещества моноклинная, а под воздействием температур может преобразоваться в пластическую и следом за этим в ромбовидную.
Фосфор способен изменяться в 11 форм. Причем 3 из них - белый, черный, красный - даже встречаются в природе, остальные можно получить искусственным путем. Отличается одна форма вещества от другой количеством атомов в молекуле. Различными цветами в химии представлен селен. Он также бывает серный, черный и красный.
Очень известная аллотропия - это кислород. Он видоизменяется до озона под действием температуры или электрического тока. Известный пример природного воздействия – молния. Во время разряда электрического поля кислород превращается в озон.
Модификации полуметаллов

Бор - это полуметалл, встречающийся в природе в аморфной и кристаллической форме. Но у него есть еще 10 известных науке форм.
Аморфным и кристаллическим бывает кремний. Сурьма в четырех формах по своей структуре представляется металлом, и в трех она аморфная, аллотропная.
Как и в случае с фосфором или селеном, мышьяк бывает серый или черный, в зависимости от формы – полимер или неметаллическая структура.
Модификации металлов

Самым широким спектром форм среди металлов обладает железо. В первом виде феррита, с характерной объемно-центрированной кубической кристаллической решеткой, железо способно существовать в температурных пределах от 0 до 769 градусов по Цельсию. Имеет свойства ферромагнетиков.
Второй тип феррита существует при температурах в диапазоне 769-917 градусов по Цельсию. Отличается объемно-центрированной кубической кристаллической решеткой. Магнетические свойства проявляет как парамагнетик.
Третий тип железа называется аустенит, характерен гранецентрированной кубической кристаллической решеткой. Способен существовать только при температурах от 917 до 1394 градусов по Цельсию. Магнитных свойств не имеет.
Четвертый тип железа возникает при температурах свыше 1397 градусов по Цельсию. Магнитных свойств не имеет, характерен объемно-центрированной кубической кристаллической решеткой.
Другой металл, имеющий несколько типов преобразования, - это олово. В аллотропной форме может существовать в виде порошка с кристаллической решеткой, подобной алмазной. Это так называемое серое олово. Есть и более привычная форма металла – белое олово. Оно встречается в виде пластичного метала серебряного цвета. Третья форма характерна тугоплавкостью, так как обладает ромбической кристаллической решеткой, называется она гамма-оловом.
Заключение

Все металлы, полуметаллы и неметаллы различных аллотропных типов с характерным строением кристаллических решеток, массой, количеством и зарядом протонов и нейтронов могут встречаться в природе в чистом, натуральном виде или получаются только в лаборатории. В обычных условиях они не сохраняют своей стабильности. Все это говорит о многообразии химических элементов и перспективах открытий новых доселе неизвестных науке форм и типов веществ. Такие исследования ведут к развитию всех отраслей жизнедеятельности человека.
Читайте также:

