Можно ли в оптический микроскоп увидеть вирус почему биология 10 класс кратко
Обновлено: 02.07.2024
Ученые из Манчестера создали самый мощный оптический микроскоп в мире, который поможет разобраться в причине возникновения многих вирусных заболеваний.
Предельное разрешение обычного оптического микроскопа – около 200 нанометров в видимом спектре - ограничено явлением дифракции Фраунгофера на линзе. Свет не распространяется строго прямолинейно, и если размеры предмета сравнимы с длиной световой волны, то он огибает предметы, и изображения получаются нечеткими.
Новый метод, объясняют руководители исследования Лин Ли (Lin Li) и Цзень Бо Ван (Zengbo Wang), теоретически не имеет ограничений по размеру деталей, которые можно разглядеть в такой микроскоп. Он сможет произвести революцию в биомедицине и позволит заглянуть внутрь клетки, наблюдая за живыми вирусами напрямую.
Научная картина мира — это система представлений человека о свойствах и закономерностях реально существующего мира, построенная в результате обобщения научных знаний и принципов.
В процессе развития науки происходит постоянное обновление знаний, идей и концепций, более ранние представления становятся частными случаями новых теорий. Научная картина мира не догма и не абсолютная истина. Научные представления об окружающем мире основаны на всей совокупности доказанных фактов и установленных причинно — следственных связей, что позволяет с определённой степенью уверенности делать способствующие развитию человеческой цивилизации заключения и прогнозы о свойствах нашего мира. Несоответствие результатов проверки теории, гипотезе, концепции, выявление новых фактов — всё это заставляет пересматривать имеющиеся представления и создавать новые, более соответствующие реальности. Поэтому формирование научной картины мира зависит от конкретного учёного или коллектива научных сотрудников, занимающихся изучением какой — либо научной проблемы.
Вопрос 2. Какие организмы среди представителей различных групп (царств) живых существ являются одноклеточными?
Среди эукариот одноклеточное строение имеют простейшие (царство Животные). Насчитывается около 40 тысяч видов одноклеточных животных (например, амёба, эвглена зеленая, инфузория — туфелька).
Одноклеточные грибы систематизированы в 4 основных классах: дейтеромицеты; хитридиомицеты; зигомицеты; аскомицеты. Ярким примером аскомицетов служат дрожжи. А одноклеточный гриб фитофтора поражает живые листья и клубни картофеля, листья и плоды томатов.
Типичным представителем низших одноклеточных растений, часто встречающихся в природе, являются водоросли: хламидомонада, хлорелла, спирогира, хлорококк, вольвокс.
Вопрос 3. Какие клетки в организме человека имеют длинные отростки и для чего эти отростки нужны?
Клетки нервной ткани — нейроны — имеют длинные отростки (аксоны). По аксону импульсы идут от тела клетки нейрона и могут передаваться на большие расстояния.
Эти отростки нужны для передачи информации различным нейронам, мышцам и железам. Информация, в виде электрического тока, достигнув окончания аксона, который уже входит в структуру синапса, обуславливает выделение медиатора — непосредственного передатчика возбуждения к другому нейрону или исполнительному органу (мышцам, железам).
Вопрос 4. Можно ли в оптический микроскоп увидеть вирус? Почему?
Величина вирусов варьирует от 20 до 300 нм (1 нм = 10 — 9 м). Практически все вирусы по своим размерам мельче, чем бактерии.
Современные световые микроскопы способны увеличить изучаемый объект в 2000—2500 раз. Эти приборы применяются в цитологии очень широко, но не позволяют изучать объекты размером менее длины световой волны (400—800 нм) — ограничено явлением дифракции Фраунгофера на линзе. Дело в том, что световая волна не может быть отражена очень маленьким предметом, из — за того что она просто огибает его.
Поэтому вирусы можно увидеть только в электронный микроскоп увеличение от 5 тыс. раз до 100тыс.
Вопрос 5. Можно ли в электронный микроскоп увидеть бактерию?
Вопрос 6. От чего зависят размеры и особенности строения клетки? Чьи клетки крупнее: кашалота или дельфина?
Для растений размеры клеток зависят от тургора и от размеров вакуолей в клетке. Для животных связь размер клетки связан главным образом с функцией, выполняемой ею. Скажем, задача эритроцитов проста — переносить кислород, лейкоцитов сложнее — борьба с инородными клетками; лейкоциты больше в размерах.
Особенности строения клеток зависят от функций, которые они выполняют.
Я думаю, что размер клеток кашалота и дельфина одинаковы.
Вопрос 7. Какие методы изучения клетки вы знаете?
1. Метод световой микроскопии. Разновидности световой микроскопии: фазово — контрастный, флеристцентная и поляризационная микроскопия.
2.Метод электронной микроскопии. Методы изучения фиксированных клеток.
3.Гистологические методы. Методы фиксации, приготовления препаратов с последующей их окраской.
4.Цитохимические методы — это избирательное окрашивание различных химических элементов (компонентов) клетки (ДНК, белок…).
5.Морфологические методы — это количественный метод, изучающий параметры основных клеточных структур.
6.Метод меченых изотопов. Используют тяжелые атомы углерода или водорода. Эти меченые атомы включают в предшественники синтеза определенных молекул. Например: при синтезе ДНК используют меченый тимидин Н3 — предшественник тимина.
7.Для обнаружения метки в цитологии используют метод авторадиографии. Изготавливают гистологические препараты и покрывают их фотоэмульсией в темноте, определенное время выдерживают при определенной температуре, затем препараты проявляют с использованием фотореактивов, при этом метка выявляется в виде зерен серебра.
8.Метод фракционирования клеток позволяет изучать внутриклеточные компоненты. Разрушают клетки, помещают их в специальные центрифуги, и разные клеточные компоненты осаждаются при разной скорости цинтрифугирования.
9.Метод рентгеноструктурного анализа используют для изучения кристаллической решетки ядра атома.
Методы изучения живых клеток.
10.Метод клеточных структур позволяет изучать живую клетку.
11.Метод микрохирургии. Например: вживление микроэлектрода.
Вопрос 8. Докажите, что клетка является системой.
Клетка является системой потому, что она:
1. Состоит из взаимодействующих и взаимосвязанных между собой элементов — мембраны, ядра, цитоплазмы, различных органелл и других клеточных структур — ресничек, микротрубочек.
2. Клетка обладает свойствами, которыми не обладают ее отдельные части.
3. Способна к метаболизму с окружающей средой, ибо в клетке постоянно происходят процессы синтеза и распада.
4. Клетка способна к саморегуляции — т.е. поддержанию гомеостаза.
5. В клетке происходят контролируемые на генетическом уровне процессы роста, размножения и развития.
Вопрос 9. Используя доступные источники информации, подготовьте презентацию о развитии представлений о клеточном строении живых организмов.
. (используйте эту информацию, её можно в краткой форме разбить на слайды, добавить картинок по теме).
Взгляды ученых о клеточном строении клетки неоднократно менялись. Развитие представлений о клеточном строении живых организмов условно можно разделить на 5 этапов.
1. В 1665 году, рассматривая под микроскопом срез пробки, английский физик Р.Гук обнаружил, что она состоит из ячеек, разделенных перегородками. Эти ячейки он назвал "клетками". Таким образом, его можно считать первооткрывателем клетки.
2. Лишь в XIX в. ученые обратили внимание на полужидкое студенистое содержимое, заполняющее клетку. К началу XIX в., после того как появились хорошие микроскопы, были разработаны методы фиксации и окраски клеток, представления о клеточном строении организмов получили общее признание.
Этот этап развития представлений о микроструктуре организмов связан с именами Линка и Рудольфи (1804), Тревирануса (1807—1821), Мейена (1830), в 1831 году Роберт Броун описывает ядро и высказывает предположение, что оно является постоянной составной частью растительной клетки и др. Этими исследователями, во — первых, было показано, что каждая ячейка — клетка покрыта своей особой оболочкой и потому клетка отделима от других ей подобных; во — вторых, было констатировано наличие клеточного содержимого, обладающего самостоятельной подвижностью. Наряду с клетками как элементарные структуры рассматривали также волоконца и сосуды растений; их клеточное строение, клеточный генез оставались неизвестны.
3. По мере совершенствования инструментальной базы и техники микроскопических исследований клеточного строения организмов, было признано, что наличие клеток представляет собой общую структурную черту биологической организации. Этот период клеточного учения является переломным. Клеточное строение организмов наблюдали многие исследователи. Наиболее обстоятельные описания клеточных структур в XIX в. дали Я. Пуркинье и М. Шлейден. Прежде всего, как обязательный элемент рассматриваются ядро и ядрышко, возникающие путем агломерации элементарных зернышек. В 1838 г. немецкий ботаник М. Шлейден доказал, что в любой растительной клетке есть ядро. Немецкий зоолог Т.Шванн в большом разнообразии клеток увидел их общность, их единый план строения. Он создал теорию, утверждающую, что клетки, содержащие ядра, представляют собой структурную и функциональную основу всех живых существ. Основные положения клеточной теории были сформулированы М. Шлейденом и Т. Шванном в 1838 — 1839 году, а затем были дополнены Р. Вирховым в1859 году.
Современная клеточная теория включает в себя 4 основных положения:
1. Клетка — элементарная структурно — функциональная единица всех живых организмов.
2. Клетки растений и животных сходны по своему строению и функциям.
3. Клетки возникают путём деления материнской клетки.
4. Клетки участвуют в формировании многоклеточного организма.
В этом периоде впервые формулируется клеточная теория, основным моментом которой является принцип общности клеткообразования во всех частях живой материи. Способ клеткообразования из сливающихся зернышек признается всеобщим, а отсюда постулируется уже сравнимость всех клеток, как растений, так и животных. Основными элементами всех клеток признаются: оболочка, протоплазма и ядро с ядрышком. Итак, все живые существа, согласно этим воззрениям, состоят из клеток или их производных, но сами клетки возникают из зернышек первично — бесструктурной массы.
5. В этом периоде существовало направление, пытавшееся разложить клетку на еще более простые живые элементы, сопоставлявшиеся и даже гомологизировавшиеся с бактериями. Этот взгляд развивался рядом французских ученых (Бешан, 1860—1883 гг. и др.) и затем (казалось, в особенно убедительной форме) Альтманом (1890—1894). Достаточных доказательств эта точка зрения, однако, не получила. Тем не менее, сходные взгляды в той или иной форме всплывают и до самого последнего времени (Иван Валлин, 1926).
6. Шестым этапом в изучении клетки условно можно назвать схему, предложенную Вильсоном (1896—1925) в его известной сводке. Она по существу стремится лишь свести все наши сведения о морфологических структурах клетки, не внося никакой принципиально новой точки зрения.
7. Это схема, которая основана на современных исследованиях о природе протоплазмы, ядра и различных включений клетки, а также их взаимодействия. Основная сущность этой схемы заключается в том, что структуру клетки мы себе представляем исключительно сложной, несмотря на то, что при применении даже наилучших световых микроскопических объективов субстанция протоплазмы (цитоплазма и ядро) представляется нам гомогенной. Современная методика морфологического исследования клетки, в связи с освоением электронной микроскопии, находится на большой высоте; хуже разработаны гистохимические методы.
Итак, современная схема строения клетки в известной мере сходна с представлениями Дюжардена (1835), Гофмейстера (1867) и др., которые также писали о гомогенности протоплазмы. Говоря о схеме строения клетки, мы и теперь должны по существу ограничиваться лишь очень немногим; мы указываем, что клетка состоит из протоплазмы, одетой тонкой мембраной. В протоплазме мы постоянно обнаруживаем хондриосомы, а также постоянное присутствие ядра. Электронная микроскопия обнаружила в протоплазме еще так называемый ретикулум, рибосомы и некоторые другие мембранные структуры. О более тонком строении ядра мы еще ничего не узнали.
Другими словами, клетка лишь внешне представляется нам просто организованной системой, тогда как ее внутренняя, интимная структура лежит за пределами видимости и нашего понимания. К этому убеждению современная цитология пришла в результате исследований целой плеяды ученых на протяжении последних 100 лет. Исследования, проведенные при использовании электронного микроскопа, ныне это подтвердили и внесли много нового, но клетка осталась клеткой, и никаких более простых и мелких полноценных живых структур не найдено.
В заключение необходимо еще раз подчеркнуть, что меньше всего мы знаем о возникновении клеток. Эта проблема практически совпадает с вопросом о возникновении жизни из неживой материи. Впервые данный вопрос был поставлен Геккелем в 1866 г., но он пока остается целиком в области гипотез.
Вопрос 10. От чего зависит выбор методов в процессе проведения исследования?
От размеров клетки, от предмета исследования (ДНК, органоиды…). Т.е. в зависимости от того, что Вы хотите узнать о данной клетке, выбирается подходящий метод исследования или комплекс исследований.
Вопрос 11. Могут ли существовать в природе настолько маленькие клетки, что их невозможно различить в современные микроскопы?
Скорее всего, не существуют. А если и существуют, то мы об этом не знаем, поэтому и не рассматриваем их в микроскопы. Если бы мы знали о таких клеточках, то, в разработанный учеными из Корнеллского Университета микроскоп, мы их точно увидели бы. Этот новый вид электронного микроскопа позволяет увидеть атомы в живых клетках, не повреждая их .
Сами вирусы увидеть нельзя. На практике смотрят на другое: культуры клеток заражённых вирусом иногда изменяются очень характерно для этого вируса и это можно увидеть в обычный микроскоп.
Мы постоянно добавляем новый функционал в основной интерфейс проекта. К сожалению, старые браузеры не в состоянии качественно работать с современными программными продуктами. Для корректной работы используйте последние версии браузеров Chrome, Mozilla Firefox, Opera, Microsoft Edge или установите браузер Atom.
Относящийся к данному классу атомно-силовой микроскоп оказался инструментом, подходящим для исследования биологических объектов и позволил не только визуализировать наноразмерные структуры, но и манипулировать ими. В частности, принципиально возможной оказалась манипуляция одиночными вирионами и прямое измерение сил, возникающих при их контакте с поверхностью клетки. Такие эксперименты позволяют получать подробные данные о самом первом и во многих случаях еще недостаточно исследованном этапе заражения клетки — адгезии вируса к ее поверхности. Данные исследования представляют и значительный практический интерес, т.к. могут дать ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
Об авторе
Вирусы являются чрезвычайно малыми объектами — их размеры лежат в диапазоне от нескольких десятков до нескольких сотен нанометров. Первым и на долгое время единственным методом прямой визуализации наноразмерных частиц стала электронная микроскопия (ЭМ), которая начала развиваться в 1930-е гг. Метод, оказавшийся очень информативным, позволил не только детально охарактеризовать структуру различных вирусов, но и исследовать процессы, происходящие в зараженной клетке.
Оказалось, что форма вирусных частиц отличается большим разнообразием: от правильных сфер до сложных структур, напоминающих кирпичи, обклеенные трубочками (вирус натуральной оспы), или щетинистых червей (вирус геморрагической лихорадки Эбола).
Вне клетки любой вирус является всего лишь молекулярным контейнером с генетическим материалом (ДНК или РНК) и вряд ли может считаться полноценным живым организмом, хотя по этому вопросу в научной среде до сих пор нет окончательной терминологической определенности.
Так, исследование репликации вируса методом просвечивающей электронной микроскопии на ультратонких срезах выглядит следующим образом: зараженные клетки обрабатывают фиксирующим раствором, обезвоживают спиртом и заливают специальной смолой. После отвердевания смолы с помощью специального прибора — ультратома — делают ультратонкие (≈ 50 нм) срезы, которые затем наносят на специальную сетку и обрабатывают растворами солей тяжелых металлов. Во время самого микроскопического исследования образец находится в вакуумной камере и подвергается действию пучка электронов с энергией в несколько десятков кэВ. Очевидно, что прижизненная визуализация в данном случае принципиально невозможна.
В течение почти полувека электронная микроскопия оставалась единственным методом визуализации наноразмерных объектов. Однако в начале 1980-х гг. эта монополия была нарушена появлением сканирующей зондовой микроскопии (СЗМ). Основным принципом СЗМ является сканирование — прецизионное (с высокой точностью) перемещение зонда вблизи исследуемой поверхности, сопряженное с отслеживанием определенного параметра, характеризующего взаимодействие между зондом и образцом. Результатом такого сканирования является топографическая карта рельефа поверхности образца.
Первым прибором СЗМ стал сканирующий туннельный микроскоп (СТМ), который мог лишь весьма ограниченно использоваться для визуализации биологических объектов, так как для его работы требовалась высокая электрическая проводимость исследуемой поверхности.
В 1986 г. швейцарский физик Г. Бинниг и его коллеги создали новый прибор семейства СЗМ — атомно-силовой микроскоп (АСМ). В основе его работы лежит силовое (Ван-дер-Ваальсово) взаимодействие атомов зонда и поверхности. АСМ не требуется электрическая проводимость поверхности образца, и он может осуществлять съемку в жидкой среде. Поэтому этот прибор оказался удобным инструментом для исследования биологических объектов.
Принципиальная схема работы атомно-силового микроскопа (АСМ). Чувствительным элементом АСМ является упругая консоль (кантилевер), на конце которой закреплен острый зонд. Силы, возникающие между атомами острия зонда и исследуемой поверхностью приводят к деформации кантилевера, которая в свою очередь фиксируется при помощи оптической системы, реализованной в большинстве современных АСМ на основе полупроводникового лазера и четырехсекционного фотоприемника. Размер кантилевера — 100÷300 × 20÷40 мкм при толщине около 2 мкм. Высота зонда — около 10 мкм
С момента появления атомно-силового микроскопа было опубликовано огромное число работ, посвященных АСМ-визуализации самых разнообразных биологических образцов. Следует все же признать, что в большинстве случаев в плане визуализации АСМ не дает ничего принципиально нового в сравнении с обычной электронной микроскопией, поэтому зачастую данный метод воспринимается биологами как техническая экзотика, а не как полноценный исследовательский инструмент.
Однако важнейшим, пусть и почти единственным преимуществом визуализации биологических объектов при помощи АСМ по сравнению с электронной микроскопией является возможность выполнения исследований нативных, природных образцов без какой-либо фиксации и специальной пробоподготовки, при физиологических параметрах среды.
Помимо визуализации рельефа поверхности с субнанометровым разрешением АСМ позволяет осуществлять прямое измерение сил, возникающих при взаимодействии одиночных наноразмерных объектов.
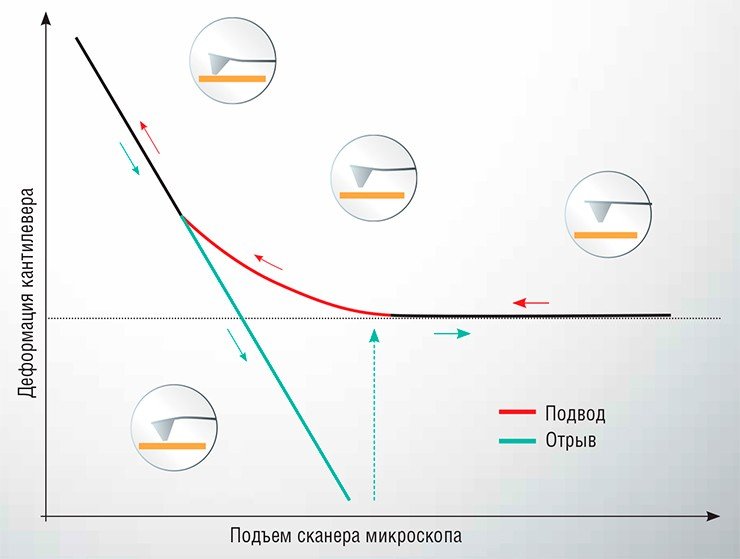
Проводятся такие измерения следующим образом: один объект закрепляется на острие зонда АСМ, а второй фиксируется на подложке, после чего зонд подводится к поверхности подложки до достижения механического контакта, а затем возвращается обратно. В ходе этого перемещения отслеживается деформация упругой консоли (кантилевера). Зависимость этого параметра от расстояния между зондом и подложкой называется силовой кривой. С ее помощью можно определить величину силы, действующей между исследуемыми объектами. Этот метод, названный атомно-силовой спектроскопией (АСС), может использоваться для исследования силовых характеристик взаимодействия самых разнообразных малых объектов: от неорганических наночастиц до вирусов и живых клеток.
Метод атомно-силовой спектроскопии позволяет определить величину силы, действующей между исследуемыми объектами. Для этого один объект закрепляется на острие зонда АСМ, а второй фиксируется на подложке. Зонд подводится к поверхности подложки и затем поднимается обратно. Зависимость деформации кантилевера от расстояния между зондом и подложкой называется силовой кривой
Начальным этапом заражения клетки вирусом является адгезия (прилипание) вирусной частицы (вириона) к клеточной поверхности с последующим проникновением генетического материала вируса внутрь клетки. Этот процесс, определяемый взаимодействием белковых рецепторов, расположенных на поверхности клетки, с поверхностными белками вириона, является критически важным для размножения вируса. И, надо отметить, в большинстве случаев изучен недостаточно.
Однако фиксация одиночной вирусной частицы на острие зонда атомно-силового микроскопа является весьма непростой задачей. Для успешного проведения эксперимента требуется большая подготовительная работа:
- получить как можно более чистый и концентрированный препарат вируса;
- подготовить на острие зонда площадку подходящего размера для посадки вириона;
- химически активировать поверхность зонда для образования ковалентных связей при контакте с белками вируса;
- убедиться в том, что на зонде закрепился действительно вирион, а не молекулы свободного белка или мелкие фрагменты клеток, всегда присутствующие в препаратах вирусов.
Оценка концентрации и степени чистоты препарата вируса обычно проводится методом просвечивающей электронной микроскопии. Площадку на острие АСМ-зонда, которое обычно изготавливают из кремния или его нитрида, формируют путем длительного сканирования кремниевой или сапфировой подложки при больших значениях развертки и силы прижатия зонда к поверхности. Наиболее наглядной иллюстрацией для этого процесса служит изменение формы острия карандаша в ходе интенсивного рисования.
Адекватным методом контроля геометрических параметров зонда атомно-силового микроскопа (а) при создании площадки для посадки вириона, является электронная микроскопия, как сканирующая, так и просвечивающая: б — площадка на острие зонда для посадки крупной вирусной частицы; в — вирусоподобная частица, закрепленная на острие зонда. Просвечивающая электронная микроскопия (JEM 1400, Jeol, Япония)
По меркам микроскопии, клетка высших организмов является относительно крупным (≈ 10 мкм) объектом, поэтому хорошо видна в световом микроскопе, при помощи которого на нее наводится кантилевер атомно-силового микроскопа. Но как быть с самим зондом, на острие которого предполагается наличие вириона? Строго говоря, вместо вириона там может оказаться все, что угодно: монослой белковых молекул, фрагмент клетки или вириона, агрегат из нескольких вирионов, случайное загрязнение и т. д. Кроме того, в процессе измерения вирион может разрушиться или оторваться от зонда. Визуализация же зонда с вирусной частицей методом электронной микроскопии до силовых измерений недопустима, так как под воздействием высушивания, вакуума и пучка электронов вирион приобретет необратимые изменения.
Наиболее эффективным методом решения данной проблемы оказалась визуализация острия зонда АСМ с помощью электронной микроскопии, осуществляемая непосредственно после силовых измерений. Если на острие будет обнаружена вирусная частица, уцелевшая в ходе эксперимента, то все сомнения развеются.
В течение последних пятидесяти лет в результате поистине титанической работы, проделанной электронными микроскопистами всего мира, накоплен огромный багаж знаний в области ультраструктурных аспектов репликации различных вирусов. Создание атомно-силового микроскопа и техники силовой спектроскопии позволило вплотную приблизиться к произвольной механической манипуляции одиночными вирусными частицами. Это выводит изучение взаимодействия вируса с клеткой на принципиально другой уровень — от структурных исследований к функциональным.
При этом атомно-силовая спектроскопия не является конкурентом для электронной микроскопии, а открывает новое самостоятельное направление исследований — наномеханику взаимодействия вирусной частицы с поверхностью клетки. Весьма вероятно, что в самом ближайшем будущем в данном направлении будут совершены фундаментальные открытия, соизмеримые по значимости с достижениями электронной микроскопии в середине прошлого века.
Изучение механизмов связывания вирусных частиц с поверхностью клетки вызывает значительный интерес не только с позиции фундаментальной науки, но и в контексте практических приложений. Более детальное понимание этих механизмов на молекулярном уровне может дать человечеству ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
В публикации использованы фото автора
* Просвечивающая электронная микроскопия с использованием специальной жидкостной ячейки и сканирующая электронная микроскопия при атмосферном давлении позволяют исследовать биологические объекты без фиксации, но из-за ряда технических трудностей и относительно низкого пространственного разрешения эти методы не получили широкого распространения.
Относящийся к данному классу атомно-силовой микроскоп оказался инструментом, подходящим для исследования биологических объектов и позволил не только визуализировать наноразмерные структуры, но и манипулировать ими. В частности, принципиально возможной оказалась манипуляция одиночными вирионами и прямое измерение сил, возникающих при их контакте с поверхностью клетки. Такие эксперименты позволяют получать подробные данные о самом первом и во многих случаях еще недостаточно исследованном этапе заражения клетки – адгезии вируса к ее поверхности. Данные исследования представляют и значительный практический интерес, т.к. могут дать ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
Вирусы являются чрезвычайно малыми объектами – их размеры лежат в диапазоне от нескольких десятков до нескольких сотен нанометров. Первым и на долгое время единственным методом прямой визуализации наноразмерных частиц стала электронная микроскопия (ЭМ), которая начала развиваться в 1930-е гг. Метод, оказавшийся очень информативным, позволил не только детально охарактеризовать структуру различных вирусов, но и исследовать процессы, происходящие в зараженной клетке.
Оказалось, что форма вирусных частиц отличается большим разнообразием: от правильных сфер до сложных структур, напоминающих кирпичи, обклеенные трубочками (вирус натуральной оспы), или щетинистых червей (вирус геморрагической лихорадки Эбола).
Вне клетки любой вирус является всего лишь молекулярным контейнером с генетическим материалом (ДНК или РНК) и вряд ли может считаться полноценным живым организмом, хотя по этому вопросу в научной среде до сих пор нет окончательной терминологической определенности.
Так, исследование репликации вируса методом просвечивающей электронной микроскопии на ультратонких срезах выглядит следующим образом: зараженные клетки обрабатывают фиксирующим раствором, обезвоживают спиртом и заливают специальной смолой. После отвердевания смолы с помощью специального прибора – ультратома – делают ультратонкие (≈ 50 нм) срезы, которые затем наносят на специальную сетку и обрабатывают растворами солей тяжелых металлов. Во время самого микроскопического исследования образец находится в вакуумной камере и подвергается действию пучка электронов с энергией в несколько десятков кэВ. Очевидно, что прижизненная визуализация в данном случае принципиально невозможна.
В течение почти полувека электронная микроскопия оставалась единственным методом визуализации наноразмерных объектов. Однако в начале 1980-х гг. эта монополия была нарушена появлением сканирующей зондовой микроскопии (СЗМ). Основным принципом СЗМ является сканирование – прецизионное (с высокой точностью) перемещение зонда вблизи исследуемой поверхности, сопряженное с отслеживанием определенного параметра, характеризующего взаимодействие между зондом и образцом. Результатом такого сканирования является топографическая карта рельефа поверхности образца.
Первым прибором СЗМ стал сканирующий туннельный микроскоп (СТМ), который мог лишь весьма ограниченно использоваться для визуализации биологических объектов, так как для его работы требовалась высокая электрическая проводимость исследуемой поверхности.
В 1986 г. швейцарский физик Г. Бинниг и его коллеги создали новый прибор семейства СЗМ – атомно-силовой микроскоп (АСМ). В основе его работы лежит силовое (Ван-дер-Ваальсово) взаимодействие атомов зонда и поверхности. АСМ не требуется электрическая проводимость поверхности образца, и он может осуществлять съемку в жидкой среде. Поэтому этот прибор оказался удобным инструментом для исследования биологических объектов.

С момента появления атомно-силового микроскопа было опубликовано огромное число работ, посвященных АСМ-визуализации самых разнообразных биологических образцов. Следует все же признать, что в большинстве случаев в плане визуализации АСМ не дает ничего принципиально нового в сравнении с обычной электронной микроскопией, поэтому зачастую данный метод воспринимается биологами как техническая экзотика, а не как полноценный исследовательский инструмент.
Однако важнейшим, пусть и почти единственным преимуществом визуализации биологических объектов при помощи АСМ по сравнению с электронной микроскопией является возможность выполнения исследований нативных, природных образцов без какой-либо фиксации и специальной пробоподготовки, при физиологических параметрах среды.
Помимо визуализации рельефа поверхности с субнанометровым разрешением АСМ позволяет осуществлять прямое измерение сил, возникающих при взаимо¬действии одиночных наноразмерных объектов.
Проводятся такие измерения следующим образом: один объект закрепляется на острие зонда АСМ, а второй фиксируется на подложке, после чего зонд подводится к поверхности подложки до достижения механического контакта, а затем возвращается обратно. В ходе этого перемещения отслеживается деформация упругой консоли (кантилевера). Зависимость этого параметра от расстояния между зондом и подложкой называется силовой кривой. С ее помощью можно определить величину силы, действующей между исследуемыми объектами. Этот метод, названный атомно-силовой спектроскопией (АСС), может использоваться для исследования силовых характеристик взаимодействия самых разнообразных малых объектов: от неорганических наночастиц до вирусов и живых клеток.
Начальным этапом заражения клетки вирусом является адгезия (прилипание) вирусной частицы (вириона) к клеточной поверхности с последующим проникновением генетического материала вируса внутрь клетки. Этот процесс, определяемый взаимодействием белковых рецепторов, расположенных на поверхности клетки, с поверхностными белками вириона, является критически важным для размножения вируса. И, надо отметить, в большинстве случаев изучен недостаточно.

Однако фиксация одиночной вирусной частицы на острие зонда атомно-силового микроскопа является весьма непростой задачей. Для успешного проведения эксперимента требуется большая подготовительная работа:
- получить как можно более чистый и концентрированный препарат вируса;
- подготовить на острие зонда площадку подходящего размера для посадки вириона;
- химически активировать поверхность зонда для образования ковалентных связей при контакте с белками вируса;
- убедиться в том, что на зонде закрепился действительно вирион, а не молекулы свободного белка или мелкие фрагменты клеток, всегда присутствующие в препаратах вирусов.
Оценка концентрации и степени чистоты препарата вируса обычно проводится методом просвечивающей электронной микроскопии. Площадку на острие АСМ-зонда, которое обычно изготавливают из кремния или его нитрида, формируют путем длительного сканирования кремниевой или сапфировой подложки при больших значениях развертки и силы прижатия зонда к поверхности. Наиболее наглядной иллюстрацией для этого процесса служит изменение формы острия карандаша в ходе интенсивного рисования.
По меркам микроскопии, клетка высших организмов является относительно крупным (≈ 10 мкм) объектом, поэтому хорошо видна в световом микроскопе, при помощи которого на нее наводится кантилевер атомно-силового микроскопа. Но как быть с самим зондом, на острие которого предполагается наличие вириона? Строго говоря, вместо вириона там может оказаться все, что угодно: монослой белковых молекул, фрагмент клетки или вириона, агрегат из нескольких вирионов, случайное загрязнение и т. д. Кроме того, в процессе измерения вирион может разрушиться или оторваться от зонда. Визуализация же зонда с вирусной частицей методом электронной микроскопии до силовых измерений недопустима, так как под воздействием высушивания, вакуума и пучка электронов вирион приобретет необратимые изменения.
Наиболее эффективным методом решения данной проблемы оказалась визуализация острия зонда АСМ с помощью электронной микроскопии, осуществляемая непосредственно после силовых измерений. Если на острие будет обнаружена вирусная частица, уцелевшая в ходе эксперимента, то все сомнения развеются.
В течение последних пятидесяти лет в результате поистине титанической работы, проделанной электронными микроскопистами всего мира, накоплен огромный багаж знаний в области ультраструктурных аспектов репликации различных вирусов. Создание атомно-силового микроскопа и техники силовой спектроскопии позволило вплотную приблизиться к произвольной механической манипуляции одиночными вирусными частицами. Это выводит изучение взаимодействия вируса с клеткой на принципиально другой уровень – от структурных исследований к функциональным.
При этом атомно-силовая спектроскопия не является конкурентом для электронной микроскопии, а открывает новое самостоятельное направление исследований – наномеханику взаимодействия вирусной частицы с поверхностью клетки. Весьма вероятно, что в самом ближайшем будущем в данном направлении будут совершены фундаментальные открытия, соизмеримые по значимости с достижениями электронной микроскопии в середине прошлого века.
Изучение механизмов связывания вирусных частиц с поверхностью клетки вызывает значительный интерес не только с позиции фундаментальной науки, но и в контексте практических приложений. Более детальное понимание этих механизмов на молекулярном уровне может дать человечеству ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
*Просвечивающая электронная микроскопия с использованием специальной жидкостной ячейки и сканирующая электронная микроскопия при атмосферном давлении позволяют исследовать биологические объекты без фиксации, но из-за ряда технических трудностей и относительно низкого пространственного разрешения эти методы не получили широкого распространения
Корнеев Д. В., Бессуднова Е. В., Зайцев Б. Н. Изучение взаимодействия наночастиц TiO2 и поверхности эритроцитов человека методом атомно-силовой спектроскопии // УНЖ. 2012. № 4. С. 73—77.
Alsteens D., Pesavent E., Cheuvart G. et al. Controlled manipulation of bacteriophages using single-virus force spectroscopy // ACSNANO. 2009. V. 3(10). P. 3063—3068.
Alsteens D., Trabelsi H., Soumillion P., Dufrene Y. F., Multiparametric atomic force microscopy imaging of single bacteriophages extruding from living bacteria // Nature Communications. V. 4. Article number: 2926.
Binnig G., Quate C. F., Gerber Ch. Atomic force microscope // Phys. Rev. Lett. 1986. V. 56(9). P. 930—933.
Cappella B., Dietler G. Force-distance curves by atomic force microscopy // Surf. Sci. Rep. 1999. V. 34. P. 1—104.
Читайте также:
- Что умеет компьютер карточки 1 класс школа россии
- Узнайте о том что такое военная галерея эрмитажа чем можно объяснить ее появление кратко
- Испытуемый его деятельность в эксперименте кратко
- Как я люблю этот вальс белоснежный танец снежинок в детском саду
- Из чего складывается оплата за детский сад в москве в 2021

