Кто впервые и как определил скорость молекул кратко
Обновлено: 04.07.2024
Предположение, что молекулы тела могут иметь любую скорость, сначала теоретически доказал в 1856 году английский физик Дж. Максвелл. Он считал, что скорость молекул в данный момент времени является случайной, и поэтому их распределение по скоростям носит статистический характер (распределение Максвелла).
Установленный им характер распределения молекул по скоростям графически представлен кривой, изображенной на рис. 1.17. Наличие у нее максимума (бугра) свидетельствует о том, что скорости большинства молекул приходятся на определенный интервал. Она несимметричная, поскольку молекул с большими скоростями меньше, чем с небольшими.
Быстрые молекулы определяют течение многих физических процессов при обычных условиях. Например, благодаря им происходит испарение жидкостей, ведь при комнатной температуре большинству молекул недостаточно энергии, чтобы разорвать связь с другими молекулами (она намного выше (3 / 2) • kT), а у молекул с высокими скоростями она достаточная.
Распределение молекул по скоростям Максвелла на протяжении продолжительного времени оставалось экспериментально неподтвержденным, и лишь в 1920 году немецкий ученый О. Штерн сумел экспериментально измерить скорости теплового движения молекул.
В середине XIX века была сформулирована молекулярно-кинетическая теория, но тогда не было никаких доказательств существования самих молекул. Вся теория базировалась на предположении о движении молекул, но как измерить скорость их движения, если они невидимы?
Теоретики первыми нашли выход. Из уравнения молекулярно-кинетической теории газов известно, что
Получена формула для расчета среднеквадратичной скорости, но масса молекулы неизвестна. Запишем по-другому значение υкв:
Например, при плотности азота, равной 1,25 кг/м, 3 , при t = 0 °С и P = 1 атм, скорости молекул азота . Для водорода: .
При этом интересно отметить, что скорость звука в газе близка к скорости молекул в этом газе , где γ – коэффициент Пуассона. Это объясняется тем, что звуковые волны переносятся молекулами газа.

Рис. 2.1
Платиновая нить А, покрытая снаружи серебром, располагается вдоль оси коаксиальных цилиндров S1, S3,. Внутри цилиндров поддерживается низкое давление порядка Па. При пропускании тока через платиновую нить она разогревается до температуры выше точки плавления серебра (961,9 °С). Серебро испаряется, и его атомы через узкие щели в цилиндре S1, и диафрагме S2, летят к охлаждаемой поверхности цилиндра S1, на которой они осаждаются. Если цилиндры S1, S3 и диафрагма не вращаются, то пучок осаждается в виде узкой полоски D на поверхности цилиндра S3. Если же вся система приводится во вращение с угловой скоростью то изображение щели смещается в точку D´ и становится расплывчатым.
Пусть l – расстояние между D и D´, измеренное вдоль поверхности цилиндра S3, оно равно где – линейная скорость точек поверхности цилиндра S3, радиусом R; - время прохождения атомами серебра расстояния . Таким образом, имеем откуда – можно определить величину скорости теплового движения атомов серебра. Температура нити в опытах Штерна равнялась 1200 °С, что соответствует среднеквадратичной скорости . В эксперименте для этой величины получилось значение от 560 до 640 м/с. Кроме того, изображение щели D´ всегда оказывалось размытым, что указывало на то, что атомы Ag движутся с различными скоростями.

Этот урок посвящен изучению того, каким способом можно измерить скорость молекул газа. Мы рассмотрим один из самых известных экспериментов в этой области – опыт Штерна.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Измерение скоростей молекул газа"
На прошлых уроках мы вывели уравнение, позволяющее связать среднюю кинетическую энергию молекул и температуру.
Как вы знаете, средняя кинетическая энергия молекул равна половине произведения массы молекулы и среднего значения квадрата скорости молекул:

Таким образом, зная температуру газа, мы можем найти среднее значение квадрата скорости его молекул:

Расчеты говорят о том, что при 0 о С, средняя скорость молекул азота достигает 500 м/с, а средняя скорость молекул водорода — 1800 м/с. Во второй половине 19 века это привело некоторых физиков в замешательство. Ведь всем хорошо известно, что запахи распространяются сравнительно медленно. Как же тогда получается, что молекулы газа двигаются с огромными скоростями, а само облако газа двигается в сотни раз медленнее?
Ответ на этот вопрос достаточно простой: молекулы двигаются беспорядочно, а потому их перемещения в сотни раз меньше пройденного пути. В качестве аналогии мы опять можем привести футбол. За один матч футболисты пробегают более десяти километров, однако, все это время они остаются в пределах футбольного поля, размеры которого равны 120 х 60 м.
Кроме расчетов скоростей молекул газа с помощью теории, существуют экспериментальные методы измерения скоростей. На сегодняшнем уроке, мы рассмотрим опыт Штерна, проведенный в 1920 году. Этот опыт был одним из первых экспериментальных подтверждений состоятельности молекулярно-кинетической теории.

Прибор Штерна представляет собой два коаксиальных цилиндра (то есть эти цилиндры обладают общей осью симметрии).
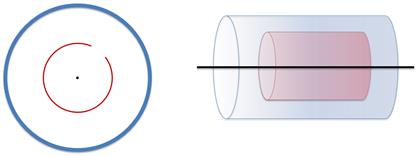
Из цилиндров откачан весь воздух. Вдоль оси малого цилиндра натянута тонкая платиновая проволока, покрытая серебром, а также в малом цилиндре имеется небольшая щель.
По проволочке пропускают электрический ток, с целью заставить серебро испаряться. В результате испарения, малый цилиндр заполняется газом из атомов серебра.
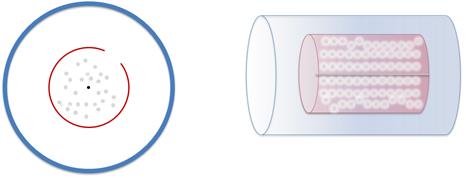
Разумеется, часть этих атомов пролетают через щель и оседают на внутренней стенке большого цилиндра. Этот слой серебра имеет определенное положение — прямо напротив щели в малом цилиндре.
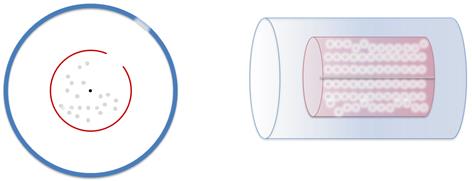
После этого, цилиндры приводят во вращение с одинаковой угловой скоростью и большой частотой (около 1500 об/с). Теперь атомы будут осаждаться не прямо напротив щели, поскольку за то время, пока они проходят расстояние от стенки малого цилиндра до стенки большого цилиндра, цилиндры поворачиваются на некоторый угол. Более того, слой серебра будет немного размытый из-за того, что не все атомы серебра двигаются с одинаковыми скоростями.
Обозначим за R радиус большого цилиндра, а радиус малого цилиндра — за r. Обозначим за d расстояние от конца радиуса, проходящего через центр щели до наибольшей концентрации атомов серебра после начала вращения. (Дело в том, что не все атомы имеют одинаковую скорость, поэтому, не все они попадают в одну и ту же точку). Поэтому, расстоянию d будет соответствовать средняя скорость атомов серебра:

Запишем теперь, что расстояние d равно:

Изучая криволинейное движение, мы убедились, что скорость вращения можно выразить через радиус вращения и частоту:

Из полученного выражения выразим время:

А теперь, это время подставим в формулу для средней скорости:

Таким образом, получили выражение, в котором средняя скорость задана через радиусы цилиндров, частоту вращения и расстояние d. Конечно же, радиусы цилиндров и расстояние d можно измерить. Частоту вращения задает сам экспериментатор, поэтому, она тоже известна. Модули скоростей, измеренные подобным способом, совпадают с теоретическим значением в пределах экспериментальной ошибки. Это говорит о том, что теоретическая формула, по которой мы вычисляли скорость, оказалась верна. Следовательно, верно и уравнение, связывающее среднюю кинетическую энергию молекул и температуру тела по абсолютной шкале Кельвина:
Скорость движения молекул впервые была определена в 1920 году немецким физиком Штерном. Опыт Штерна заключается в следующем. По общей оси двух цилиндров, вращавшихся с одинаковой угловой скоростью, натянута посеребренная платиновая проволока O, которая накаливается электрическим током (рис. 77). При температуре 1200°C молекулы серебра испаряются с поверхности проволоки и часть их вылетает через узкую щель, прорезанную вдоль внутреннего цилиндра (щель a на рисунке).

На холодной стенке внешнего цилиндра частицы серебра осаждаются в виде серебряной полоски. Однако за то время, в течение которого частица пролетает расстояние s между цилиндрами. Стенки их поворачиваются на некоторый угол (точка b на стенке внешнего цилиндра переходит в положение b1). Измеряя этот угол, можно подсчитать время поворота внешнего цилиндра, а следовательно, и время t движения частицы от щели до стенки второго цилиндра. Отсюда легко определить и скорость молекулы серебра:
Измеренная таким способом скорость молекул оказалась близкой к теоретически рассчитанной и для серебра заключалась в пределах от 50 до 625 м/с.
Значение этого опыта состоит в том, что его результаты совпали с результатами, полученными теоретически на основании молекулярно-кинетической теории; таким образом, правильность выводов теории подтвердилась.
Ниже приводятся средние скорости молекул некоторых газов и паров, полученные теоретически (при 0°C и 760 мм рт. ст.).

Как видите, эти скорости громадны. Их можно сравнивать лишь со скоростями пуль и артиллерийских снарядов.
Читайте также:
- В чем состояли основные особенности неоконсерватизма отличавшие его от других идейных течений кратко
- Как тролли на свой лад рождество справляли краткое содержание
- К н я плюсковой пушкин анализ кратко
- Проблема деятельности в психологии кратко
- Какие страны и почему считались в 18 веке великими державами 8 класс кратко

