Каковы механизмы образования ковалентной связи что такое донор акцептор приведите примеры кратко
Обновлено: 07.07.2024
Идея об образовании химической связи с помощью пары электронов, принадлежащих обоим соединяющимся атомам, была высказана в 1916г американским физико-химиком Дж. Льюисом.
Ковалентная связь существует между атомами как в молекулах, так и в кристаллах. Она возникает как между одинаковыми атомами (например, в молекулах Н2, Cl2, О2, в кристалле алмаза), так и между разными атомами (например, в молекулах Н2О и NН3, в кристаллах SiC). Почти все связи в молекулах органических соединений являются ковалентными (С-С, С-Н, С-N, и др.).
Различают два механизма образования ковалентной связи:
Обменный механизм образования ковалентной связи заключается в том, что каждый из соединяющихся атомов предоставляет на образование общей электронной пары (связи) по одному неспаренному электрону. Электроны взаимодействующих атомов должны при этом иметь противоположные спины.
Рассмотрим для примера образование ковалентной связи в молекуле водорода. При сближении атомов водорода происходит проникновение их электронных облаков друг в друга, которое называется перекрыванием электронных облаков (рис. 3.2), электронная плотность между ядрами возрастает. Ядра притягиваются друг к другу. Вследствие этого снижается энергия системы. При очень сильном сближении атомов возрастает отталкивание ядер. Поэтому имеется оптимальное расстояние между ядрами (длина связи l), при котором система имеет минимальную энергию. При таком состоянии выделяется энергия, называемая энергией связи Есв.
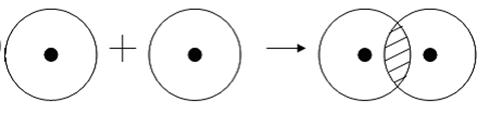
Рис. 3.2. Схема перекрывания электронных облаков при образовании молекулы водорода
Схематично образование молекулы водорода из атомов можно представить следующим образом (точка означает электрон, черта – пару электронов):
Н + Н→Н : Н или Н + Н→Н – Н .
В общем виде для молекул АВ других веществ:
Донорно-акцепторный механизм образования ковалентной связи заключается в том, что одна частица – донор – представляет на образование связи электронную пару, а вторая – акцептор – свободную орбиталь:
А : + В = А : В .
Рассмотрим механизмы образования химических связей в молекуле аммиака и ионе аммония .
Атом азота имеет на внешнем энергетическом уровне два спаренных и три неспаренных электрона:
Атом водорода на s – подуровне имеет один неспаренный электрон.
В молекуле аммиака неспаренные 2р – электроны атома азота образуют три электронные пары с электронами 3-х атомов водорода:
В молекуле NH3 образованы 3 ковалентных связи по обменному механизму.
2. Образование комплексного иона – иона аммония.
У атома азота остается неподелённая пара электронов , т. е. два электрона с антипараллельными спинами на одной атомной орбитали. Атомная орбиталь иона водорода не содержит электронов (вакантная орбиталь). При сближении молекулы аммиака и иона водорода происходит взаимодействие неподеленной пары электронов атома азота и вакантной орбитали иона водорода. Неподеленная пара электронов становится общей для атомов азота и водорода, возникает химическая связь по донорно – акцепторному механизму. Атом азота молекулы аммиака является донором, а ион водорода – акцептором:
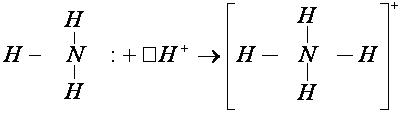
.
Следует отметить, что в ионе NH4 + все четыре связи равноценны и неразличимы, следовательно, в ионе заряд делокализован (рассредоточен) по всему комплексу.
Рассмотренные примеры показывают, что способность атома образовывать ковалентные связи обусловливается не только одноэлектронными, но и 2-электронными облаками или наличием свободных орбиталей.
По донорно-акцепторному механизму образуются связи в комплексных соединениях: [BF4] - ; [Cu(NH3)4] 2+ ; [Zn(OH)4] 2- и т. д.
Ковалентная связь обладает следующими свойствами:
- полярность и поляризуемость.

Идея об образовании химической связи с помощью пары электронов, принадлежащих обоим соединяющимся атомам, была высказана в 1916г американским физико-химиком Дж. Льюисом.
Ковалентная связь существует между атомами как в молекулах, так и в кристаллах. Она возникает как между одинаковыми атомами (например, в молекулах Н2, Cl2, О2, в кристалле алмаза), так и между разными атомами (например, в молекулах Н2О и NН3, в кристаллах SiC). Почти все связи в молекулах органических соединений являются ковалентными (С-С, С-Н, С-N, и др.).
Различают два механизма образования ковалентной связи:
Обменный механизм образования ковалентной связи заключается в том, что каждый из соединяющихся атомов предоставляет на образование общей электронной пары (связи) по одному неспаренному электрону. Электроны взаимодействующих атомов должны при этом иметь противоположные спины.
Рассмотрим для примера образование ковалентной связи в молекуле водорода. При сближении атомов водорода происходит проникновение их электронных облаков друг в друга, которое называется перекрыванием электронных облаков (рис. 3.2), электронная плотность между ядрами возрастает. Ядра притягиваются друг к другу. Вследствие этого снижается энергия системы. При очень сильном сближении атомов возрастает отталкивание ядер. Поэтому имеется оптимальное расстояние между ядрами (длина связи l), при котором система имеет минимальную энергию. При таком состоянии выделяется энергия, называемая энергией связи Есв.

Рис. 3.2. Схема перекрывания электронных облаков при образовании молекулы водорода
Схематично образование молекулы водорода из атомов можно представить следующим образом (точка означает электрон, черта – пару электронов):
Н + Н→Н : Н или Н + Н→Н – Н .
В общем виде для молекул АВ других веществ:
Донорно-акцепторный механизм образования ковалентной связи заключается в том, что одна частица – донор – представляет на образование связи электронную пару, а вторая – акцептор – свободную орбиталь:
А : + В = А : В .
Рассмотрим механизмы образования химических связей в молекуле аммиака и ионе аммония .
Атом азота имеет на внешнем энергетическом уровне два спаренных и три неспаренных электрона:
Атом водорода на s – подуровне имеет один неспаренный электрон.
В молекуле аммиака неспаренные 2р – электроны атома азота образуют три электронные пары с электронами 3-х атомов водорода:
В молекуле NH3 образованы 3 ковалентных связи по обменному механизму.
2. Образование комплексного иона – иона аммония.
У атома азота остается неподелённая пара электронов , т. е. два электрона с антипараллельными спинами на одной атомной орбитали. Атомная орбиталь иона водорода не содержит электронов (вакантная орбиталь). При сближении молекулы аммиака и иона водорода происходит взаимодействие неподеленной пары электронов атома азота и вакантной орбитали иона водорода. Неподеленная пара электронов становится общей для атомов азота и водорода, возникает химическая связь по донорно – акцепторному механизму. Атом азота молекулы аммиака является донором, а ион водорода – акцептором:
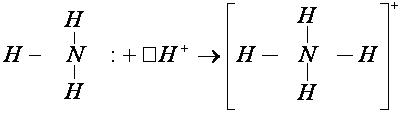
.
Следует отметить, что в ионе NH4 + все четыре связи равноценны и неразличимы, следовательно, в ионе заряд делокализован (рассредоточен) по всему комплексу.
Рассмотренные примеры показывают, что способность атома образовывать ковалентные связи обусловливается не только одноэлектронными, но и 2-электронными облаками или наличием свободных орбиталей.
По донорно-акцепторному механизму образуются связи в комплексных соединениях: [BF4] - ; [Cu(NH3)4] 2+ ; [Zn(OH)4] 2- и т. д.
Ковалентная связь обладает следующими свойствами:
В рассмотренных на стр.32 учебника примерах образования ковалентной связи каждый из атомов предоставил в общую электронную пару по одному электрону. Такой механизм образования ковалентной связи называют обменным. Однако существует и другой механизм: один из атомов обладает свободной электронной парой (ее называют неподеленной) и передает ее в общее пользование с другим атомом, у которого имеется свободная (пустая, вакантная) орбиталь. Первый атом называют донором, а второй — акцептором. Такой механизм образования ковалентной связи называют донорно-акцепторным.
№4. См. стр. 32. Примеры.

Механизмы образования ковалентной связи:
а) Обменный механизм — для образования связи каждый из
атомов предоставляет по одному неспаренному электрону.
При этом формальные заряды атомов остаются неизменными.
б) Донорно-акцепторный механизм — для образования связи
по данному механизму оба электрона предоставляет один
из атомов — донор. Второй из атомов, участвующих в об-
разовании связи, называется акцептором.
В образовавшейся молекуле формальный заряд донора уве-
личивается на единицу, а акцептора уменьшается на единицу.
связь, осуществляемая за счёт образования общих электронных пар, принадлежащих обоим атомам.
Существуют два механизма образования ковалентной связи: обменный и донорно-акцепторный.
При обменном механизме каждый из атомов отдаёт в общее пользование по одному неспаренному электрону. Таким образом построено большинство органических соединений (см. электронные формулы метана, этана, этена, ацетилена).
Ковалентная связь может быть образована также парой электронов, предоставляемой одним атомом, называемым донором электронов, и вакантной орбиталью другого атома, называемого акцептором электронов. Такой механизм образования ковалентной связи носит название донорно-акцепторным. Поясним механизм донорно-акцепторного взаимодействия на примере образовании хлорида метиламмония с помощью электронных формул (точками обозначены валентные электроны, а пустым квадратиком свободная `s`-орбиталь водорода):

В ионе метиламмония все связи, образованные по двум различным механизмам, равноценны.
Читайте также:

